Biotecnologia de
Bactérias Fixadoras
de Nitrogênio
Profa Fabiana G. da S. Pinto
CICLO DO NITROGÊNIO
Fabiana G. S. Pinto
Ciclo do Nitrogênio:
Fonte: atmosfera (79% de N).
O nitrogênio é importante porque faz parte das proteínas e ácidos
nucleicos.
Fixação (Rhizobium sp.): fixam o N transformando-o em NH4+
(amônia). Os decompositores transformam matéria orgânica em
NH4+.
Nitrificação (bactérias nitrificantes): transformação da amônia em
nitrito (pelas bactérias Nitrosomona sp.) e posteriormente em nitrato
(pelas bactérias Nitrobacter sp.).
Incorporação do nitrato pelas plantas. A predação “leva” o
nitrogênio através da cadeia alimentar. Com a formação de
compostos nitrogenados pelos animais (amônia, ácido úrico e úreia)
o nitrogênio volta para o ambiente.
Desnitrificação: reotrno do nitrogênio para a atmosfera através das
bactérias desnitrificantes (Pseudomonas sp.). Elas transformam
nitrato e amônia em N.
Fabiana G. S. Pinto
IMPORTÂNCIA ECOLÓGICA
Ciclo do nitrogênio:
fixação N2 @ captação do nitrogênio atmosférico e incorporação à
cadeia alimentar @ absorvem o N2 e transformam-no em nitrato
(NO3−) e amônia (NH3) @ formas utilizadas pelas plantas:
bactérias do gênero Rhizobium: (Fixação Simbiótica)
associação mutualística com raízes de plantas leguminosas.
bactérias do solo @ gênero Azotobacter. (Fixação não simbiótica)
Fabiana G. S. Pinto
Ciclo do nitrogênio:
Desnitrificação @ transformação de matéria nitrogenada em N2
@ bactérias desnitrificantes:
utilizam nitrato como aceptor final de elétrons na respiração
anaeróbia @ liberação de N2 para a atmosfera.
- Agricultura é processo indesejável → empobrece o solo
- ↑ Desnitrificação: ↑ quantidade material orgânico, ↑ T (25 -60ºC),
pH neutro a alcalino.
Ex.: Agrobacterium, Alcaligenes, Bacillus, Thiobacilus e
Pseudomonas
Glicose + NO3− (nitrato) Î CO2 + H2O + N2 + energia
Amonificação @ transformação do nitrogênio presente na
forma orgânica no corpo de organismos mortos em amônia
(NH3) por bactérias decompositoras:
retorno do nitrogênio para o meio @ disponível para bactéria e
plantas.
Conversão nitrato a amônia: bactérias fazem redução assimilativa
de nitrato
- Objetivo: amônia para biossíntese aas
Fabiana G. S. Pinto
Ciclo do nitrogênio:
nitrificação @ transformação da amônia a nitrato @ bactérias
nitrificantes @ energia liberada usada na síntese de compostos
orgânicos a partir de CO2 e H2O (quimiossíntese):
bactérias amônia-oxidantes:oxidam a amônia a nitrito @
Nitrosomonas e Nitrosococcus;
bactérias nitrito – oxidantes: oxidam nitrito a nitrato @
Nitrobacter e Nitrococcus, Nitrospina
nitrato liberado no meio @ diretamente utilizado pelas plantas:
convertido para a forma orgânica @ aminoácidos e nucleotídeos.
Fabiana G. S. Pinto
CICLO DO NITROGÊNIO
Fabiana G. S. Pinto
Fixação Biológica
do Nitrogênio em
Sistemas
Agrícolas
Fabiana G. S. Pinto
• Estima-se que, nas últimas cinco décadas,
cerca de 2 dos 8,7 bilhões de hectares de
terras agricultáveis, pastagens permanentes
e florestas do mundo tenham sido
degradadas;
• A degradação química, física e biológica do
solo é relevante para a sustentabilidade
agrícola, particularmente nas regiões
tropicais;
• A degradação química, com a perda da
fertilidade do solo, pode ser acentuada pelo
custo elevado dos fertilizantes, em especial
fontes de N, grande parte deles importados.
Nesse contexto, a FBN é
um processo “chave” para a
sustentabilidade dos
agroecossistemas
Fabiana G. S. Pinto
O que nos aguarda?
1960
2000
20302040
1,8
3,5
5,5
3
6
8-10
Área cultivada (ha x
109)
1,3
1,5
1,8
Uso de fertilizante
nitrogenado (Tg/1012g)
10
88
120
9
40
55-60
Produção de alimentos
(Mt x 109)
População (bilhões)
Uso de fertilizante
fosfatado Tg/1012g)
Fabiana G. S. Pinto
Fixação biológica do N2
N
N
N2
NH3
NH4+
Nitrogenase
Nódulos
Leghemoglobina
Cultura
% N da fixação
N total fixado
Soja
0-95
0-450
Feijão
0-70
0-165
Amendoim
campo
Grão-de-bico
22-92
32-206
0-82
0-141
Lentilha
28-87
5-191
Ervilha
5-95
4-244
Unkovich & Pate, Field Crops Res., 2000.
Fabiana G. S. Pinto
5.600
kg/ha
2.750
kg/ha
C fóssil
C biológico
Atmosfera - CO2
CO2
Energia de
fontes
fósseis
CO2
Energia de
fontes
biológicas
C
CO2
Biomassa da planta
e dos
microrganismos
1 ton amônia = 6
barris de petróleo
Não-renovável
Fabiana G. S. Pinto
Renovável
Soja (Glycine max)
46% da área cultivada no
país;
16% da economia.
Feijoeiro
(Phaseolus vulgaris)
1/3 das proteínas consumidas
pela população.
Fabiana G. S. Pinto
Histórico da soja na América do Sul
• Cultura exótica introduzida no final do século XIX na
Argentina (1880) e no Brasil (1882);
• Solos isentos de bactérias capazes de nodular a soja
de modo efetivo;
• Inoculantes foram trazidos de outros países durante a
expansão da cultura (1950s, 1960s);
• Programa de seleção de estirpes iniciou
concomitantemente.
Inoculada
Não inoculada
Fabiana G. S. Pinto
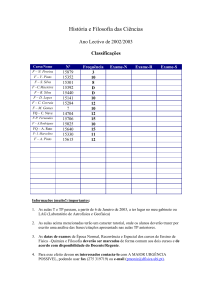
Ano
Brasil
Hoje
Estirpes (SEMIA)
1956
500
504
505
512
513
516
517
519
521
1957
504
505
509
512
513
516
519
521
525
1958
504
505
509
512
515
517
519
534
535
1961
519
521
526
531
534
535
1962
504
510
513
519
527
531
1964
504
513
527
531
1965
504
513
519
532
1966
532
543
566
1968-1975 543
566
587
1976
527
532
566
1977
527
566
586
1978
527
532
566
1979-1991 587
5019
1992-........
587
5019 5079 5080
+ 90% das áreas cultivadas
População estabelecida com ≥ 103
células de Bradyrhizobium/g solo
Fabiana G. S. Pinto
Reinoculação
Ponta Grossa, 97/98, 98/99
S/Reinoc.
C/Reinoc.
4000
Médias de 8 combinações
de estirpes
3500
3000
Rendimento (kg/ha)
+ 498 kg/ha
+ 15,2%
rendimento
+ 81% massa
nódulos
Campo & Hungria, Simpósio sobre Fertilidade do Solo e Nutrição de Plantas no Sistema Plantio Direto, 2000.
Fabiana G. S. Pinto
Reinoculação
NI
IP
NI+ 200 kg N
3100
3050
3000
2950
+ 8%
2900
(P<0.05)
2800
• 29 ensaios
conduzidos em
solos com 103 a
106 células/g
solo, em oito
estados, de
1992/93 a
2001/02.
• Rendimentos
>2.400 kg/ha,
rendimento
máximo de 4.700
kg/ha,
incrementos de
até 1.950 kg/ha.
2850
2750
b
a
b
2700
Rendimento (kg/ha)
Fabiana G. S. Pinto
Hungria et al., Nitrogen
Nutrition and Sustainable
Plant Productivity, 2005.
Reinoculação na Argentina
• 74 ensaios;
• Tratamento não inoculado ~ 2.950
kg/ha;
• Rendimento máximo: 6.070 kg/ha;
• Incremento médio pela reinoculação
de 14%, com rendimento médio de
3.250 kg/ha.
Fabiana G. S. Pinto
Hungria et al., Nitrogen
Nutrition and Sustainable
Plant Productivity, 2005.
• Na China, rendimentos
máximos não são
conseguidos
exclusivamente com a
FBN (Gan et al., Nutr. Cycl. Agroecosyst.,
2003).
• Maiores rendimentos com
50 kg N/ha em V4, V6
ou R1 (Gan et al., Field Crops Res.,
2002, Nutr. Cycl. Agroecosyst., 2003).
• Rendimentos inferiores
aos do Brasil e
Argentina.
No Brasil, a recomendação de apenas 30 kg de
N/ha implicaria em um custo de US$ 13,3/ha para
o agricultor, e de US$ 280 milhões/safra para o
país
Fabiana G. S. Pinto
A
14
NI
NI+200N
SI
SI+30N SOW
N-NH3 kg ha-1
12
10
Volatilização
da NH3
SI+50N R2
SI+50N R4
8
6
4
2
0
0
20
40
60
80
100
120
Time (DAS)
15 a 25% de perdas por volatilização
60
B
N-NH3 kg ha-1
50
40
30
20
10
0
0
20
40
60
80
100
Time (DAS)
Hungria et al., Can. J. Plant Sci., 2005.
Fabiana G. S. Pinto
120
Perda de Nfertilizantes por
volatilização:
Argentina
Uréia - 35,7%.
Uréia - amônio nitrato - 9,5%.
Nitrato de amôniocalcáreo - 1,1%.
Potencial de aquecimento global
CO2
CH4
N20
1
23
296
Fontanetto et al., INTA, 2002.
Fabiana G. S. Pinto
Brasil
e Argentina –
Governo
respostas à inoculação
Rede
mesmo em solos
comde
1 ensaios
milhão
de células/g solo
Governo
+ Privado
Vários ensaios, anos, repetições
EUA – Populações tão
Vários
ensaios
????????
baixas
quanto
10 a 100
células/g de solo podem
Procedimentos
de inoculação
limitar a resposta
à
cuidadosos?
inoculação
(Dunigan et al., 1984; Singleton and Tavares, 1986; Thies et al.,
1991; Nazih and Weaver, 1994)
Fabiana G. S. Pinto
Seleção de estirpes para maior eficiência de FBN
e competitividade
SEMIA 5079
(=CPAC 15)
SEMIA 566
(1992)
Novas estirpes
(1966)
variantes
Sorogrupo
566 (USDA
123)
100
80
60
40
20
0
Hungria &
Vargas,
Field Crops
Res., 2000
mg N/pl
1
2
3
4
5
Fabiana G. S. Pinto
6
7
8
9
Desempenho das estirpes variantes.
Médias de quatro ensaios conduzidos no Paraná.
Tratamento
Nodulação
(mg/pl)
Ocupação (%)
antes
dos nódulos
depois
Rendimento
(kg/ha)
NI
80 b
-
-
2.322 c
NI + N
17 c
-
-
3.548 a
SEMIA 566
132 a
28
52*
2.927 b
Variante
146 a
28
70*
3.559 a
CB 1809
98 b
8
18
2.926 b
Variante
145 a
8
42*
3.580 a
Hungria & Vargas, Field Crops Res., 2000
Fabiana G. S. Pinto
GL 1 encontrados seis marcadores
GL 2
Já foram
moleculares GL
Satt416
relacionados
à nodulação e um Satt233
marcador relacionado à
12,0
Satt187
produção deSatt304
biomassa nas populações
F2:3 de BRS 133
(baixa)
21,5 x Embrapa 20 (média) e F2:7 de Bossier (alta)
34,1
X Embrapa Satt066
20 (média) (Nicolás et al., 2005; Santos et al., 2005)
GL 5
(Satt126)*
GL 4
12,7
8,7
Satt251
Satt539
Satt558
Satt216
(Sat_099)
(Satt373)
Satt232
Satt551
GL 9
21,8
Satt306
GL 10
Satt523
29,0
GL 8
23,4
Satt192
40,4
Satt197
Satt242
Sct_001
GL 6
Satt509
19,3
GL 7
Satt296
3
GL 11
Sct_189
Sat_123
25,8
Satt332
Os marcadores
podem ser utilizados em programas de
21,8
Satt440
melhoramento visando
o incremento na contribuição da
FBN em soja
Fabiana G. S. Pinto
3) Transferência lateral
de genes simbióticos
11
87
96
(A)
5
44
67
73
Jaccard (Opt:0.50%) (Tol 2.0%-2.0%) (H>0.0% S>0.0%) [0.0%-100.0%]
RPO1
1 00
95
90
85
80
75
70
65
60
55
50
RPO1
45
BOX
40
10 0
95
90
85
80
75
70
65
60
55
50
45
40
35
30
25
Box
35
Box
30
Jaccard (Opt:0.50%) (Tol 2.0%-2.0%) (H>0.0% S>0.0%) [0.0%-100.0%]
25
1) Dispersão de estirpes
20
Ecologia de Rizóbios: Importante para
predizer respostas à inoculação
RPO
1
47
95
31
79
45
68
21
89
84
23
94
13
19
6
39
16
15
57
59
61
93
14
22
1
12
10
27
91
RN
PI
81
83
PB
AC
17
PE
RO
TO
29
53
9
AL
SE
MT
7
18
20
BA
80
72
3
5019
98
GO
97
4
25
35
MG
MS
26
85
ES
90
28
SP
79
95
RJ
64
88
PR
70
24
32
30
SC
38
42
RS
43
2) Variabilidade
morfológica, fisiológica,
genética e simbiótica pela
adaptação ao solo
28
15
63
39
5079
16
53
55
21
41
68
84
100
94
49
89
96
6
13
19
87
86
99
44
66
45
52
73
50
77
17
587
4
9
64
65
67
88
43
74
98
46
27
26
25
14
70
83
18
40
51
57
72
3
22
24
29
36
81
82
91
90
80
59
36
97
586
30
49
93
55
7
56
20
62
35
65
32
82
38
74
60
40
1
51
5
31
58
78
85
Nishi et al. Symbiosis, 1996.
Hungria et al. Plant Soil 1996, Biol. Fertil. Soils,
1998.
Boddey & Hungria. Biol. Fertil. Soils, 1997.
Santos et al. FEMS 1999.
Ferreira & Hungria. Field Crops Res., 2002.
Galli-Terasawa et al. World J. Microbiol.
Biotechnol., 2003.
Fabiana G. S. Pinto
42
12
50
CE
61
46
52
MA
62
587
41
PA
586
99
100
AM
11
86
77
AP
5019
66
63
RR
56
Entender a ecologia dos rizóbios é importante para delinear novas
estratégias de substituição de estirpes estabelecidas e
competitivas por estirpes mais eficientes
100
Importância
da
reinoculação
80
Anos
Ocupação dos nódulos (%)
60
2
3
4
6
40
20
0
29w
587
CPAC 15
CPAC 7
Sorogrupos
Mendes et al., Biol. Fertil. Soils, 2004.
Fabiana G. S. Pinto
Feijoeiro
• Origem: Mesoamerica, Andes,
centro secundário no noroeste da
Argentina;
• Área cultivada no Brasil:
2003/04 – 4,223,000 ha;
• Rendimento médio nacional – 826
kg/ha;
• Em geral cultivado por
agricultores pobres e com baixo
nível tecnológico
Fabiana G. S. Pinto
Microssimbiontes do feijoeiro
•
5 espécies Rhizobium:
- R. leguminosarum bv. phaseoli (Jordan, 1984)
- R. tropici (Martínez-Romero et al., 1991)
- R. etli bv. phaseoli (Segovia et al., 1993)
- R. gallicum (Amarger et al., 1997)
- R. giardinii (Amarger et al., 1997)
• Brasil:
• R. etli, R. leguminosarum: altas porcentagens
diluições solos
• R. tropici: predomina plantas isca cultivares feijão mesoamericano
R. tropici
Elevada competitividade
Estabilidade genética
Tolerância à acidez e
altas temperaturas
Fabiana G. S. Pinto
Paraná
•
Conhecimento sobre diversidade rizóbios é pequeno
•
Poucos estudos
•
Seleção estirpes rizóbios para o feijão (1994)
grande variabilidade fenotípica e genotípica
- R. tropici PRF 81: suplementar N2 906 Kg. ha -1
- Recomendação para uso em inoculantes comerciais 1998
•
Desenvolver estudos genéticos com estirpes brasileiras
Fabiana G. S. Pinto
Seleção de estirpes
para os trópicos
Tolerância a
1. Estabilidade genética
2. Temperaturas elevadas
R. tropici
3. Acidez
Competitiva
Alta eficiência de FBN
Fabiana G. S. Pinto
4000
3000
Rendimento (kg/ha)
a
a
a ab
ab
c
c
a
PRF 81
CIAT 899
C - N
C + N
2000
1000
0
Ponta
FabianaGrossa
G. S. Pinto
Londrina
Hungria et al. (2000)
Tratamento de sementes
Em + 93% das áreas semeadas com soja as sementes são tratadas com fungicidas
(Henning, Patologia e Tratamento de Sementes: Noções Gerais, 2004).
1
Semeadura o
mais rápido
possível
2
Concentração
elevada de
células/semente
3
Mas o desejável
seria… compatibilidade
Fabiana G. S. Pinto
Inoculação no
sulco
Pelo menos seis
vezes a dose
recomendada
4400
300
4300
280
PC
4200
PD
PC
260
4100
PD
240
4000
Rendimento (kg/ha)
220
NDff (kg N/ha)
100
80
60
19 milhões sob PD
PC
40
PD
20
0
NDff (%)
Londrina, PR
Plantio Direto
Fabiana G. S. Pinto
Plantio Convencional
84% dos 3,1 milhões de ha de áreas novas são cultivadas com soja
/www.estadao.com.br/ciencia/noticias/2005/mai/18/210.htm
Fabiana G. S. Pinto
Primeira companhia
de inoculante (EUA):
1898
Beijerinck (1888) isolou
bactérias dos nódulos:
Bacillus radicicola
Argentina
Brasil
30
25
20
15
10
2003/ 2004
2002/ 2003
2001/ 2002
2000/ 2001
1999/ 2000
98/ 99
97/ 98
95/ 96
93/ 94
90/ 91
85/ 86
80/ 81
75/ 76
0
70/ 71
5
No Brasil, 26.096.949 milhões de doses de inoculantes
comercializadas em 2003/04
Fabiana G. S. Pinto
Em Londrina, rendimento de 5.980 kg/ha e Ndf 300 kg N/ha
Estimativas no Brasil de Ndf – 72-94% (50% EUA)
zEconomia
nacional estimada pela FBN
z(21 milhões ha, 2.737 kg/ha)
~US$ 3 bilhões/ano
Fabiana G. S. Pinto
Origem da Diazotrofia
•
Idade da Anaerobiose (Era Arqueana)
- Primeiras formas de vida: 3700nifH
m.a.
nifD e nifK
- Aparição sistemas informativos primitivos e processos
metabólicos
- Rotas fixação de N2
•
Diazotrofia
- Procariotos
- Complexo enzimático : Nitrogenase
8H+ + 8e-O+216ATP → 2NH3 + 16ADP + 16 PO4- + H2
- NitrogenaseNé2 +inativada
- Reduz N2, acetileno, azidas e cianetos
- Função ancestral: Detoxificação de derivados do HCN
•
A FBN em simbiose com plantas deve ter se originado depois diazotrofia
e conviveram na rizosfera da planta como epífitos e endófitos (400m.a)
Fabiana G. S. Pinto
Biodiversidade dos Diazótrofos
•
Distribuídos em grupos com diferentes metabolismos e
estilos de vida
- Aeróbios, anaeróbios, autótrofos, heterótrofos, metanotrófos
- Vida livre ou em simbiose
•
FBN
Bacteria
6 Filos
- Bactérias verdes sulfurosas
- Cianobactérias
- Gram positivas de baixo e alto conteúdo de GC
- Spirochaetes
- Firmicutes
- Proteobacteria
Rizóbios
•
•
FBN
Testes bioquímicos
Presença operon nifHDK
nitrogenase
FBN surgiu apenas uma vez na evolução
Fabiana G. S. Pinto
Discrepância genes nifD e nifK de Methanobaterium e
Bradyrhizobium japonicum
evento de duplicação antes
da divergência das linhagens de Bacteria e Arquea
Ampla distribuição da diazotrofia é explicada por 2 teorias:
•
1ª - Todas as bactérias possuíam a capacidade de FBN e foram
perdendo essa característica depois das mudanças da atmosfera
anoxígena para oxígena;
2ª - Transferência horizontal genes FBN entre linhagens, que
integraram ao genoma conferindo vantagem adaptativa
Ex: Chlorobium tepidum (Bactéria verde sulfurosa) e Methanobacterium
thermoautotrophicum (Arquea) = ordenação similar operon
•
FBN em associações simbióticas
- Cianobactérias
tecidos de plantas
- Frankia
nódulos com plantas não leguminosas
- Rizóbios
nódulos leguminosas
Fabiana G. S. Pinto
Coevolução de Rizóbio-Leguminosa
•
gene rbcL
filogenia molecular leguminosas
•
A predisposição a formação nódulo surgiu apenas 1 vez em
angiosperma (caráter ancestral) que tem sido conservado ou
perdido nas linhagens
•
Família Leguminosae
650 gêneros, 18000 espécies
- 3 subfamílias
Caesalpinioideae, Mimosoideae e
Papilionoideae
•
Presença ou ausência de espécies nodulantes
•
Nodulação surgiu várias vezes na filogenia das Leguminosas e
se perdeu em algumas linhagens
•
Houve coevolução rizóbio-leguminosa
mutualística
Fabiana G. S. Pinto
relação simbiose
•
Rizóbios
•
Estabelecimento simbiose: Rizóbio-Leguminosa
→
Simbiose com leguminosas → nódulos
Deformação e curvatura
do pêlo radicular
Quimiotaxia
Formação do cordão
de infeccção
Adesão e troca de sinais
Diferenciação em bacteróides
Bactérias no nódulo
em formação
Fabiana G. S. Pinto
Divisão céls córtex e
formação primórdio nodular
Intercâmbio de sinais específicos entre os simbiontes.
Phaseolus
CH2OH
HO
HO
CH2OH
O
O
HO
N
R
CH2OSO3H
O
NHAc
CH3
O
O
HO
NHAc
2
CH2OH
HO
OH
HO
R
CH2OH
HO
HO
CH2OH
O
O
HO
N
R
O
HO
CH3
CH2OSO3H
O
NHAc
O
O
HO
NHAc
2
CH2OSO3H
O
NHAc
CH3
CH2OH
O
N
O
HO
2
O
NHAc
OH
Fatores de
nodulação
O
O
CH2OH
HO
CH2OH
O
N
O
NHAc
O=C CH3
(CH2)9
O
CH2OSO3H
O
O
HO
HO
O
HO
2
O
NHAc
OH
P
HC
HC
(CH2)5
CH3
O
B
Nod D
O
C
A
O
O
Flavonóid
es
O
S
U
I
H
P
Q
J
pSym
D1
Rhizobium
tropici
Fabiana G. S. Pinto
Q
OH
•
Estrutura Fatores Nod
genes nodABC
•
Modificações
atribuem especificidade ou promiscuidade
interação com seu hospedeiro
•
Coevolução rizóbio-leguminosa
especialização fatores
Nod
gerando ampla gama de modificações para se
adequar ao hospedeiro
•
Simbionte específico por Leguminosa
- Alta especificidade: Azorhizobium caulinodans (Sesbania rostrata)
- Baixa especificidade: Rhizobium NGR234 (232 leguminosas)
•
Leguminosa específica por Simbionte
- Vicia faba: R. leguminosarum bv. viceae (poliinsaturação fator Nod)
oligômeros N-acetil-D-glucosamina
•
Promiscuidade caráter ancestral
•
Planta prosmícua
hierarquia de preferências tipo de
modificação do fator Nod
Fabiana G. S. Pinto
Origem Genes Simbióticos
•
Genes FBN mais antigo que os genes nod, e ambos coevoluíram com
rizóbios, integraram suas funções e agruparam em operons localizados
cromossomo ou plasmídeos
•
Genes de nodulação
e
Genes de fixação de nitrogênio
genes nod, nol e noe
•
Localização
•
genes nif e fix
Extracromossomal (plasmídeos simbióticos)
Cromossomal (ilhas simbióticas)
Organização genes em rizóbios
-
Operons
Rhizobium e Sinorhizobium: plasmídeos
Bradyrhizobium: cromossomo
Mesorhirhizobium: 2 formas
Fabiana G. S. Pinto
Mobilidade Genética
•
Evolução de genoma: perda ou aquisição de material genético
•
Genoma básico
Genoma móvel
•
Plasmídeos ou ilhas simbióticas
•
Perda ou aquisição de plasmídeos
•
Exs: Plasm. R. tropici
funções essenciais
úteis adaptação (genes simbióticos)
veículos transferência
genética
fenótipo simbiótico
(Phaseolus) Agrobacterium tumefaciens
Sinorhizobium adhaerens
Fabiana G. S. Pinto
Evolução e Filogenia de Rizóbios
•
Moléculas conservadas
tempo de divergência linhagens em
função alterações nas sequencias
•
Taxa evolução em todas a linhagens é parecida
•
Estimativa Tempo Divergência de rizóbios α-Proteobacteria
1-) Glutamina sintetase (GSI e GSII):
* GSII: Rhizobium e Sinorhizobium (+ recentes); Mesorhizobium e Bradyrhizobium
* GSI: Rhizobium- Sinorhizobium- Mesorhizobium (+ recentes); e Bradyrhizobium
2-)Taxa de substituição de aa genes ortólogos
•
Separação linhagens rizóbios: 553m.a. Bradyrhizobium
203 m.a. Sinorhizobium *
Fabiana G. S. Pinto
Localização rizóbios
•
Gene rrs (16S)
•
Carl Woese (1970)
•
Filo Proteobacteria
•
α- Proteobacteria
foi estabelecidacomo padrão em estudos de
filogenia e taxonomia
Archea, Bacteria e Eucarya
com 5 Classes
αβγδε
7 gêneros (48 sp)
- Rhizobium; Sinorhizobium; Mesorhizobium; Bradyrhizobium; Azorhizobium; Methylobacterium
e Devosia
•
β- Proteobacteria
2 gêneros (3 sp)
- Burkholderia e Wautersia
•
5 rizóbios genoma sequenciado
•
Árvore filogenética gene 16S dos rizóbios
Fabiana G. S. Pinto
Gene rrs bom marcador molecular ???
•
Bom marcador até Gênero?
•
É muito conservado e pode não ser informativo para inferir
relações filogenéticas
•
Pode sofrer eventos de recombinação por transferência
lateral
•
Pode haver mais de uma cópia e essas serem diferentes
EXCELENTE marcador filogenia de rizóbios
Fabiana G. S. Pinto
Inferências Filogenéticas com outros genes
•
Genes cromossomais:
•
rrl
23S rRNA
glnA e glnII
glutamina sintetase GSI e GSII
atpD
subunidade ATP sitetase
recA
recombinação
rpoB
subunidade RNA polimerase
dnaK
processos celulares : montagem das ptn
•
•
•
•
•
•
Construções filogenéticas coincidem com 16S rRNA
- diferenças nível intragenérico
Fabiana G. S. Pinto
Incongruências Filogenéticas Genes Simbióticos
•
Genes simbióticos
•
•
nifH
nitrogenase redutase (FBN)
nodABC
estrutura básica fator Nod
nodD
regulação
•
Filogenias genes simbióticos são incongruentes com 16S
•
Construções filogenéticas genes simbióticos
•
relações com hospedeiro
Nodulação
- Relacionada com planta hospedeira e/ou região biogeográfica
Exs: nodABC e nodD; nodC e nifH
Fabiana G. S. Pinto
6Estudos genômicos com rizóbios
6Sequenciamento plasmídeo Rhizobium NGR 234 (Freiberg et al, 1997)
6Kaneko et al, 2000
Sequenciamento completo Mesorhizobium loti
1 cromossomo (7Mb)
pMLa (351 Kb) e pMLb (208 Kb)
Ilha simbiótica (611 Kb)
6Galibert et al, 2001
Sequenciamento completo Sinorhizobium meliloti 1021
1 cromossomo (3,7 Kb)
pSymA (1,4 Kb) genes FBN e pSymB (1,7 Kb)
Fabiana G. S. Pinto
Göttfert et al., 2001
Sequenciamento região cromossômica eficiência simbiótica 410 Kb
Bradyrhizobium japonicum
6 Kaneko et al., 2002
Sequenciamento completo B. japonicum
1 cromossomo (9Mb) sem plasmídeos (8317 genes)
681 Kb→ilha simbiótica
Genes para transposases
Young et al., 2006
Sequenciamento R. leguminosarum biovar viceae estirpe 3841
1 cromossomo (5,05Mb) e 6 plasmídeos (7263 genes)
González et al., 2006
Sequenciamento R. etli CFN42
1 cromossomo (4,38Mb) e 6 plasmídeos
4287 genes similares a outros rizóbios
Fabiana G. S. Pinto
Região
Comparação entre genomas S. meliloti, M. loti, região
cromossomal 410 Kb B. japonicum e plasmideo
simbiótico 536Kb Rhizobium sp NGR 234
* 35% genes M. loti diferentes S. meliloti
* M. loti ilhas simbióticas que não apresentam
equivalente S. meliloti
* As informações pSymA e pSymB S. meliloti dispersas
em M. lotti
* Os genes de FBN de B. japonicum (crom) semelhantes
a M. loti
Todas estas observações indicam que rizóbios diferem significativamente
quanto ao conteúdo e organização gênica, independentemente de suas
relações taxonômicas e hábitos simbióticas
Fabiana G. S. Pinto
Fabiana G. S. Pinto
Genes Ortólogos
Genes Parálogos
Filogenia espécies
Filogenia de genes
“Genes Homólogos”
Fabiana G. S. Pinto