Estrutura Atômica
A descoberta da estrutura
atômica
tô i
• Os gregos antigos foram os primeiros a postular que a matéria é
constituída de elementos indivisíveis.
• Thales
Th l – água
á
• Anaxímenes – ar
• Heráclito
H á lit – fogo
f
• Empédocles – terra, ar, água e fogo (grande erro do
pensamento humano…)
humano )
• Leupico – “a matéria é discreta ou contínua?” - átomos
• Demócrito – existem muitos tipos de átomos (V AC)
Teoria atômica da matéria
• John Dalton:
– Cada elemento é composto de átomos.
átomos
– Todos os átomos de um elemento são idênticos.
– Nas reações químicas,
químicas os átomos não são alterados.
alterados
• Os compostos são formados quando átomos de mais de um
elemento se combinam.
• Lei de Dalton das proporções múltiplas: Quando dois elementos
formam diferentes compostos, a proporção da massa dos elementos
em um composto
t está
tá relacionada
l i d à proporção
ã da
d massa do
d outro
t
através de um número inteiro pequeno.
• Mais tarde, os cientistas constataram que o átomo era
constituído
co
st tu do de entidades
e t dades ca
carregadas.
egadas – Faraday
a aday e seus
experimentos de eletroquímica…
A descoberta da estrutura
atômica
tô i
Raios catódicos e elétrons
• Um tubo de raios catódicos é um recipiente com um eletrodo em
cada extremidade.
• Uma voltagem alta é aplicada através dos eletrodos.
A descoberta da estrutura
atômica
tô i
R i catódicos
Raios
tódi
e elétrons
lét
• A voltagem
lt
ffaz com que partículas
tí l negativas
ti
se desloquem
d l
do
d
eletrodo negativo para o eletrodo positivo.
• A trajetória dos elétrons pode ser alterada pela presença de um
campo magnético.
• Considere os raios catódicos saindo do eletrodo positivo através de
um pequeno orifício.
– Se eles interagirem com um campo magnético perpendicular a
um campo elétrico aplicado,
aplicado os raios catódicos podem sofrer
diferentes desvios.
A descoberta da estrutura
atômica
tô i
R i catódicos
Raios
tódi
e elétrons
lét
A descoberta da estrutura
atômica
tô i
R i catódicos
Raios
tódi
e elétrons
lét
– A quantidade
tid d de
d ddesvio
i ddos raios
i catódicos
tódi
ddepende
d dos
d
campos magnético e elétrico aplicados.
– Por sua vez, a quantidade do desvio também depende da
proporção carga-massa do elétron.
• Em 1897, Thomson determinou que a proporção carga-massa de
um elétron é 1,76 × 108 C/g.
• Objetivo: encontrar a carga no elétron para determinar sua massa.
A descoberta da estrutura
atômica
tô i
R di ti id d
Radioatividade
Considere o seguinte experimento:
• Uma substância radioativa é colocada em um anteparo contendo
um pequeno orifício de tal forma que um feixe de radiação seja
emitido ppelo orifício.
• A radiação passa entre duas chapas eletricamente carregadas e é
detectada.
• Três
T ê pontos são observados
b
d no detector:
d
– um ponto no sentido da chapa positiva,
– um ponto que não é afetado pelo campo elétrico,
elétrico
– um ponto no sentido da chapa negativa.
A descoberta da estrutura
atômica
tô i
Radioatividade
A descoberta da estrutura
atômica
tô i
R di ti id d
Radioatividade
• Um alto desvio no sentido da chapa positiva corresponde à
radiação que é negativamente carregada e tem massa baixa
baixa. Essa se
chama radiação β (consiste de elétrons).
• Nenhum desvio corresponde
p
a uma radiação
ç neutra. Essa se chama
radiação γ.
• Um pequeno desvio no sentido da chapa carregada negativamente
corresponde à radiação carregada positivamente e de massa alta.
Essa se chama radiação α.
A descoberta da estrutura
atômica
tô i
R i catódicos
Raios
tódi
e elétrons
lét
Considere
C
id o seguinte
i t experimento:
i
t
• Gotas de óleo são borrifadas sobre uma chapa carregada
positivamente contendo um pequeno orifício.
• À medida que as gotas de óleo passam através do orifício, elas são
carregadas negativamente.
• A gravidade força as gotas para baixo. O campo elétrico aplicado
força as gotas para cima.
• Quando uma gota está perfeitamente equilibrada,
equilibrada seu peso é igual à
força de atração eletrostática entre a gota e a chapa positiva.
A descoberta da estrutura
atômica
tô i
R i catódicos
Raios
tódi
e elétrons
lét
A descoberta da estrutura
atômica
tô i
R i catódicos
Raios
tódi
e elétrons
lét
• Utili
Utilizando
d este
t experimento,
i
t Millikan
Millik determinou
d t
i
que a carga no
elétron é 1,60 x 10-19 C.
• Conhecendo a proporção carga-massa, 1,76 x 108 C/g, Millikan
calculou a massa do elétron: 9,10 x 10-28 g.
• Com números mais exatos, concluimos que a massa do elétron é
28 g.
9 10939 x 10-28
9,10939
g
A descoberta da estrutura
atômica
tô i
O átomo
át
com núcleo
ú l
• Pela separação da radiação,
conclui se que o átomo consiste de
conclui-se
entidades neutras e carregadas
negativa
g
e ppositivamente.
• Thomson supôs que todas essas
espécies carregadas eram
encontradas
d em uma esfera.
f
A descoberta da estrutura
atômica
tô i
O átomo
át
com núcleo
ú l
Rutherford executou o seguinte experimento:
• Uma fonte de partículas α foi colocada na boca de um detector
circular.
• As ppartículas α foram lançadas
ç
através de um pedaço
p ç de chapa
p de
ouro.
• A maioria das partículas α passou diretamente através da chapa,
sem desviar.
d i
• Algumas partículas α foram desviadas com ângulos grandes.
• Se o modelo do átomo de Thomson estivesse correto,
correto o resultado
de Rutherford seria impossível.
A descoberta da estrutura
atômica
tô i
O átomo
át
com núcleo
ú l
• P
Para ffazer com que a maioria
i i ddas partículas
tí l α passe através
t é de
d um
pedaço de chapa sem sofrer desvio, a maior parte do átomo deve
consistir de carga negativa difusa de massa baixa − o elétron.
• Para explicar o pequeno número de desvios grandes das partículas
α, o centro ou núcleo do átomo deve ser constituído de uma carga
positiva densa.
A descoberta da estrutura
atômica
tô i
O átomo
át
com núcleo
ú l
• Rutherford modificou o modelo de
Thomson da seguinte maneira:
– Suponha
p
qque o átomo é esférico
mas a carga positiva deve estar
localizada no centro, com uma
carga negativa
i difusa
dif
em torno
dele.
A descoberta da estrutura
atômica
tô i
A descoberta da estrutura
atômica
tô i
• O átomo consite de entidades neutras, positivas e negativas
(prótons elétrons e nêutrons).
(prótons,
nêutrons)
• Os pprótons e nêutrons estão localizados no núcleo do átomo,, qque é
pequeno. A maior parte da massa do átomo se deve ao núcleo.
– Pode haver um número variável de nêutrons para o mesmo
número
ú
dde prótons.
ó
Os
O iisótopos
ó
têm
ê o mesmo número
ú
de
d
prótons, mas números diferentes de nêutrons.
• Os elétrons estão localizados fora do núcleo. Grande parte do
volume do átomo se deve aos elétrons.
A visão moderna da estrutura
atômica
tô i
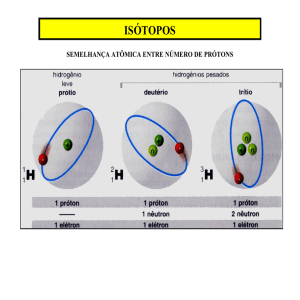
Isótopos números atômicos e números de massa
Isótopos,
• Número atômico (Z) = número de prótons no núcleo
núcleo. Número de
massa (A) = número total de núcleos no núcleo (por exemplo,
prótons e nêutrons).
• Por convenção, para um elemento X, escreve-se
• Isótopos têm o mesmo Z, porém A é diferente.
• Encontramos o Z na tabela periódica.
A
Z
X
Pesos atômicos
A escala de massa atômica
• A massa do 1H é 1,6735 x 10-24 g
e do 16O é 2,6560 x 10-23 g.
• Definimos: a massa de 12C = exatamente 12 u.
• Usando unidades de massa
atômica:
1 u = 1,66054 x 10-24 g
1 g = 6,02214 x 1023 u
Como 1mol = 6,02214 x 1023 unidades,
Podemos associar u e g para 1 mol de substância
Pesos atômicos
Massas atômicas médias
• A massa atômica relativa: massas médias dos isótopos:
– O C natural: 98,892
,
% de 12C + 1,107
,
% de 13C.
• A massa média do C:
• (0,9893)(12
(0 9893)(12 u)) + (0
(0,0107)(13,00335)
010 )(13 00335) = 12
12,01
01 u
• A massa atômica (MA) é também conhecida como massa atômica
média, ou simplesmente peso atômico.
• As massas atômicas estão relacionadas na tabela periódica.
Espectros de linhas e o
modelo de Bohr
O modelo
d l de
d Bohr
B h
• Rutherford supôs que os elétrons orbitavam o núcleo da mesma
forma que os planetas orbitam em torno do sol.
• Entretanto, uma partícula carregada movendo em uma trajetória
circular deve perder energia.
• Isso significa que o átomo deve ser instável de acordo com a teoria
d R
de
Rutherford.
h f d
Natureza ondulatória da luz
Natureza ondulatória da luz
• Todas as ondas têm um comprimento de onda característico, λ, e
uma amplitude, A.
• A frequência, ν, de uma onda é o número de ciclos que passam por
um ponto em um segundo.
d
• A velocidade de uma onda, V, é dada por sua frequência
multiplicada
lti li d pelo
l seu comprimento
i
t de
d onda.
d V=ν.
V
λ
• Para a luz, velocidade = c = ν. λ
Natureza ondulatória da luz
Espectros de linhas e o
modelo de Bohr
O modelo de Bohr
• Bohr observou o espectro de linhas de determinados elementos e
admitiu que os elétrons estavam confinados em estados específicos
de energia.
energia Esses foram denominados órbitas,
órbitas ou camadas.
camadas
Espectros de linhas e o
modelo de Bohr
Espectros de linhas
• Balmer: descobriu que as linhas no espectro de linhas visíveis do
hidrogênio se encaixam em uma simples equação.
• Mais tarde
tarde, Rydberg generalizou a equação de Balmer
para:
⎛ 1
1 ⎞
= 109678⋅ ⎜⎜ 2 − 2 ⎟⎟
λ
⎝ n1 n2 ⎠
1
em q
que 109678 é uma constante empírica.
p
Espectros de linhas e o
modelo de Bohr
O modelo de Bohr
• Já que os estados de energia são quantizados, a luz emitida por
át
átomos
excitados
it d deve
d
ser quantizada
ti d e aparecer como espectro
t de
d
linhas.
• Após muita matemática,
matemática Bohr mostrou que
(
E = − 2.18 × 10
−18
)
⎛ 1 ⎞
J⎜ ⎟
⎝ n2 ⎠
onde n representa o número da camada em que se encontra o
elétron mais tade conhecida como número quântico principal (por
elétron,
exemplo, n = 1, 2, 3, … e nada mais).
Espectros de linhas e o
modelo de Bohr
O modelo de Bohr
Espectros de linhas e o
modelo de Bohr
O ensaio de chamas
Li
Na
K
Energia quantizada e fótons
• Planck: a energia só pode ser liberada (ou absorvida) por átomos
em certos pedaços de tamanhos mínimos, chamados quantum.
• A relação entre a energia e a frequência é E = hν
onde h é a constante de Planck (6,626 × 10-34 J s).
Espectros de linhas e o
modelo de Bohr
O modelo de Bohr
• Podemos mostrar que
⎛ 1
⎞
hc
1
= − 2.18 × 10 −18 J ⎜ 2 − 2 ⎟
ΔE = hν =
⎜n
⎟
λ
n
i ⎠
⎝ f
(
)
• Quando ni > nff, a energia é emitida.
• Quando nf > ni, a energia é absorvida.
1
λ
(
− 2.18 × 10
=
hc
−18
)
J ⎛⎜ 1
1 ⎞⎟
−
⎜ n2 n2 ⎟
i ⎠
⎝ f
109730
Exercício
Espectros de linhas e o
modelo de Bohr
Limitações do modelo de Bohr
• Pode explicar adequadamente apenas o espectro de linhas do átomo
de hidrogênio.
• Os elétrons não são completamente descritos como partículas
pequenas.
O Comportamento
ondulatório da matéria
• Sabendo-se que a luz tem uma natureza de partícula, parece
razoável perguntar se a matéria tem natureza ondulatória.
• Utilizando as equações de Einstein e de Planck, De Broglie
mostrou:
λ =
h
m v
• O momento, mv, é uma propriedade de partícula, enquanto λ é uma
propriedade ondulatória.
• de
d Broglie
B li resumiu
i os conceitos
i de
d ondas
d e partículas,
í l com efeitos
f i
notáveis se os objetos são pequenos.
O Comportamento
ondulatório da matéria
O Comportamento
ondulatório da matéria
O princípio da incerteza
• O princípio da incerteza de Heisenberg: na escala de massa de
partículas
tí l atômicas,
tô i
não
ã podemos
d
determinar
d t
i
exatamente
t
t a
posição, a direção do movimento e a velocidade simultaneamente.
• Para os elétrons: não podemos determinar seu momento e sua
posição simultaneamente
simultaneamente.
• Mas podemos
podemos, baseando-nos
baseando nos na estatística,
estatística determinar a
probabilidade de encontrar um elétron em determinada região.
Mecânica quântica e
orbitais atômicos
• Schrödinger propôs uma equação que contém os termos onda e
partícula,
tí l com enfoque
f
estatístico.
t tí ti
• A resolução
l
dda equação lleva às
à funções
f
de
d onda,
d que definem
d fi
o
elétron em termos de energia, posição espacial no átomo, etc.
• O quadrado da função de onda fornece a probabilidade de se
encontrar o elétron
elétron, isto éé, dá a densidade eletrônica para o átomo e
nos leva à definição de orbital.
Mecânica quântica e
orbitais atômicos
• Equações de Schrödinger:
Partículas elementares
elementares…
…
• O Modelo Padrão: