Propriedades Mecânicas e
Térmicas dos Materiais
Márcio Nasser Medina
Este documento tem nível de compartilhamento de
acordo com a licença 3.0 do Creative Commons.
http://creativecommons.org.br
http://creativecommons.org/licenses/by-sa/3.0/br/legalcode
Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Propriedades Mecânicas e Térmicas dos Materiais
Ao longo do curso de Química, você já pôde perceber que essa ciência estuda a matéria e sua
composição, propriedades, estruturas e reações. Já aprendeu que a matéria é formada por átomos e
compostos que podem ocorrer como substâncias puras ou como misturas. Chamamos de composto as
substâncias em que dois ou mais tipos de átomos estão combinados quimicamente.
As substâncias estão identificadas por suas propriedades físicas, tais como: densidade, solubilidade,
calor específico, ponto de fusão e de ebulição e cor.
As diferenças nessas propriedades permitem que componentes sejam separados de uma mistura:
líquidos podem ser purificados por destilação simples ou fracionada; sólidos, por cristalização
fracionada. A cromatografia, por exemplo, também pode ser utilizada para separação de substâncias
que possuem propriedades de dissolução em dois sistemas, um móvel e outro estacionário. A
separação dos componentes da folha de uma planta pela bipartição dos mesmos em éter e carbonato
de cálcio (giz) é um exemplo de cromatografia.
Separando os pigmentos de uma planta por cromatografia em giz. ‐ Macere em um gral uma folha de espinafre (grande conteúdo de pigmentos) e adicione éter comum. ‐ Coloque a solução obtida em uma placa de Petri e, em cima do sistema, introduza um pedaço inteiro de giz branco. Espere alguns minutos. ‐ O resultado será surpreendente. PROPRIEDADES FÍSICAS
A mudança de fase de uma substância pode ocorrer de diversas maneiras. Quando fervemos um litro de
água na cidade do Rio de Janeiro, que se localiza ao nível do mar, a água inicia sua fervura por volta dos
100 oC. Se você fizer o mesmo procedimento na cidade de São Paulo (que se localiza a uma altitude de
860 metros), a água iniciará sua ebulição em uma temperatura abaixo de 100 oC, por volta dos 96 oC.
. 1 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Figura 1
Assim, podemos perceber que a pressão atmosférica altera a temperatura de ebulição.
No entanto, nossas roupas molhadas, após serem lavadas, secam à temperatura ambiente e em
nenhum momento a água precisou ser aquecida até a temperatura de ebulição para passar ao estado
de vapor, visto que em locais frios ou quentes a água da roupa é capaz de secar.
Em ambos os exemplos acima, ocorreu mudança da fase líquida para a de vapor em diferentes
maneiras: violenta (ebulição) ou suave (evaporação).
Mas, por que isso ocorre?
Não sei se você já percebeu que, quando andamos de bicicleta, transpiramos muito pouco em relação a
quando paramos. Ou ainda, se você já frequentou a sauna de um condomínio ou clube, notou que há
uma sensação de se transpirar mais na sauna a vapor, do que na sauna seca. O que justifica isso é o que
também explica o fato do ventilador nos refrescar, mesmo soprando ar na temperatura ambiente.
Nosso corpo utiliza a transpiração como regulador térmico que, além de eliminar o calor em excesso
contido dentro do nosso corpo, ainda resfria a superfície da pele ao entrar em contato com correntes de
ar. O fato é que o nosso suor, como a água das roupas, evapora (muda de fase) sem precisar ferver,
retirando do corpo o calor para sua evaporação.
Assim, podemos perceber que a pressão atmosférica altera a temperatura de ebulição.
. 2 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais No entanto, nossas roupas molhadas, após serem lavadas, secam à temperatura ambiente e em
nenhum momento a água precisou ser aquecida até a temperatura de ebulição para passar ao estado
de vapor, visto que em locais frios ou quentes a água da roupa é capaz de secar.
Em ambos os exemplos acima, ocorreu mudança da fase líquida para a de vapor em diferentes
maneiras: violenta (ebulição) ou suave (evaporação).
Mas, por que isso ocorre?
Não sei se você já percebeu que, quando andamos de bicicleta, transpiramos muito pouco em relação a
quando paramos. Ou ainda, se você já frequentou a sauna de um condomínio ou clube, notou que há
uma sensação de se transpirar mais na sauna a vapor, do que na sauna seca. O que justifica isso é o que
também explica o fato do ventilador nos refrescar, mesmo soprando ar na temperatura ambiente.
Nosso corpo utiliza a transpiração como regulador térmico que, além de eliminar o calor em excesso
contido dentro do nosso corpo, ainda resfria a superfície da pele ao entrar em contato com correntes de
ar. O fato é que o nosso suor, como a água das roupas, evapora (muda de fase) sem precisar ferver,
retirando do corpo o calor para sua evaporação.
Imagine-se em um prédio comercial bem alto, esperando o elevador chegar para apanhá-lo por volta da
hora do rush. Todas as vezes que ele para no andar onde você se encontra, está sempre lotado de
pessoas e você não consegue entrar, por mais que empurre um ou outro passageiro. Eles, por sua vez,
empurram-te de volta para fora. Para você entrar, alguém teria de sair do elevador. Então, acaba
esperando outro chegar ao seu andar ou se irrita e desce pelas escadas.
Agora, imagine-se nesse mesmo prédio em um dia de domingo ou fora do horário comercial. Ao abrir a
porta do elevador, raro será encontrar algum passageiro ali dentro, não é verdade? Então, você
consegue deixar aquele andar facilmente.
Conseguiu imaginar? É mais ou menos assim que acontece na dinâmica dos líquidos. Uma gota de água
da roupa ou de suor do corpo é representada por você naquela situação. Para evaporar, ela necessita da
energia que será fornecida pelo corpo. Mas, mesmo adquirindo essa energia, dependendo da situação,
ela não será capaz de evaporar, pois a atmosfera já se encontra saturada de vapor d’água (lembre-se
dos outros passageiros!). Desse modo, ficará parada na superfície em forma de gota ou escorrerá.
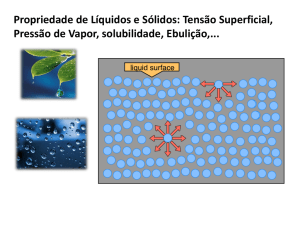
A passagem de moléculas do líquido para a fase de vapor e a passagem de moléculas de vapor para a
fase líquida está constantemente ocorrendo junto à superfície do líquido. É um processo dinâmico, em
que o líquido evapora quando é maior a quantidade de moléculas que passam para a parte de vapor.
No entanto, se a umidade for grande (elevador cheio), isto é, a concentração de vapor junto à superfície
do líquido for elevada, haverá uma diminuição de moléculas evaporadas, o que representa uma
. 3 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais diminuição da velocidade de evaporação e, possivelmente, uma passagem do vapor para o estado
líquido (liquefação).
A sensação térmica depende da presença de vapor d’água na atmosfera. Na floresta Amazônica, a
atmosfera encontra-se sempre saturada (calor úmido), dificultando a evaporação do suor. Já no deserto
de Atacama (Chile), a presença de vapor d’água na atmosfera é quase nula, o que provoca uma
transpiração adequada, evitando os males da hipertermia.
Para as moléculas se vaporizarem, elas precisam absorver calor. A evaporação produz a sensação de frio
devido à captação de calor pelas moléculas de água durante o processo. É essa sensação que sentimos
ao sair da água, enquanto nosso corpo está molhado. A água, para evaporar, retira calor do nosso corpo,
diminuindo, assim, a temperatura da pele (que cedeu calor!).
O vento que sentimos ao andar de bicicleta e ao sentarmos em frente a um ventilador, aumenta a
velocidade do processo da evaporação, por isso a diminuição da sensação de calor nessas situações.
Digamos que os elevadores descessem e subissem muito velozmente ou que tivessem vários
elevadores disponíveis para que você e todas as demais pessoas abandonassem o prédio. Isso aceleraria
o processo, de forma semelhante ao que o ventilador faz. Ao afastar a umidade de perto da superfície,
haverá uma maior evaporação das moléculas de água, causando uma sensação de frio, igualmente
àquela que sentimos ao sair molhados do banho.
Conforto Térmico Humano: é um conceito subjetivo, associado à sensação
térmica considerada agradável ao homem. Em termos físicos, está associado
ao estado em que o indivíduo encontra-se em equilíbrio térmico com o
ambiente, de forma que seu corpo não necessita despender energia para
elevar ou reduzir a temperatura interna. A rigor, o conforto térmico
dependerá de variáveis do ambiente: temperatura, umidade relativa, vento,
pressão barométrica, calor irradiado pelos corpos vizinhos, etc.; e de variáveis
do indivíduo: peso, superfície, indumentária, estado de repouso ou atividade,
etc.
. 4 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais PRESSÃO DE VAPOR
Experimentalmente, observou-se que um gás a alta pressão poderia se liquefazer, como o gás dos
isqueiros ou GLP dos botijões de cozinha. Dessa maneira, o experimento consistiu de um cilindro
fechado por um êmbolo móvel. Ao comprimir o gás (diminuir o volume) à temperatura constante, a
pressão exercida pelo vapor aumenta. Continuando a diminuição do volume, a partir de certo ponto o
vapor começa a se condensar (virar líquido).
Simulação 01
Um recipiente provido de um êmbolo vertical móvel com um
gás ocupando o interior. Ao abaixar o êmbolo, a pressão
aumenta e a condensação se inicia. Um manômetro registra a
pressão. Moléculas penetram através da superfície do líquido
que vai se formando.
Nessa temperatura, a pressão em que ocorre a condensação é chamada de pressão máxima de vapor.
Se fizermos o mecanismo ao contrário, a partir de um líquido, ou seja, ir diminuindo a pressão sobre ele,
observaremos o fenômeno inverso.
Simulação 02
Um recipiente provido de um êmbolo vertical móvel com um
líquido ocupando o interior e tangenciando a superfície livre
do líquido. Ao levantar o êmbolo, a pressão diminui e a
evaporação se inicia. Um manômetro registra a pressão e
moléculas se desprendem da superfície do líquido e
vagueiam pelo espaço livre acima da superfície desse líquido.
Podemos observar que a pressão de vapor de um líquido é a pressão onde ocorrerá mudança de fase
daquela substância.
. 5 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Em nosso dia-a-dia, esse efeito também pode ser percebido ao abrirmos um vidro de perfume e
sentirmos os seus vapores. Devido ao espaço “vazio”, e ao próprio esvaziamento do recipiente, a
pressão sobre o líquido diminui, permitindo que o líquido se evapore mais rápido. Após certo tempo, o
vapor e o líquido entram novamente em equilíbrio dinâmico e esse processo “para”. Isso ocorre porque
se uma molécula conseguir sair do líquido para o vapor, outra terá saído do vapor e entrado no líquido.
Ao abrirmos o frasco, devido à diferença de pressão (a interna está maior do que a externa), os vapores
são expelidos do frasco, permitindo-nos sentir o seu aroma, mesmo à distância.
Há alguns anos foi comercializada uma tampa PUMP para refrigerantes que prometiam manter a
bebida com gás por mais tempo. Na verdade, sua função era bombear ar para dentro da garrafa,
preenchendo assim o espaço “vazio” com o ar a alta pressão. Dessa forma, o gás carbônico
diluído na bebida não conseguia sair do líquido, mantendo-se “preso”. Podia-se, então, beber a
bebida com gás, mesmo depois de alguns dias. Lembre-se que sempre houve ar atmosférico
naquele espaço “vazio”, mas que a pressão em que ele se encontra não é suficiente para
assegurar que o gás carbônico diluído no refrigerante permaneça preso. Por isso, mesmo
mantendo a garrafa bem fechada, após a primeira abertura, o gás do refrigerante “escapa” depois
de algumas horas na geladeira.
Figura 2
Figura 2
. 6 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Um uso bem distinto da pressão e da temperatura é na previsão de tempo.
Sabemos que o ar quente é menos denso (mais leve) do que o ar mais frio. Assim, em um dia qualquer,
você poderia esperar que o ar sobre um deserto tivesse uma pressão menor do que o ar sobre uma
calota de gelo. E isso seria verdadeiro. Essa mesma diferença de pressão ocorre em todo o planeta, por
vários motivos. As diferenças de pressão têm um grande efeito sobre o clima, de modo que se você
souber a pressão do ar, assim como a tendência da pressão, será capaz de predizer certas coisas sobre o
tempo. Em geral, uma área de alta pressão estará ensolarada e uma área de baixa pressão estará
nublada e chuvosa.
A partir da meteorologia náutica, utilizada pelos navegantes, a chegada de uma frente fria, com ventos
fortes e chuvas, pode ser prevista pelas alterações bruscas das medidas de um barômetro e de um
termômetro. Uma vez que a pressão do ar caia rapidamente – um barômetro "descendo" indica uma
diminuição da pressão do ar – e a temperatura local suba, aumentará a indicação do termômetro, com
igual velocidade. Da mesma maneira, se a marcação da pressão estiver subindo – um barômetro
"subindo" indica um aumento da pressão do ar – é sinal de que o tempo será bom. Pode-se perceber
que a velocidade com que a pressão se modifica é um parâmetro para saber a duração do tempo bom
ou mau. Por exemplo, se a mudança for brusca, o mau tempo será de curta duração e o bom tempo
logo voltará. Se for lenta, poderemos prever que o mau tempo terá longa duração.
BARÔMETRO
TERMÔMETRO
TEMPO PROVÁVEL
Subindo
Subindo
Tempo bom, ventos quentes e secos
Subindo
Estacionário
Tempo bom, ventos frescos
Subindo
Baixando
Tempo bom
Estacionário
Subindo
Tempo mudando para bom
Estacionário
Estacionário
Tempo incerto, ventos variáveis
Estacionário
Baixando
Chuva provável
Baixando
Subindo
Tempo instável, aproximação de frente
Baixando
Estacionário
Frente quente com chuvas prováveis
Baixando
Baixando
Chuvas abundantes e ventos fortes
Tabela 1
. 7 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Figura 3
Embora a leitura conjunta do barômetro e do termômetro permita acertar, com bastante frequência, as
condições do tempo, não se pode confiar integralmente nesse tipo de previsão. Atualmente, a previsão
do tempo é feita por meio de satélites meteorológicos e data-loggers que registram todas as variações
em diferentes regiões do país.
Temperatura do ar em superfície: é a subtração entre o campo de temperatura do ar em superfície em
um dado horário e o campo 24 horas antes. Valores positivos indicam aumento de temperatura do ar
em 24 horas. Por exemplo, diminuição considerável de temperatura do ar sugere que o modelo está
prevendo a entrada de uma massa de ar frio sobre a região, enquanto que se ocorrer um elevado
aumento de temperatura do ar, indica incursão de uma massa de ar quente sobre a região.
Pressão ao nível médio do mar: é a subtração entre o campo de pressão reduzido ao nível médio do
mar em um dado horário e o campo 24 horas antes. Valores positivos indicam aumento da pressão
atmosférica em 24 horas. Esse campo representa o deslocamento dos centros de alta e baixa pressão ao
nível médio do mar, previsto pelo modelo. Diminuição de pressão (aproximação de um centro de baixa
. 8 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais pressão) pode indicar condições favoráveis ao aumento da instabilidade na atmosfera, o que favorece a
formação de nuvens. Já o aumento de pressão (aproximação de um centro de alta pressão)
desfavorece a formação de nuvens de chuva. Esse campo é relevante para a previsão de tempo nas
regiões extratropicais.
PONTO DE EBULIÇÃO
Quando colocamos certa quantidade de líquido para ferver em um recipiente aberto, por exemplo, uma
quantidade de água para o preparo de um macarrão, notaremos que, a partir de certo instante,
começam a surgir bolhas, inicialmente no fundo. As primeiras bolhas são do ar que estava diluído na
água. Em seguida, por volta dos 100 oC (se você estiver ao nível do mar) surgem bolhas maiores de
vapor, formando-se em todo o líquido. Essas bolhas sobem para a superfície e se quebram. Nesse
momento, dizemos que o líquido está em ebulição.
A temperatura em que o líquido ferve, como já vimos, depende da pressão exercida sobre ele. Isso
porque a pressão da bolha para conseguir sair e explodir precisa ser maior do que a pressão acima dela.
Concluiu-se que um líquido entra em ebulição a uma temperatura na qual a pressão de vapor iguala-se
à pressão exercida sobre sua superfície. Veja o gráfico a seguir.
Gráfico 1
. 9 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Podemos observar que, conforme a pressão sobre o líquido vai se elevando, aumentará também sua
temperatura de ebulição. Naturalmente, uma diminuição de pressão provoca um abaixamento na
temperatura de ebulição. Isso explica o porquê de em São Paulo a água ferver a uma temperatura
menor do que no Rio de Janeiro, pois em locais situados acima do nível do mar, onde a pressão
atmosférica é menor do que 760 mmHg, a água entrará em ebulição a temperaturas inferiores a 100 oC
(observe a tabela a seguir).
No alto do monte Everest, cuja altitude é de 8.848 m e a pressão atmosférica é cerca de 26 mmHg, a
água entra em ebulição a 72 oC. Então, tentar cozinhar no alto do monte Everest, sem panela de
pressão, é quase impossível para alguns alimentos.
Pressão Atmosférica
Ponto de Ebulição da
(mmHg)
água (oC)
0
760
100
500
720
98
1000
670
97
1500
640
95
2000
600
93
2500
560
92
9000
240
70
Altitude (m)
Tabela 2: Ponto de ebulição da água a diversas altitudes
. 10 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Substância
Ponto de
Substância
Ponto de
ebulição (°C)
ebulição (°C)
Água (H2O)
100
Zinco (Zn)
918
Álcool (C2H6O)
78
Alumínio (Al)
2519
Cobre (Cu)
2595
Cloreto de sódio (NaCl)
1465
Chumbo (Pb)
1744
Acetona (C3H6O)
56,5
Enxofre (S)
445
Ácido acético (C2H4O2)
118
Ferro (Fe)
3000
Anilina (C6H7N)
184,1
Hidrogênio (H2)
-253
Benzeno (C6H6)
80,1
Mercúrio (Hg)
357
Clorofórmio (CHCl3)
61,3
Nitrogênio (N2)
-196
Fenol (C6H5OH)
181,4
Ouro (Au)
2966
Nitrobenzeno (C6H5NO2)
211
Oxigênio (O2)
-183
Sulfureto de carbono (CS2)
46,7
Prata (Ar)
2212
Tetracloreto de carbono
76,7
(CCl4)
Tabela 3: Pontos de ebulição de substâncias ao nível do mar (p = 1 atm = 105 Pa = 760 mmHg)
Observando a tabela, podemos perceber que os metais possuem os pontos de ebulição bastante altos,
acima de 1200 oC. Já os líquidos fixos (pouco voláteis) têm pontos de ebulição acima de 100 oC e os
voláteis, abaixo de 100oC.
PONTO DE FUSÃO
Para uma substância pura, o ponto de fusão é igual ao ponto de congelamento. Ele representa a
temperatura na qual as fases líquida e sólida estão em equilíbrio. Os pontos de fusão são geralmente
medidos em um recipiente aberto (submetido à pressão atmosférica).
. 11 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Substância
Ponto de
Substância
Ponto de
fusão (°C)
fusão (°C)
Água (H2O)
0
Zinco (Zn)
420
Álcool (C2H6O)
-114
Alumínio (Al)
660
Cobre (Cu)
1083
Cloreto de sódio (NaCl)
801
Chumbo (Pb)
327
Acetona (C3H6O)
-95
Enxofre (S)
115
Ácido acético (C2H4O2)
16,6
Ferro (Fe)
232
Anilina (C6H7N)
-6,3
Hidrogênio (H2)
1535
Benzeno (C6H6)
5,5
Mercúrio (Hg)
-259
Clorofórmio (CHCl3)
-63,6
Nitrogênio (N2)
-39
Fenol (C6H5OH)
40,6
Ouro (Au)
1604
Nitrobenzeno (C6H5NO2)
5,7
Oxigênio (O2)
-223
Sulfureto de carbono (CS2)
-110,8
Prata (Ar)
962
Tetracloreto de carbono
-22,6
(CCl4)
Tabela 4: Pontos de fusão de substâncias ao nível do mar (p = 1 atm = 105 Pa = 760 mmHg)
. 12 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Faça você mesmo: mudança do ponto de ebulição pela variação da
pressão
1) Ferva uma pequena quantidade de água (uns 100 ml), para
que seja rápido.
2) Pegue uma seringa grande (de 25 ml ou 50 ml), sem agulha.
3) Assim que a água começar a ferver, apague o fogo e
preencha 1/3 da seringa com essa água a 100 oC (se você estiver ao
nível do mar) e tampe o bico com um pedaço de borracha ou massa
epóxi. Aponte a seringa verticalmente e puxe o êmbolo rapidamente.
Veja que a água volta a borbulhar, embora a temperatura não
seja mais de 100 oC. Ao aumentar o espaço interno (o volume), a
pressão será reduzida, diminuindo também o ponto de ebulição da
água, que estará fervendo abaixo de 100 oC.
Mas os pontos de ebulição e fusão ainda sofrem influência de outros fatores, como, por exemplo, a
adição de soluto não volátil ao solvente, também conhecidos como abaixamento crioscópico
(abaixando o ponto de fusão) ou tonoscópico (aumento do ponto de ebulição). Essas são propriedades
coligativas, não dependem da natureza química das partículas, apenas do número de partículas de
soluto diluídas. Para entendermos isso melhor, podemos realizar uma experiência bem simples:
misturar sal na água. Ao adicionarmos sal à água, os pontos de ebulição e fusão sofrem alterações, isto
é, o ponto de ebulição aumenta e o ponto de fusão diminui. Alguns exemplos interessantes ilustram
essa propriedade.
Nos países temperados, durante o frio de inverno, as estradas ficam cobertas por uma densa camada de
gelo ou neve, o que impede o tráfego de veículos. Uma solução encontrada foi espalhar sal pelo asfalto.
Quando o sal é espalhado pelo piso, há dissolução do sal na água, separando-se os íons Na+ e o Cl-.
Acontece que a temperatura de solidificação da água depende fortemente do teor de sal dissolvido.
Veja na tabela a seguir a diminuição da temperatura de fusão da água em função do cloreto de sódio
(NaCl) dissolvido.
. 13 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Percentagem em massa
Concentração de
Temperatura de
de NaCl na solução
NaCl em g/L
fusão em oC.
0
0
0
3,5
36
- 2,1
5
53
- 3,1
10
121
- 6,5
15
176
- 10,9
20
260
- 16,5
Tabela 5
Podemos verificar por meio dos dados que, realmente, conforme a concentração de NaCl aumenta, há
uma sensível diminuição da temperatura de fusão. Atente também para a segunda linha da tabela, essa
concentração registrada é justamente a concentração de sal na água do mar, confirmando o dado que
ela congela a – 2,1oC.
Nos churrascos, é muito comum enchermos uma caixa de isopor ou um latão de gelo para refrescar as
bebidas. Esse processo de resfriamento costuma ser acelerado acrescentando-se sal à mistura de gelo,
água e latinhas. A água líquida conduz melhor o calor do que o gelo. Além disso, o líquido resultante da
mistura de gelo e sal está a uma temperatura abaixo de 0 °C. Tudo isso faz com que a energia térmica da
bebida seja "removida" com maior velocidade, tornando-a mais gelada em menos tempo.
. 14 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Faça você mesmo: gelando uma bebida mais rápido.
Você já participou daqueles churrascos de turma em que a comissão
organizadora demorou a colocar as bebidas da festa na geladeira ou no
freezer, ou mesmo foi surpreendido com o término da bebida no meio
da festa e no mercado só havia bebida a temperatura ambiente?
Conhecendo as propriedades físicas da matéria, você pode resfriar
bebidas enlatadas e engarrafadas rapidamente. Teste você mesmo!
1) Encha um recipiente com água e gelo.
2) Adicione sal à mistura. Isso funciona porque a água com sal tem um
ponto de congelamento menor do que a água pura.
3) Adicione as bebidas e mexa continuamente por alguns instantes.
Ao mexer, estará forçando a convecção, o que acelera a transferência
de calor entre a bebida e a água com gelo e sal.
4) Espere dois minutos e meça a temperatura de uma das bebidas,
que deve já ter diminuído perceptivelmente. Se ainda precisar de mais
tempo, mexa o restante por mais um minuto ou dois.
5) Aprecie a bebida gelada. Ela deve estar agora na temperatura ideal.
. 15 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Faça você mesmo: mudança do ponto de fusão pela variação da
pressão
1)
Congele a água em um pote de sorvete de 2 L.
2)
Retire com cuidado o bloco de gelo e coloque-o apoiado em
uma prateleira de vidro ou plástico, de preferência com a mesma
largura que a do bloco.
3)
Encha duas garrafas PET de 2 L de água (o que dará cerca
de 2 kg cada uma) e prenda-as nas extremidades com um fio
metálico bem fino (de preferência uma corda de guitarra E ou B).
Atenção: esse fio NÃO deve possuir nenhuma película o envolvendo!
4)
Coloque o fio esticado sobre o bloco de gelo de maneira que
as garrafas PET estejam penduradas sem encostar ao chão.
Dependendo das condições locais, essa experiência poderá durar
horas. Veja o que acontecerá com o fio e o gelo. O fio irá transpassar
o gelo, como se estivesse cortando-o (e está!). Assim que o gelo
afundar, haverá um regelo na parte acima. E isso irá continuar até
que o fio passe totalmente (ou o gelo derreta todo!).
Com o aumento da pressão naquele ponto, o ponto de fusão
abaixa, derretendo mais rápido o gelo. Ao transpassar o fio pelo gelo,
a pressão sobre o ponto volta a ser a atmosférica, retornando ao 0 oC
– o ponto de fusão, (que é a temperatura do gelo!) –, colando as
superfícies acima do fio, o regelo.
Há alguns anos, começou a ser vendido no Brasil um líquido curioso, conhecido como anticongelante.
De fato, os proprietários de automóveis ignoraram e até mesmo riram dessa notícia, afinal, para que nos
preocupar com o “congelamento” do motor em um país tropical, cuja temperatura média é de 25 oC?
Vamos entender o porquê da importância desse tipo de produto para o bom funcionamento do carro.
Nos países subtropicais e temperados que possuem invernos rigorosos, a temperatura permanece
abaixo de zero durante horas, às vezes dias.
Os veículos automotores utilizam, em sua maioria, água como arrefecedores (esfriadores) do motor. Em
uma noite de frio (é possível!), a água do radiador congela, pois é fato que a água congela a zero grau.
. 16 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Primeiro, é importante saber que, quando a água congela, ela se expande, isto é, aumenta de volume, o
que a Física chama de comportamento anômalo da água. Isso é explicável pela conformação espacial
que as moléculas adquirem ao se atraírem mais fortemente por pontes de hidrogênio no estado sólido.
Então, se a água do radiador congelar, ele irá se romper e, por conseguinte, danificar o motor do
automóvel.
Misturando-se o anticongelante etileno-glicol (OH–CH2–CH2–OH) na água do radiador, esse tipo de
fenômeno estará resolvido. Uma vez adicionado, ele passa a atrair fortemente as moléculas da água.
Isso acontece porque o etileno-glicol carrega dois grupos OH. Em cada um deles há uma carga negativa
no O- e uma positiva no H+. Essas mesmas cargas aparecem na molécula de H2O, possibilitando o
surgimento de forças de atrações eletrostáticas entre esses dois tipos de moléculas, que dificultam a
organização dos cristais de gelo. E, de fato, a água só irá congelar agora a -37 oC (≅ - 35 oF).
Curiosamente, o uso desse anticongelante altera também o ponto de ebulição da água, aumentando-a,
o que possibilita que a água ferva a temperaturas acima de 100 oC. Na verdade, a adição de 50% de
etileno glicol à água do radiador faz com que a temperatura de congelamento seja inferior a -33o C e a
de ebulição superior a 163 oC. Será que os motoristas ririam agora?
Experimentalmente, pode-se perceber um fenômeno muito importante para a manutenção da vida.
Coloque álcool etílico em um cilindro fechado por uma membrana semipermeável e mergulhe-o em
água pura. Após alguns instantes, a membrana começará a inchar consideravelmente, podendo até se
romper. Devido à membrana ser semipermeável, a água poderá atravessá-la, mas o álcool não. O
aumento de pressão no recipiente é determinado pela difusão da água para a solução, que pode ser
alterada pela adição de solutos não-voláteis aos solventes. Esse aumento de pressão é chamado de
pressão osmótica.
Para entender o que é pressão osmótica, é necessário, primeiramente, saber o que é osmose. O
processo no qual duas soluções de mesmo solvente – ou uma solução e seu solvente – são separadas
por uma membrana semipermeável, ocorrendo a difusão do solvente de modo que as duas soluções
fiquem com a mesma concentração, é chamado de osmose. Esse é um tipo de difusão na qual, embora
a membrana semipermeável permita a passagem de solvente nos dois sentidos, o solvente da solução
mais diluída passa para a mais concentrada. Pressão osmótica é, então, a pressão que deve ser exercida
sobre a solução para impedir a passagem de solvente de uma solução para outra, ou seja, impedir a
osmose.
. 17 . Sala de Leitura Propriedades Mecânicas e Térmicas dos Materiais Soluções de mesma pressão osmótica são ditas isotônicas. Em soluções de diferentes pressões
osmóticas, a solução de menor pressão é dita hipotônica e a de maior pressão, hipertônica.
Os seres vivos se depararam com a osmose desde sua origem, uma vez que tudo indica que eles
surgiram em meio aquoso, como sistemas isolados do ambiente por uma membrana semipermeável
capaz de regular a passagem dos sais e nutrientes para o interior da célula ou o exterior dela.
Durante o processo evolutivo, os seres vivos desenvolveram não só maneiras de evitar problemas
causados pela osmose (inchação ou ressecamento), como também processos que aproveitam a
dinâmica osmótica nos fenômenos biológicos.
A regulação da osmose em meio marinho (a osmorregulação) é um problema importante, tanto para
peixes ósseos, como para peixes cartilaginosos.
Os tubarões, no entanto, lidam com o problema de forma totalmente diferente do restante dos peixes.
Eles reabsorvem praticamente todos os produtos azotados resultantes do metabolismo proteico,
aumentando, assim, a pressão osmótica dos seus fluidos internos. Eles retêm uma grande quantidade
de ureia circulante (menos tóxica), sintetizada a partir da amônia (altamente tóxica), o que aumenta a
pressão osmótica do sangue a ponto de quase igualá-la a do mar. Dessa maneira, os tubarões não têm
os problemas que os peixes ósseos possuem, pois esses gastam muita energia para manter a sua
concentração interna menor do que a da água do mar. O curioso é que, dessa maneira, também não há
ressecamento dos olhos do tubarão, permitindo sua visão embaixo da água salgada. Assim, tornam-se
hipertônicos em relação ao meio salgado, forçando a água a entrar passivamente, por osmose.
Em nosso cotidiano, podemos destacar a salmoura feita nos peixes como um dos mais antigos meios de
conservação de alimentos, a exemplo do bacalhau e da carne kosher dos judeus. Na salga, a ação do sal
é dupla: o sal desidrata a carne por diferença de pressão osmótica entre o meio externo e interno e
penetra na carne, baixando a atividade da água.
. 18 .