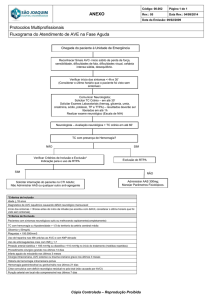
Postpartum haemorrhage: what is the best uterotonic agent for prophylaxis?
Abstract Resumo
A hemorragia puerperal é a principal causa isolada de morbimortalidade materna no mundo.
O uso rotineiro de uterotônicos no terceiro período do parto mostrou reduzir a incidência
de hemorragia puerperal em 40 a 50%, mas a droga de escolha ainda é desconhecida por
muitos obstetras. Foi feita uma atualização sobre as drogas comumente usadas para profilaxia
da hemorragia puerperal, comparando principalmente a eficácia e os efeitos colaterais.
Postpartum haemorrhage is the single most important cause of maternal morbidity and
mortality. The routine use of uterotonic agents during the third stage of labour reduces
the risk of haemorrhage by 40 to 50%, but the drug of choice for this purpose remains
unknown for many obstetrician-gynecologists. An update on the common used drugs for
prophylaxis of the puerperal hemorrhage was made, mainly comparing the collateral effect
and efficacy.
AT U A L I Z A Ç Ã O
Hemorragia puerperal:
qual melhor uterotônico para profilaxia?
Carolina Sales Vieira
Ricardo Cavalli de Carvalho
Geraldo Duarte
Antônio Alberto Nogueira
Rafael Kioshi Yano
Silvana Maria Quintana
Palavras-chave
Hemorragia puerperal
Ocitocina
Uterotônicos
Keywords
Postpartum Haemorrhage
Uterotonic agents
Oxytocin
Departamento de Ginecologia e Obstetrícia da Faculdade de Medicina de Ribeirão Preto (USP)
FEMINA | Julho 2007 | vol 35 | nº 7
435
Hemorragia puerperal: qual melhor uterotônico para profilaxia?
Introdução
• Desconhecimento por parte da equipe de saúde de medidas
A Organização Mundial de Saúde (OMS) estima que
aproximadamente 529.000 mulheres morram anualmente
devido a complicações relacionadas ao ciclo gravídico-puerperal, sendo os países em desenvolvimento responsáveis por
grande parte dessas mortes (WHO, 2004).
No Brasil, a razão de morte materna é de 74,5 óbitos /
100.000 nascidos vivos, enquanto em países desenvolvidos
como Canadá e Estados Unidos, as taxas de mortalidade
materna são inferiores a 9 óbitos / 100.000 nascidos vivos
(Ministério da Saúde, 2000). Enquanto na África e Ásia a
hemorragia puerperal representa a principal causa de óbito, na
América Latina e Caribe, as desordens hipertensivas lideram
as causas de mortes maternas (Khan et al., 2006). Em nosso
país, quanto às causas de óbito materno, predominam as
obstétricas diretas (74%), sendo as principais responsáveis,
em ordem decrescente, a pré-eclampsia / eclampsia, as hemorragias e as infecções (puerperal e aborto). A grande maioria
dessas mortes poderia ser evitada mediante a adoção de
assistência adequada ao pré-natal, parto, puerpério, urgências
e emergências obstétricas (Ministério da Saúde, 2000).
Embora, no Brasil, a hemorragia puerperal (HP) não represente
a principal causa de morte materna, trata-se da causa isolada
mais importante de morbimortalidade mundo, com 14 milhões de
casos novos anualmente (WHO, 1998), correspondendo a 25%
do total de óbitos maternos no mundo (Tsu et al., 2004).
Com alta e variada incidência reportada (Elbourne et al.,
2003), cerca de 5 a 18% de todos os partos, a HP pode ser
controlada ou tornar-se fatal. A maioria dos óbitos por HP ocorre
dentro dos primeiros 7 dias após o parto (Li et al., 1996).
Em 1992, Kane et al. realizaram um estudo, no Egito, no
qual 88% das mortes por HP ocorreram nas quatro primeiras horas pós-parto, mostrando que as primeiras horas são
cruciais na determinação do prognóstico materno.
Muitos fatores influenciam para que a HP torne-se fatal
ou apresente alta morbidade:
• Alta incidência de anemia grave entre as gestantes de países
•
em desenvolvimento, o que leva a menor tolerância à perda
sangüínea comparado a mulheres saudáveis;
• Em alguns países e em algumas regiões brasileiras, o acesso
a hospitais é difícil, o que retarda a abordagem adequada da
HP. Com isso, muitas puérperas que necessitariam apenas de
medidas simples (uterotônicos, compressão uterina) são submetidas a procedimentos de maior risco como a histerectomia
pelo agravamento do quadro da hemorragia;
• Mesmo em partos hospitalares, muitos médicos e a equipe de
saúde não são preparados para procedimentos de urgências e
emergências obstétricas;
436
FEMINA | Julho 2007 | vol 35 | nº 7
•
•
•
preventivas a fim de se reduzir a incidência de HP;
Incidência elevada de partos cirúrgicos em alguns países em
desenvolvimento, como o Brasil, o que acaba por conduzir
gestações absolutamente normais a riscos materno-fetais desnecessários (incidência de HP em partos vaginais 3,2% versus
6,9% em cesarianas) (ACOG, 1998);
Falta de banco de sangue ou acesso a serviços de transfusão
de hemoderivados em maternidades;
Inadequação da abordagem técnica da equipe de saúde no
terceiro período do parto e/ou falta de vigilância no quarto
período do parto (ou de Greenberg);
Estocagem inadequada de uterotônicos em países tropicais, o
que pode levar a queda de eficácia do mesmo.
Por tudo isso, em países com alta mortalidade materna
como o Brasil, a introdução de práticas de baixo custo e
baseadas em evidências científicas que previnam a HP é uma
maneira de investimento na qualidade da saúde da mulher e
na redução da morbimortalidade materna.
Hemorragia puerperal
Classicamente, HP é definida como a perda sanguínea
maior ou igual a 500 mL proveniente do trato genital nas
primeiras 24 h do parto (McCormick et al., 2002). Apesar
de ser a definição mais aceita, sabe-se que o diagnóstico
de hemorragia é normalmente subjetivo, o que provoca
a subestimação do volume real de sangue perdido na
ordem de 30 a 50% (ACOG, 1998). Contribui para esse
subdiagnóstico da HP o fato do sangue misturar-se a
urina ou líquido amniótico, além de estar disperso em
compressas e gazes, dificultando sua medida precisa (Tsu
et al., 2004).
Levando-se em conta a dificuldade de aferir objetivamente
a perda sangüínea, uma definição mais acurada para HP é a
diminuição de 10% do hematócrito de admissão para aquele
colhido no pós-parto (ACOG, 1998). Pode ser também definida como qualquer perda sangüínea que cause alterações
hemodinâmicas capazes de ameaçar a vida da puérpera. Essa
definição também é útil clinicamente, em especial nos países
em desenvolvimento, nos quais a incidência de gestantes
anêmicas é alta e essas pacientes apresentam menor tolerância
a perdas sangüíneas.
Com relação às causas mais comuns de HP, cita-se em ordem
decrescente a hipotonia ou atonia uterina (principal causa),
traumas do trato genital e retenção de restos placentários
(Ministério da Saúde, 2000). Desse modo, a prevenção da HP
depende eminentemente de se evitar essas morbidades e da
profilaxia da anemia na gravidez.
Hemorragia puerperal: qual melhor uterotônico para profilaxia?
Existem alguns fatores associados ao aumento da incidência
de HP (Quadro 1), porém sabe-se que dois terços dos casos
de HP ocorrem em mulheres sem fatores de risco. Em vista
de não haver fatores de riscos que seguramente possam ser
usados para predição de HP, muitos estudos sugerem que a
profilaxia de HP deva ser feita em todas pacientes, independente
da existência ou não de fatores de risco, principalmente em
países em desenvolvimento (McCormick et al., 2002).
Objetivando reduzir a incidência de HP, as pesquisas partiram para a avaliação do impacto que a introdução do manejo
ativo do terceiro período teria sobre a incidência de HP. É bem
documentado que o manejo ativo reduz a incidência de HP
(6,8% versus 16,5%) (Rogers et al., 1998; Prendiville et al.,
2002). As medidas que constituem o manejo ativo são as
seguintes: (a) uterotônico profilático em todas as pacientes
um minuto após a expulsão fetal; (b) clampagem e corte do
cordão umbilical logo após a expulsão fetal; (c) dequitação
placentária assistida aplicando tração controlada no cordão
umbilical. Enquanto as duas últimas práticas são alvo de grandes
divergências, necessitando de mais estudos para averiguar seu
real valor, o uso rotineiro de uterotônicos na profilaxia para HP
tem evidências científicas mais consistentes, mostrando uma
redução de 40% a 50% nas taxas de HP comparada à ausência
do seu uso (Elbourne et al., 2003; Maughan et al., 2006).
Uterotônico a ser usado na profilaxia
da hemorragia pós-parto
Enquanto a eficácia da administração rotineira de drogas
uterotônicas para profilaxia da HP está bem definida, a escolha
da melhor droga a ser empregada ainda gera controvérsias.
Na escolha do ocitócico deve-se levar em conta a eficácia,
os efeitos adversos, a via de administração, o custo da medicação além das condições de armazenamento necessárias
para conservação da droga.
Em 1932, descobriu-se a primeira droga com poder uterotônico (ergometrina). Com sua introdução houve grande queda
na incidência de HP, porém vários efeitos adversos começaram a
ser atribuídos à ergometrina. Alguns efeitos graves, porém raros
(como parada cardíaca, edema agudo de pulmão, infarto agudo
do miocárdio e hemorragia intracraniana), foram descritos, o que
poderia limitar seu uso na profilaxia universal para HP (Prendiville
et al., 1988). Na busca de um fármaco com igual efeito ocitócico,
porém com menores efeitos colaterais, foi sintetizada a ocitocina
em 1953. Posteriormente, foi desenvolvida uma droga chamada
sintometrina que consistia na associação da ergometrina com
a ocitocina (Prendiville et al., 1988).
Em 1988, foi realizado um estudo clássico que acessou as
evidências de ensaios clínicos controlados a respeito do efeito
da administração rotineira de ocitócicos no terceiro período do
parto para prevenir a HP. Os autores concluíram que o uso de
ocitócicos rotineiramente reduz o risco para HP em 40%, ou
seja, reduz a incidência de HP de 10% para 6% (Prendiville et
al., 1988). Em 2003, foi publicada uma revisão sistemática
sobre o uso profilático de ocitocina no terceiro período do
parto que incluiu os 14 ensaios clínicos de maior impacto e
metodologia mais adequada publicados na literatura. Foram
comparados ocitocina isolada versus ausência de uterotônicos,
ocitocina isolada versus derivados de ergot isolados (ergometrina
e metilergonovina) e ocitocina associada a ergometrina versus
derivados de ergot isolados (Tabela 1). Os autores concluíram
que há fortes evidências do benefício da ocitocina profilática
Quadro 1 - Fatores de risco para hemorragia pós-parto
• Hiperdistensão uterina (prenhez múltipla, macrossomia fetal e polidrâmnio);
• Parto prolongado ou precipitado;
• Uso abusivo de ocitócicos no trabalho de parto;
• Infecção intra-amniótica;
• Manobras inadequadas no expulsivo (Kristeller) e no terceiro período do parto;
• Condições que comprometem a contração e retração uterina (analgotócia sistêmica, miomas uterinos, acretismo placentário, hipoproteinemia, grande
multiparidade e partos induzidos);
• Pré-eclâmpsia;
• Episiotomia de rotina;
• Parto vaginal operatório;
• Cesariana.
Adaptado de ACOG, 1998; Mccormick et al., 2002.
FEMINA | Julho 2007 | vol 35 | nº 7
437
Hemorragia puerperal: qual melhor uterotônico para profilaxia?
comparada a ausência de uterotônicos traduzido por redução
de 50% do risco de HP e da necessidade de ocitócicos terapêuticos (Elbourne et al., 2003).
Comparando a ocitocina isolada com outros uterotônicos
(derivados de ergot isolados ou associação ocitocina-ergometrina),
os dados são escassos para apontar qual a droga mais eficaz,
mostrando, na maioria das vezes, equivalência de eficácia para
reduzir a HP entre elas e, poucas vezes, é relatada discreta vantagem de um ocitócico sobre o outro (Elbourne et al., 2003).
Recentemente, tem-se usado o misoprostol, análogo
sintético da prostaglandina E1, para prevenção da hemorragia
pós-parto na dose de 400 a 600 mcg, via oral ou retal. Essa
droga apresenta vantagens de custo inferior aos demais uterotônicos, não necessitar de refrigeração ou proteção contra
luz para manter sua efetividade e não ser injetável. Alguns
estudos haviam apontado efetividade similar do misoprostol
em relação à ocitocina, porém esses estudos não tinham poder
suficiente para testar a equivalência entre esses dois fármacos
pelo número inadequado de pacientes. A possibilidade de uma
droga economicamente viável para países em desenvolvimento
associada a uma provável eficácia similar à ocitocina, motivou
a OMS a realizar um trial multicêntrico com 18.530 pacientes
comparando 10 UI de ocitocina com 600 mcg de misoprostol. A
incidência de HP foi 4% com o uso de misoprostol versus 3% com
a ocitocina, sendo essa diferença estatisticamente significante.
Assim, a OMS recomenda que o uso de 10 UI de ocitocina na
profilaxia de HP é preferível a 600 mcg de misoprostol. Porém,
apesar de ser menos efetivo que as drogas uterotônicas de uso
parenteral, em locais em que não há recurso humano capacitado
para aplicação de injeção ou mesmo recursos financeiros para
aquisição das medicações injetáveis, o uso do misoprostol para
prevenção de HP, na dose de 400 a 600 mcg, é a medicação de
escolha (Gülmezoglu et al., 2001). Além disso, em metanálise
recente, os autores concluíram que a pequena diferença estatisticamente significativa entre o misoprostol e os uterotônicos
convencionais não o torna clinicamente inferior às demais
medicações (Langenbach, 2006).
Observando o início e o modo de ação de cada uterotônico,
sabe-se que 2 min e 30 s após a administração intramuscular
(IM) da ocitocina, já se iniciam os efeitos dessa medicação.
Esse efeito máximo ocorre em 15 min da administração e
dura por 30 min. Já o início da ação da ergometrina é mais
lento, cerca de 7 min, atingindo o efeito máximo em 45 min,
com duração por 3 h. A associação ocitocina+derivados do
ergot combina o início de ação mais precoce da ocitocina
com o efeito mais durador do derivados do ergot (Yuen et
al., 1995). O misoprostol depende da via de administração
para início e duração de seus efeitos, na via oral o início é de
15 a 30 min, enquanto na via retal de 1 a 2 h, já a duração
é mais efêmera na via oral comparada à via retal (Goldberg
et al., 2001).
Em relação às condições de estocagem, os fabricantes tanto
da ocitocina sintética quanto da metilergometrina recomendam
que essas drogas devem ser mantidas em temperaturas inferiores
a 22ºC para manter sua validade por três anos. Já o misoprostol
não necessita de temperatura ideal para sua conservação, o que
pode ser vantajoso para locais onde não há refrigerador ou a
fonte de energia não é estável (Langenbach, 2006).
Quanto aos efeitos colaterais, os principais estão apresentados na Tabela 2. Os derivados do ergot provocam
Tabela 1 - Comparação da efetividade entre os diversos uterotônicos
Comparação
Ocitocina versus Placebo
Ocitocina versus Derivados do ergot isolados
Ocitocina + Derivados do ergot versus derivados do ergot
Redução do risco de HP
50%
10% (a favor da ocitocina)*
sem diferença estatística
Dose utilizada
5 a 10 UI
2 a 10 UI x 0,2 a 0,4 mg
5 UI+0,5 mg x 0,2 a 0,5 mg
HP = Hemorragia puerperal. Adaptada de Elboune et al, 2003.
* Sem diferença estatística
Tabela 2 - Efeitos adversos relacionados a cada uterotônico
Droga
Efeitos adversos
Derivados do Ergot
Náuseas e vômitos
Cefaléias
Retenção placentária
Aumento da PA
Retardo da apojadura
IAM
Parada cardíaca
Hemorragia intra-craniana
Adaptada de Prendiville et al., 1988; Gülmezoglu et al., 2001; Elboune et al., 2003.
438
FEMINA | Julho 2007 | vol 35 | nº 7
Ocitocina
Retenção placentária Hipotensão
Misoprostol
Tremores
Hipertermia
Náuseas e vômitos
Diarréia
Retenção placentária
Hemorragia puerperal: qual melhor uterotônico para profilaxia?
freqüentemente náuseas, vômitos, cefaléia e aumento dos
níveis pressóricos, devendo ser evitados em pacientes hipertensas. Comparados à ocitocina, provocam maior risco
de retenção placentária. São também descritos aumento
de risco para infarto agudo do miocárdio, parada cardíaca,
hemorragia intracraniana e edema agudo de pulmão. Esses
últimos efeitos adversos são extremamente raros, necessitando-se de estudos com maior número de pacientes
para avaliar se essa associação é realmente verdadeira. A
ocitocina é associada a aumento de risco para hipotensão,
não confirmada em metanálises. Há uma tendência, não
estatisticamente significativa, da ocitocina aumentar o risco
de encarceramento placentário em relação ao não uso de
uterotônicos, porém quando comparada aos derivados do
ergot, reduz em 43% o risco de retenção placentária. Não
são descritos efeitos adversos graves relacionados ao uso
da ocitocina sintética e do misoprostol. O misoprostol é
associado à hipertermia, tremores, vômitos e diarréia. Em
relação à ocitocina, o misoprostol não aumentou a incidência de encarceramento placentário (Prendiville et al., 1988;
Gülmezoglu et al., 2001; Elboune et al., 2003).
A via de administração parece não afetar a eficácia da
droga. A ocitocina pode ser dada endovenosa (EV) ou intramuscular, sendo preferível a última quando a paciente não
estiver com venóclise. O misoprostol pode ser usado via
oral ou retal (Gülmezoglu et al., 2001; Elboune et al., 2003;
Langenbach, 2006).
É importante também para prevenir a HP, aplicar o
uterotônico no momento certo. Há momentos diferentes
descritos para administração da droga: no desprendimento
do pólo cefálico, na saída do ombro anterior, logo após a
expulsão fetal, após a clampagem e corte do cordão, após
dequitação placentária ou após 20 min do parto (Prendiville
et al., 1988). Ainda não há um consenso na literatura sobre
qual é o melhor momento para administração do ocitócico,
mas Khan et al., 1997, relataram efetividade superior na
prevenção da HP se o ocitócico for administrado antes da
dequitação placentária. O Ministério da Saúde do Brasil
(2000) recomenda a aplicação do uterotônico profilático
para HP antes da dequitação placentária.
Considerações finais
Apesar de serem ainda necessários mais estudos para
estabelecer conclusões definitivas sobre o uso de uterotônicos
profilaticamente em todos os partos, seu papel é bem estabelecido na redução de 40 a 50% na incidência de hemorragia
pós-parto. Provavelmente, países em desenvolvimento, como
o Brasil, se beneficiariam da adoção do ocitócico profilático
para HP, devido às altas taxas de mortalidade materna e à
grande participação atribuída a HP.
À luz dos conhecimentos atuais, a droga de escolha
para profilaxia de HP é a ocitocina na dose de 10 UI IM ou
EV diluída. Essa droga é a opção recomendada pela OMS,
pelo Ministério da Saúde do Brasil e pelas metanálises
disponíveis até a presente dada. Até o momento, considerando riscos e benefícios, não há suporte científico
para o uso isolado dos derivados de ergot na profilaxia
para HP para todos partos, não por sua efetividade que é
similar à da ocitocina, mas por seus efeitos colaterais. Há
evidências científicas para uso dos derivados do ergot na
profilaxia para HP apenas em associação com a ocitocina.
Vale ressaltar que o papel dos derivados do ergot isolados
no tratamento da hemorragia pós-parto já estabelecida
não é alvo dessa atualização.
A OMS preconiza o uso preventivo de 10 UI de ocitocina, como uma medida de se reduzir a incidência de HP,
principalmente em países em desenvolvimento. No Brasil, o
Ministério da Saúde em conjunto com a Federação Brasileira
de Ginecologia e Obstetrícia (FEBRASGO) preconizam como
profilaxia para HP 10 UI de ocitocina IM em todos os partos
(Ministério da Saúde, 2000) ou principalmente naqueles com
maior risco para HP.
Em locais com poucos recursos financeiros, vale a pena a
introdução do misoprostol, 400 a 600 mcg (2 a 3 comprimidos
de 200 mcg), via oral ou retal, para prevenção da HP.
Por último, é importante que cada serviço de saúde estabeleça seu protocolo para prevenção da HP baseado nas
evidências científicas disponíveis, buscando contribuir para
redução da mortalidade materna e de complicações graves
para a saúde da mulher.
FEMINA | Julho 2007 | vol 35 | nº 7
439
Hemorragia puerperal: qual melhor uterotônico para profilaxia?
Leituras suplementares
1. American College of Obstetricians and Gynecologists
(ACOG). ACOG educational bulletin. Postpartum
hemorrhage. Int J Gynaecol Obstet 1998; 61:
79-86.
2. Elbourne DR, Prendiville WJ, Carroli G et al. Prophylactic
use of oxytocin in the third stage of labour (Cochrane
Review). In: Cochrane Library, Issue 1, 2003. Oxford:
Update software.
3. Goldberg AB, Greenberg MB, Darney PD. Misoprostol
and pregnancy. N Engl J Med 2001; 344: 38-47.
4. Gülmezoglu AM, Villar J, Ngoc NT et al. WHO multicentre
randomized trial of misoprostol in the management of the
third stage of labour. Lancet 2001; 358: 689-95.
Preventing postpartum hemorrhage in low-resource settings.
Int J Gynecol Obstet 2002; 77: 267-75.
12. Ministério da Saúde. Urgências e Emergências Maternas:
guia para diagnóstico e conduta em situações de risco
de morte materna/Secretaria de Políticas de Saúde,
Área Técnica de Saúde da Mulher. Brasília: Ministério
da Saúde, 2000. 2ª edição.
13. Prendiville WJ, Elbourne D, McDonald S. Active versus
expectant management in the third stage of labour
(Cochrane Review). The Cochrane Library, Issue 1, 2002.
Oxford: Update Software.
14. Prendiville W, Elbourne D, Chalmers I. The effects of
in Giza, Egypt: magnitude, causes and prevention. Stud
Fam Planning 1992; 23: 45-57.
routine oxytocic administration in the management of
the third stage of labour: an overview of the evidence
from controlled trials. British Journal of Obstetrics and
Gynaecology 1988; 95: 3-16.
6. Khan GQ, John IS, Wani S et al. Controlled cord traction
15. Rogers J, Wood J, McCandlish R et al. Active versus
5. Kane TT, Thomas T, El-Kady AA et al. Maternal mortality
versus minimal intervention techniques in delivery of the
placenta: a randomized controlled trial. Am J Obstet
Gynecol 1997; 177: 770-4.
7. Khan KS, Wojdyla D, Say L, et al. WHO analysis of
causes of maternal death: a systematic review. Lancet
2006; 367: 1066-74.
8. Langenbach C. Misoprostol in preventing postpartum
hemorrhage: A meta-analysis. Int J Gynecol Obstet 2006;
92: 10-18.
9. Li XF, Fortney JA, Kotelchuck M, Glover LH. The postpartum
period: the key to maternal mortality. Int J Gynecol Obstet
1996; 54: 1-10.
10. Maughan KL, Heim SW, Galazka SS. Preventing postpartum
hemorrhage: managing the third stage of labor. Am Fam
Physician 2006; 73: 1025-8.
440
11. McCormick ML, Sanghvi HC, Kinzie B, McIntosh N.
FEMINA | Julho 2007 | vol 35 | nº 7
expectant versus expectant management of the third stage
of labour: the Hinchingbrooke randomized controlled
trial. Lancet 1998; 351: 693-9.
16. Tsu VD, Langer A, Aldrich T. Postpartum hemorrhage
in developing countries: is the public health community
using the right tools? Int J Gynecol and Obstet 2004;
85(Suppl 1): S42–S51.
17. World Health Organization. Maternal Mortality in 2000:
estimates developed by WHO, UNICEF and UNFPA.
Geneva: The World Health Organization; 2004.
18. World Health Organization. Mother-baby package (WHO/
RHT/MSM/94.11, Rev1). Geneva: WHO; 1998.
19. Yuen PM, Chan NST, Yim SF, Chang AMZ. A randomized
double blind comparision of Syntometrine® and Syntocinon®
in the management of the third stage of labour. Br J Obstet
Gynaecol 1995; 102: 377-80.