-1-
2A
1
H
Be
9,0
12
Mg
Li
7,0
Na
23,0
24
Cr
23
V
22
Ti
48,0
40
Zr
21
Sc
45,0
39
20
Ca
40,0
38
K
39,0
37
Unp
Unq
Série
dos
Actinídios
Ra
(226)
Fr
(223)
( ) = Nº de massa do
isótopo mais
estável
Massa Atômica
Símbolo
Número Atômico
105
104
89 - 103
88
87
(262)
181,0
(263)
Unh
184,0
106
Pr
141,0
140.0
La
138,0
75
(237)
_14
(242)
_1
(243)
Produto iônico da água, KW, a 25 ºC = 1,0 10
Am
95
(247)
Cm
96
(247)
Bk
97
98
(251)
Cf
(254)
Es
99
165,0
Ho
162,5
67
66
207,0
Pb
82
119,0
Dy
204,0
Tl
81
115,0
In
50
Sn
73,0
49
Ge
32
28,0
70,0
Ga
31
27,0
_1
R = 0,082 atm.L.mol .K
_1
(253)
Fm
100
167,0
Er
68
209,0
Bi
83
122,0
Sb
51
75,0
As
33
31,0
18
I
127,0
(210)
(210)
(256)
Md
(253)
No
102
169,0
101
Yb
173,0
Tm
70
At
Po
69
85
128,0
84
(257)
Lr
103
175,0
Lu
71
(222)
Rn
86
Xe
131,0
53
Te
54
80,0
84,0
Kr
36
40,0
52
Br
35
35,5
Ar
17
Cl
20,0
Ne
10
4,0
He
2
0
19,0
F
9
7A
17
18
79,0
Se
34
32,0
S
16
P
15
14
Si
13
Al
O
16,0
N
14,0
8
6A
16
C
7
5A
15
12,0
6
4A
14
11,0
B
5
3A
13
F = 96500 Coulombs
Tb
159,0
Gd
65
201,0
157,0
64
197,0
Eu
63
195,0
80
Hg
79
Au
112,0
Cd
48
65,0
Zn
30
2B
12
78
108,0
Ag
47
63,5
Cu
29
1B
11
Pt
106,0
Pd
46
59,0
Ni
28
10
152,0
Dados: Constante de Avogadro = 6,0 10 átomos.mol
(238)
Pa
Th
232,0
Ac
(227)
(231)
94
Pu
93
Np
92
150,0
Sm
62
(266)
Une
109
192,0
U
23
(147)
Pm
61
(265)
Uno
108
190,0
Os
77
Ir
76
91
144,0
Nd
60
(262)
Uns
186,0
107
Re
90
89
Série dos Actinídios
59
58
Ce
57
Série dos Lantanídios
(261)
178,5
137,0
133,0
W
74
Ta
Série
dos
Lantanídios
Cs
73
72
Hf
57 - 71
56
Ba
55
Rh
103,0
Ru
45
59,0
Co
27
8B
9
101,0
(99)
Mo
96,0
Nb
93,0
91,0
Y
89,0
Sr
Tc
88,0
43
Rb
44
55,0
56,0
Fe
26
8
42
Mn
25
7B
7
52,0
85,5
41
51,0
6B
19
5B
4B
3B
6
24,0
5
4
Elementos de Transição
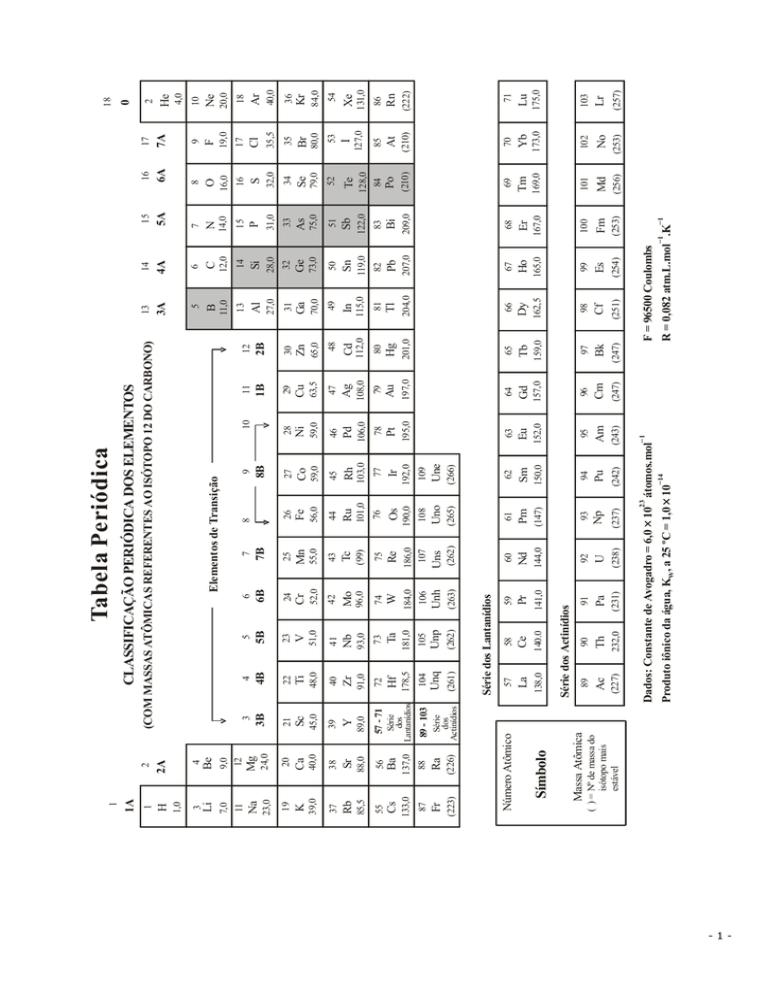
(COM MASSAS ATÔMICAS REFERENTES AO ISÓTOPO 12 DO CARBONO)
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
Tabela Periódica
3
11
4
3
1,0
2
1A
1
1. Alguns princípios ativos de medicamentos são bases fracas e,
para serem absorvidos pelo organismo humano, obedecem,
como um dos parâmetros, a equação de Henderson-Hasselbach.
Essa equação determina a razão molar entre forma protonada e
não protonada do princípio ativo dependendo do pH do meio. A
forma não protonada é aquela que tem maior capacidade de
atravessar as membranas celulares durante o processo de
absorção. A equação de Henderson-Hasselbach adaptada para
bases fracas é representada a seguir.
log10
protonada
= pka − pH
não protonada
Nessa equação, pka é a constante de dissociação do princípio
ativo. Considerando-se essa equação, um medicamento
caracterizado como base fraca, com pka de 4,5, terá maior
absorção
a) no estômago, com pH de 1,5.
b) na bexiga, com pH de 2,5.
c) no túbulo coletor do néfron, com pH de 3,5.
d) na pele, com pH de 4,5.
e) no duodeno, com pH de 6,5.
Um litro de solução contém 1,24 g de ácido carbônico e 16,8 g
de bicarbonato de sódio. Sabendo-se que Ka = 2 ⋅ 10
determine o pOH dessa solução-tampão.
(Considere: Log 2 = 0,3)
a) 7,7
b) 7,4
c) 6,6
d) 6,3
e) 6,9
−7
,
4. O pH do plasma sanguíneo está entre 7,35 e 7,45 e essa faixa
estreita é mantida graças aos sistemas de tampão biológicos.
Um dos sistemas que atua como tampão no sangue está
representado na equação.
HPO42− (aq ) + H3O+ (aq )
H2PO4 − (aq ) + H2O (l )
2. Uma solução tampão contém 0,1mol L de CH3 COOH
e 0,1mol L de CH3 COONa. Considerando-se que a
−5
constante de ionização do ácido acético é igual a Ka = 10 ,
assinale o que for correto com relação a essa solução.
01) O pH dessa solução tampão é igual a 5.
02) A adição de 0,1mL de solução aquosa de HCl
As dores musculares após atividade física em excesso estão
relacionadas com a liberação, durante a contração muscular, de
uma substância representada na fórmula estrutural a seguir.
0,1mol L em 200 mL da solução tampão irá ocasionar
uma variação significativa no pH do sistema.
04) Adicionando-se HCl a essa solução, os íons H+ serão
consumidos
segundo
a
seguinte
reação:
CH3 COONa( aq ) + HCl ( aq ) → CH3 COOH( aq ) + NaCl ( aq ) .
08) Variando-se as concentrações de ambos, CH3 COOH
e CH3 COONa, para 0,2 mol L, o pH da solução
tampão irá variar.
16) Adicionando-se NaOH a essa solução, o pH não irá variar
significativamente, pois as hidroxilas adicionadas serão
consumidas pelas moléculas não ionizadas de
CH3 COOH.
3. A solução-tampão é geralmente uma mistura de um ácido
fraco com o sal desse ácido, ou uma base fraca com o sal dessa
base. Essa solução tem por finalidade evitar que ocorram
variações muito grandes no pH ou no pOH de uma solução. A
eficácia da solução-tampão pode ser vista no sangue, em que,
mesmo com a adição de ácido ou base em pequenas
quantidades ao plasma sanguíneo, praticamente não há
alteração no pH.
a) Quando o sistema é perturbado com solução de NaHCO3, o
que se verifica com o deslocamento do equilíbrio
representado na equação?
b) A presença no sangue da substância em excesso, relacionada
com a contração muscular, pode ser considerada um caso de
acidose ou de alcalose? Justifique.
5. O tampão acetato pode ser preparado pela mistura, em
solução, de acetato de sódio anidro (CH3COONa) e ácido acético
(CH3COOH). O pH desse tampão pode variar de 4,0 a 5,4 de
acordo com a proporção dessa mistura.
Sobre o tampão acetato, é ERRADO afirmar que:
a) o pH do tampão acetato depende da proporção entre o ácido
acético e seu sal.
b) o pH da solução tampão nunca se altera após a adição de
ácido forte.
c) o tampão acetato é característico da faixa ácida de pH.
d) o pH da solução tampão praticamente não se altera após a
adição de pequena quantidade de água.
e) a adição de NaOH ao tampão aumenta a concentração de
acetato no meio.
6. Soluções-tampão são soluções que resistem à mudança no
pH quando ácidos ou bases são adicionados ou quando ocorre
diluição. Estas soluções são particularmente importantes em
processos bioquímicos, pois muitos sistemas biológicos
-2-
dependem do pH. Cita-se, por exemplo, a dependência do pH na
taxa de clivagem da ligação amida do aminoácido tripisina pela
enzima quimotripisina, em que a alteração em uma unidade de
pH 8 (pH ótimo) para 7 resulta numa redução em 50% na ação
enzimática. Para que a solução-tampão tenha ação tamponante
significativa, é preciso ter quantidades comparáveis de ácido e
base conjugados. Em um laboratório de Química, uma soluçãotampão foi preparada pela mistura de 0,50 L de ácido etanoico
−1
(CH3COOH) 0,20 mol L
com 0,50 L de hidróxido de sódio
acidose é quando o sangue apresenta um excesso de ácido,
acarretando uma __________ do pH sanguíneo e a alcalose é
quando o sangue apresenta um excesso de base, acarretando
uma __________ do pH sanguíneo.
a) básico, ácido, básico, redução, elevação.
b) básico, ácido, básico, elevação, redução.
c) ácido, básico, ácido, elevação, redução.
d) ácido, básico, ácido, redução, elevação.
e) neutro, ácido, básico, elevação, redução.
−1
(NaOH) 0,10 mol L .
Dado: pKa do ácido etanoico = 4,75 e log 0,666 = - 0,1765
a) Determine o pH da solução-tampão.
b) Determine o pH da solução-tampão após a adição de 0,01 mol
de NaOH em 1,00 L da solução preparada.
Apresente os cálculos realizados na resolução da questão.
7. Soluções tampão são utilizadas para evitar uma variação
brusca de pH e são constituídas por um ácido fraco (ou uma
base fraca) e o sal do seu par conjugado. Para produzir uma
solução tampão, deve-se misturar:
a) CH3 COOH e H2SO4
b) NH4 OH e KOH
c) CH3 COOH e CH3 COONa
d) KOH e NaCl
e) HCl e KOH
10.
Uma solução tampão pode ser obtida, misturando-se
soluções de ácido acético e acetato de sódio, o que constitui um
tampão ácido cujo equilíbrio pode ser representado da seguinte
maneira:
CH3COOH + H2O
+
H3O + CH3COO
-
Considere que um tampão seja preparado misturando-se
volumes iguais de solução de CH3COONa 0,50 M.
-5
Sabendo-se que para o ácido em questão Ka = 1,8 × 10 e pKa =
4,74, informe:
a) o pH da solução;
b) o pH da solução resultante após adição de pequena
quantidade de solução de NaOH 0,010 M;
c) o pH da solução resultante após adição de pequena
quantidade de solução de HCℓ 0,010 M;
d) a conclusão que pode ser tirada em relação ao pH de um
tampão (a) após adição de pequenas quantidades de ácido ou
base forte.
8.
A presença de tampão é fundamental para manter a
estabilidade de ecossistemas menores, como lagos, por
exemplo. Íons fosfato, originários da decomposição da matéria
orgânica, formam um tampão, sendo um dos equilíbrios
expressos pela seguinte equação:
H2PO−4 (aq)
HPO24− (aq) + H+ (aq)
Se no equilíbrio foram medidas as concentrações molares
[H2PO4− ] = 2 mol ⋅ L−1 ,
+
[HPO24− ] = 1 mol ⋅ L−1
e
−1
[H ] = 0,2 mol ⋅ L , o valor da constante de equilíbrio é:
a) 2
b) 0,2
c) 0,1
d) 0,01
e) 1
9. Considere a equação química a seguir e assinale a alternativa
que completa corretamente o texto.
CO2(g) + H2O( l )
H2CO3(aq)
+
−
H (aq) + HCO 3 (aq)
Durante um exercício físico prolongado, quando a respiração
aumenta, a concentração de dióxido de carbono diminui e o
sangue torna-se mais __________. Por outro lado, numa
situação de repouso, a respiração diminui, a concentração de
dióxido de carbono aumenta e o sangue torna-se mais
__________. O pH sanguíneo é regulado constantemente e seu
valor normal está situado entre 7,35 a 7,45, sendo ligeiramente
__________. Uma alteração no controle do pH pode alterar o
equilíbrio ácido-base produzindo a acidose ou a alcalose. A
-3-
COMENTÁRIOS
Resposta da questão 1:
[E]
[H2CO3 ] = 0,02 mol / L
[NaHCO3 ] = 0,2 mol
A equação de Henderson-Hasselbach é válida com melhor
aproximação entre pH 4 e pH 10, devido às simplificações feitas.
Nas alternativas o valor que melhor se encaixa é pH = 6,5
(duodeno).
Resposta da questão 2:
01 + 04 + 16 = 21.
CH3COO− + H+
0,1M
A partir da equação de Henderson-Hasselbach, vem:
pK a = − log(2 × 10−7 )
pK a = 7 − log2 = 7 − 0,3 = 6,7
[sal]
[ácido]
0,2
pH = 6,7 + log
= 6,7 + log10
0,02
pH = 6,7 + 1 = 7,7
pH + pOH = 14
pOH = 14 − 7,7 = 6,3
pOH = 6,3
pH = pK a + log
01) Verdadeira.
No tampão, ocorre o seguinte equilíbrio:
CH3 COOH
1,24
= 0,02 mol
62
16,8
= 0,2 mol
nNaHCO =
3
84
Para 1 L de solução, teremos :
nH CO =
2
3
0,1M
x
concentrações no equilíbrio
A concentração final de ácido acético é praticamente igual à
inicial por se tratar de um ácido fraco, ou seja, de baixo
grau de ionização.
Para calcularmos o valor de pH, devemos obter o valor de x,
o que será feito usando-se a expressão da constante de
ionização do ácido:
[CH3 COO− ] ⋅ [H+ ]
10 −1 ⋅ x
K=
⇒ 10−5 =
⇒ x = 10 −5 mol / L
[CH3 COO]
10−1
Resposta da questão 4:
a) Hidrólise:
NaHCO3 em água
Na+ + HCO3− + H2O
Na+ + HCO3− + H2O
HCO3−
Pela definição de pH, teremos:
pH = − log[H+ ] ⇒ pH = − log10−5 = 5,0
02) Falsa. A principal função do tampão é garantir que não haja
variação significativa de pH quando, ao sistema, são
adicionadas pequenas quantidades de ácidos ou bases. No
caso em questão, a adição de um volume de 0,1mL de
HCl a 200 mL de tampão não provocaria grande variação
de pH.
04) Verdadeira. Os íons acetato são bases fortes de Bronsted+
Lowry e, portanto, podem consumir íons H originados da
adição de ácido. Pode-se expressar o processo por meio de
outra equação (sem a presença dos íons expectadores).
−
CH3 COO(aq)
+
+ H(aq)
→ CH3 COOH(aq)
[CH3 COO− ] ⋅ [H+ ]
, podemos assumir que, se
[CH3 COOH]
–
Na+ + OH− + H2O + CO2
OH− + CO2
(meio básico)
Então,
HPO24− + H3 O+
H2PO4− + H2O
OH−
desloca para a esquerda
devido ao consumo de H3O +
←
b) Teremos:
CH3CH(OH)COO− + H+ + H2O
H2O + CH3 CH(OH)COOH
(ácido fraco)
08) Falsa. De acordo com a expressão da constante de equilíbrio
K=
Na+ + OH− + H2O + CO2
Ocorre a produção em excesso de um ácido fraco, o pH diminui,
ou seja, em caso de acidose o pH do sangue diminui.
+
{CH3COOH] = {CH3COO ], então [H } = K.
Na prática, isso significa que, para qualquer tampão no qual
as concentrações de ácido acético e acetato sejam iguais, o
+
valor de [H ], e consequentemente de pH, é constante (e
igual a 5, conforme calculado na afirmativa [01]).
16) Verdadeira. A equação representativa do processo é:
−
−
CH3 COOH(aq) + OH(aq)
→ CH3 COO(aq)
+ H2O( l )
Resposta da questão 5:
[B]
Uma solução tampão tem a propriedade de não apresentar
grandes variações de pH, quando são adicionadas certas
quantidades de ácidos ou bases fortes. A alternativa [B] afirma
que o pH da solução tampão não varia.
Resposta da questão 3:
[D]
Teremos:
-4-
Resposta da questão 6:
a) Cálculo do número de mols do ácido e da base:
nCH3COOH = [CH3 COOH] × VCH3COOH
nCH3COOH = 0,20 M × 0,50 L = 0,10 mol
nNaOH = [NaOH] × VCH3COOH
nNaOH = 0,10 M × 0,50 L = 0,05 mol
CH3 COOH + NaOH → CH3 COO− + Na+ + H2O
1 mol
1 mol
0,10 mol
0,05 mol
(excesso de 0,05 mol)
0,05 mol
0,05 mol
V = 0,50 L + 0,50 L = 1 L
[CH3 COOH]excesso =
[CH3 COO− ] =
0,05
= 0,05 M
1
0,05
= 0,05 M
1
pH = pK a + log
[CH3COO− ]
[CH3 COOH]excesso
pH = 4,75 + log
[HPO24− ][H+ ]
[H2PO4− ]
=
1× 0,2
= 0,1
2
Resposta da questão 9:
[A]
Primeira lacuna: Se a concentração de CO2 diminui, o equilíbrio
desloca-se no sentido de repor CO2, conforme enuncia o
principio de le Chatelier. Assim haverá uma diminuição na
+
concentração de H aumentando a basicidade do sangue.
1 mol
0,05 mol
0,05 mol
Ke =
0,05 M
= 4,75
0,05 M
Segunda lacuna: Nesse caso, o aumento da concentração de
CO2 provocará um deslocamento de equilíbrio no sentido de seu
+
consumo, o que aumentará a produção de íons H aumentando
a acidez do sangue.
Terceira lacuna: Se o pH do sangue situa-se entre 7,35 e 7,45,
dizemos então que será levemente básico.
Quarta lacuna: Em situação de acidose, ocorre redução do pH
sanguíneo aumentando sua acidez.
Quinta lacuna: Em situação de alcalose, ocorre aumento do pH
sanguíneo aumentando sua basicidade.
Resposta da questão 10:
b) Teremos:
Cálculo da nova concentração de NaOH:
0,05 + 0,01
[NaOH] =
= 0,06 M
1
CH3 COOH + NaOH → CH3 COO − + Na+ + H2 O
0,06 M
0,06 M
0,06 M
[CH3 COOH] = 0,06 M
[CH3 COO − ] = 0,06 M
pH = pK a + log
pH = pK a − log
[CH3 COO− ]
[CH3 COOH]excesso
[CH3 COOH]excesso
pH = 4,75 − log
[CH3 COO − ]
a) pH = pKa + log Cs/Ca = 4,74 + log 0,50/0,50 = 4,74
b) pH = pKa + log Cs/Ca = 4,74 + log 0,51/0,49 = 4,74
c) pH = pKa + log Cs/Ca = 4,74 + log 0,49/0,51 = 4,72
d) Com base nos cálculos, pode-se chegar à conclusão que toda
solução considerada tampão, é aquela que resiste à variação no
pH após sofrer adição de pequenas quantidades de ácidos ou
bases fortes. No caso a concentração das substâncias
adicionadas é bastante inferior à concentração inicial, tanto do
ácido quanto do sal. Pode-se observar também que a variação
no pH foi de apenas 0,02 unidades de pH.
0,04 M
= 4,75 − log0,666
0,06 M
pH = 4,75 − 0,1765 = 4,5735
Resposta da questão 7:
[C]
Deve-se misturar um ácido fraco e um sal solúvel deste ácido
com base forte: CH3 COOH e CH3 COONa .
CH3 − CH2 − COOH
CH3 − CH2 − COONa
H+ + CH3 − CH2 − COO−
Na + + CH3 − CH2 − COO−
Resposta da questão 8:
[C]
-5-