Modelos Atômicos
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Primeira idéia sobre o átomo
(evolução histórica)
No ano 450 a.C. , dois filósofos
gregos, Demócrito e Leucipo,
imaginaram que se pegássemos um
corpo qualquer e o fôssemos dividindo
sucessivas vezes, haveria um certo
ponto em que essa divisão não seria
mais possível. Teríamos chegado ao
átomo.
A palavra átomo deriva do grego,
a = não e tomo = parte, o que
significa, indivisível.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Naquele tempo tratava-se apenas de um
pensamento filosófico sem base
experimental que o sustentasse.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Baseado nas “Leis Ponderais” (1808)
→ Esfera maciça;
→ Indivisível;
→ Indestrutível;
→ Imperecível;
→ Sem carga elétrica;
•“Bola De Bilhar”
John Dalton
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
“Os átomos são esferas maciças, homogêneas, indivisíveis e indestrutíveis.”
(modelo bola de bilhar ).
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Tales de Mileto (640 - 546 a.C.)
Fez algumas experiências com
âmbar (em grego - elektron) e
descobriu que esse adquire uma
carga elétrica quando é atritado
com uma flanela.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Benjamin Franklin
(1706 - 1790)
Observou que existem duas
espécies de cargas elétricas,
chamadas por ele,
arbitrariamente de positiva e
negativa.
Com essas observações foi
possível explicar o fenômeno
relatado por Tales de Mileto.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Cargas elétricas de sinais
opostos se atraem.
Cargas elétricas de mesmo
sinal se repelem.
Mais tarde essas e outras
observações intensificaram a
realização de experimentos
envolvendo eletricidade, os
quais permitiram associar a
eletricidade ao átomo.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
A descoberta da primeira
partícula sub atômica : O
ELÉTRON.
Perto do final do séc. XIX,
o inglês Willian Crookes
(1832 - 1919) inventou uma
ampola que permite realizar
descargas elétricas através do
ar a baixa pressão em seu
interior (ar rarefeito).
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Quando se estabelece a
corrente elétrica através do
gás, são produzidos raios,
ditos RAIOS
CATÓDICOS,que vão
incidir na extremidade da
ampola que contém o pólo
positivo da fonte de alta
tensão, com isso, aparece
uma luminosidade no vidro.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Sendo os raios catódicos um fluxo de elétrons,
podemos concluir finalmente que:
- os elétrons se propagam em linha reta,
- os elétrons possuem massa (são
corpusculares) e
- os elétrons possuem carga elétrica de natureza
negativa.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Modelo atómico de Thomson ou modelo do
pudim de passas: o átomo seria uma esfera
maciça de carga positiva, uniformemente
distribuída, onde se encontrariam incrustados os
elétrons com carga negativa.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
A descoberta da segunda partícula
subatômica: o próton
Em 1886, o físico alemão Eugen
Goldstein, (1850-1930) descobriu um
novo tipo de raio utilizando uma
ampola de Crookes, modificada.
Goldstein adaptou à ampola, que
continha gás a baixa pressão, um
cátodo perfurado e, ao provocar uma
descarga elétrica no gás a baixa
pressão, observou um feixe de raios
coloridos surgir atrás do cátodo, vindo
da direção do ânodo.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Esses raios foram
denominados de raios
anódicos
ou raios canais.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
1895 – Roentgen descobre o
raio-x utilizando tubo de
raios catódicos.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
• 1896 - Becquerel descobre a radioatividade: emissão espontânea
de radiação vindo do Urânio.
• 1897 - Casal Curie descobrem dois elementos radioativos:
Polônio e o Rádio.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
•Rutherford e Pierre Curie
fazem um experimento para
determinar o que constitui as
emissões radioativas.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
ERNEST RUTHERFORD
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Experimento
de
Rutherford
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Observações
Grande quantidade de partículas α atravessam a lâmina.
Uma pequena quantidade de partículas α não atravessaram
a lâmina e voltavam.
Algumas partículas α sofreram desvios.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
Já que a maioria das partículas α
atravessava a lâmina de ouro sem
sofrer desvios, a maior parte do átomo
deveria ser vazia. Espaço que foi
denominado de eletrosfera, onde
estariam os elétrons.
As partículas α que voltavam
indicavam que deveria existir uma
pequena região maciça, denominado
NÚCLEO, onde estaria concentrada a
massa do átomo.
Já que um pequeno número de
partículas α sofrem desvios
significativos ao atravessar a lâmina de
ouro, o núcleo deve ser pequeno e
positivo, proporcionando uma
repulsão.
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
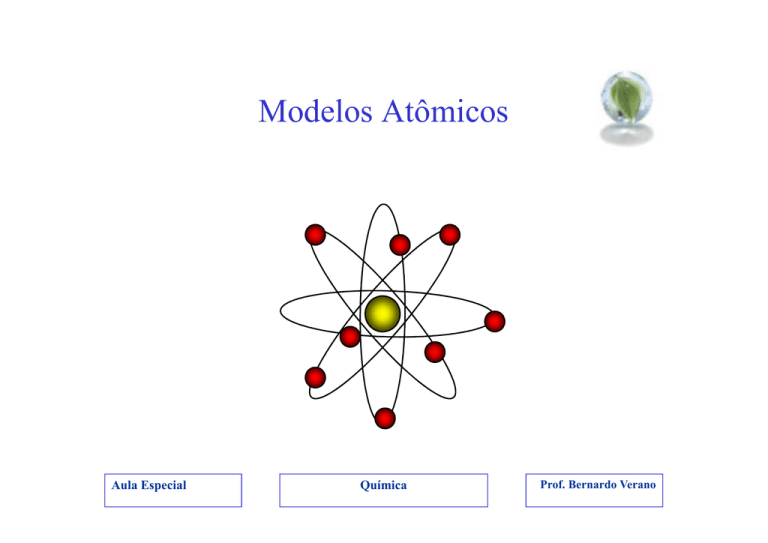
•“Planetário”
→ Núcleo e eletrosfera
→ Planetas em volta do sol
→Núcleo pequeno e denso
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
O átomo possui um núcleo
pequeno, denso e positivo,
formado por prótons
(+).Chadwick comprova a
existência de nêutrons (partículas
sem carga e massa semelhante ao
próton), respondendo a dúvida da
repulsão entre cargas +
Uma região praticamente sem
massa envolvendo o núcleo,
denominada eletrosfera(local
onde os elétrons giram ao redor
do núcleo).
Aula Especial
Química
Prof. Bernardo Verano
Modelos Atômicos
PARTÍCULA
MASSA
RELATIVA
CARGA
RELATIVA
Elétron
_1_
1836
-1
Próton
1
+1
Nêutron
1
0
Aula Especial
Química
Prof. Bernardo Verano