Unidade 03- Funções Orgânicas (cont.)
Capítulo 05- Ácido Carboxílico
1.1- Introdução:
Os
ácidos
carboxílicos
são
compostos caracterizados pela presença do
grupo carboxila.
Os ácidos são um produto da
oxidação dos álcoois primários ou dos
aldeídos. Seu grupo funcional é o grupo
carboxila: –COOH; isto é, um grupo
carbonila e um grupo hidroxila situados
num mesmo carbono. Por ser um derivado
dos aldeídos, o grupo carboxila localiza-se
sempre na extremidade de uma cadeia.
Moléculas que possuem tal grupo
funcional também são chamadas de ácidos
orgânicos.
Os ácidos carboxílicos podem ser
obtidos por oxidação dos aldeídos, por
meio de agentes oxidantes, como o
permanganato de potássio ou o dicromato
de potássio em meio ácido:
RCHO + (Cr2O7)
2–
+
+
+ H → RCOOH + Cr3 + H2O
Podem ser obtidos também por
hidrólise de derivados dos ácidos, como os
ésteres, os cloretos de ácidos, os anidridos
e as nitrilas. Por exemplo, a partir de um
éster, obtém-se um ácido e um álcool:
quanto à solubilidade. Os ácidos com até 4
carbonos são líquidos incolores, miscíveis
com a água, os ácidos de 5 a 9 carbonos
são líquidos incolores e viscosos, muito
pouco solúveis. Os ácidos com dez ou mais
carbonos são sólidos brancos, semelhante
à cera, insolúveis em água. O ácido
aromático mais simples, o ácido benzoico,
por apresentar já elevado número de
carbonos, não tem apreciável solubilidade
em água. Os ácidos carboxílicos são
solúveis em solventes menos polares,
como o éter, o álcool, o benzeno. A
solubilidade é inversamente proporcional
ao comprimento da cadeia R-, pois a
mesma é apolar. Logo, quanto maior a
parte apolar do composto menos solúvel o
mesmo será em solventes polares.
O cheiro característico dos ácidos
alifáticos
mais
baixos
passa
progressivamente de forte e irritante nos
ácidos
fórmico
e
acético,
para
extremamente desagradável (semelhante à
manteiga rançosa) nos ácidos butírico (4C),
valérico (5C) e capróico (6C). Os ácidos
mais altos não têm muito odor, por serem
pouco voláteis.
Comparando-se um ácido carboxílico
e um álcool, ambos com o mesmo número
de carbonos, o ácido terá maior ponto de
ebulição, devido à formação de duas
ligações de hidrogênio e não apenas uma,
como no álcool. Veja:
R – COOR' + H2O → R – COOH + R' – OH
Como se poderia prever pela estrutura
molecular, os ácidos carboxílicos são
substâncias polares e podem, como os
álcoois, formar ligações de hidrogênio
entre si ou com moléculas de outra
espécie. Por essa razão, os ácidos
carboxílicos apresentam praticamente o
mesmo comportamento dos álcoois,
Propriedades químicas
Os ácidos carboxílicos possuem
caráter ácido devido à sua ionização em
água:
R-COOH + H2O
R-COO- + H3O+
Essa força ácida pode ser maior ou
menor dependendo do tipo de efeito
indutivo causado pelo grupamento ligado à
carboxila:
Ácido + (nome da cadeia carbônica
derivada do hidrocarboneto) + ÓICO
ex.: CH3-CH2-COOH (ácido propanoico)
1.3- Nomenclatura Usual:
Recebem nomes arbitrários, em geral,
de origem latina ou grega.
No primeiro caso (a) o grupo X é elétronatraente (eletronegativo). O efeito indutivo
é -I e, portanto, deixa a carbonila com
déficit eletrônico, o que leva a um
enfraquecimento da ligação com o
hidrogênio ácido. Logo, será mais fácil a
liberação do próton. Assim, o caráter ácido
aumenta.
No segundo caso (b) o grupo X é
elétron-repelente. O efeito indutivo é +I e,
portanto, deixa a carbonila com superávit
eletrônico, o que leva a um aumento da
força de ligação com o hidrogênio ácido.
Logo, será mais difícil a liberação do
próton. Assim, o caráter ácido diminui.
Os ácidos aromáticos comportam-se
de maneira semelhante quando neles se
inserem grupos substituintes. Assim, a
introdução de grupos CH3, OH ou NH2
(efeito indutivo -I) no ácido benzoico, por
exemplo, conduz a ácidos mais fracos do
que ele; já a introdução de grupos Cl, Br ou
NO2 (efeito indutivo +I) conduz a ácidos
mais fortes. Também influencia sobre a
força ácida o efeito da ressonância do anel
aromático, que enfraquece o ácido devido
à deslocalização de cargas elétricas.
1.2- Nomenclatura Oficial:
Os ácidos são nomeados como os
hidrocarbonetos, com o mesmo número de
carbonos antepondo-se à palavra ácido e
acrescentando-se o sufixo ico.
Obs.: em caso de ácidos dicarboxilicos
devemos acrescentar o prefixo di antes do
sufixo.
Exemplo:
HOOC - CH2 - COOH
Nomenclatura oficial: Ácido propanodióico
Ácido cítrico ou ácido 2- hidroxipropanotrióico:
HOOC - ( OH ) CH ( COOH ) - COOH
Aminoácido ou ácido 2-aminonome do radical acila
R - CH (NH2) - COOH
Nomenclatura usual: Ácido malônico
1.4- Principais Ácidos Carboxílicos:
Nomenclatura usual: Ácido propanílico
Ácido metanoico:
HOOC - CH2 - CH2 - CH2 - CH2 - COOH
Nomenclatura oficial: Ácido hexanodióico
Nomenclatura usual: Ácido adípico
HO2CCO2H
Nomenclatura oficial: Ácido Etanodióico
Nomenclatura usual: Ácido Oxálico
Ácidos com outros grupos funcionais
Ácido láctico ou ácido 2-hidroxipropanóico:
CH3 - CH (OH) - COOH
Ácido tartárico ou ácido dihidróxibutanodióico:
HCOO - CH (OH) - CH (OH) - COOH
Ácido salicílico ou ácido Parahidróxi-benzoico
É também conhecido como ácido fórmico,
por ter sido obtido, historicamente a partir
da maceração de formigas. É um liquido
incolor, de cheiro irritante, que quando
injetado nos tecidos, provoca dor e
irritação característica.
Uma das principais aplicações do ácido
fórmico é como fixador de pigmentos e
corantes em tecidos, como algodão, lã e
linho.
Ácido etanoico:
Também conhecido como ácido acético, é
um liquido incolor à temperatura
ambiente, como cheiro irritante e sabor
azedo, tendo sido isolado, pela primeira
vez, a partir do vinho azedo 9vinagre)acetum= vinagre.
A oxidação do etanol é o método industrial
mais comumente utilizado para a produção
desse ácido. O vinagre, usado como
tempero na alimentação, é uma solução
aquosa que contem de 6 a 10% em massa
de ácido acético.
HO - (C6H4) - COOH
Ácido benzoico
Ácido tricloroacético ou ácido
tricloroetanóico:
CCl3 - COOH
É um sólido branco, cristalino, solúvel em
água, usado na medicina como fungicida.
Tanto ele quanto seus sais de sódio são
utilizados como conservantes.
Leitura Complementar:
substituição do cálcio no tecido, com sua
Um dos produtos mais utilizados para
eliminação posterior por ACIDOSE (sem
devolver gradualmente a cor aos cabelos
que
grisalhos é o Grecin, que consiste numa
recalcificação),
solução incolor de acetato de chumbo
interferências no ciclo de Krebs, na
(Pb(H3CCOO)2). Quando essa solução é
formação da HEME ao nível de fígado. Tais
aplicada aos cabelos, o íon chumbo (Pb+2)
interferências se processam nas várias
reage
etapas de formação do sangue, através de
com o
enxofre presente
nas
necessariamente
até
enzimáticas
ocorra
as
a
complexas
proteínas do cabelo, formando PbS, de cor
inibições
preta. Repetidas aplicações originam mais
frequentes casos de ANEMIAS. Por outro
sulfeto de chumbo (PbS), escurecendo os
lado, lesões CANCEROSAS a nível de
cabelos.
cérebro, resultantes da intoxicação pelo
CHUMBO
ORGÂNICO
celulares,
são
com
conhecidas.
O acumulo de chumbo no organismo pode
Diz-se
que
o
envenenamento
pelo
ser prejudicial, podendo provocar uma
CHUMBO
INORGÂNICO
tem
ação
doença chamada saturnismo.
preferencial pelos ossos. Já o CHUMBO
Diz-se que há Absorção de Chumbo quando
ORGÂNICO,
o mesmo tendo penetrado por quaisquer
decomposição, tende a provocar lesão
vias, atinge os tecidos. Quando o chumbo
nervosa no cérebro; após a decomposição
absorvido provoca sintomas subjetivos e
total, segue integralmente a trajetória do
objetivos, diz-se que ocorre a Intoxicação
chumbo inorgânico.
enquanto
em
fase
de
Saturnina.
Com relação ao mecanismo das reações
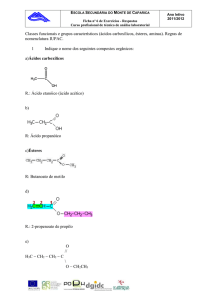
Capítulo 02: Ésteres Orgânicos:
bioquímicas envolvidas na intoxicação,
sabe-se,
que
o
mesmo
é
bastante
diversificado e complexo, variando desde a
2.1- Introdução
Os
Ésteres
são
compostos
orgânicos que apresentam fórmula geral
R−COO− R1, são caracterizados pelo grupo
funcional:
R e R1 são radicais orgânicos.
Os
ésteres,
nas
condições
ambientes, se apresentam como líquidos
ou sólidos, dependendo da quantidade de
carbono. Os primeiros membros da série,
os que apresentam baixa massa molecular,
são líquidos incolores, de cheiro agradável.
No entanto, à medida que se aumenta a
massa molecular, vão se tornando líquidos
xaroposos, viscosos e gordurosos, até se
tornarem sólidos (aspecto de cera), daí
ocorre a perda de cheiro agradável. São
compostos insolúveis em água, porém são
solúveis em álcool, éter e clorofórmio.
Como não apresentam ligações de
hidrogênio, os ésteres têm ponto de
ebulição menor que o dos álcoois e ácidos
de mesma massa molecular.
Os ésteres são utilizados na
preparação de extratos artificiais que
imitam o odor e o gosto de frutas, por isso
são usados na fabricação de xaropes,
doces, pastilhas, refrescos, etc. Os ésteres
ocorrem naturalmente na natureza na
forma de essências de frutas, nos óleos e
gorduras (glicéridos), nas ceras e nos
fosfátides (lecitina do ovo e cefalina do
cérebro).
Vejamos para que são utilizadas cada uma
dessas formas:
Essências: são usadas para imitar o sabor e
o aroma de algumas frutas, são também
chamadas
de
flavorizantes
ou
aromatizantes e muito usadas em indústria
de alimentos para dar cheiro e sabor aos
produtos. Exemplo: o flavorizante acetato
de pentila é um ingrediente do grupo dos
ésteres, e é usado para dar sabor artificial
de banana em alimentos.
Óleos e gorduras: são os ésteres mais
usados em
nosso dia-a-dia, são
encontrados em produtos como óleo de
soja, margarina e azeite de oliva.
Ceras: usadas na fabricação de graxas para
sapatos, cera para dar brilho a pisos, papel
manteiga, velas, etc. A cera de abelha e a
cera de carnaúba também fazem parte da
classe de ésteres.
Alguns ésteres são usados como
medicamentos, os de cadeia carbônica
mais longa e que existem nos óleos e
gorduras são aproveitados na produção de
sabões.
Propriedades Físicas:
Em geral, líquidos voláteis, incolores,
de odor agradável àqueles que
apresentam
massas
moleculares
menores.
Líquidos viscosos, xaroposos e
gordurosos aqueles que massas
moleculares médias.
Sólidos com aspecto de cera aqueles
que apresentam as maiores massas
moleculares.
Praticamente
não
apresentam
polaridade molecular.
Insolúveis em água, entretanto,
solúveis em álcool.
Como não apresentam pontes de
hidrogênio possuem pontos de fusão e
ebulição inferiores aos dos ácidos e
álcoois de mesma massa molecular.
Propriedades Químicas:
Hidrólise
do Gr. hýdor, água + lýsis, quebra:
É uma reação química, em que um dos
reagentes é a água. Através desta reação
grandes moléculas como os lipídios, por
exemplo, são decompostas em moléculas
menores que os constituem.
Há basicamente dois tipos de hidrólise de
ésteres: ácida e básica.
A hidrólise ácida ocorre em meio ácido e é
um processo reversível, gerando um álcool
e um ácido carboxílico:
R-COO-R1 + HOH
R-COOH + HO-R1
A hidrólise básica, ou saponificação, é
realizada em meio básico. Trata-se de um
processo irreversível, gerando álcool e um
sal de ácido carboxílico:
R-COO-R1 + BOH(aq) → R-COO-B+ + HO-R1
Onde BOH é uma base, por exemplo, KOH.
Saponificação
É a reação de um éster com uma base
originando um sal orgânico e um álcool.
Exemplo: Etanoato de metila + NaOH →
etanoato de sódio + álcool metílico
CH3-COO-CH3 + NaOH → [CH3-COO][Na] +
CH3-OH
produção de flavorizantes para a
produção de refrescos, doces,
pastilhas, xaropes, balas e etc.
produção de sabões;
como medicamentos;
produção
de
perfumes
e
cosméticos;
na alimentação.
2.2- Nomenclatura oficial e usual:
Simplificadamente
podemos
considerar que os ésteres se originam a
partir das substituição do hidrogênio do
grupo OH de um ácido carboxílico por um
radical orgânico (R).
Tanto a nomenclatura IUPAC
quanto a usual dos ésteres baseiam-se na
nomenclatura doa ácidos carboxílicos dos
quais derivam.
Sua nomenclatura oficial pode ser
obtida substituindo a terminação ico do
nome do ácido de origem por ATO e
acrescentando-se o nome do radical que
substitui o hidrogênio, com terminação
ILA.
CH3COO - CH3 → Acetato de metila
ou etanoato de metila
CH3 - CH2 - COO - CH2 - CH3 →
propanoato de etila
Ou seja, a reação orgânica descrita ocorre
quando misturamos algum tipo de éster
(gordura vegetal ou animal; óleos;
essências de frutas, flores e madeira; nas
ceras de carnaúba e abelha, etc...) com
hidróxido de sódio (soda cáustica) ou
potassa cáustica, que pode ser encontrada
na cinza vegetal. O calor produzido ao
misturar-se os óleos ou gorduras, um álcali
e água pura é suficiente para iniciar-se a
reação química. Essa reação pode originar
um sal orgânico e um álcool.
A saponificação pode ser aplicada em:
CH3 - COO - CH2 - CH2 - CH2 - CH3 →
Etanoato de butila
CH2 = C (CH3) - COO - CH3 → metil
propenoato de metila, o
monômero do acrílico (plástico).
Capítulo 03: Éteres
2ª maneira
3.1- Introdução
Éteres são compostos orgânicos que
apresentam o grupo funcional - O(oxigênio) entre dois radicais (carbonos),
ou seja, se caracterizam pela presença de
oxigênio ligado a dois átomos de carbono.
Características físicas dos éteres:
no estado líquido são muito voláteis,
incolores e de cheiro agradável, não
apresentam solubilidade em água, mas
podem ser encontrados também na fase
sólida ou gasosa. Para saber o estado físico
de um éter é só observar a quantidade de
carbonos: os éteres com até três carbonos
se encontram no estado gasoso, os com
mais de três carbonos são líquidos e os de
massa molecular maior são sólidos.
Quanto às propriedades químicas, possuem
caráter básico e são altamente inflamáveis e
voláteis, apesar da pouca reatividade. A
aplicação desses compostos é variada,
podem ser usados para fabricar seda
artificial, celulóide e ainda como solvente
na obtenção de gorduras, óleos e resinas. A
aplicação de éteres na medicina é
importante: é usado como anestésico e
para
preparar
medicamentos.
3.2- Nomenclatura Oficial:
Segundo a IUPAC, há
maneiras de dar nome aos éteres:
duas
1ª maneira:
Prefixo que indica o nº de carbonos do
menor radical + OXI + nome do
hidrocarboneto correspondente ao
maior radical
Radical radical éter (os radicais em
ordem alfabética)
NOMENCLATURAS
Estrutura
1ª maneira
2ª maneira
H3C-O-CH2-CH3
metoxietano
Etil-metil-éter
H3C-CH2-O-CH2-CH3
Etoxietano
Dietil-éter
3.3- Nomenclatura Usual:
A nomenclatura usual é aquela em
que as regras para o estabelecimento do
nome dos éteres são dadas a seguir:
ÉTER + NOME DO MENOR RADICAL +
NOME DO MAIOR RADICAL + ICO
H3C-O-CH2-CH3 – ÉTER METIL-ETÍLICO
H3C-CH2-O-CH2-CH3 – ÉTER DIETÍLICO OU
ÉTER ETÍLICO.
Obs.; quando os dois radicais forem iguais,
o prefixo di pode ser dispensado.
Leitura Complementar:
O Principal Éter:
Uma conhecida forma de éter, que já foi
muito usada na medicina, é o éter comum
(etoxietano), um líquido altamente volátil
que atualmente entrou em desuso em
razão dos perigos de causar incêndios. Esse
éter também é conhecido pelas
denominações de éter etílico, éter dietílico
ou éter sulfúrico.
O éter etílico foi isolado pela primeira vez
no século XVI, por Valerius Cordus. Esta
forma de éter tem a temperatura de
ebulição 34,6 °C, este dado confirma a
volatilidade deste líquido. Seus vapores são
mais densos do que o ar e se acumulam na
superfície do solo, formando com o
oxigênio, uma mistura explosiva. Sua
aplicação como anestésico se justifica pela
ação no organismo, uma vez que relaxa os
músculos, altera a respiração e a pressão
arterial,
e,
consequentemente,
os
batimentos
cardíacos.
As
maiores
desvantagens são causar irritação no trato
respiratório e a possibilidade de provocar
incêndios nas salas de cirurgia. Isso fez com
que fosse substituído por outras formas.
Exemplo de anestésico inalável atual:
Óxido nitroso.
Da mesma forma que a acetona, grandes
quantidades de éter também tem sua
comercialização controlada pela Policia
Federal, pois ele é um dos componentes
usados na produção de cocaína.
Bibliografia:
http://www.klickeducacao.com.br/conteud
o/pagina/0,6313,POR-1029-18228-,00.html
http://clovisbezerra.tripod.com/materiaisdidaticos/fibras-i/trans1a13.pdf
http://www.pucrs.br/quimica/professores/
arigony/acidos/constante.htm
http://reocities.com/Vienna/choir/9201/ac
idos_carboxilicos.htm
http://pt.wikipedia.org/wiki/%C3%81cido_
carbox%C3%ADlico
http://www.brasilmedicina.com.br/noticia
s/pgnoticias_det.asp?AreaSelect=3&Codig
o=134
http://mundoeducacao.uol.com.br/quimic
a/esteres.htm
http://www.brasilescola.com/quimica/este
res.htm
http://pt.wikipedia.org/wiki/%C3%89ster
http://www.brasilescola.com/quimica/eter
es.htm
http://mundoeducacao.uol.com.br/quimic
a/eteres.htm
http://pt.wikipedia.org/wiki/%C3%89ter
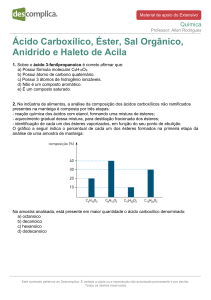
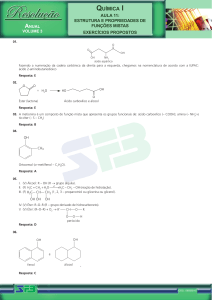
Exercícios:
1Dê o nome oficial dos ácidos
carboxílicos representados a seguir:
a)
H3C – CH2 – CH2 – CH2 – COOH
b)
H3C – (CH2)8 – COOH
c)
HOOC – CH2 – CH2 – COOH
d) H3C – C(CH3)2 – CH2 – COOH
e) HOOC – CH(CH2 CH3) – CH(CH3) – CH2 –
CH3
2Escreva as fórmulas estruturais e
moleculares dos ácidos carboxílicos a
seguir:
a)
ácido proparnodióico
b)
ácido heptanóico
c)
ácido propenóico
d)
ácido butenodióico
e)
ácido 2, 3 – dimetil – butanóico
3O ácido butírico contribui para o
cheiro característico de manteiga rançosa.
Esse ácido é formado por quatro átomos
de carbono unidos numa cadeia reta e
saturada. De a fórmula estrutural e o nome
oficial do ácido.
4A expressão “Você está cheirando a
bode” caracteriza um cheiro desagradável.
Algumas das substâncias responsáveis pelo
cheiro de bodes e cabras (caprinos) são os
ácidos capróico, caprílico e cáprico.
Sabendo que esses ácidos apresentam
cadeia alifática, normal e saturada com
respectivamente 6, 8 e 10 átomos de
carbono por molécula, escreva suas
fórmulas estruturais e dê seus nomes
oficiais.
5Uma molécula do ácido carboxílico
produzido por algumas formigas apresenta
quantas ligações do tipo sigma e quanta do
tipo pi?
6- Escreva as fórmulas estruturais dos
seguintes éteres:
a) metoxipropano
b) metoximetano
c) propoxibutano
d) etoxibenzeno
e) etil-propil-éter
f) butil-etil-éter
7Construa duas fórmulas estruturais
de éteres com cadeia reta e saturada que
apresentem fórmula molecular C4H10O. Dê
seus nomes oficiais.
Essência
Rum
Laranja
Maça-verde
Abacaxi
Éster presente
Formiato de etila
Acetato de octila
Acetato de etila
Butanoato de etila
Escreva as fórmulas estruturais desses
ésteres orgânicos.
11- os ésteres podem ser obtidos por meio
da reação entre ácidos e álcoois.
Genericamente, temos:
Com base nessa informação, equacione ou
complete as reações a seguir e indique o
nome dos ésteres formados:
a) Ácido acético e metanol
b) ácido fórmico e etanol
8O difenil-éter ou fenoxibenzeno
apresenta fórmula molecular igual a:
a) C6H10O
b) C12H12O
c)
C12H10O
d) C 6H6O
e)
C12H12O2
c) ácido butanoico e 1-propanol;
9- Qual dos compostos abaixo pertencem à
função “éter”:
12- O urucum é uma planta da América
tropical. Seu nome vem do tupi uru-ku, que
significa vermelho. Da polpa do seu fruto
obtém-se um corante vermelho: bixina.
Esse corante, lipossolúvel, é muito usado
na indústria de alimentos e na de
cosméticos. Sua formula estrutural pode
ser representada por:
a) CH3CH2CH3
b) CH3COCH3
c) CH3COOCH3
d) ácido benzoico e 2-propanol
e) x + y -˃ H3C + CH2-COO-CH2-CH3 + H2O
d) CH3CH2OCH3
e) CH3CH2CHO
10- A maioria dos ésteres de pequena
massa molar é constituída por líquidos de
cheiro agradável. As essências das frutas e
das flores são geralmente consequência da
presença de ésteres voláteis, embora
outros compostos orgânicos também
possam participar. Alguns ésteres comuns,
de odores característicos, são fornecidos
abaixo:
A respeito da estrutura apresentada:
a) quais funções estão presentes?
b) qual a sua fórmula molecular?
c) indique o número de carbonos
terciários, secundários e primários.
Indique os radicais presentes.