Glicólise e desidrogénase do piruvato; Rui Fontes
Glicólise e desidrogénase do piruvato
1-
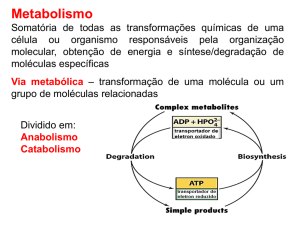
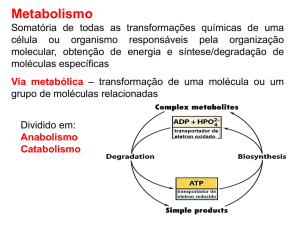
O metabolismo energético dos seres vivos pode ser interpretado como um processo no qual os nutrientes
são oxidados pelo O2 (catabolismo) gerando a energia necessária para a síntese de ATP (a partir de
ADP + Pi), ao mesmo tempo que o ATP formado é hidrolisado (a ADP + Pi) fornecendo a energia
utilizada na síntese de múltiplas substâncias (anabolismo), na atividade muscular e na manutenção dos
gradientes iónicos. Juntamente com outros mecanismos, a fome é um importante mecanismo
homeostático: a ingestão de alimentos fornece ao organismo as substâncias cuja oxidação permite
manter a concentração de ATP praticamente constante (“estacionária”). Numa determinada célula do
organismo a concentração de ATP praticamente não varia, mesmo quando a sua velocidade de hidrólise
aumenta porque, quando isto acontece (por exemplo, nas fibras musculares, durante o esforço físico),
aumenta igualmente a sua velocidade de síntese (formação de ATP a partir de ADP e Pi). Este aumento
da velocidade de síntese de ATP implica um aumento da velocidade do catabolismo: um aumento na
velocidade de oxidação dos nutrientes.
2-
A glicólise é uma via metabólica do citoplasma das células (de todas as células) em que a glicose é, num
processo exergónico, convertida em piruvato (ou lactato) e se forma, concomitantemente e num
processo endergónico, ATP a partir de ADP + Pi. As enzimas da glicólise são, no seu conjunto, “a
máquina” que permite a acoplagem dos dois processos.
3-
Na maioria das células do organismo a entrada da glicose do sangue para o citoplasma dá-se a favor do
gradiente e o transporte é catalisado por proteínas da membrana que são uniporters. Estes uniporters
designam-se por GLUTs e podem ser produtos de genes distintos em órgãos distintos. Nos casos do polo
basal dos enterócitos e dos hepatócitos a concentração de glicose pode, em certas condições, ser mais alta
no citoplasma que no sangue: nestas condições o GLUT (nestes casos, o GLUT2) catalisa a saída de
glicose da célula. Noutras condições ocorre o inverso e a glicose entra para estas células. No caso dos
músculos, porque toda a glicose que entra é imediatamente fosforilada a glicose-6-fosfato (catálise pela
hexocínase II1; ver Equação 1) e não existem, aqui, enzimas capazes de converter a glicose-6-fosfato em
glicose, o gradiente de concentrações favorece sempre a entrada de glicose. Nos músculos, o transporte
transmembranar de glicose é catalisado pelo GLUT4 mas o número de transportadores na membrana
sarcoplasmática de uma fibra muscular varia consoante o estado hormonal e a atividade contráctil da
fibra muscular. O número de moléculas de GLUT4 na membrana sarcoplasmática e, consequentemente,
a velocidade com que uma fibra muscular capta a glicose do sangue aumenta quando aumenta a
concentração de insulina no sangue ou quando aumenta a atividade contráctil da fibra muscular em
questão [1]. Ambos os estímulos promovem a migração para a membrana sarcoplasmática de vesículas
que estavam no citoplasma e que contêm GLUT4: as vesículas fundem-se com a membrana que
incorpora as moléculas de GLUT4 na sua estrutura.
4-
As enzimas da glicólise são: a cínase da glicose ou a cínase das hexoses (ver nota 1 e Equação 1), a
isomérase das fosfohexoses (ver Equação 2), a cínase-1 da frutose-6-fosfato (ver Equação 3), a
aldólase (ver Equação 4), a isomérase das trioses-fosfato (ver Equação 5), a desidrogénase do
gliceraldeído-3-fosfato (ver Equação 6), a cínase do 3-fosfoglicerato (ver Equação 7), a mútase do
fosfoglicerato (ver Equação 8), a enólase (ver Equação 9) e a cínase do piruvato (ver Equação 10). Tal
como em todas as vias metabólicas, um dos produtos formados pela ação catalítica de uma enzima é
substrato de uma outra enzima permitindo compreender que se possa desenhar uma cadeia sequenciada
de reações e que, no seu conjunto, as enzimas da glicólise convertam glicose em piruvato. Se ignorarmos
momentaneamente a formação de NADH e o consumo e formação de ATP poderemos escrever a
seguinte sequência de transformações: glicose → glicose-6-fosfato → frutose-6-fosfato → frutose-1,6bisfosfato → (dihidroxiacetona-fosfato + gliceraldeído-3-fosfato); dihidroxiacetona-fosfato →
gliceraldeído-3-fosfato → 1,3-bisfosfoglicerato → 3-fosfoglicerato → 2-fosfoglicerato →
fosfoenolpiruvato → piruvato.
1
O reconhecimento recente da estrutura primária das diferentes isoenzimas que, nos mamíferos, são capazes de catalisar a
fosforilação da glicose motivou uma mudança na nomenclatura das isoenzimas com esta atividade catalítica. Os estudos
funcionais já haviam demonstrado, há mais de 50 anos, que havia, pelo menos, duas isoenzimas com esta atividade que
foram, então, designadas por cínase da glicose (mais específica para a glicose e existindo no fígado, rim e células β dos
ilhéus pancreáticos) e por cínase das hexoses (existe noutras células e é menos específica aceitando também a frutose
como substrato). Atualmente a cínase da glicose também é designada por hexocínase IV. A atividade da cínase das
hexoses é, sabe-se hoje, partilhada por três hexocínases diferentes designadas de hexocínases I, II e III.
Página 1 de 6
Glicólise e desidrogénase do piruvato; Rui Fontes
Equação 1
Equação 2
Equação 3
Equação 4
Equação 5
Equação 6
Equação 7
Equação 8
Equação 9
Equação 10
glicose + ATP → glicose-6-fosfato + ADP
glicose-6-fosfato ↔ frutose-6-fosfato
frutose-6-fosfato + ATP → frutose-1,6-bisfosfato + ADP
frutose-1,6-bisfosfato ↔ gliceraldeído-3-fosfato + dihidroxiacetona-fosfato
dihidroxiacetona-fosfato ↔ gliceraldeído-3-fosfato
gliceraldeído-3-fosfato + Pi + NAD+ ↔ 1,3-bisfosfoglicerato + NADH
1,3-bisfosfoglicerato + ADP ↔ 3-fosfoglicerato + ATP
3-fosfoglicerato ↔ 2-fosfoglicerato
2-fosfoglicerato ↔ fosfoenolpiruvato + H2O
fosfoenolpiruvato + ADP → piruvato + ATP
5-
A aldólase (ver Equação 4) é a enzima da glicólise que catalisa a cisão (lise) da molécula de frutose-1,6bisfosfato (6C) em gliceraldeído-3-fosfato (3C) e dihidroxiacetona-fosfato (3C). A transformação da
dihidroxiacetona-fosfato em gliceraldeído-3-fosfato (ver Equação 5) e a posterior transformação deste
composto em piruvato (3C; ver Equações 6-10) permite compreender que uma molécula de glicose (6C)
dê origem a duas de piruvato (2 × 3C). Antes da lise da frutose-1,6-bisfosfato duas moléculas de ATP
servem como substratos dadores de fosfato em reações de fosfotransferência catalisadas pelas cínases
da glicose e da frutose-6-fosfato (ver Equação 1 e Equação 3). Depois da lise da frutose-1,6-bisfosfato
ocorre a formação de ATP em duas reações de fosfotransferência em que o substrato aceitador é o ADP e
os substratos dadores são o 1,3-bisfosfoglicerato (cínase do 3-fosfoglicerato; ver Equação 7) e o
fosfoenolpiruvato (cínase do piruvato; ver Equação 10). As reações de formação de ATP a partir de ADP
através de reações de fosfotransferência designam-se, comummente, de “fosforilações ao nível do
substrato” (por contraponto com à “fosforilação oxidativa” mitocondrial). Também já depois da lise da
frutose 1,6-bisfosfato ocorre a redução do NAD+ (e consequente formação do NADH) numa reação em
que, concomitantemente com a reação de oxirredução ocorre a adição de fosfato inorgânico (Pi): esta
reação é a catalisada pela desidrogénase do gliceraldeído-3-fosfato (ver Equação 6).
6-
O somatório das reações envolvidas na formação do piruvato a partir de glicose pode ser expressa pela
Equação 11:
Equação 11
glicose (C6H12O6) + 2NAD+ + 2ADP + 2Pi →
2 ác. pirúvico (C3H4O3) + 2NADH + 2ATP + 2H2O
A energia libertada no processo de cisão e oxidação de um mole de glicose por dois moles de NAD+
permite a formação de 2 moles de ATP (a partir de ADP e Pi). O processo oxidativo envolve dois pares
de eletrões que são cedidos pela glicose (que se oxida a piruvato) e aceites por dois NAD+ (que se
reduzem a NADH).
7-
Os eritrócitos são as células mais simples do organismo. Porque não têm mitocôndrias, todo o ATP que
hidrolisam (por exemplo, na ação da ATPase do Na+/K+) formando ADP e Pi é reposto na transformação
expressa pela Equação 11, ou seja, na glicólise. Existe aqui, tal como em todas as células do organismo,
um ciclo de formação e hidrólise de ATP onde as concentrações de ATP, ADP e Pi se mantêm
estacionárias. A concentração de NAD+ (e NADH) dentro dos eritrócitos é (como em todas as células)
muito baixa (estimada em cerca de 78 µM [2]) e, na ausência de um mecanismo que permitisse reoxidar
o NADH a NAD+, todo o NAD+ do eritrócito se esgotaria em cerca de 1 minuto2. De facto a
concentração de NAD+ (e NADH) é estacionária porque cada molécula de NADH que se forma na
glicólise é imediatamente oxidada a NAD+ por ação catalítica da desidrogénase do lactato:
Equação 12
2 NADH + 2 ácido pirúvico ↔ 2 NAD+ + 2 ácido láctico
O somatório da Equação 11 e da Equação 12 e de uma outra (Equação 13) que representa todos os
processos que, no eritrócito, hidrolisam ATP à mesma velocidade com que se forma permitem escrever a
Equação 14.
Equação 13
Equação 14
2 ATP + 2 H2O → 2 ADP + 2 Pi
glicose (C6H12O6) → 2 ácido láctico (C3H6O3)
Temos 2 L de eritrócitos que oxidam cerca de 70 µmol de glicose por minuto (e reduzem 140 µmol de NAD+ no mesmo
tempo).
2
Página 2 de 6
Glicólise e desidrogénase do piruvato; Rui Fontes
Assim, os eritrócitos consomem glicose e libertam continuamente ácido láctico que vai ser metabolizado
por outras células do organismo. À glicólise que tem como produto o ácido láctico (= lactato + protão)
chama-se glicólise anaeróbica porque não consome oxigénio. A Equação 14 mostra que o processo não
é globalmente oxidativo: o número de oxidação médio dos carbonos da glicose e do ácido láctico são
iguais (em ambos os casos, 0). Nos mamíferos, a única reação em que o ácido láctico é substrato é a que
é catalisada pela desidrogénase do lactato (Equação 12), uma enzima que catalisa uma reação
fisiologicamente reversível. Nos órgãos para onde o ácido láctico é exportado (fígado e coração, por
exemplo) a única reação em que o ácido láctico intervém é a que é expressa pela Equação 12 mas, agora,
desenvolve-se no sentido de formar ácido pirúvico que será depois oxidado nas mitocôndrias desses
órgãos ou, eventualmente, sofrer outras transformações (como, no fígado, a conversão em glicose).
8-
Ao contrário dos eritrócitos todas as outras células têm mitocôndrias e, em condições “normais”, o ácido
láctico que vertem para o sangue é relativamente escasso. Nestes casos, cada molécula de NADH que se
forma durante a glicólise é imediatamente oxidada (ver Equação 15Equação 11), não por ação da
desidrogénase do lactato, mas sim pelo O2 na cadeia respiratória das mitocôndrias:
Equação 15
2 NADH + O2 → 2 NAD+ + 2 H2O
Desta forma as concentrações de NADH são mantidas baixas na célula ao mesmo tempo que o NAD+ é
regenerado. O somatório da Equação 11 e da Equação 15 é a Equação 16 que expressa a ação conjugada
das enzimas da glicólise e da cadeia respiratória, ou seja, a glicólise aeróbica:
Equação 16
9-
glicose (C6H12O6) + O2 + 2ADP + 2Pi → 2 ácido pirúvico (C3H4O3) + 2ATP + 2H2O
Em condições geralmente designadas de aerobiose, o ácido pirúvico entra para as mitocôndrias onde, por
ação catalítica da desidrogénase do piruvato se converte em acetil-CoA. A reação catalisada pela
desidrogénase do piruvato é fisiologicamente irreversível e é descrita pela Equação 17:
Equação 17
piruvato + CoA + NAD+ → acetil-CoA + CO2 + NADH
O processo catalítico é frequentemente descrito como uma “oxidação descarboxilativa” porque a par de
uma reação de oxi-redução ocorre uma descarboxilação (saída de CO2) de tal forma que o número de
carbonos do resíduo acetilo da acetil-CoA (dois) é menor que o do piruvato (três). Permitindo a oxidação
das novas moléculas de ácido pirúvico formadas durante a oxidação da glicose, cada molécula de NADH
formada é imediatamente oxidada a NAD+ pelo O2 na cadeia respiratória (ver Equação 15). O resíduo
acetilo do acetil-CoA é oxidado a CO2 no ciclo de Krebs e neste processo também se formam ATPs.
10-
A desidrogénase do piruvato (ver Equação 17) é, de facto, um complexo multienzímico composto por
5 tipos diferentes de proteínas que se designam por (E1) desidrogénase do piruvato, (E2) transacetílase
do dihidrolipoato, (E3) desidrogénase do dihidrolipoato, (E4) cínase da desidrogénase do piruvato e (E5)
fosfátase da desidrogénase do piruvato. Estas proteínas estão organizadas em agregados dentro da
mitocôndria. As proteínas E1, E2 e E3 são coletivamente responsáveis pela catálise expressa pela
Equação 17 e contêm, como grupos prostéticos tiamina-pirofosfato, ácido lipóico e FAD,
respetivamente. A cínase da desidrogénase do piruvato (E4; ver Equação 18) e a fosfátase da
desidrogénase do piruvato (E5; ver Equação 19) têm papéis reguladores da atividade catalítica do
complexo. Quando a proteína E1 de um dado complexo está na forma desfosforilada este complexo está
ativo enquanto a forma fosforilada é inativa. A cínase da desidrogénase do piruvato catalisa a
fosforilação da proteína E1 catalisando a transferência do fosfato γ do ATP (ver Equação 18) e,
consequentemente, inativando o complexo. A fosfátase da desidrogénase do piruvato catalisa a hidrólise
de E1 fosforilada (ver Equação 19) e, consequentemente, promove a ativação do complexo.
Equação 18
Equação 19
11-
ATP + desidrogénase do piruvato desfosforilada (ativa) →
ADP + desidrogénase do piruvato fosforilada (inativa)
desidrogénase do piruvato fosforilada (inativa) + H2O →
desidrogénase do piruvato desfosforilada (ativa) + Pi
Num coração normal cada molécula de ácido pirúvico formado durante a oxidação da glicose é
imediatamente oxidada formando-se CO2 (ver Equação 15 e Equação 17): a glicólise do miocárdio
normal é aeróbica. Contudo, em situações em que o fluxo sanguíneo está perturbado (situações de
isquemia como o infarto ou angina de peito) o fornecimento de O2 não é suficiente para oxidar todas as
Página 3 de 6
Glicólise e desidrogénase do piruvato; Rui Fontes
moléculas de NADH formadas. Assim, ocorre aumento da concentração intracelular de NADH (e
diminuição na de NAD+) que faz com que a reação catalisada pela desidrogénase do lactato (Equação 12)
passe a evoluir no sentido da formação de ácido láctico. Ao contrário do que acontece no coração
saudável (que oxida ácido láctico), o coração isquémico produz ácido láctico: parte da glicólise do
coração isquémico é anaeróbica [3] sendo a Equação 14 a que melhor descreve o processo. Uma
situação semelhante acontece em tumores sólidos mal irrigados.
12-
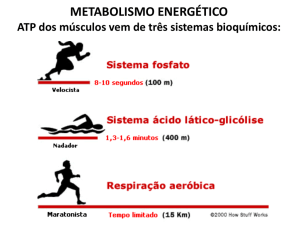
Apesar do seu baixo rendimento “energético” (apenas 2 moles de ATP formadas por mole de glicose
cindida), a glicólise anaeróbica tem um papel essencial na sobrevivência dos indivíduos e, em última
análise, na sobrevivência das espécies. Nas fibras musculares esqueléticas, em particular nas que são
mais pobres em mitocôndrias (fibras musculares brancas), a glicólise pode aumentar explosivamente de
velocidade em situações em que a velocidade de hidrólise do ATP aumenta de forma dramática (ao subir
a uma árvore, por exemplo). Numa situação deste tipo, embora a velocidade de oxidação do piruvato pela
cadeia respiratória aumente, este aumento de velocidade não é suficiente para acompanhar o aumento
explosivo da velocidade da glicólise. A atividade da desidrogénase do lactato das fibras musculares
permite este aumento explosivo da velocidade da glicólise porque converte o NADH e o ácido pirúvico
em NAD+ e ácido láctico (Equação 12): em situações deste tipo uma parte substancial do ATP formado
na fibra muscular (essencial para manter a sua síntese à mesma velocidade com que se hidrolisa) resulta
da glicólise anaeróbica [4-5].
13-
De facto, mesmo em repouso, os músculos, sobretudo as fibras musculares brancas, produzem,
normalmente, algum lactato, mas o exercício físico intensifica marcadamente o processo [5]. Durante o
exercício que é costume designar-se de “anaeróbico” a concentração de lactato nas fibras musculares
pode aumentar cerca de 30 vezes e é comum afirmar-se que é esta acumulação do ião lactato que provoca
a fadiga. Contudo as evidências experimentais demonstram que, embora a concentração de lactato
formado endogenamente esteja diretamente relacionada com o grau de fadiga, o ião lactato não interfere
na atividade contráctil. Como mostra a Equação 14, na glicólise anaeróbica uma substância aprótida
(a glicose) transforma-se numa outra que emite protões (ácido láctico). O pKa do ácido láctico (≈4) é
mais baixo que o pH do citoplasma das fibras musculares (≈7) e, por isso, a esmagadora maioria das
moléculas de ácido láctico dissocia-se formando o ião lactato e provocando uma descida do pH (de cerca
7 para valores tão baixos quanto 6,5). No esforço muscular contráctil em regime anaeróbico a descida
do pH inibe a atividade muscular contráctil e é um dos fatores envolvidos no processo de fadiga que
impede um sprinter de continuar a correr depois de terminar a sua prova. Durante os processos
isquémicos a descida do pH intracelular que ocorre devido à glicólise anaeróbica também contribui para
a diminuição da capacidade contráctil e este efeito tem uma enorme importância clínica: no coração
isquémico a capacidade de bombeamento está diminuída.
14-
Pelo menos nos órgãos ditos “excitáveis” (como, por exemplo, o músculo esquelético) a velocidade de
hidrólise do ATP pode sofrer variações muito marcadas (no estado de esforço pode ser mais de 100 vezes
superior à do estado de repouso) mas, em condições fisiológicas, a velocidade de síntese sobe de forma
paralela. Isto só é possível porque a velocidade de consumo de nutrientes, incluindo o de glicose na
glicólise (e subsequente oxidação do piruvato pelo O2) também aumenta marcadamente em
situações de esforço. Os mecanismos moleculares que, nos mamíferos, permitem explicar estas subidas
de velocidade da glicólise são ainda mal compreendidos e, por isso, são atualmente objeto de intensa
investigação e especulação [4]. (a) Um dos mecanismos que se crê terem importância nesta adaptação do
consumo de glicose às necessidades de ATP já foi referido acima: o esforço muscular contráctil induz o
aumento do número de moléculas de GLUT4 na membrana das fibras musculares e o consequente
aumento na velocidade da entrada de glicose para essas fibras. Esse aumento dá-se de forma muito rápida
porque não implica a síntese de novas moléculas de transportador nos ribossomas, mas sim a fusão de
vesículas intracelulares (que já contêm GLUT4) com a membrana celular. (b) Um outro mecanismo que
poderá ser importante na adaptação do consumo de glicose às situações de esforço é o ião Ca2+. Quando
uma fibra muscular é excitada pelo seu nervo motor aumenta a concentração citoplasmática e
mitocondrial de Ca2+: no caso do citoplasma este aumento pode ser de 100 vezes (de 0,1 µM para 10
µM) [5]. A fosfátase da desidrogénase do piruvato é o componente do complexo desidrogénase do
piruvato que catalisa a sua desfosforilação e a consequente ativação do processo de conversão do
piruvato em acetil-CoA (ver Equação 17). A fosfátase da desidrogénase do piruvato é ativada pelo Ca2+
e, consequentemente, quando a concentração de Ca2+ aumenta em resposta ao estímulo nervoso aumenta
também a velocidade de oxidação do piruvato a acetil-CoA.
Página 4 de 6
Glicólise e desidrogénase do piruvato; Rui Fontes
15-
É comum escrever-se que nas situações fisiológicas em que há aumento do consumo de ATP nas células
a sua concentração desce. De facto é possível observar descida da concentração de ATP em condições
experimentais que não parecem refletir situações fisiológicas [3, 6, 7]. Atualmente, crê-se que essas
descidas são artefactos experimentais ou refletem condições extremas dificilmente observáveis num ser
vivo saudável; no atual estádio do conhecimento pensa-se que, em condições fisiológicas, a
concentração de ATP não sofre qualquer variação apreciável dentro das células [7, 9-12]. No entanto, no
caso dos músculos esqueléticos, parece poder ocorrer em situações de esforço, aumentos na concentração
de ADP e AMP [4, 10-11]. Pode parecer estranho que, resultando o ADP da hidrólise do ATP (ATP +
H2O → ADP + Pi) e o AMP da conversão do ADP (catálise pela cínase do adenilato; ver Equação 20)
possam ocorrer aumentos de concentração do ADP e AMP sem que, praticamente, ocorram variações na
concentração de ATP. Em repouso a concentração de ATP pode ser cerca de 100 vezes superior à de
ADP e cerca de 10000 vezes superior à de AMP [8]. Assim, tendo em conta a reação de hidrólise do
ATP, à descida de 1% na concentração de ATP corresponde a subida para o dobro na concentração de
ADP. Por sua vez, tendo em conta o equilíbrio químico da reação catalisada pela cínase de adenilato (ver
Equação 20), a uma subida percentual modesta no ADP corresponde uma variação percentual mais
marcada no AMP [9]. Quer o AMP quer o ADP são potentes ativadores alostéricos de uma das enzimas
da glicólise que se pensa ter maior importância na regulação da velocidade da glicólise: a cínase-1 da
frutose 6-fosfato (ver Equação 3). Curiosamente, um dos substratos desta enzima é o ATP mas, em
concentrações fisiológicas, o ATP, para além de se ligar no centro ativo, pode também ligar-se ao centro
alostérico e inibir a atividade da enzima. A ação ativadora do ADP e do AMP resulta da sua capacidade
para competir com o ATP pelo centro alostérico da enzima: quando as concentrações de AMP e/ou ADP
aumentam substituem o ATP no centro alostérico e impedem a sua ação inibidora.
Equação 20
2 ADP ↔ AMP + ATP
16-
No que se refere à regulação da glicólise e da desidrogénase do piruvato no fígado destacaríamos o
papel da glicemia (concentração de glicose no sangue) e das hormonas insulina e glicagina. Estas
hormonas são, respetivamente, sintetizadas nas células β e nas células α dos ilhéus de Langerhans do
pâncreas. Quando se ingere uma refeição que contenha glicídeos, a concentração de glicose aumenta no
sangue e de forma muito marcada na veia porta; nesta veia, que irriga o fígado, a concentração de glicose
pode subir de 4 mM para 14 mM. Este aumento na glicemia provoca aumento da síntese e secreção de
insulina e poderá causar descida na de glicagina: de qualquer forma, o aumento da glicemia provoca
sempre aumento da razão entre as concentrações de insulina e de glicagina. Quer diretamente, quer
através das ações destas hormonas (a insulina é ativadora da oxidação da glicose e glicagina é inibidora)
o aumento da glicemia vai estimular a velocidade de oxidação de glicose no fígado. Quando, pelo
contrário, a glicemia baixa o fígado deixa de oxidar glicose (e passa a oxidar ácidos gordos).
17-
Ao contrário do que acontece nos músculos, a concentração de glicose dentro dos hepatócitos é
semelhante à do sangue: o transportador GLUT2 tem grande atividade e permite manter uma situação de
“quase equilíbrio” entre as duas faces da membrana. Assim, quando aumenta a concentração de glicose
no sangue também aumenta, de forma paralela, a concentração de glicose dentro dos hepatócitos.
Quando a glicemia é baixa, grande parte da cínase da glicose (ou hexocínase IV; ver Equação 1) está
sequestrada dentro do núcleo ligada a uma outra proteína que a inibe. A ligação da glicose ao complexo
hexocínase IV- proteína inibidora leva à sua dissociação e à subsequente translocação da hexocínase
IV do núcleo para o citoplasma onde inicia a glicólise [14]. O aumento da concentração plasmática da
insulina (que acompanha a da glicose) também estimula a glicólise: no fígado, os efeitos ativadores da
insulina na velocidade da glicólise resultam, pelo menos em parte, da indução da síntese de enzimas
chave da glicólise, como a cínase da glicose e a cínase do piruvato. A insulina, porque reprime a
expressão da cínase da desidrogénase do piruvato, também estimula a desidrogénase do piruvato; na
ausência da cínase, a desidrogénase do piruvato mantêm-se na forma desfosforilada, a ativa [10].
18-
A glicagina é uma hormona que, no ser humano e em concentrações fisiológicas, exerce os seus efeitos,
apenas no fígado; é na membrana celular dos hepatócitos que existem recetores capazes de a reconhecer.
O aumento da secreção pancreática de glicagina (células α) quando a glicemia desce faz parte dum
mecanismo homeostático que permite poupar glicose no fígado neste estado nutricional; em jejum a
glicagina vai fazer diminuir, no fígado, a concentração de uma substância (frutose-2,6-bisfosfato) que é
um potente ativador alostérico de uma enzima da glicólise: a cínase-1 da frutose 6-fosfato (ver Equação
3). Desta forma, a glicagina, diminuindo a atividade desta enzima da glicólise vai, no fígado, diminuir
a velocidade de consumo de glicose. A glicagina também induz a inibição da cínase do piruvato
Página 5 de 6
Glicólise e desidrogénase do piruvato; Rui Fontes
hepática, outra enzima da glicólise. O efeito inibidor da glicagina na cínase do piruvato hepática é uma
consequência da fosforilação da enzima: a cínase do piruvato hepática é, tal como a desidrogénase do
piruvato, inativada por fosforilação.
1. Russell, R. R., 3rd, Bergeron, R., Shulman, G. I. & Young, L. H. (1999) Translocation of myocardial GLUT-4 and increased glucose
uptake through activation of AMPK by AICAR, Am J Physiol. 277, H643-9.
2. Millman, M. S. & Omachi, A. (1972) The role of oxidized nicotinamide adenine dinucleotide in fluoride inhibition of active sodium
transport in human erythrocytes, J Gen Physiol. 60, 337-50.
3. Stanley, W. C. (2004) Myocardial energy metabolism during ischemia and the mechanisms of metabolic therapies, J Cardiovasc
Pharmacol Ther. 9 Suppl 1, S31-45.
4. Korzeniewski, B. & Liguzinski, P. (2004) Theoretical studies on the regulation of anaerobic glycolysis and its influence on oxidative
phosphorylation in skeletal muscle, Biophys Chem. 110, 147-69.
5. Balaban, R. S. (2002) Cardiac energy metabolism homeostasis: role of cytosolic calcium, J Mol Cell Cardiol. 34, 1259-71.
6. Korzeniewski, B. (2006) Oxygen consumption and metabolite concentrations during transitions between different work intensities in
heart, Am J Physiol Heart Circ Physiol. 291, H1466-74.
7. Ihlemann, J., Ploug, T., Hellsten, Y. & Galbo, H. (2000) Effect of stimulation frequency on contraction-induced glucose transport in
rat skeletal muscle, Am J Physiol Endocrinol Metab. 279, E862-7.
8. Stephens, T. J., Chen, Z. P., Canny, B. J., Michell, B. J., Kemp, B. E. & McConell, G. K. (2002) Progressive increase in human
skeletal muscle AMPKalpha2 activity and ACC phosphorylation during exercise, Am J Physiol Endocrinol Metab. 282, E688-94.
9. Sacktor, B. & Wormser-Shavit, E. (1966) Regulation of metabolism in working muscle in vivo. I. Concentrations of some glycolytic,
tricarboxylic acid cycle, and amino acid intermediates in insect flight muscle during flight, J Biol Chem. 241, 624-31.
10. Sugden, M. C. & Holness, M. J. (2006) Mechanisms underlying regulation of the expression and activities of the mammalian
pyruvate dehydrogenase kinases, Arch Physiol Biochem. 112, 139-49.
Página 6 de 6