RELAÇÕES SOLO-ÁGUA-PLANTA EM
AMBIENTES NATURAIS E AGRÍCOLAS DO
NORDESTE BRASILEIRO
PROMOÇÃO
Universidade Federal Rural de Pernambuco
PARTE I
Claudivan Feitosa de Lacerda
Engenheiro Agrônomo/UFC
MS, Solos e Nutrição de Plantas/UFC
DS, Fisiologia Vegetal/UFV
Professor Adjunto
Departamento de Engenharia Agrícola
Centro de Ciências Agrárias
Universidade Federal do Ceará
Recife – Pernambuco
Dezembro de 2007
CONTEÚDO
UNIDADE
PÁGINA
UNIDADE 1 - A ÁGUA E O SEU CICLO NO SISTEMA SOLOPLANTA-ATMOSFERA
3
1. O CICLO DA ÁGUA NO SISTEMA SOLO-PLANTA-ATMOSFERA
2. ESTRUTURA DA ÁGUA
3. PROPRIEDADES DA ÁGUA
4. IMPORTÂNCIA DA ÁGUA PARA OS VEGETAIS
3
4
5
8
UNIDADE 2 – DEFINIÇÕES RELATIVAS À QUANTIFICAÇÃO DE
ÁGUA NO SISTEMA SOLO-PANTA-ATMOSFERA
10
1. FORMAS DE QUANTIFICAÇÃO DE ÁGUA
2. ENERGIA TOTAL DA ÁGUA NO SISTEMA
10
10
UNIDADE 3 – ATRIBUTOS FÍSICOS E QUANTIFICAÇÃO DA ÁGUA
NO SOLO
15
1. ATRIBUTOS FÍSICOS DO SOLO
2. QUANTIFCAÇÃO DA ÁGUA NO SOLO
15
18
UNIDADE
4
–
CARACTERÍSTICAS
QUANTIFICAÇÃO DA ÁGUA NA PLANTA
ESTRUTURAIS
E
1. ORGANIZAÇÃO ESTRUTURAL DAS PLANTAS
27
27
2. QUANTIFICAÇÃO DE ÁGUA NA PLANTA
36
UNIDADE 5 – CARACTERIZAÇÃO QUANTIFICAÇÃO DE ÁGUA NA
ATMOSFERA
43
1. COMPOSIÇÃO E CARACTERIZAÇÃO DA ATMOSFERA
2. QUANTIFICAÇÃO DO VAPOR DÁGUA NA ATMOSFERA
43
45
UNIDADE 6 – TRANSPORTE DE ÁGUA NO SISTEMA SOLOPLANTA
47
1. ABSORÇÃO DE ÁGUA PELAS PLANTAS
2. TRANSPORTE DE ÁGUA PARA A PARTE AÉREA
47
53
58
1
UNIDADE
7.
TRANSPIRAÇÃO,
EVAPOTRANSPIRAÇÃO,
PRODUTIVIDADE E EFICIÊNCIA NO USO DA ÁGUA
1. CONCEITOS E FUNÇÕES
2. A FORÇA MOTRIZ E AS RESISTÊNCIAS AO FLUXO
TRANSPIRATÓRIO
3. FISIOLOGIA DOS ESTÔMATOS
4. COMPORTAMENTO ESTOMÁTICO E EFICIÊNCIA NO USO DA
ÁGUA
5. QUANTIFICAÇÃO DA TRANSPIRAÇÃO E EVAPOTRANSPIRAÇÃO
58
60
UNIDADE 8 – DÉFICIT HÍDRICO E CRESCIMENTO VEGETAL I:
70
61
64
67
MECANISMOS FISIOLÓGICOS, PROCESSOS E FENOLOGIA
1. DÉFICIT HÍDRICO DIÁRIO: uma condição normal das plantas
2. CARACTERIZAÇÃO E OCORRÊNCIA DA SECA
3. MECANISMOS DE RESISTÊNCIA À SECA
4. REAÇÕES DAS PLANTAS AO ESTRESSE HÍDRICO
70
72
72
74
BIBLIOGRAFIA
78
2
UNIDADE 1 - A ÁGUA E O SEU CICLO NO SISTEMA SOLO-PLANTAATMOSFERA
1. O CICLO DA ÁGUA NO SISTEMA SOLO-PLANTA-ATMOSFERA
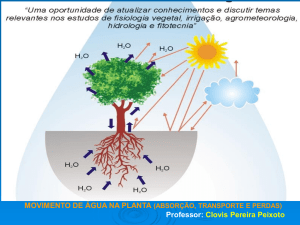
A água é a substância mais reciclável da natureza. Na faixa de temperatura que ocorre
sobre a terra ela pode ser encontrada nos estados sólido, líquido e gasoso, e as condições
ambientais permitem constantes mudanças de estado.
O vapor d’água na atmosfera em condições especiais forma as nuvens, podendo retornar
à superfície na forma de chuva (estado líquido), granizo ou neve (estado sólido). A chuva,
principal forma de precipitação na nossa região, ao atingir a superfície do solo nele se infiltra,
podendo ocorrer escoamento de parte da água sobre a superfície do solo
(Figura 1.1). Esse escoamento superficial ou “run-off” pode ser maior ou menor, dependendo
da intensidade da chuva, da declividade e das características físicas do solo. Em geral, quanto
maior o escoamento superficial maiores são as perdas de solo por erosão.
Figura 1.1 – O ciclo da água no Sistema SSPA (Reichardt, 1990).
3
A água que se infiltra no solo fica armazenada nos seus poros, ficando parte dela
disponível para as plantas. Quando o volume de água ultrapassa a capacidade de
armazenamento do solo, o excedente é percolado para horizontes mais profundos,
contribuindo para a recarga dos aqüíferos subterrâneos.
A água dentro do solo não permanece estática e, em geral, nem todos os poros do solo
ficam preenchidos com água. Nos solos não saturados, uma parte dos poros fica cheia de ar,
constituindo a atmosfera do solo, fundamental para a respiração dos microorganismos e das
raízes de plantas. Nos tortuosos poros cheios de água pode-se observar movimento de água
em todas as direções, em geral de regiões mais úmidas para regiões mais secas. Por exemplo,
quando horizontes mais superficiais se encontram mais secos que os horizontes mais
profundos pode-se observar a ascensão capilar, ou seja, um movimento ascendente de água
que em alguns casos específicos pode atingir a superfície do solo.
A água no solo e nos cursos de água evapora constantemente, sendo a taxa de
evaporação dependente da energia solar disponível para conversão da água líquida para a
forma de vapor. A água no solo é também retirada pelas raízes das plantas e depois evapora
no interior das folhas, sendo posteriormente transferidas para a atmosfera pela transpiração. O
processo conjunto que envolve a evaporação direta do solo e a transpiração das plantas é
denominado evapotranspiração, sendo fundamental para realimentar a atmosfera com vapor
de água. A taxa da evapotranspiração depende basicamente da demanda da atmosfera, da
intensidade de radiação e da disponibilidade de água no solo.
.
2. ESTRUTURA DA ÁGUA
Estrutura da Molécula
A molécula de água consiste de um átomo de oxigênio covalentemente ligado a dois
átomos de hidrogênio. A água é formada por mais de uma espécie molecular, desde que,
existem três tipos de isótopos de H (H1, H2 e H3) e três isótopos de O (O16, O17 e O18), os
quais podem ser combinados em 18 diferentes modos. No entanto, as quantidades de isótopos
presentes que não sejam o hidrogênio e o oxigênio comuns (H1 e O18) são muito pequenas.
Muitas das propriedades da água dependem do arranjo espacial dos átomos de H e O. Na
configuração espacial da molécula de água o oxigênio fica no centro de um tetraedro regular
com seus orbitais híbridos dirigindo-se para os vértices e unindo-se aos dois aos dois átomos
de hidrogênio, sendo que as duas ligações O – H formam um ângulo entre si de 105o. O
oxigênio é fortemente eletronegativo e tende a atrair em sua direção os elétrons dos átomos de
hidrogênio. Conseqüentemente, o oxigênio adquire uma carga negativa parcial (δ-), enquanto
que os dois átomos de hidrogênio se tornam positivamente carregados (δ+). Esta distribuição
assimétrica de cargas, torna a água uma molécula polar.
Embora a carga líquida da molécula de água seja zero, a separação de cargas positivas e
negativas gera uma forte atração mútua entre moléculas de água adjacentes e entre moléculas
de água e algumas macromoléculas e superfícies coloidais. Nestes casos, as ligações
predominantes são as interações dipolo-dipolo e as conhecidas pontes de hidrogênio. As
pontes de hidrogênio são fundamentais para as interações intermoleculares e ocorrem quando
átomos de H são encontrados entre dois centros eletronegativos. Como veremos adiante, as
pontes de H são determinantes da maioria das propriedades da água e de suas funções nos
vegetais.
Na água pode-se observar, também, as interações de van de Walls, as quais se
desenvolvem pela tendência que tem um núcleo (positivamente carregado) de uma molécula
4
de atrair os elétrons (negativamente carregados) de moléculas vizinhas. Essas forças são
relativamente fracas, sendo efetivas apenas quando as moléculas estão próximas umas das
outras.
Estrutura da Água Líquida e Sólida
Como comentamos anteriormente, a distribuição líquida das cargas na molécula de água
formam um tetraedro, com duas extremidades negativas e duas positivas. Por conseguinte,
cada molécula de água tende a se unir, através de pontes de H, com quatro outras moléculas.
Isso tem sido observado nos cristais de gelo, os quais formam estruturas hexagonais com
grandes espaços vazios no centro. Quando o gelo se funde, as ligações de H são estendidas e
as moléculas afastam-se entre si, com a distância entre os átomos de O aumentando de 2,75 Å
para 2,90 Å, em média. Essa modificação abriria a estrutura ainda mais e faria a água líquida
menos densa, se não fosse o fato de que ao tornar-se fluida, suas moléculas se unem entre si,
formando grupos compactos, conhecidos como agregados. Ao invés de quatro, cada molécula
de água no estado líquido é agora circundada pó um número maior de moléculas vizinhas. Isto
resulta no colapso parcial da estrutura do gelo e um aumento na densidade da água,
alcançando o máximo em 4oC. Quando a temperatura sobe acima de 4oC, ocorre um aumento
na agitação térmica das moléculas, induzindo um pequeno decréscimo na densidade, porém
permanecendo ainda bem superior à densidade do gelo.
A menor densidade do gelo, em relação à da água líquida, assume relativa importância
em regiões muito frias. Nestas regiões, o gelo flutua nas superfícies dos lagos ao invés de
descer para o fundo, sendo isto extremamente importante para a sobrevivência de organismos
aquáticos de todos os tipos, os quais vivem no fundo desses reservatórios de água.
Por outro lado, a forte atração das moléculas de água no estado líquido é fundamental na
determinação das estruturas de macromoléculas (proteínas, por exemplo) e de outras
estruturas celulares (como as membranas), influenciando diretamente nas suas funções. As
membranas celulares são formadas de proteínas e de uma bicamada de fosfolipídeos (os quais
possuem uma parte hidrofílica e outra hidrofóbica). Neste caso, as partes hidrofóbicas das
duas camadas se unem por interações hidrofóbicas e as partes hidrofílicas interagem com a
água. Verifica-se então, a maximização das interações hidrofóbicas e hidrofílicas, sendo que
os grupos polares da membrana são expostos à água com o conseqüente deslocamento dos
grupos não polares para o interior da estrutura. Esses tipos de interações são também
determinantes para a estrutura terciária das proteínas. De modo geral, pode-se dizer que as
interações hidrofóbicas entre moléculas biológicas ou dentro de uma mesma molécula
resultam, principalmente, das intensas forças de atração que as moléculas de água
desenvolvem entre si.
3. PROPRIEDADES DA ÁGUA
Temperatura e Estado Físico
A propriedade mais simples e, talvez, mais importante da água, é que ela é líquida na
faixa de temperatura compatível com a vida. Em geral, os pontos de fusão e ebulição se
relacionam com o tamanho molecular e, as mudanças de estado físico para pequenas
moléculas ocorrem em temperaturas menores do que para as grandes. Isto é observado em
algumas moléculas, como amônia e hidrocarbonetos (metano e etano), as quais são agrupadas
através das fracas forças de Van der Waals e a energia requerida para mudança de estado é
5
relativamente pequena. Estas moléculas são encontradas como gases em temperaturas
ambientes (Tabela 1.1).
Tabela 1.1 – Algumas propriedades físicas da água e de outras moléculas de similar tamanho
molecular (Hopkins, 2000).
Molécula
Água
Amônia
CO2
Metano
Etano
Metanol
Etanol
Massa
Molecular
(Da)
18
17
44
16
30
32
46
Calor
Específico
(J/g/oC)
4,2
5,0
2,6
2,4
Ponto de
fusão
(oC)
0
-77
-57
-182
-183
-94
-117
Calor de
fusão
(J/g)
335
452
180
58
96
100
109
Ponto de
Ebulição
(oC)
100
-33
-78
-164
-88
65
78
Calor de
vaporização
J/g)
2452
1234
301
556
523
1226
878
Com base no seu tamanho somente, era de se esperar que a água também ocorresse na
forma de vapor nas temperaturas encontradas na maior parte da terra, o que não ocorre na
realidade. Estas diferenças estão associadas à presença do oxigênio na molécula de água, o
qual introduz a polaridade e a oportunidade de formação de pontes de hidrogênio,
fortalecendo as interações intermoleculares e aumentando a quantidade de energia requerida
para separar estas moléculas. Outras moléculas que contêm oxigênio, como etanol e metanol,
também possuem pontos de ebulição próximos ao da água (Tabela 1.1).
Absorção e Dissipação de Calor
O termo calor específico é usado para descrever a capacidade térmica de uma
substância, ou seja, a quantidade de energia que pode ser absorvida pela substância para um
determinado aumento de sua temperatura. O calor específico da água é 4,184 J g-1 oC-1, sendo
maior do que o da maioria das substâncias, exceto amônia líquida (Tabela 1.1). Esse alto calor
específico da água está associado ao arranjo de suas moléculas, o qual permite que os átomos
de O e H vibrem livremente, como se fossem átomos livres. Para as plantas isso é
particularmente importante, pois reduz os danos relacionados às flutuações de temperatura do
ambiente.
A estrutura ordenada das moléculas de água na forma líquida também assegura uma alta
capacidade de condução de calor, ou seja, alta condutividade térmica. Isso significa que a
água conduz calor rapidamente de um ponto para outro. Desta forma, a combinação do alto
calor específico com a alta condutividade térmica faz com que a água absorva e redistribua
grandes quantidades de energia calorífica, sem que ocorra um grande aumento de
temperatura. Para os tecidos vegetais que consistem de grande proporção de água, isto
assegura um alto grau e estabilidade de temperatura.
Fusão e Vaporização da Água
Um certo montante de energia é requerido para causar uma mudança de estado de uma
substância, como do sólido para o líquido ou do líquido para o gasoso, sem que ocorra
mudança de temperatura. O montante de energia requerido para converter uma substância do
estado sólido para o líquido é conhecido como calor de fusão. No caso da água, 335 J são
requeridos para converter 1 grama de gelo para 1 grama de água líquida em 0 oC (Tabela 1.1).
Este alto calor de fusão da água é atribuído à grande quantidade de energia necessária para
sobrepujar as forças intermoleculares associadas às pontes de hidrogênio.
6
Assim como as pontes de hidrogênio aumentam a energia requerida para fundir o gelo,
elas também aumentam a energia requerida para evaporar a água. O calor de vaporização da
água, ou seja, a energia requerida para converter 1 mol de água líquida para um mol de água
na forma de vapor, é cerca de 44 kJ mol-1 em 25 oC. Este alto calor de vaporização da água
significa que as plantas podem perder uma substancial quantidade de calor quando a água
evapora das superfícies foliares. Tal perda de calor é um importante mecanismo para
regulação da temperatura em folhas de plantas terrestres que estão expostas, freqüentemente,
às intensas radiações do sol. O resfriamento das folhas é considerado um importante papel da
transpiração.
Água como Solvente
A água é normalmente conhecida como solvente universal, podendo dissolver um
número de substâncias bem maior do que qualquer outro líquido comum. Isto se deve ao
caráter dipolar de suas moléculas, evidenciado pela elevada constante dielétrica (os valores da
constante dielétrica da água, metanol, etanol e benzeno, em 25 oC, são 78,4 , 33,6 , 24,3 e 2,3,
respectivamente). Esta constante dielétrica mede a capacidade de uma substância para
neutralizar parcialmente a atração entre cargas elétricas. Assim, as camadas de hidratação
(uma ou mais camadas de moléculas de água) que circundam os íons (ou moléculas) em
solução, reduzem a possibilidade de que os íons se re-combinem para formar cristais.
O arranjo dos átomos de O e H das moléculas de água em torno dos íons depende se este
é um cátion ou um ânion. Nas camadas de hidratação de cátions o átomo de O (parcialmente
negativo) é atraído pelo núcleo do cátion. O inverso ocorre com os ânions, os quais atraem
mais os átomos de hidrogênio.
A excelente capacidade de solvente da água é fundamental para a realização das reações
bioquímicas e para o transporte de substâncias dentro da planta.
Incompressibilidade
Para todos os propósitos práticos, líquidos são incompressíveis. Isto significa que as leis
da mecânica se aplicam aos organismos que possuem grandes proporções de água. Na
realidade, a forma normal de uma célula é mantida pela pressão hidrostática positiva exercida
sobre as suas paredes, e criada pela entrada de água no seu protoplasma. O murchamento de
plantas jovens em crescimento torna aparente que as suas células constituem-se em sistemas
hidráulicos. Além disso, o crescimento celular e outros movimentos de células (como a
abertura estomática) estão também associados com essa pressão hidrostática criada pela
entrada de água nas células.
Coesão e Aderência
A forte atração mútua entre moléculas de água resultante das ligações de hidrogênio, é
também conhecida como coesão. Uma conseqüência da coesão é que a água tem uma elevada
tensão superficial, a qual é mais evidente nas interfaces entre a água e o ar. A tensão
superficial surge por que as forças coesivas entre as moléculas de água são muito mais fortes
do que a interação entre a água e o ar. O resultado é que as moléculas de água na superfície
são constantemente “puxadas” para dentro da massa de água. A alta tensão superficial explica
a forma esférica das gotas de água e, também, o fato de que a superfície da água pode suportar
o peso de pequenos insetos. A coesão é diretamente responsável, também, pela capacidade de
colunas de água de resistirem (sem quebrar) a elevadas tensões (pressão negativa). Colunas de
água são capazes de resistir a elevadas tensões, da ordem de –30 MPa.
7
As mesmas forças que atraem as moléculas de água entre si, também atraem as
moléculas de água para superfícies sólidas, um processo conhecido como aderência. A água
possui grande aderência por outras substâncias que têm em sua molécula grande quantidade
de átomos de oxigênio e nitrogênio (vidro, celulose, argila, proteínas, etc.).
As propriedades de coesão e aderência, combinadas, explicam por que a água ascende
em tubos capilares e são excepcionalmente importantes na manutenção da continuidade de
colunas de água nas plantas. Na realidade, o transporte de água da raiz para as folhas de
plantas transpirando ocorre sob tensão, no xilema. Isso somente é possível devido às
propriedades da água (coesão e a aderência) e à estrutura dos vasos condutores (o tecido
xilemático é formado de vasos de dimensões capilares e as paredes dos vasos são rígidas e
capazes de resistir às tensões criadas).
4. IMPORTÂNCIA DA ÁGUA PARA OS VEGETAIS
A vida teve origem na água e todas as formas de vida estão de alguma forma
intimamente ligadas à água. A fitomassa é em sua maior parte composta de água. O
protoplasma contém em média 85 a 90% de água e mesmo as organelas ricas em proteínas e
lipídeos, como os cloroplastos e as mitocôndrias, contêm 50% de água. Os frutos com alto
conteúdo de polpa são especialmente ricos em água (85 a 95% do peso fresco); as folhas
tenras possuem de 80 a 90% e as raízes de 70-95%. A madeira recém-colhida contém
aproximadamente 50% de água. Por outro lado, as sementes colhidas são pobres em água (a
maioria das sementes armazenadas apresenta valores entre 10 e 15%), sendo que algumas
sementes que acumulam óleos contêm de 5 a 7% de água apenas.
É importante destacar que o conteúdo de água, além de variar com os tipos de células e
tecidos, também é bastante influenciado pelas condições ambientais e pela fisiologia da
planta. Assim, o conteúdo de água de plantas depende do nível de atividades metabólicas, do
estado hídrico do ar e do solo, e de um conjunto de outros fatores. De modo geral, os tecidos
em crescimento ou com alta atividade metabólica não suportam graus elevados de
desidratação, tornando evidente que a água executa funções vitais no vegetal e, sem ela, a
vida como conhecemos poderia não existir. Podemos destacar as seguintes funções da água
nos vegetais:
• Age como solvente para nutrientes minerais e substâncias orgânicas;
• Contribui fundamentalmente para a absorção e transporte de minerais das raízes para as
folhas, via xilema, e para a translocação de substâncias orgânicas e de minerais, via floema;
• Forma o ambiente adequado onde a maioria das reações bioquímicas ocorre, participando
em muitas delas como reagente (hidrólises). É também a fonte de elétrons na fotossíntese;
• Influencia a estrutura e, conseqüentemente, a função de macromoléculas (proteínas, ácidos
nucléicos, polissacarídeos, etc.) e de membranas.
• É responsável pela manutenção da turgescência e, portanto, contribui para o crescimento e
para a manutenção da forma e estrutura dos tecidos tenros;
• Contribui para que as plantas não sofram tanto com as flutuações de temperatura do
ambiente.
De todos os recursos que a planta necessita para o crescimento e função, a água é o mais
abundante, executando as funções vitais descritas acima. Deste modo, a sua falta ou
deficiência limitam a produtividade vegetal, tanto em ecossistemas naturais como em cultivos.
Isso é marcante no semi-árido brasileiro, o que torna a prática da irrigação tão importante para
a nossa agricultura. Neste caso, torna-se de fundamental importância estimar as necessidades
8
hídricas das culturas nos seus diferentes estádios de desenvolvimento, buscando-se obter
elevadas produtividades com o uso racional dos recursos hídricos. Para isso, faz-se necessário
o conhecimento de solo, do clima e da planta (o gargalo do sistema solo-planta-atmosfera).
De modo geral, as funções da água nas plantas estão muito associadas às suas propriedades,
conforme demonstrado na tabela abaixo:
Tabela 1.2. Relação entre as propriedades e funções da água nos vegetais
Propriedades
• Alto calor específico
• Alto calor de vaporização
• Alta condutividade térmica
• Alta constante dielétrica (Solvente)
•
Alta coesão das moléculas de água
•
Coesão, aderência e alta tensão
superficial
Incompressibilidade
•
Funções
Estabilidade térmica
Ambiente adequado para a ocorrência
das reações bioquímicas
Transporte de substâncias na planta
Influencia a estrutura e funções das
macro-moléculas e membranas
Transporte no xilema
Manutenção da turgescência e da
forma dos tecidos e órgãos;
Crescimento
Movimentos reversíveis
9
UNIDADE 2 – DEFINIÇÕES RELATIVAS À QUANTIFICAÇÃO DE ÁGUA NO
SISTEMA SOLO-PANTA-ATMOSFERA
1. FORMAS DE QUANTIFICAÇÃO DE ÁGUA
A quantificação de água no sistema solo-planta-atmosfera é um tema bastante amplo. A
água pode ser medida em termos de conteúdo, teor, energia e de fluxos. Esse conjunto de
mensurações permite, dentre outras coisas: calcular o balanço hídrico e o volume de água
armazenada no solo, mensurar o movimento de água no sistema e quantificar o estado hídrico
do solo, das plantas e da atmosfera.
Para quantificarmos a água utilizada pelas plantas torna-se necessário o monitoramento
do sistema que pode ser feito no solo, na planta e na atmosfera. O monitoramento da água no
solo é feito utilizando-se sensores de umidade do solo, sendo que os mais utilizados são os
tensiômetros e sensores eletrométricos. O monitoramento do estado hídrico da planta pode ser
feito pela medição da tensão da água no xilema, medição da taxa de fluxo de seiva,
dendrometria, medição das taxa de transpiração e de condutância estomática, observações
visuais, dentre outros. O monitoramento via clima é feito mediante o uso de observações
meteorológicas, as quais são utilizadas na estimativa do consumo de água pelas plantas, a
chamada evapotranspiração da cultura (ETc). Para o cálculo da Etc, são necessárias as
estimativas da evapotranspiração de referência (ETo) e do coeficiente de cultura (Kc). A ETo
pode ser estimada por equações, como a de Penman-Monteith, ou a partir de dados de
evaporação do tanque classe A. As estimativas de ETo requerem medição de diversas
variáveis (velocidade dos ventos, umidade do ar, temperatura do ar e radiação).
2. ENERGIA TOTAL DA ÁGUA NO SISTEMA
2.1 Definição do potencial hídrico
A água no sistema solo-planta atmosfera busca constantemente o equilíbrio
termodinâmico obedecendo a tendência universal de se mover de locais onde apresenta maior
energia para aqueles onde o nível energético é mais baixo. Essa energia associada é de
natureza cinética e potencial, sendo que a contribuição do componente cinético é
normalmente insignificante devido à baixa velocidade do movimento da água. Entretanto, a
água neste sistema possui energia potencial desde que se desloca em resposta a certas forças
inerentes aos componentes do sistema. Isso confere à energia potencial um caráter dinâmico,
mudando em um local com o passar do tempo.
A água se move de locais de maior energia para locais de menor energia, tornando-se
necessário quantificarmos essa diferença de energia entre dois locais distintos no sistema
solo-planta-atmosfera. Essa energia associada com a água é, principalmente, de natureza
potencial, sendo esse estado de energia descrito pela função termodinâmica Energia Livres de
Gibbs (G), que recebe o nome de energia total da água.
De acordo com as leis da termodinâmica, a energia livre representa o potencial para
realizar trabalho. Essa energia livre depende da concentração de moléculas e da energia livre
média por molécula, de modo que um grande volume de água possui mais energia livre do
que um pequeno volume de água, sob condições idênticas. Portanto, como trabalhamos no
sistema solo-planta-atmosfera, cada componente com volume diferente, torna-se mais
10
conveniente medirmos a energia livre de uma substância (no caso, a água) em relação a uma
quantidade unitária da substância. A quantidade de energia livre por mol é conhecida como
Energia Livre Molal Parcial de Gibbs (G) e pode ser também referida como potencial químico
(µ). Esse potencial químico, como a concentração e a temperatura, é independente da
quantidade da substância sob consideração.
O valor absoluto de potencial químico ou da energia livre associada com a água está
entre aquelas quantidades que não são convenientemente mensuráveis. Torna-se mais
interessante a medida da diferença de potencial químico (∆µw) ou de energia livre (∆Gw), pois
ela nos dará a direção do transporte de água. Para obtermos a diferença usamos como
referencial o potencial químico da água pura (µow) na condição normal de pressão
atmosférica. Assim, temos a equação:
∆Gw = ∆µw = µw - µow
em que: ∆µw = diferença de potencial químico ou diferença em energia livre molal
parcial de Gibbs (∆Gw), dado em ergs mol-1; µw = potencial químico de água na solução;
µow = potencial químico da água pura.
Como observamos acima, o potencial químico da água é expresso em unidade de
energia por uma quantidade unitária da água (ergs mol-1). Na década de 1960, Slatyer (na
Austrália) e Taylor (nos EUA) propuseram que o potencial químico da água poderia ser usado
como base para importantes propriedades da água no sistema solo-planta-atmosfera. Eles
propuseram a divisão do termo ∆µw pelo volume molal parcial da água (Vw), transformando a
unidade para pressão, a qual é mais facilmente mensurável:
∆µw = µw - µow = ergs x mol-1 = ergs = dina x cm = dina x cm-2
Vw
cm3 x mol-1
cm3
cm3
106 dina x cm-2 = 1 bar = 0,987 atm (atmosfera) = 0,1 MPa (megapascal)
Taylor e Slatyer introduziram o termo potencial hídrico (representado pela letra grega Ψ
= psi), definido como:
Ψw = µw - µow
Vw
“O potencial hídrico é o potencial químico da água em um sistema, expresso em
unidades de pressão e comparado ao potencial químico da água pura em pressão atmosférica e
mesma temperatura e altura, com o potencial químico de referência sendo estabelecido como
zero.”
11
Na maioria dos sistemas biológicos, o fluxo de água é governado pelo Ψw, com a água
se movendo de regiões de maior para regiões de menor potencial hídrico. Exceções
importantes são: o fluxo da seiva no floema e a perda de água por gutação, os quais são
governados pela pressão.
2.2 As Forças que Compõem o ΨW
O Ψw é uma expressão quantitativa da energia livre associada com a água. Essa energia
livre da água pode ser influenciada por quatro principais fatores: concentração de solutos,
pressão, forças de superfície e gravidade, as quais definem os componentes do potencial
hídrico (Ψw ):
Ψ w = Ψs + Ψp + Ψm + Ψg
Os termos Ψs, Ψp, Ψm e Ψg denotam os efeitos de solutos, pressão, forças de superfície
e gravidade, respectivamente, sobre a energia livre da água. A contribuição de cada uma
dessas forças dependerá da parte do sistema analisada. O estado de referência ou potencial
hídrico padrão foi estabelecido como zero. Assim, os fatores acima podem aumentar ou
diminuir o potencial hídrico, ou seja, a energia livre capaz de realizar trabalho. Em geral, o
Ψw é negativo, indicando que as forças que reduzem a energia livre da água prevalecem sobre
as que aumentam. Isso parece ser fundamental para o transporte de água no sistema soloplanta-atmosfera.
Solutos – O termo Ψs, conhecido como potencial de soluto ou potencial osmótico,
representa os efeitos dos solutos dissolvidos sobre o potencial hídrico. As moléculas dipolares
da água são atraídas e retidas pelos solutos (cátions e ânions), induzindo um decréscimo na
atividade da água. Assim, o potencial osmótico tem quase sempre valor negativo. Ele é zero
quando a água é pura.
No protoplasma de células de plantas bem irrigadas, o Ψs pode ser alto (- 0,5 MPa),
embora valores de – 0,8 a –1,2 sejam mais típicos. Em plantas crescendo em condições de
estresse hídrico, plantas que acumulam compostos orgânicos solúveis (sacarose na cana de
açúcar, por exemplo) e em halófitas crescendo em ambientes salinos, o valor de Ψs é bem
menor. Em atriplex, planta adaptada a ambientes salinos, o potencial osmótico pode atingir
valores de até – 2,5 MPa.
Embora o Ψs dentro da célula seja bem negativo, no apoplasto (paredes celulares e
espaços intercelulares) a concentração de solutos é bem menor, assim, o Ψs é bem maior,
sendo comum valores em torno de - 0,1. É importante destacar, que os valores mais negativos
do potencial hídrico nas paredes celulares, espaços intercelulares e no xilema devem-se à
pressão negativa formada em conseqüência da transpiração e não devido ao acúmulo de
solutos.
O valor do potencial osmótico dos solos é geralmente muito baixo, visto que a solução
do solo é geralmente bem diluída. No entanto, em solos salinos esse valor pode ser da ordem
de -0,2 MPa ou menores, o que já representa uma redução considerável no potencial da água
no solo.
Pressão – O termo Ψp corresponde ao potencial de pressão. Quando a pressão for
positiva há aumento do Ψw, quando negativa (tensão) há diminuição do Ψw . Quando nos
referimos à pressão positiva dentro da célula, Ψp é usualmente denominado de potencial de
12
turgescência. A pressão positiva em solos inundados (com lâmina de água acima do solo) é
comumente referida como pressão hidrostática. O Ψp pode ser positivo, como ocorre nas
células túrgidas, sendo que dentro de células de plantas bem irrigadas os valores variam de 0,1
a 1,0 MPa, dependendo do valor do potencial osmótico dentro da célula. O valor de Ψp pode
ser igual a zero, como nas células em estado de plasmólise incipiente (ponto a partir do qual a
plasmólise pode iniciar).
Um potencial de turgescência positivo é importante por duas principais razões:
• Para o crescimento celular
TC = m (P – Y)
TC = taxa de crescimento; m = módulo de elasticidade da parede celular; P ou Ψp representa
o potencial de turgescência e Y representa a pressão limite.
Para que ocorra crescimento a diferença P – Y tem que ser positiva.
• Para manter a rigidez das células e a forma dos tecidos não lignificados. Por exemplo, as
folhas podem murchar se a pressão de turgescência ficar abaixo de zero.
Enquanto a solução dentro da célula pode ter um valor positivo de pressão, fora dela
pode ter valor negativo. Por exemplo, no xilema de plantas transpirando, desenvolve-se uma
pressão negativa que pode atingir valores de –1,0 MPa ou menor. A magnitude dessa pressão
negativa nas paredes celulares e no xilema varia consideravelmente, dependendo da taxa de
transpiração e da altura da planta. Durante o meio dia, quando a transpiração é máxima, a
pressão negativa no xilema alcança o menor valor (mais negativo). Durante a noite, quando a
transpiração é baixa e a planta se re-hidrata, o valor tende a ser relativamente maior. Essa
pressão negativa no xilema é de fundamental importância para o transporte de água das raízes
até a parte aérea. Ela também garante o equilíbrio dinâmico, em termos de Ψw, entre o interior
e o exterior das células das folhas.
É importante destacar que os valores de Ψp, positivo dentro da célula e negativo no
apoplasto, são desvios para cima ou para baixo, em relação à pressão atmosférica reinante. A
exposição de protoplastos e do xilema ao ar exterior significará que o valor de Ψp atingirá o
equilíbrio com a pressão atmosférica externa (cerca de 1,0 atm ou 0,1 MPa) e seu valor será
zero.
Mátrico – O potencial mátrico (Ψm) é o componente do potencial hídrico que define as
influências que as forças superficiais e espaços intermicelares exercem sobre o potencial
químico da água O potencial mátrico é devido primariamente à pressão negativa local,
causada pela capilaridade, e pela interação da água com as superfícies sólidas (partículas do
solo, macromoléculas coloidais, etc.). O Ψm é, em geral negativo, podendo ser zero em
sistemas isentos de partículas coloidais. Seu valor é desprezível em células diferenciadas que
apresentam grandes vacúolos. O Ψm é importante na caracterização do processo de embebição
de sementes e nas relações hídricas de solos. A tensão negativa formada nas paredes celulares
das células das folhas é também referida como potencial mátrico.
Gravidade – O Ψg representa o potencial gravitacional e expressa a ação do campo
gravitacional sobre a energia livre da água. Ele é definido como o trabalho necessário para
manter a água suspensa em determinado ponto em relação à atração da gravidade. O efeito da
gravidade sobre o Ψw depende da densidade da água (∂w), da aceleração da gravidade (g) e da
altura (h) em relação a um ponto de referência. Pode ser calculado pela equação:
Ψg = ∂w . g . h
13
Normalmente, a superfície do solo é tomada como referência, h = 0 e, portanto, Ψg = 0. O
potencial gravitacional (Ψg) é positivo acima e negativo abaixo da superfície do solo (ponto
de referência).
Baseado na equação acima é possível estimar um Ψg = 0,01 MPA para cada metro
acima do solo. Desta forma, uma distância vertical de 10 m introduz um Ψg de 0,1 MPa na
equação do Ψw. Portanto, o Ψg deve ser considerado no transporte a longa distância, pelo
menos acima de 10 m (árvores de grande porte). No solo, ele é importante na percolação de
água, notadamente quando o conteúdo de água do solo é alto.
É importante destacar que o potencial hídrico representa a força total que determina a
direção do movimento da água. Isto quer dizer que a direção do movimento de água é
determinada somente pela diferença de Ψw entre dois pontos (células adjacentes, por
exemplo), e não pela diferença de um dos seus componentes isolado.
14
UNIDADE 3 – ATRIBUTOS FÍSICOS E QUANTIFICAÇÃO DA ÁGUA NO SOLO
1. ATRIBUTOS FÍSICOS DO SOLO
FASES DO SOLO
O solo é um sistema complexo formado de três fases: sólida, líquida e gasosa. O arranjo
das partículas sólidas deixa espaços vazios de diferentes tamanhos, denominados de poros, os
quais têm a capacidade de armazenar líquidos e gases. O solo, portanto, pode ser visto como
um grande reservatório de água para as culturas, sendo necessária a reposição periódica da
água para garantir uma produção vegetal adequada.
A parte sólida é formada pela matéria mineral e matéria orgânica, com predominância da
parte mineral. A porção mineral consiste de partículas de vários tamanhos, resultante da
decomposição das rochas que deram origem ao solo. A fração orgânica tem se origina a partir
do acúmulo de resíduo vegetais e animais, ocorrendo no solo em diferentes estágios de
decomposição. A matéria orgânica é fundamental para a atividade dos microorganismos,
sendo, portanto, importante para a manutenção da vida do solo.
A parte líquida do solo é chamada de solução do solo e consiste essencialmente de água e
materiais solúveis dissolvidos (minerais e moléculas orgânicas). Ela ocupa parte dos poros do
solo, podendo ocupar praticamente todos os espaços vazios em solos saturados. A medida que
o solo vai secando, os poros maiores (macroporos) vão se esvaziando e a água passa a ocupar
apenas os poros menores (microporos), os quais possuem maior poder de retenção de água.
A parte gasosa ocupa os espaços vazios não ocupados pela água, sendo a principal fonte
de oxigênio para a respiração das plantas e dos organismos vivos do solo. O ar do solo possui
evidentemente os mesmos componentes do ar da atmosfera, porém alguns gases são
encontrados em concentrações mais elevadas ou mais baixas no solo, dependendo do nível de
atividades dos organismos do solo (raízes de plantas, microorganismos e outros organismos
vivos do solo) e da sua compactação. Em geral, o ar do solo apresenta maiores concentrações
de CO2 e menores de oxigênio, quando comparado com o ar atmosférico. Essas diferenças
serão menores quanto menos compacto for o solo.
Em geral, se considera que o solo ideal deve ter 50% dos seus espaços preenchidos pela
parte sólida, 30% pela solução do solo e 20% pelo ar do solo. Essas proporções, entretanto,
são bastante vaiáveis, dependendo do tipo de solo e de suas propriedades físicas
(principalmente textura, estrutura e densidade).
TEXTURA DO SOLO
A textura do solo refere-se à distribuição das partículas minerais do solo em termos de
tamanho, sendo uma propriedade indicadora da capacidade de armazenamento de água no
solo. A textura é estudada pela análise granulométrica, a qual permite encontrar a proporção
das seguintes partículas: areia (partículas com diâmetro de 2 a 0,02 mm), silte (partículas com
diâmetro variando de 0,02 a 0,002) e argila (partículas com diâmetro menor que 0,002 mm).
A textura do solo pode diferir entre as diferentes camadas ou horizontes, porém, para cada
horizonte ela normalmente não sofre modificações em uma escala de tempo relativamente
longa.
As proporções das partículas do solo, fornecidas pela análise granulométrica, permite
classificar o solo em termos de textura utilizando-se o triângulo textural (Figura 2.1). Nesse
triângulo são encontradas 13 classes texturais possíveis, podendo se encontrar solos com mais
de 85% de areia (classe textural areia) e solos com mais de 40% de argila (classes texturais
argila e argila pesada). Entre as classes extremas encontramos várias classes intermediárias,
15
sendo que os solos de textura franca (textura média) apresentam proporções mais ou menos
equilibradas das frações areia, silte e argila.
Figura 2.1 – Triângulo para classificação das classes texturais (Kiehl, 1979)
Em geral, quanto maiores forem as partículas do solo maior é a proporção de macroporos.
Isso indica que os solos com textura arenosa têm menor capacidade de retenção e
armazenamento de água e de nutrientes do que os solos de textura argilosa.
ESTRUTURA DO SOLO
A estrutura do solo refere-se ao arranjo das partículas e à adesão de partículas menores na
formação de partículas maiores denominadas agregados. Essa estruturação é mais comum em
solos que contêm partículas menores como a argila, sendo os solos arenosos considerados
como solos de estrutura de grãos simples. Trata-se de um conceito bastante qualitativo,
podendo se considerar um solo bem estruturado ou mal estruturado. Em geral, solos bem
estruturados apresentam muitos agregados, de forma angular, que se esboroa com relativa
16
facilidade quando úmida. Esta boa estrutura melhora a permeabilidade do solo à água e
garante melhores condições de aeração e penetração de raízes. Solos mal estruturados
apresentam problemas para serem trabalhados e dificultam a penetração de raízes e de água.
Nas áreas cultivadas, a estrutura do solo é bastante afetada pelo manejo do solo,
principalmente a camada superficial. Essa estrutura, portanto, pode ser modificada para
melhor ou para pior, dependendo das práticas agrícolas utilizadas. Práticas agrícolas como
rotação de cultura, incorporação de resíduos orgânicos, preparo de solo quando a umidade é
adequada (aração e gradagem em solos muitos secos ou muito úmidos), dentre outras,
prejudicam a estrutura do solo. A destruição da estrutura pode também ocorrer em solos
agrícolas irrigados com água ricas em sódio. Esse elemento tende a dispersar a argila,
destruindo os agregados e impermeabilizando o solo.
DENSIDADE DO SOLO E POROSIDADE
A densidade global de um solo (ds) é definida pela relação entre a massa de uma amostra
de solo seca a 110 ºC e o volume ocupado pelas partículas e poros do solo. Ela deve ser
preferencialmente medida a partir de amostras retiradas sem destruir sua estrutura, mas nas
análises de rotina ela é medida com terra fina seca ao ar (solo desestruturado). A densidade é
considerada um bom indicador do grau de compactação do solo.
A densidade do solo varia de 1,1 a 1,6 g cm-3, dependendo da textura, da estrutura e dos
teores de matéria orgânica do solo. Solos com elevados teores de matéria orgânica têm
menores valores de densidade e solos argilosos apresentam menores valores de densidade do
que os solos arenosos. Solos com densidade acima de 1,7 g cm-3 já dificultam a penetração de
raízes.
A densidade do solo difere da densidade das partículas do solo. A densidade das partículas
refere-se à relação entre a massa de uma amostra de solo seca e o volume das partículas, sem
considerar os poros do solo. Em geral, se considera o valor de 2,65 g cm-3 para fins de
cálculo, admitindo que os minerais predominantes são o quartzo, os feldspatos e os silicatos
alumínio. Esse valor, no entanto, pode apresentar variações em virtude de predominância de
determinados minerais no solo (por exemplo, 10% de hamatita pode elevar a densidade das
partículas para 2,77) e dependendo do teor de matéria orgânica no solo.
A porosidade total de um solo é definida pela relação entre o volume ocupado pelos poros
e o volume total do solo. Como é difícil medir o volume de poros, na prática utiliza-se a
seguinte relação:
α = [1- ds/2,65] x 100
De acordo com a expressão acima, quanto maior for a densidade do solo, menor será a
porosidade total do solo. Essa porosidade total é dividida em macroporosidade e
micriporosidade. A macroporidade é considerada como porosidade de aeração, ou seja, ela
corresponde aos poros vazios após o solo ter sido saturado e o excesso de água ter percolado
pela ação da força gravitacional (esse solo, como veremos adiante, se encontra na capacidade
de campo). A quantidade de microporos será maior, quanto menores forem as partículas do
solo (em solos bem estruturados), sendo um bom indicador da capacidade de retenção de água
pelo solo.
17
2. QUANTIFCAÇÃO DA ÁGUA NO SOLO
2.1 Teor de Umidade do Solo
Método direto (gravimétrico)
A determinação da umidade do solo é de grande importância no monitoramento hídrico de
áreas agrícolas, bem como em estudos que enfoquem a relação solo-água-planta. Existem
vários métodos diretos e indiretos para essa determinação, os quais apresentam diferentes
vantagens e limitações. Dentre os métodos diretos pode-se ressaltar o método gravimétrico,
por ser bastante usual enormemente utilizado como padrão para calibrações de métodos
indiretos na medição da umidade de um determinado solo.
A umidade à base de peso “u” é a mais facilmente medida, pois ela necessita apenas do
uso de uma balança de precisão e pode se utilizar amostras de solo desestruturadas. O
instrumento mais utilizado nas coletas de material é o trado, o qual permite retirar amostras
em diferentes profundidades.
Uma vez coletada a amostra deve-se ter o cuidado de não permitir perdas de água por
evaporação. É comum o uso de latinhas de alumínio, as quais devem ter tampas justas e
seladas com fita adesiva. Sacos plásticos também podem ser utilizados.
No laboratório toma-se a massa úmida (mu) e, em seguida, coloca-se o material para secar
em estufa a 105 oC, até peso constante. O material então é novamente pesado, obtendo-se a
massa seca (ms). A percentagem de umidade na base de peso é dada pela expressão:
u = 100 x (mu – ms)/ms
Embora a medição da umidade na base de peso seja mais facilitada, a umidade na base de
volume é bem mais utilizada nos cálculos que envolvem água no solo. Porém, quando se
pretende expressar o valor da umidade na base de volume (θ), deve se coletar as amostras em
anéis volumétricos de volumes conhecidos (V). Em seguida, são obtidas as massas úmidas e
secas e calcula-se a percentagem de umidade na base de volume pela expressão:
θ = 100 x (mu – ms)/V
Alternativamente, pode se calcular a umidade na base de volume multiplicando-se a
umidade na base e peso (u) pela densidade do solo (ds):
θ = u x ds
Os valores de umidade do solo são extremamente variáveis, em relação ao tempo. Os
valores extremos são a umidade do solo seco a 105 oC e o solo saturado, no qual todos os
poros são ocupados com água. A umidade do solo seco a 105 oC é considerada como zero,
apesar dessas amostras ainda conterem a água de cristalização.
Com os dados de umidade do solo na base de volume pode-se estimar a quantidade de
água armazenada em determinado volume de solo. Por exemplo: qual seria a quantidade de
água armazenada em um hectare, considerando a profundidade de 20 cm (L) e a umidade
média (θ) de 0,326 cm3 de água/cm3 de solo? Nesse caso temos:
AL = θ x L = 0,326 cm3/cm3 x 20 cm = 6,52 cm ou 65,2 mm
18
Como uma lâmina de 1 mm corresponde a 1 litro/m2, temos 65,2 litros/m2 ou 652.000
litros por hectare:
Métodos indiretos (Sonda de Nêutrons, TDR, etc.)
Muitos tipos de sensores são fabricados e utilizados para medição da umidade do solo, os
quais necessitam de testes para calibração. Para se obter bons resultados com os métodos
indiretos de quantificação da água no solo, tornam-se necessários, além da calibração, que os
sensores sejam convenientemente instalados no solo. Alguns cuidados especiais no manejo de
tais sensores são listados abaixo:
- O local de instalação dos sensores deve ser representativo do desenvolvimento da lavoura e
do tipo de solo da área cultivada.
- Instalar cuidadosamente os sensores para permitir um perfeito contato do instrumento com o
solo,
garantindo
bom
funcionamento
especialmente
em
solos
arenosos.
- Instalar os sensores em várias profundidades para avaliação do perfil de umidade do solo. O
momento da irrigação deve ser avaliado pelos sensores instalados no terço superior e/ou na
metade da profundidade efetiva das raízes (80% das raízes finas). O acompanhamento de
aplicações excessivas ou deficientes de água deve ser feito por sensores próximos ao limite da
profundidade explorada pelas raízes.
- Instalar sempre mais de uma estação de controle em cada área representativa da cultura.
Dois ou três sensores são instalados a 1/3 ou na metade da profundidade efetiva das raízes e
outro no limite inferior.
Dentre os métodos indiretos, a utilização da sonda de nêutrons se destaca por permitir a
aferição da umidade do solo com o mínimo de alteração no perfil, e a qualquer momento, de
forma extremamente rápida e prática. Nesse método, o aparelho (moderador ou sonda de
nêutrons) é constituído de uma fonte radioativa que emite feixes de nêutrons rápidos e de um
contador de neutros lentos. Os primeiros se chocam com núcleos de outros átomos até atingir
a energia de neutros lentos, ou moderados.
A moderação é eficiente quando existem átomos na matéria de massa equivalente às
massas dos nêutrons emitidos. Estudos mostram que o átomo mais eficiente nesse processo é
o H, o que explica a moderação de neutros pela água do solo. Para a realização da leitura, são
inseridos no solo, em locais típicos do terreno e nas profundidades desejadas, tubos de acesso,
onde se introduz a fonte de neutros rápidos e o detector de neutros lentos, conectados ao
registrado. Quanto maior o teor de umidade do solo, maior o “freio” que os átomos de H das
moléculas de água exercem sobre os neutros rápidos emitidos, e maior a contagem de neutros
lentos registrada.
Uma das limitações da utilização do uso da sonda de nêutrons para estes fins diz respeito à
exposição radioativa do operador, ao custo da aparelhagem e à necessidade de se obter curvas
de calibração para cada tipo de solo dentro das profundidades desejadas. Estas curvas de
calibração relacionam a contagem relativa da sonda com a umidade volumétrica do solo, o
que, por exemplo, permite ao usuário a determinação da necessidade ou não de irrigar uma
determinada área de forma rápida e precisa. Na determinação dessas curvas o tipo de tubo de
acesso usado para introdução da sonda é um dos fatores que podem alterar a qualidade dos
resultados obtidos, pois o tipo de material constituinte do tubo pode influenciar a contagem de
nêutrons da sonda, como é o caso de materiais com alto teor de hidrogênio (PVC). O material
recomendado para a confecção dos tubos de acesso é o alumínio por ser totalmente
“transparente” aos nêutrons, no entanto, tem sido relatado que este material sofre problemas
de corrosão em solos ácidos, predominante em regiões tropicais. Além da dificuldade na
19
aquisição de tubos de acesso em alumínio em áreas rurais, questões de ordem econômica
podem inviabilizar o monitoramento de áreas muito amplas.
As sondas de TDR (Time Domain Reflectometry) vem sendo largamente utilizadas para
determinação da umidade do solo, devido a facilidade de operação e instalação das sondas no
solo. A técnica baseia-se na medida do tempo de viagem de um sinal eletromagnético através
de um meio. O TDR mede a constante dielétrica do solo (å), na faixa de freqüência de 10
MHz a 1 GHz. Esta variável no solo é principalmente dependente da umidade do solo(è), o
que proporciona que sejam correlacionadas.
2.2 Medição do Potencial Hídrico do Solo
A direção do movimento de água no sistema SPA é definida, primordialmente, pelo
gradiente de potencial hídrico. No solo, como nos outros componentes do sistema, o Ψw pode
ser expresso em quatro componentes:
Ψ w = Ψs + Ψp + Ψm + Ψg
Para fins de simplificação, vamos considerar que o solo tem baixa condutividade
elétrica (não salino) e o conteúdo de água será mantido abaixo da saturação. Nestas
condições, nós podemos desprezar o Ψp (não existe uma lâmina de água capaz de criar uma
pressão hidrostática positiva), o Ψs (a concentração sais na solução do solo é baixa) e o Ψg
(consideraremos um fluxo horizontal, não havendo diferença de altura). Neste caso, teremos:
Ψw = Ψm (com sinal negativo)
Como já destacamos, o potencial mátrico é conseqüência dos efeitos de capilaridade e
da interação da água com as superfícies sólidas do solo (principalmente a argila). Veja a
explicação que se segue: A água, como sabemos, possui uma alta tensão superficial que tende
a minimizar as interfaces ar–água. Quando o solo torna-se seco, a água é primeiramente
removida dos espaços mais largos entre partículas e, em seguida, recede dentro dos
interstícios entre partículas do solo e a superfície ar – água fica na forma de menisco. A
pressão negativa se desenvolve e pode ser expressa como:
Ψm = - 2T/r , em que T é a tensão superficial da água (7,28 x 10-8 MPa) e r é o raio de
curvatura do menisco.
Em solos secos, o valor de Ψm na água do solo torna-se completamente negativo por
que o raio de curvatura na superfície ar–água torna-se muito pequeno.
Na prática, o Ψw dos solos normais é geralmente medido como sendo aproximadamente
igual ao Ψm. Em geral, para a determinação do potencial hídrico no solo, mede-se o potencial
mátrico do solo e considera-o igual ao Ψw, desprezando-se a contribuição do componente
osmótico (em geral, a solução do solo é muito diluída). A determinação do Ψm pode ser feita
em laboratório (utilizando-se o Extrator de Richards) ou no campo (utilizando-se
Tensiômetros, que permitem obter boas leituras até tensões de cerca de -0,08 MPa).
20
Os tensiômetros mais simples consistem de um tubo munido na parte inferior de um
bulbo de porcelana porosa, e conectado na parte superior (através de uma mangueira) a uma
cuba contendo mercúrio (Figura 2.2).
O tubo é enterrado de modo que o bulbo fica na profundidade desejada. O aparelho é
cheio com água e fechado hermeticamente. Estando o solo saturado, haverá um equilíbrio
entre a água do solo e a do tensiômetro, com o Ψm sendo igual a zero. A medida que o solo
retira água do tensiômetro, via bulbo, a altura da coluna de Hg (devido sua maior densidade)
aumenta e essa variação deve ser registrada. Neste caso, pode-se calcular o Ψm pela seguinte
equação:
Ψm = -12,6h + h1 + h2 cm. H2O
Em que: h (altura da coluna de mercúrio); h1 (altura da cuba); h2 (profundidade)
21
Figura 2.3 – Modelo de tensiômetro
2.3 Água Disponível
Quando um solo tem todos os seus poros cheios de água o excesso de água é então
drenado e, quando a água do solo entra em equilíbrio, diz-se que o solo atingiu a capacidade
de campo (CC). Esse equilíbrio é atingido por que o potencial gravitacional (que força a
descida da água) se iguala ao potencial mátrico (que representa a força de retenção de água
pelo solo). A capacidade de campo representa, então, o conteúdo de água do solo após ele ter
sido saturado com água e o excesso ter drenado pela ação da gravidade. Ela é maior em solos
argilosos e em solos que possuem alto conteúdo de húmus e muito menor nos solos arenosos.
22
A capacidade de campo representa o conteúdo ideal de água no solo, onde se espera que
os microporos estejam cheios de água e os poros maiores cheios de ar. À medida que o solo
vai secando, a água disponível decresce até atingir o limite inferior de umidade, no qual a
reserva de água se esgotou. Esse ponto é conhecido como Ponto de Murcha Permanente
(PMP).
Os métodos mais usuais de medida da CC e do PMP utilizam amostras deformadas e as
determinações são obtidas em laboratório, embora possam ser utilizados métodos de campo.
Métodos de campo (direto) – Esse método permite obter a quantidade de água armazenada
no solo, tanto na capacidade de campo como no ponto de murcha permanente.
Para a determinação da capacidade de campo deve-se inundar uma área de 4 a 25 m2.
Em seguida, a área deve ser coberta com lona plástica ou palhas para prevenir a perda de água
por evaporação. Espera-se a condição de equilíbrio (Ψm = Ψg), que, na prática ocorre depois
de 2 a 3 dias em solos arenosos e de 4 a 7 dias em solos argilosos. Retiram-se, então, a
cobertura plástica e as amostras em diferentes profundidades na camada de interesse (L), para
obtenção da umidade média (θCC). Com os dados, calcula-se a Lâmina de água armazenada na
capacidade de campo na camada de solo avaliada (ALCC):
AL(CC) = θCC x L (o resultado deve ser expresso em milímetros)
Exemplo: Uma área de 3 m x 3 m foi inundada e, após 5 dias, a umidade volumétrica
média medida foi de 0,340 cm3/cm3. Estime a umidade na capacidade de campo,
considerando a profundidade de 40 cm.
A40(CC) = 0,340 cm3/cm3 x 40 cm = 13,6 cm ou 136 mm.
Isso significa que a camada de 0 a 40 cm pode reter até 136 mm. Quando a umidade na
camada ultrapassar esse valor, o excedente vai ser drenado para as camadas inferiores do solo.
Para a medição direta do ponto de murcha permanente, devem-se colocar sementes de
girassol em pequenos vasos contendo cerca de 200 g de solo. Após a germinação, duas
plântulas devem ser mantidas e quando elas possuírem de 4 a 6 folhas deve-se suspender o
suprimento de água até que elas entrem em murcha. Em seguidas, as plantas são levadas para
um ambiente com umidade relativa próxima de 100% para verificar a capacidade de
recuperação das plantas. Esse procedimento deve ser repetido até que as plantas não mais se
recuperem. Quando as plantas permanecerem murchas, diz-se que o solo atingiu o ponto de
murcha permanente. Amostras são então coletadas para obtenção da umidade na base de peso
(u) e de volume (θ = u x ds). A quantidade de água armazenada no PMP (ALPMP) é
calculada multiplicando-se a umidade média no PMP (θPMP) pela profundidade da camada
(L):
AL(PMP) = θPMP x L (o resultado deve ser expresso em milímetros)
Exemplo: Supondo-se que utilizando amostras da camada de solo de 0-40 cm do exemplo
anterior, obteve um valor de uPMP = 0,150 g/g e a densidade do solo igual a 1,50 g/cm3.
(θPMP) = 0,150 g/g x 1,50 g/cm3 = 0,225 cm3/cm3
A40(PMP) = 0,225 cm3/cm3 x 40 = 9,0 cm ou 90 mm.
A partir dos valores de água armazenada na capacidade de campo e no ponto de murcha,
pode-se calcular a água disponível:
23
AD = AL(CC) - AL(PMP)
No exemplo acima teremos:
AD = 136 – 90 = 46 mm
Ou seja, do total de água disponível na capacidade de campo (136 mm), cerca de 90 mm não
podem ser utilizadas pelas plantas, na camada de solo considerada.
Métodos de Laboratório (indiretos) – Esses métodos são utilizados em laboratórios de
rotina de análise de solo, e permitem obter relações entre a tensão de água no solo (Ψm) e o
teor de umidade (θ). Nesses métodos, sistemas de ar comprimido e manômetros são acoplados
aos aparelhos para produzir e registrar, respectivamente, as pressões necessárias às medições.
Para determinação da capacidade de campo, aplica-se uma pressão de 1/3 de atmosfera á
amostra de solo previamente saturada. O aparelho utilizado para tal fim é conhecido como
“panela de pressão”, que consta de um recipiente de alumínio, contendo no seu interior discos
de cerâmica porosa, onde são colocadas amostras de terra saturadas com água. Fechada a
panela hermeticamente, aplica-se a pressão de 0,33 atm que removerá a água da amostra. A
água atravessa a placa de cerâmica e é drenada para o exterior do aparelho. Quando se
observa o equilíbrio, ou seja, não ocorre mais saída de água, as amostras são retiradas para
medição da umidade na base de peso (u) e de volume (θ = u x ds).
O método indireto para determinação do PMP consiste no emprego da placa ou membrana
de Richards. O aparelho consiste de uma câmara metálica, resistente a elevadas pressões,
ligada à atmosfera externa por uma membrana semi-permeável. A montagem do aparelho se
faz colocando no fundo da placa uma tela metálica para facilitar a drenagem da água. Sobre
essa tela coloca-se a membrana semi-permeável e, sobre essa última, são colocados anéis de
borracha para receber as amostras de solo, que devem ser saturadas. Em seguida, a placa é
fechada e a pressão aplicada (na prática se considera o valor de 15 atm ou 1,5 MPa para o
PMP) forçará a passagem da água pela membrana e posterior saída para o meio externo
através de um dreno. A remoção da água ocorrerá até o ponto de equilíbrio entre a pressão
aplicada e a tensão com que a água está retida no solo, ou seja, o potencial mátrico do solo.
Em seguida, as amostras são retiradas para medição da umidade na base de peso (u) e de
volume (θ = u x ds).
A partir da metodologia de laboratório descrita acima, pode-se construir uma curva
relacionando o potencial mátrico (tensão de água no solo) com os respectivos valores de
umidade. Para isso, é necessário utilizar pressões variando de próximo de zero até 15 atm.
Essa curva é denominada de ‘curva característica de retenção de água do solo’.
2.4 Fluxos de Água no Solo
As plantas podem absorver água por toda sua superfície, mas a maior parte do
suprimento hídrico da planta provém do solo. As plantas inferiores não possuem raízes e,
portanto, dependem da absorção de água realizada diretamente pela parte aérea. Nas plantas
superiores, no entanto, a absorção de água é feita pelas raízes, órgão especializado nessa
função. Portanto, torna-se preponderante entender como a água se movimenta no solo e como
ela chega até a superfície radicular para ser absorvida.
24
A direção do movimento de água no sistema SPA é definida, primordialmente, pelo
gradiente de potencial hídrico. No entanto, para a maioria dos solos pode-se simplificar a
equação do potencial hídrico, considerando-o igual ao potencial mátrico:
Ψw = Ψm (com sinal negativo)
Para medirmos o gradiente de Ψw entre dois pontos, podemos utilizar dois tensiômetros
nos pontos e nas profundidades desejadas. Vamos considerar no nosso sistema a possibilidade
de ocorrência de fluxo horizontal de água. Para isso, vamos instalar dois tensiômetros, um na
vizinhança do sistema radicular de uma planta de feijão (ponto A) e outro distante 20 cm
(ponto B), em um local sem nenhuma raiz. A altura da cuba é de 10 cm para os dois
tensiômetros, sendo os mesmos colocados a 30 cm de profundidade. A leitura do tensiômetro
no ponto A foi de 30 cm e no ponto B de 20 cm. Aplicando-se a equação vista anteriormente
para o tensiômetro, temos:
ΨmA = - 338 cm. H2O
ΨmB = - 212 cm. H2O
Logo o gradiente de potencial hídrico será:
∆Ψm = ∆Ψw = - 338 – (-212)/20 = -6,3 cm. H2O
O Ψw é maior em B do que em A, indica que a direção do fluxo de água é de B para A.
Esse movimento de água no solo ocorre predominantemente por fluxo em massa, ou seja, por
diferença de pressão aqui representada por diferença no potencial mátrico (tensão ou pressão
negativa). Quando a planta absorve água do solo, ocorre uma redução no Ψm próximo a
superfície da raiz, ficando estabelecido um gradiente de potencial hídrico favorável ao
movimento de água das regiões vizinhas em direção à superfície radicular. Como os poros
estão cheios de água e são interconectados, a água move-se para a superfície da raiz por fluxo
em massa, através dos canais, a favor do gradiente de pressão.
Deve-se ter em mente, no entanto, que o fluxo de água no solo não depende apenas do
∆Ψm, mas também da condutividade hidráulica do solo (K). A condutividade hidráulica, por
sua vez, depende da textura (é maior em solos arenosos) e da estrutura do solo e é fortemente
influenciada pelo teor de umidade do solo. Ela é máxima quando o solo está saturado, porém
decresce drasticamente quando o conteúdo de água do solo diminui devido, principalmente, à
substituição da água pelo ar nos poros do solo.
Os dois componentes, ∆Ψm e condutividade hidráulica são resumidos na equação de
Darcy-Buckinhan. Considerando o fluxo em apenas uma direção temos:
q = - K(θ) . ∆Ψw/∆X
Em que: q = densidade de fluxo de água (m.s-1)
K(θ) = condutividade hidráulica na umidade do solo θ (m.s-1)
∆Ψw/∆X (gradiente de potencial hídrico, em m.m-1)
A taxa de fluxo de água no solo depende do tamanho do gradiente de Ψm estabelecido
e, também, da condutividade hidráulica do solo (mede a facilidade com que a água se move
no solo). Em solos saturados ou próximos da capacidade de campo (conteúdo de água do
solo após ele ter sido saturado com água e o excesso ter drenado pela ação da gravidade) as
25
resistências ao fluxo são pequenas. Quando o conteúdo de água decresce a condutividade
hidráulica decresce drasticamente, em decorrência da substituição da água pelo ar nos poros
do solo. Em solos muito secos, o Ψw pode cair até o conhecido valor do ponto de murcha
permanente, que representa o conteúdo mínimo de água disponível para as plantas. Neste
ponto, o Ψw do solo é tão baixo que a planta não pode manter a turgescência, mesmo que
toda a transpiração seja parada. A planta permanece murcha mesmo à noite, quando a
transpiração cessa quase inteiramente. Isso significa que o Ψw do solo é menor ou igual ao Ψs
da folha (neste caso Ψp = 0 e Ψw = Ψs ). Nos laboratórios que analisam a água no solo é
comum o uso do valor de – 1,5 MPa para o potencial hídrico do solo (ou mátrico),
correspondente ao ponto de murcha permanente. Evidente que não se deve esperar que o solo
atinja tensões de tal magnitude para aplicar água às plantas, principalmente se levarmos em
consideração que o fluxo de água no solo é muito dependente da condutividade hidráulica e
que a maioria das culturas são sensíveis à deficiência de água no solo.
Devemos relembrar também que a ocorrência de fluxos verticais depende muito das
magnitudes dos valores dos potenciais mátrico e gravitacional. Em solos saturados o potencial
mátrico é aproximadamente igual a zero, o que favorece o fluxo descendente (percolação)
forçada pela gravidade. Quando o solo atinge a capacidade de campo, os dois valores de
potenciais se equivalem, podendo-se dizer que toda a água está sendo retida pelo solo.
Quando as camadas superficiais do solo perdem mais água, o valor das forças matriciais
supera a da gravidade, podendo ocorrer fluxo ascendente (ascensão capilar). Isso ocorre
principalmente nos solos de várzeas, sendo a altura capilar bastante influenciada pela textura
do solo (é normalmente maior em solos argilosos).
26
UNIDADE 4 – CARACTERÍSTICAS ESTRUTURAIS E QUANTIFICAÇÃO DA
ÁGUA NA PLANTA
1. ORGANIZAÇÃO ESTRUTURAL DAS PLANTAS
INTRODUÇÃO
A Fisiologia Vegetal estuda os processos e as funções do vegetal, bem como as
respostas das plantas às variações do meio ambiente. Os processos e as funções do vegetal são
organizados ou ocorrem nas estruturas do vegetal, em níveis subcelulares, celulares, de
tecidos ou de órgãos. Torna-se fundamental, portanto, conhecermos a estrutura da planta e de
suas partes, antes de entrarmos na discussão do funcionamento do vegetal.
O termo Estrutura significa “armação, esqueleto, arcabouço”, sendo que a matéria viva
tem uma organização que obedece a seqüência abaixo:
Átomos
⇓
Moléculas
⇓
Macromoléculas
⇓
Células
⇓
⇓
Tecidos ⇒
(C, H, O e N)
(aminoácidos, glicose, ácidos graxos, etc.)
(proteínas, celulose, lipídios, etc.)
(membranas, paredes, organelas, etc.)
Órgãos ⇒ Organismo
Neste capítulo serão abordados os seguintes itens:
• Estrutura da célula vegetal e as funções desempenhadas pelas diferentes partes da célula,
particularmente aquelas envolvidas diretamente nas relações hídricas das plantas;
• Os tecidos vegetais e suas funções;
• As estruturas básicas e funções de raízes, caules e folhas;
A CÉLULA VEGETAL
Podemos dividir uma célula vegetal da seguinte forma:
Célula Vegetal = Parede Celular + Protoplasto
Parede Celular
Protoplasto ⇒ Membrana Celular + Protoplasma
Protoplasma ⇒ Citoplasma + Núcleo
27
Citoplasma ⇒ Citosol + Organelas
O Citoplasma é a solução dentro da célula, incluindo as organelas, com exceção do Núcleo
Citosol – é a solução dentro da célula, que fica externa às organelas
Organelas – Mitocôndrias, Plastídios, Retículo endoplasmático, complexo de Golgi,
Vacúolos, Peroxissomos (Glioxissomos), Oleossomos
Nesse texto, iremos destacar as três partes da célula vegetal que influenciam diretamente
nas relações hídricas, que são: parede celular, membrana celular e vacúolo.
Parede Celular
As células são caracterizadas não somente pelo seu conteúdo e organização interna,
mas também por uma complexa mistura de materiais extracelulares que, nas plantas é
referida como parede celular (a parede celular diferencia as células vegetais das células
animais). Esta parede é constituída, principalmente, de carboidratos, proteínas e de
algumas substâncias complexas (Tabela 4.1). Estes componentes são sintetizados dentro da
célula e transportados através da membrana plasmática para o local onde eles se
organizam.
A parede celular possui diversas funções:
• Atua como um exoesqueleto celular, possibilitando a formação de uma pressão positiva
dentro da célula (turgescência) e, conseqüentemente, a manutenção da forma da célula;
• Por resistir à pressão de turgescência, ela se torna importante para as relações hídricas da
planta;
• A parede celular permite a junção de células adjacentes;
• Determina a resistência mecânica das estruturas do vegetal, permitindo que muitas plantas
cresçam e se tornem árvores de grandes alturas;
• A resistência mecânica das paredes do xilema também permite que as células resistam às
fortes tensões criadas dentro dos vasos, o que é fundamental para o transporte de água e
minerais do solo até as folhas;
• Em sementes, os polissacarídeos da parede das células do endosperma ou dos cotilédones
funcionam como reservas metabólicas. Na grande maioria das paredes celulares, isso não
ocorre;
• Alguns oligossacarídeos presentes na parede celular podem atuar como moléculas de
sinalização, durante a diferenciação celular e durante o reconhecimento de patógenos e
simbiontes.
• Embora a parede celular seja permeável para pequenas moléculas, ela atua como uma
barreira à difusão de macromoléculas, sendo a principal barreira à invasão de patógenos.
Estruturalmente, podemos dividir a parede celular, de fora para dentro, em: Lamela
Média, Parede Primária e Parede Secundária.
A Lamela Média é uma fina camada de material, considerada o cimento que promove a
junção de paredes primárias de células adjacentes. É constituída de substâncias pécticas (ácido
péctico, pectato de cálcio e de magnésio) e de proteínas (não são as mesmas encontradas no
restante da parede celular). A lamela média é a primeira camada que se forma na parede
celular, originando-se na placa celular que é formada durante a divisão celular.
28
As Paredes Primárias são formadas em células jovens em crescimento. Algumas
paredes primárias, tais como aquelas do parênquima de bulbos de cebola, são muito finas (100
nm) e possuem arquitetura simples. Outras paredes primárias, tais como aquelas encontradas
em colênquima ou em epidermes, podem ser bem mais espessas e conter múltiplas camadas.
A parede primária é constituída de celulose, hemiceluloses, pectinas e proteínas (Tabela
4.1). A celulose é uma molécula longa, não ramificada, formada de resíduos de glicose unidos
por ligação β-1,4, sendo sintetizada na membrana plasmática pelo complexo enzimático
contendo a celulose sintase. Uma única molécula de celulose, sintetizada por esse complexo
enzimático, pode conter acima de 3.000 unidades de glicose. A junção de 50 a 60 moléculas
de celulose através de pontes de hidrogênio produz as Microfibrilas, as quais possuem
espessura de 5 a 12 nm.
Tabela 4.1 – Composição média de paredes primária e secundária
Componentes
Parede Primária
%
Polissacarídeos
90
Celulose
30
Hemicelulose
30
Pectinas
30
Proteínas
10
Lignina
-
Parede Secundária
65 – 85
50 – 80
5 – 30
15 – 35
As microfibrilas de celulose são embebidas em uma matriz amorfa de polissacarídios
não celulósicos, principalmente hemiceluloses e substâncias pécticas. A hemicelulose é uma
mistura complexa de açúcares e derivados de açúcares, que formam uma rede altamente
ramificada. As hemiceluloses e pectinas são sintetizadas no Complexo de Golgi, em reações
catalisadas por enzimas provenientes do retículo endoplasmático, e transportadas em vesículas
que se fundem com a membrana celular, liberando o conteúdo na parede em crescimento. A
orientação das microfibrilas de celulose, dentro da matriz amorfa, é mais ou menos ao acaso,
embora, nas células que se alongam (como em caules e raízes) elas tendem a serem orientadas
na direção paralela ao crescimento.
A parede primária da célula também contém aproximadamente 10% de glicoproteínas
(proteínas contendo açúcares ligados), as quais são ricas no aminoácido hidroxiprolina. Estas
glicoproteínas são conhecidas como Extensinas. Embora não se conheça a precisa função das
extensinas, acredita-se que elas contribuem para a rigidez da parede celular, ou seja, elas são
proteínas estruturais.
As paredes secundárias são formadas após a célula parar de crescer. Elas são ricas em
celulose e lignina (Tabela 4.1). No entanto, elas podem conter polissacarídeos não celulósicos
(principalmente aqueles classificados como hemiceluloses) e proteínas. A parede secundária
pode tornar-se altamente especializada em estrutura e função, refletindo o estado de
especialização celular. As células do xilema de árvores, por exemplo, apresentam paredes
secundárias bastante espessas, que são reforçadas pela presença de lignina. Isto é fundamental
para a sustentação da planta e para o transporte de água a longa distância.
Depois da celulose, a lignina é a substância orgânica mais abundante nas plantas. Tratase de um composto fenólico, formado a partir de três álcoois: coniferil, cumaril e sinapil, os
quais são sintetizados, dentro da célula, a partir do aminoácido fenilalanina. As moléculas dos
três álcoois, uma vez na parede celular, sofrem a ação de enzimas que os convertem para a
forma de radicais livres. Estes radicais livres são altamente reativos e se unem ao acaso,
29
produzindo a lignina. Esta é a grande diferença entre a lignina e outros biopolímeros, como
amido e celulose, ou seja, nestes últimos as ligações não são ao acaso.
Do exposto acima, vê-se que a estrutura da parede celular varia consideravelmente,
dependendo da função exercida pela célula. Células que têm a função de sustentação, como
fibras e esclereídeos, possuem parede secundária altamente lignificada. Este também é o caso
dos vasos condutores do xilema. Por outro lado, células com elevada atividade metabólica e
células em crescimento possuem apenas parede primária. Outras células podem possuir
espessamento da parede primária, como é o caso de células epidérmicas de caules. Nas folhas,
as células-guarda (que são células epidérmicas diferenciadas) possuem espessamento
diferencial da parede celular, o que está relacionado a sua função (mudanças de volume destas
células permitem a abertura ou fechamento do estômato e, conseqüentemente, as trocas
gasosas).
Membrana Plasmática
O sistema de membranas celulares é crucial para a vida da célula. A membrana
plasmática (plasmalema ou membrana celular) e as demais membranas que circundam os
diversos compartimentos celulares (cloroplastos, mitocôndrias, vacúolos, núcleo, etc.),
mantêm as diferenças essenciais entre o citosol e o meio externo e, entre o citosol e o interior
de cada compartimento, respectivamente. Todas estas membranas biológicas têm organização
molecular semelhante, consistindo de uma bicamada lipídica contendo proteínas embebidas,
formando uma estrutura conhecida como “mosaico fluido” (Figura 4.1).
Os lipídios constituintes das membranas são moléculas insolúveis em água de natureza
anfipática (possuem uma região hidrofílica e outra hidrofóbica), arranjadas em uma dupla
camada de cerca de 8 a 10 nm de espessura. Essa bicamada lipídica forma a estrutura básica
das membranas e, em face de sua relativa impermeabilidade, funciona como barreira ao
movimento de íons e de moléculas polares.
Dentre as principais classes de lipídios encontradas em membranas vegetais, a mais
abundante é a dos fosfolipídios, os quais são formados por uma molécula de glicerol que se
liga de um lado a um grupo fosfato e do outro a dois ácido graxos (Figura 4.1). Ligados ao
grupo fosfato, podem aparecer colina, serina, etanolamina ou inositol, constituindo os
diversos tipos de fosfolipídios. Os ácidos graxos contêm entre 14 e 24 átomos de carbono,
sendo geralmente, um saturado e outro insaturado. Diferenças no comprimento da cadeia e no
grau de saturação dos ácidos graxos influenciam diretamente a estrutura da membrana. A
presença de duplas ligações provoca dobras na cadeia de carbono acarretando, um aumento na
permeabilidade da membrana.
As proteínas associadas com a bicamada lipídica são de dois tipos: as integrais ou
intrínsecas e as periféricas (Figura 4.1). Visto que as bicamadas de fosfolipídios são
praticamente impermeáveis a maioria das substâncias polares, os fluxos de íons através das
membranas biológicas ocorrem quase que exclusivamente através de proteínas integrais
(proteínas transmembranares, isto é, que têm acesso aos dois lados da membrana). Estas
proteínas podem ter um ou mais domínios através da membrana e estão envolvidas também
na síntese de ATP, na transdução de sinais e na formação de gradiente eletroquímico.
30
Figura 4.1 – A estrutura da membrana plasmática. Note a bicamada lipídica e as
proteínas integrais e periféricas (Taiz & Zeiger, 2002)
Vacúolos
Os vacúolos são organelas circundadas por uma única membrana conhecida como
tonoplasto. As células meristemáticas têm numerosos vacúolos pequenos. Já nas células
maduras, o vacúolo é um compartimento único que pode ocupar de 80 a 90% do volume
celular.
Os vacúolos possuem diferentes funções e propriedades, dependendo do tipo de
célula em que ele ocorre:
• Em células em crescimento, muitos compostos orgânicos e inorgânicos acumulam nos
vacúolos. Estes solutos criam a pressão osmótica que é responsável pela pressão de
turgescência necessária para o crescimento e manutenção da forma dos tecidos.
• Em plantas suculentas, a flutuação diária no conteúdo de ácidos orgânicos nos vacúolos é
conhecida como Metabolismo Ácido das Crassuláceas (plantas CAM, como cactáceas e
crassuláceas). Isto está diretamente associado à fixação de CO2 (Fotossíntese).
• Vacúolos são também ricos em enzimas hidrolíticas (proteases, glicosidases, etc.) que
participam da degradação das macromoléculas celulares durante o processo de senescência.
Neste aspecto, eles se assemelham aos lisossomos de células animais, que funcionam na
digestão intracelular.
• Um tipo especializado de vacúolo, conhecido como Corpo Protéico, é abundante em
sementes, servindo como o local de estoque de proteínas.
31
• Muitas células de plantas sintetizam pigmentos, tais como antocianina e betacianina, os
quais são armazenados nos vacúolos. Outros produtos secundários, incluindo alcalóides,
saponinas, glicosídios cianogênicos, etc., também se acumulam nos vacúolos.
• Estoque de cristais de oxalato de cálcio (como em plantas de Araceae).
• Acúmulo de sais potencialmente tóxicos (Na+, Cl-, etc.) em halófitas (plantas nativas de
ambientes salinos)
• Os vacúolos têm importante papel na homeostase de íons, mantendo as concentrações de
alguns íons (Ca2+, PO42-, NO3-, etc.) constantes e em níveis adequados no citosol.
Plasmodesmas e as Definições de Simplasto e Apoplasto
Os plamodesmas são extensões tubulares da membrana plasmática, de 40 a 50 nm de
diâmetro, que atravessam a parede celular e conectam os citoplasmas de células adjacentes.
Cada plasmodesma contém um estreito tubo de retículo endoplasmático, conhecido como
desmotúbulo. Assim, os plasmodesmas permitem não somente a junção dos conteúdos das
regiões citosólicas de células adjacentes, mas, também, o conteúdo do retículo
endoplasmático. No entanto, o pequeno diâmetro dos plasmodesmas evita que ocorra
transferência de organelas e muitas macromoléculas entre as células, permitindo apenas a
difusão de pequenas moléculas (como sacarose) e de íons (K+, Cl-, Ca2+, etc.).
A conexão de células vizinhas através dos plasmodesmas, cria uma rede contínua de
citoplasmas em toda a planta, conhecida como Simplasto. De maneira similar, estas células
produzem uma rede de espaços extracelulares, conhecida como Apoplasto. O apoplasto
compreende o espaço formado pelas paredes de células interconectadas, pelos espaços
intercelulares e pelos tecidos vasculares não vivos (vasos do xilema). Os conceitos de
simplasto e apoplasto são especialmente úteis quando estudamos o transporte de água e de
solutos dissolvidos (sacarose, nutrientes minerais, etc.) na planta.
A PLANTA COMO UM ORGANISMO
Meristemas e Tecidos
O crescimento das plantas é concentrado em regiões de divisão celular conhecidas
como MERISTEMAS. Praticamente, todas as divisões nucleares (mitoses) e todas as
divisões celulares (citocineses) ocorrem nas regiões meristemáticas. Após a divisão celular
algumas células permanecem como células meristemáticas e outras se expandem (zona de
alongamento) e produzem o crescimento do órgão. Esses meristemas se classificam como:
• Meristemas Apicais – Encontrados nos ápices e ramificações de caules e raízes –
produzem o crescimento em extensão.
• Meristemas Intercalares – Encontrados entre tecidos maduros ou diferenciados (por
exemplo, acima do nó no colmo de milho) – produzem o crescimento em extensão.
• Meristemas Laterais – Situados paralelamente ao eixo do órgão em que se encontram –
produzem o crescimento em diâmetro
Quanto a origem os meristemas se classificam em:
Meristemas Primários – Se desenvolvem de células embrionárias (Apicais). produzem o
corpo primário das plantas (Tabela 4.2)
32
Meristemas Secundários – Se desenvolvem de células maduras diferenciadas (Meristemas
Laterais – CÂMBIO VASCULAR E FELOGÊNIO). produzem o crescimento secundário
ou em diâmetro (Tabela 4.2)
Tabela 4.2 - Corpo primário e secundário de raízes e de caules, da superfície para o centro.
RAIZ
CAULE
Secundária
Primário
Secundário
Primária
Epiderme
Periderme
Epiderme
Periderme
Córtex
Floema secundário
Córtex
Floema Secundário
Endoderme
Xilema secundário
Cilindro Vascular,
com floema e xilema
primários
Xilema secundário
Cilindro Vascular,
Xilema primário no
Medula
com floema e xilema
centro, às vezes não
primários
visível
Periderme = súber (externa) , felogênio e feloderma (interna)
Medula
O crescimento secundário é característico de dicotiledôneas e gimnospermas
Certas monocotiledôneas (Palmae), exibem considerável espessamento, resultante da
atividade de um meristema lateral especial. Porém, estas plantas nunca alcançam o diâmetro
de árvores dicotiledôneas adultas.
OBS: em caules em crescimento primário e secundário pode-se encontrar, no centro, uma
medula.
Os tecidos encontrados nos órgãos do vegetal e originados a partir dos meristemas
podem ser assim classificados:
Tecido Dérmico - corresponde à “pele” da planta
A epiderme é o tecido dérmico de plantas jovens que apresentam crescimento primário.
Deve-se destacar que sua função depende da função do órgão. Por exemplo, a superfície da
parte aérea, especialmente a das folhas, é coberta com cutícula cerosa para reduzir as perdas
de água, além de pêlos e tricomas que são extensões das células epidérmicas. Nas superfícies
de raízes as células são adaptadas para absorção de água e nutrientes minerais. Extensões
destas células epidérmicas, os pêlos radiculares, aumentam a superfície de absorção. Como se
vê, as adaptações aparentemente semelhantes nas folhas e raízes, produzem funções que
atendem a necessidade do vegetal.
Nas plantas que apresentam crescimento secundário, a epiderme é destruída e a
Periderme (composta pelo súber, felogênio e feloderma) passa a funcionar como tecido de
proteção. Isso ocorre principalmente em caules e raízes de dicotiledôneas e de gimnospermas.
33
Tecido Fundamental - compõe ou preenche o corpo da planta. Os tecidos fundamentais
apresentam diferentes tipos de células com diferentes funções:
• Parênquima – constituído de células metabolicamente ativas com parede celular fina
(parede primária). Está presente em todos os órgãos da planta.
Funções: fotossíntese, respiração, assimilação, armazenamento, secreção, etc.
• Colênquima – Células alongadas com parede primária espessa. Contribui como suporte
estrutural para plantas em crescimento, particularmente na parte aérea (caules herbáceos).
• Esclerênquima – São células com parede celular secundária e são freqüentemente mortas
na maturidade. A principal função é dá suporte mecânico, principalmente, nas partes maduras
da planta. Os principais tipos são as fibras e os esclereídeos.
Tecido vascular
Os tecidos vasculares são compostos de dois principais sistemas de condução: o xilema
e o floema. O xilema transporta água e minerais das raízes para o resto da planta. O floema
distribui os produtos da fotossíntese e uma variedade de outros solutos por toda a planta.
Os traqueídeos e os elementos de vaso são as células condutoras do xilema. Estes dois
tipos de células possuem paredes secundárias espessas e perdem seu citoplasma na
maturidade; isto é, elas são mortas quando funcionais. Os elementos crivados, nas
angiospermas, e as células crivadas, nas gimnospermas, são responsáveis pela translocação
de açúcares e outras substâncias no floema. Diferente das células condutoras do xilema, as
células condutoras do floema são vivas quando funcionais. No entanto, elas não possuem
núcleo e vacúolos centrais, e possuem relativamente poucas organelas citoplasmáticas.
Anatomia dos Órgãos Vegetais
No corpo vegetativo de uma planta podemos distinguir três órgãos: folha, caule e raiz
(Figura 4.2). Estudos da anatomia desses órgãos, em cortes transversais, permitem as
seguintes observações:
As folhas são estruturas tipicamente laminares, presas aos caules através do pecíolo,
sendo o principal órgão fotossintetizante. Os locais de inserção de folhas no caule são
conhecidos como Nó (node) e a região entre dois Nós é conhecida como Entrenó (internode).
A lâmina foliar, também conhecida como limbo, possui uma epiderme superior (adaxial) e
uma epiderme inferior (abaxial). Entre as duas epidermes é que se localiza o tecido
fotossintético, conhecido como mesofilo, que significa meio da folha. Uma cutícula cerosa
cobrindo as duas epidermes, principalmente a adaxial, também é observada.
34
Figura 4.2 – Representação de um corpo vegetativo primário de uma dicotiledônea. Cortes
transversais de uma folha (A), de um caule (B) e de uma raiz (C). (Taiz & Zeiger, 1998)
O mesofilo é constituído de células de parênquima, podendo ser distinguido, na maioria
das dicotiledôneas, o parênquima palissádico, uma a três camadas de células alongadas
localizadas abaixo da epiderme adaxial, e o parênquima esponjoso, células com formatos
irregulares e que permitem a formação de grandes espaços intercelulares (Figura 4.2A). Nas
folhas de monocotiledôneas, normalmente não se observa essa distinção.
As folhas também possuem uma rede de feixes vasculares, contendo xilema e floema,
que são contínuos, através do pecíolo, com o tecido vascular do caule. Em folhas de
dicotiledôneas, observa-se um sistema de feixes (conhecidos como nervuras) interconectados
e de tamanho decrescente, que asseguram o transporte de água e minerais para cada célula
fotossintetizante e a remoção dos produtos da fotossíntese. Em folhas de monocotiledôneas,
as nervuras são distribuídas paralelamente ao longo do limbo foliar.
O caule funciona principalmente como suporte, podendo realizar fotossíntese em muitas
espécies. Em caules jovens de dicotiledôneas, os feixes vasculares são bem organizados,
35
formando um anel concêntrico em torno de uma medula parenquimática (Figuras 4.2B). Na
maioria das dicotiledôneas, o xilema fica para dentro e o floema para fora. O córtex, também
constituído de células parenquimáticas, se localiza externamente aos feixes vasculares e a
epiderme é a camada mais externa.
No entanto, o arranjo dos tecidos em caules pode variar consideravelmente, dependendo
da idade do órgão e se a espécie é monocotiledônea ou dicotiledônea. Diferente do caule de
dicotiledôneas, caules da maioria das monocotiledôneas, apresentam os tecidos vasculares
arranjados em feixes mais ou menos dispersos entre os tecidos de preenchimento. Nestas
plantas, torna-se difícil distinguir claramente os limites entre o córtex, os cilindros vasculares
e a medula. Os feixes usualmente contêm fibras (esclerênquima), as quais contribuem para a
resistência mecânica destes caules. Por outro lado, em caules mais velhos de dicotiledôneas,
que apresentam crescimento secundário, ocorre formação de floema secundário para fora e
xilema secundário para dentro, a partir do câmbio vascular. Nestes caules, a epiderme é
substituída pela periderme.
As raízes ancoram a planta e absorvem água e minerais do solo. Nas raízes de
dicotiledôneas podemos distinguir a raiz principal e inúmeras raízes laterais. Um diagrama de
uma seção transversal de uma raiz primária (raiz que apresenta crescimento primário) mostra
uma disposição bem diferente daquela observada em caules (Figura 4.2C). Neste diagrama
podemos distinguir, de fora para dentro, as seguintes camadas de células: epiderme, córtex,
endoderme e cilindro central (estelo). No cilindro central é que são encontrados os feixes
vasculares, sendo que o xilema se localiza mais internamente e o floema mais externamente.
Também se observa uma camada de células abaixo da endoderme, conhecida como periciclo,
a partir da qual se desenvolvem as raízes laterais.
Além da atividade do meristema apical, o desenvolvimento dos caules e do sistema
radicular de gimnospermas e de dicotiledôneas depende, também, da atividade de meristemas
laterais (ou secundários). Estes meristemas são o câmbio vascular e o felogênio, os quais vão
produzir o crescimento em diâmetro destes órgãos. A tabela 4 mostrou as diferenças entre
caules e raízes com crescimento primário e com crescimento secundário. Muitas
monocotiledôneas não formam câmbio vascular, e o pequeno crescimento radial deve-se ao
aumento em diâmetro de células não meristemáticas.
2. QUANTIFICAÇÃO DE ÁGUA NA PLANTA
2.1 Teores de Água na Planta
Determinação do Teor de Água e do Grau de Suculência
Para a determinação do teor de água em plantas é necessário, inicialmente, que se realize a
pesagem do material fresco logo após a coleta. Caso o local da coleta seja distante do local de
pesagem, deve-se acondicionar o material de modo a prevenir as perdas de água. O material
fresco deve ser, em seguida, colocado para secar em estufa com circulação forçada de ar, à
temperatura de 65 oC. O teor de água é obtido pela seguinte expressão:
TA = 100 x (MF – MS)/MF
36
Para obtenção do grau de suculência torna-se necessária a medição da área foliar (A), a
qual é obtida medindo a área de uma das superfícies foliares utilizando-se equipamentos ou
métodos específicos. O grau de suculência, g de H2O/unidade de área, é dado do pela seguinte
expressão:
GS = (MF – MS)/A
Determinação do Déficit de Saturação Hídrica e do Teor Relativo de Água
O déficit de saturação hídrica (∆wsat) é um excelente indicador do balanço hídrico da
planta, pois representa a quantidade de água que ela precisa para alcançar sua total saturação.
O teor relativo de água (Ø) expressa o conteúdo de água em relação ao observado na
saturação, em um dado tempo. Estas duas variáveis são determinadas de forma idêntica, e os
seus resultados são complementares. Assim, se o teor relativo de água em um dado órgão for
80%, o déficit de saturação hídrica será 20%.
As metodologias empregadas na determinação do teor relativo de água e do déficit de
saturação hídrica baseiam-se nas obtenções dos pesos frescos, secos e túrgidos (peso
máximo). Os dois primeiros pesos são facilmente obtidos em laboratório, porém, a obtenção
do peso túrgido consiste na principal limitação apresentada pelos diferentes métodos. Estas
dificuldades relacionam-se, principalmente, com o tempo de saturação, o qual varia de espécie
para espécie, e com as condições do meio (umidade relativa do ar, temperatura, iluminação,
etc.). Estas dificuldades podem ser contornadas, trabalhando-se com amostras de tamanho
pequeno e sob condições controladas.
As determinações podem ser feitas com folhas inteiras ou com discos de folhas. Na
determinação em folha inteira, três folhas maduras, aproximadamente com a mesma idade
fisiológica, são rápida e individualmente pesadas para a obtenção do peso fresco (PF). Após a
pesagem, cada folha, é identificada e colocada em um tubo de ensaio com o pecíolo submerso
em água, e levada a uma câmara úmida (umidade relativa de 90%; temperatura de 30° C; e
intensidade luminosa próxima do ponto de compensação luminoso) onde permanece por 24
horas (nos estudos com discos foliares o tempo para saturação é consideravelmente menor).
Após este tempo as folhas são enxugadas e pesadas novamente para a obtenção do peso
máximo (PM). Em seguida, estas folhas são colocadas para secar em estufa, a uma
temperatura em torno de 80° C, até a obtenção do peso seco constante (PS). Com estes dados
calcula-se o teor relativo de água (Ø) e o déficit de saturação hídrica(∆wsat) utilizando-se as
seguintes fórmulas matemáticas:
Ø = PF - PS x 100 (%)
PM - PS
∆wsat = PM - PF x 100 (%)
PM - PS
37
2.2 Determinação do Potencial Hídrico de Tecidos de Plantas
2.2.1 Método da Bomba de Pressão
Um método relativamente rápido para estimar o Ψw de tecidos, como folhas ou ramos
inteiros, é o da bomba de pressão (Figura 4.3). A bomba de pressão (tipo Scholander) mede a
pressão hidrostática negativa (tensão) que existe no xilema de muitas plantas. Neste caso é
assumido que o Ψw do xilema é igual ao Ψw médio de todo o órgão. Isto é provavelmente
válido pois: 1- em muitos casos o potencial osmótico do xilema é desprezível, assim o
principal componente do potencial hídrico no xilema é a pressão hidrostática negativa
(tensão) na coluna do xilema; 2 – o xilema está em contato intimo com a maioria das células
do órgão e até mesmo de toda a planta.
Figura 4.2 – Diagrama da bomba de pressão para determinação do potencial hídrico de
tecidos (Hopkins, 2000)
Nesta técnica, o órgão a ser medido tem que ser cortado e colocado na câmara, de acordo
com a figura 4.2. Antes do corte, a coluna de água no xilema está sob tensão. Quando a
coluna de água é cortada, a água é puxada para dentro dos capilares do xilema (Figura 4.2A).
Para fazer a medição, a câmara é pressurizada com gás comprimido até que a água retorne
para a superfície do corte (Figura 4.2B). O observador, quando notar o umedecimento da
superfície do corte, deve parar a pressurização e anotar a pressão marcada no manômetro.
Este valor, com sinal negativo, corresponde ao Ψw do órgão. Esta determinação deve ser feita,
preferencialmente, nas primeiras horas do dia.
38
2.2.2 Método baseado na mudança do peso do tecido
O potencial hídrico de alguns tecidos pode ser estimado equilibrando-se amostras de
tecido, previamente pesadas, em soluções de potencial osmótico conhecido. O objetivo é
determinar qual solução tem um potencial osmótico equivalente ao potencial hídrico do
tecido. Se o Ψs da solução externa é mais negativo do que o Ψw do tecido, ocorre saída de
água do tecido e, conseqüente perda de peso; se o Ψs da solução externa é menos negativo
do que o Ψw do tecido, ocorre entrada de água no tecido e, conseqüente ganho de peso;
aquela solução na qual o tecido não ganha nem perde peso tem um potencial osmótico
equivalente ao Ψw do tecido (Figura 8)
39
Figura 4.3 – Medição do potencial hídrico pelo método de mudança no peso do tecido
(Hopkins, 2000).
40
Na prática, amostras de tamanho uniforme são preparadas, pesadas, e colocadas em
soluções de conhecida molalidade (Figura 8A). Preferencialmente, deve-se utilizar solutos
que não sejam absorvidos pelas células (sorbitol, polietileno glicol, manitol, etc) para que não
ocorram alterações significativas do potencial osmótico do tecido. Após suficiente tempo para
que ocorra o equilíbrio entre o tecido e a solução, os tecidos são retirados, secos com papel e
novamente pesados. A perda ou ganho de peso é calculada como uma percentagem do peso
inicial e relacionado graficamente com a concentração da solução (Figura 8B).
O Ψs da solução pode ser calculado pela equação de van’t Hoff:
Ψs = - C.R.T
em que: C = concentração molal (moles por kg de água); R = constante universal dos
gases (0,00831 kg MPa mol-1 oK-1); e T = temperatura absoluta (oC + 273).
2.2.3 Métodos de determinação do potencial osmótico
Existem, basicamente, dois tipos de métodos para a determinação do potencial
osmótico(Ψs) de uma célula ou tecido: ”in situ”, pelos métodos celulares ou pela obtenção do
suco dos tecidos e a determinação do seu Ψs por métodos diretos ou indiretos.
Nos métodos celulares, normalmente o Ψs é medido após as células ou tecidos terem
alcançado o equilíbrio osmótico, em soluções testes de Ψs conhecido. Naqueles em que se usa
o suco celular é assumido que o potencial osmótico do suco liberado dos tecidos, após a
destruição da semipermeabilidade das membranas, é o mesmo da solução vacuolar, que estava
“in situ”, em equilíbrio dinâmico com as estruturas citoplasmáticas, todas elas sob a mesma
pressão de turgescência.
Os métodos mais comuns para a obtenção do suco celular baseiam-se na ruptura do
tecido vegetal mediante baixas temperaturas (congelamento a - 20° C), altas temperaturas (60
minutos em banho-maria) ou maceração com uma posterior centrifugação (2000 g durante 5
minutos). Estes métodos de extração do suco celular apresentam uma desvantagem bastante
conhecida em todos os estudos de fisiologia vegetal, ou seja, as dificuldades em medir ou
estudar propriedades de órgãos e tecidos sem alterar a estrutura e função das amostras.
Mediante a ruptura das membranas os solutos de vacúolos, citossol e diversas organelas
misturam-se possibilitando inúmeras reações com a conseqüente formação de diversos
complexos.
Um dos métodos mais utilizados para medição do Ψs é através da determinação do
ponto de congelamento do suco celular pelo método crioscópico. Este método permite
determinar, com muita precisão, o ponto de congelamento de uma solução.
O ponto de congelamento (PC) de uma solução aquosa contendo solutos não voláteis
dissolvidos é menor do que 0 °C. A magnitude da depressão do PC abaixo de 0 °C é
diretamente proporcional ao número de partículas do soluto dissolvido (Lei de BLADGEN).
Uma solução 1,0 osmolal de um soluto não ionizável congela a - 1,858 °C (Lei da depressão
constante de RAOULT). Tal solução possui um Ψs de -2,27 MPa. Esta relação quantitativa
entre o PC de uma solução de concentração conhecida e seu Ψs , permite determinar o Ψs de
uma amostra (suco celular) baseado no seu PC.
- 2,27 MPa = Ψs
1,86 oC
∆f
41
Assim, Ψs = 1,22 x ∆f
∆f = ponto de congelamento, em oC
Um dos aparelhos utilizados nas determinações do Ψs , baseado nos fundamentos
descritos acima, é o microscópio de DRUCKER-BURIAN com termômetro para crioscopia.
Este aparelho permite a obtenção dos pontos de congelamento das amostras e, com o uso de
tabelas aliado ao conhecimento da relação descrita por RAOULT (ver Cramer & Boyer,
1995), é possível se calcular o Ψs do órgão ou tecido. Medições menos trabalhosas podem ser
obtidas com aparelhos mais modernos (osmômetros), os quais permitem a determinação direta
da osmolalidade da solução. Neste caso, o Ψs pode ser calculado por uma regra de três
simples.
42
UNIDADE 5 – CARACTERIZAÇÃO E QUANTIFICAÇÃO DE ÁGUA NA
ATMOSFERA
1. COMPOSIÇÃO E CARACTERIZAÇÃO DA ATMOSFERA
Composição da Atmosfera
A atmosfera é composta de diferentes gases, sendo que alguns se apresentam em
concentrações pouco variáveis e outros em concentrações variáveis. Em média o ar seco é
formado de cerca de 78% de N2, 21% de O2, 1% de argônio e 0,03% de CO2. Outros gases
estão presentes em concentrações muito menores como neônio, hélio e ozônio, embora essas
concentrações possam ser maiores em camadas mais elevadas da atmosfera (como o ozônio
na estratosfera). Alguns gases, como o N2O, NO, SO2, NO2, CO2 , CO, etc., apresentam
concentrações variáveis. Essa mistura de gases, chamada de ar seco, pode reter até 4% de
vapor d’água (na base de volume), dependendo da temperatura do ar.
Pressão Atmosférica, Pressão de Vapor e Déficit de Pressão de Vapor
A pressão atmosférica real de um local (PR) corresponde ao peso da coluna de ar que fica
sobreposta a qualquer ponto da atmosfera. Na superfície da terra, representa o peso de uma
coluna de ar com seção transversal de área unitária, estendendo-se da superfície da terra aos
limites superiores da atmosfera. Ela corresponde à pressão devida ao ar seco (Pa) mais a
pressão atual de vapor d’água (ea):
PR = Pa + ea
Esses valores de pressão podem ser expressos em mmHg, atm, mb e hPa, sendo;
760 mmHg = 1,0 atm = 1013,3 mb = 1013,3 hPa
Quando o ar está saturado a pressão real (PR) corresponde á soma da pressão dos gases (Pa)
para a pressão de saturação do vapor d’água (es)
PR = Pa + es
A pressão de vapor de saturação depende diretamente da temperatura, sendo maior quanto
maior for a temperatura. A diferença entre a pressão atual de vapor do ar (ea) e a pressão de
saturação (es) corresponde ao déficit de pressão de vapor (DPV):
DPV = es - ea
O DPV representa, portanto, a quantidade de vapor d’água necessária para saturar o ar,
sendo um excelente indicador da demanda evaporativa da atmosfera.
43
Implicações dos Elementos Meteorológicos para a Demanda de Água pela Atmosfera
As estimativas do consumo de água pelas culturas levam em consideração os principais
elementos meteorológicos: radiação, temperatura, ventos e umidade. A radiação solar afeta
diretamente a demanda atmosférica de água, pois ela é a fonte primária e energia para todos
os processos que ocorrem no sistema solo-planta-atmosfera. A radiação solar que atinge a
terra é principalmente a radiação de ondas curtas, com comprimentos de onda variando de 200
a 3000 nm. Essa radiação engloba parte da radiação ultravioleta, a radiação visível (usada na
fotossíntese) e parte da radiação infravermelha (Tabela 5.1). A radiação emitida pela terra é
caracterizada como radiação de ondas longas (acima de 3000 nm) com baixo valor energético.
Embora o saldo de radiação durante a noite seja negativo, o balanço de radiação é positivo
particularmente nas condições tropicais, ou seja, a terra absorve mais radiação do que emite.
Parte da energia é utilizada diretamente para o processo de evaporação da água, ou seja, é
convertida em calor latente. Outra parte da energia promove o aquecimento das superfícies e
do ar atmosférico, ou seja, é transformada em calor sensível.
Tabela 5.1 – Principais radiações de interesse biológico (Hopkins, 2000)
Cor
Ultravioleta
UV – C
UV – B
UV – A
Visível
Violeta
Azul
Verde
Amarelo
Laranja
Vermelho
Vermelho distante
Infra-Vermelho
Faixa de Comprimento de
Onda (nm)
100 – 400
100 – 280
280 – 320
320 – 400
400 – 740
400 – 425
425 – 490
490 – 550
550 – 585
585 – 640
640 – 700
700 – 740
> 740
Energia Média
(kJ mol-1 fótons)
471
399
332
290
274
230
212
196
181
166
85
O aumento da temperatura do ar é diretamente responsável pelas mudanças da pressão
atmosférica e durante o dia provoca o aumento da pressão de saturação do vapor d’água e,
conseqüentemente, do déficit de pressão de vapor. Assim, durante o dia se observa um
aumento da demanda evaporativa do ar, implicando em maior consumo de água pelas plantas.
A temperatura do ar é diretamente responsável pelas mudanças da pressão atmosférica, que
por sua vez alteram as direções e a velocidade dos ventos. Os ventos transportam massas de ar
de uma região para outra, afetando diretamente os processos de transferência de água no
sistema solo planta atmosfera.
Em resumo, havendo disponibilidade de água no solo, o consumo de água será maior
quanto maior for o DPV e quanto maior for a velocidade dos ventos.
44
2. QUANTIFICAÇÃO DO VAPOR DÁGUA NA ATMOSFERA
A quantidade de vapor d’água na atmosfera pode ser obtida na forma de pressão, e os
valores de pressão de vapor podem ser utilizados nos cálculos das umidades absoluta e
relativa, bem como na estimativa do potencial hídrico do ar. Para essas medições são
utilizados psicrômetros, instrumento meteorológico formado por dois termômetros de
mercúrio, sendo um denominado de bulbo seco e o outro de bulbo úmido. O bulbo desse
último é mantido constantemente úmido por um cadarço. Com a passagem de ar sobre o bulbo
umedecido pelo cadarço ocorre a evaporação da água e, em conseqüência, ocorre consumo de
calor sensível e diminuição da temperatura do termômetro de bulbo úmido. Assim, quanto
mais seco estiver o ar, menor será a temperatura desse termômetro e maior será a diferença
psicrométrica (Ts – Tu).
A partir dos valores de temperatura do bulbo seco (Ts) e do bulbo úmido (Tu), pode-se
calcular a pressão de saturação do vapor d’água (es) e a pressão atual de vapor (ea).
A pressão de saturação é dada pela seguinte expressão:
e s = X * 10
7 , 5 . Ts
237 , 3 + Ts
X é igual a 4,58, para pressões em mmHg; 6,107, para em mb ou hPa; 0,6107, para em kPa.
1,0 mb = 0,75 mmHg = 0,1 kPa
A pressão atual do vapor d’água é dada pela seguinte expressão:
ea = esu − A . PR . (Ts − Tu )
A = 0,00067, para psicrômetros aspirados e 0,0008 para psicrômetros comuns; PR = pressão
real do local.
esu é a pressão de saturação, considerando a temperatura do termômetro de bulbo úmido. Para
seu cálculo utiliza-se a mesma fórmula de es, substituindo-se Ts por Tu.
A partir dos valores de ea e es pode-se calcular a umidade relativa do ar (UR):
e
U .R. = a . 100
es
A umidade relativa é definida como a relação entre a quantidade de vapor d’água existente
num determinado volume de ar e a quantidade que este mesmo volume poderia ter se
estivesse saturado, na mesma temperatura.
A umidade absoluta (UA) representa a quantidade de vapor d’água medida em gramas,
contida em um metro cúbico de ar. É calculada pela seguinte expressão:
45
Y . ea
U . A. =
Ts + 273
Y é igual a 288,9, quando es é em mmHg, 216,7, quando em mb e 2167, em kPa.
A partir dos valores de pressão de vapor pode-se obter o potencial hídrico do ar. O valor
do potencial hídrico do ar é dado pela seguinte expressão:
Ψw = RT ln (ea/es)
Vw
Em geral, o potencial hídrico do ar é bem mais negativo do que os potenciais observados
nos solos e nas plantas, o que torna a atmosfera uma grade demandadora de água. Durante o
dia, os valores de umidade relativa do ar e de potencial hídrico são menores quanto maiores
forem os valores de temperatura, ou seja, próximo ao meio dia. Quanto maior a temperatura
maior a pressão de vapor na saturação. Isso acarreta menor potencial hídrico, menor umidade
relativa, maior déficit de pressão de vapor do ar e maior demanda evaporativa do ar.
Com os dados de pressão de vapor pode-se calcular, também, a temperatura de ponto de
orvalho (TO).
O valor de TO é dada pela seguinte expressão:
e
237,3 . Log a
X
To =
ea
7,5 − Log
X
A TO corresponde à temperatura em que ea se iguala a es, isto é, durante a noite a
temperatura decresce reduzindo a pressão de vapor de saturação (es). Quando es se iguala a ea,
as condições ficam propicias à formação do orvalho (condensação do vapor d’água que ocorre
quando ele entre em contato com superfícies, como as folhas).
Calculou-se o déficit de pressão de vapor atmosférico (DPV) pela seguinte fórmula
(Jones, 1992):
Em que o t é calculado pela equação:
46
UNIDADE 6 – TRANSPORTE DE ÁGUA NO SISTEMA SOLO-PLANTA
A parte aérea das plantas terrestres está exposta ao ambiente atmosférico, perdendo água
constantemente para o meio. Essa água deve ser reposta com novos suprimentos hídricos
provenientes principalmente do solo. Assim, a absorção, o transporte de água das raízes para a
parte aérea, e a transpiração são processos básicos acoplados e inseparáveis do balanço
hídrico da planta. O déficit de pressão hídrica do ar é a força motora para a transpiração e a
quantidade de água no solo é o fator decisivo para o abastecimento hídrico da planta. O
balanço hídrico da planta é mantido por um constante fluxo de água e a situação de equilíbrio
na verdade é alcançada por meio de um equilíbrio dinâmico.
Procuraremos nessa etapa compreender os processos de transporte de água no sistema
solo-planta-atmosfera:
•
•
•
Movimento de água da superfície radicular até o xilema da raiz (absorção);
Transporte de água da raiz até as folhas, via xilema (transporte a longa distância);
Transferência de água, na forma de vapor, da folha para a atmosfera (transpiração).
1. ABSORÇÃO DE ÁGUA PELAS PLANTAS
O principal foco dos estudos sobre a economia de água em plantas e em células de
plantas relaciona-se a fatores que governam o movimento de água de célula para célula ou
entre células e o meio ambiente. Um dos principais objetivos da Fisiologia Vegetal é,
portanto, entender a dinâmica da água quando ela flui para dentro e para fora da célula, ou
desde o solo, passando pela planta e chegando até a atmosfera.
Para o estudo das relações hídricas ao nível celular devemos relembrar que em uma
célula vegetal típica, a parede celular, a membrana celular e os grandes vacúolos executam
papéis cruciais nesse processo. A membrana celular semi-permeável garante a existência de
diferentes concentrações de solutos entre a célula e o meio externo (solução do solo ou
apoplasto). A parede celular resiste, até certo ponto, à pressão de turgescência criada pela
entrada de água na célula, garantindo a forma dos tecidos tenros. Já os vacúolos, graças ao
grande volume, são responsáveis pela regulação da pressão osmótica interna da célula.
Algumas células diferem grandemente dessa célula típica. Os vasos do xilema, por exemplo,
são células mortas quando funcionais, com paredes secundárias lignificadas e, evidentemente,
não possuem protoplasto. As rígidas paredes destas células são fundamentais para o transporte
de água das raízes para a parte aérea, visto que esse transporte é feito, normalmente, sob forte
tensão criada pela transpiração da água nas folhas.
Nesta unidade, vamos procurar entender as relações hídricas de células típicas, contendo
parede celular primária, membrana plasmática e grandes vacúolos, e a partir desse
entendimento básico, procurar compreender como as plantas absorvem e transportam água.
47
O Conceito de Osmose
Os movimentos de água no estado líquido podem ser impulsionados por diferença de
pressão (fluxo em massa) ou por diferença de concentração (difusão). O fluxo em massa
ocorre quando uma força externa, tal como gravidade ou pressão, é aplicada. Como resultado,
todas as moléculas da substância movem-se como uma massa única. Um exemplo clássico é a
água que recebemos nas torneiras de nossas casas, nas quais a água flui em resposta a uma
pressão hidrostática estabelecida pela gravidade. O movimento de água por fluxo em massa é
comum nos solos e no xilema de plantas.
O fluxo em massa é explicado pela equação de Poiseuille:
Fluxo = πr4
8η
x
∆P
∆x
Em que: r = raio da tubulação; η = viscosidade do líquido; ∆P = gradiente de pressão e
∆x = distância a ser percorrida
A difusão pode ser interpretada como um movimento de uma substância, de uma região
de alta concentração para uma região de baixa concentração, acompanhado de movimentos ao
acaso de moléculas individuais. Assim, enquanto o fluxo em massa é impulsionado pela
pressão, a difusão é impulsionada pela diferença de concentração. Por exemplo, o cheiro de
um perfume ou de éter poderá se espalhar rapidamente em uma sala, se o recipiente for
deixado aberto. Isto ocorre por diferença de concentração.
A difusão é explicada pela Lei de Fick:
Js = Ds . ∆Cs/∆x
Em que, Js = fluxo difusivo (mol m-2 s-1) Ds = coeficiente de difusão; ∆Cs = diferença de
concentração; e ∆x = distância a ser percorrida
O movimento de água líquida, por diferença de concentração, é lento, de modo que a
difusão somente se torna importante para as plantas, quando se trata de transporte a curta
distância (dentro da célula ou, quando muito, de uma célula para outra). Em particular, a
difusão é um importante fator no suprimento de CO2 para a fotossíntese bem como para a
perda de vapor d’água durante a transpiração na folha.
Um terceiro processo responsável pelo transporte de água é a osmose, a qual se refere ao
movimento de um solvente, tal como a água, através de uma membrana. Para entendermos o
conceito de osmose, imagine um sistema (osmômetro) composto por um recipiente dividido
ao meio por uma membrana com permeabilidade seletiva (Figura 6.1).
48
Figura 6.1 – Movimento de água como resultado do processo de osmose. Observe o sistema
acima, nas situações inicial (I) e final (F).
Se a água pura é colocada de um lado da membrana (A) e alguma solução (por exemplo
KCl 0,1 M) for colocada no outro lado (B), observa-se que a água se movimenta de A para B.
Como a água se movimenta de locais de maior energia para locais de menor energia, pode-se
inferir que a energia associada com a água é maior em A do que em B. Esta tendência de
movimento de água é contrabalançada e o equilíbrio é estabelecido devido a pressão
hidrostática desenvolvida pelo peso da coluna da solução, sendo chamada de pressão
osmótica. Assim, qualquer solução colocada num osmômetro, terá, por conseguinte, a
capacidade para desenvolver uma pressão osmótica.
O transporte descrito acima e mostrado na figura 7.1 é conhecido como osmose. Nós
poderíamos fazer o sistema retornar para a situação inicial se aplicássemos uma pressão em B.
Neste caso teríamos a osmose reversa, princípio utilizado pelos aparelhos dessalinizadores de
água.
A entrada de água nas células vegetais passa obrigatoriamente pela membrana
plasmática, a qual funciona como uma barreira à entrada de muitas substâncias. Portanto, o
processo de osmose ocorre comumente em células de plantas devido às diferenças nas
concentrações de solutos entre os dois lados da membrana plasmática. A concentração de
soluto dentro da célula é tipicamente 0,5 a 1,0 molal maior que no lado externo (solução do
solo ou apoplasto), causando uma forte tendência de movimento de água para o interior da
célula. Esse transporte de água por osmose pode ocorrer através da bicamada lipídica ou
através de poros na membrana (conhecidos como canais de água ou aquoporinas). A entrada
de água na célula cria uma pressão hidrostática que é normalmente inferior à pressão osmótica
interna. Devemos relembrar, que diferente do sistema de vasos comunicantes mostrados na
figura 7.1, á célula vegetal é um sistema fechado, sendo a pressão criada exercida sobre a
parede celular.
No movimento de água por osmose, a direção e a taxa de fluxo de água sobre a
membrana são determinados pela soma de duas principais forças (gradiente de pressão e de
concentração).
Osmose = f (gradiente de pressão + gradiente de concentração)
49
A Fisiologia da Entrada e Saída de Água da Célula
Quando em células vegetais típicas estudamos o transporte de água, podemos ignorar o
potencial gravitacional (considerando que não existe diferença de altura) e o mátrico
(assumindo que as células são diferenciadas com grandes vacúolos). Neste caso, a equação do
potencial hídrico é simplificada:
Ψ w = Ψs + Ψp
Alguns livros também apresentam essa equação da seguinte forma:
Ψw = P – π
em que: P = pressão hidrostática e π = pressão osmótica
OBS: Quando uma solução tem Ψs = - 0,5 MPa a π = 0,5 MPa , ou seja, o potencial
osmótico é negativo e a pressão osmótica é positiva.
O estado hídrico da célula vegetal sofre mudanças constantemente, quando ela se ajusta
seu conteúdo de água às mudanças no ambiente (solo e atmosfera) ou às mudanças inerentes
ao seu próprio desenvolvimento. Essas mudanças dinâmicas no estado hídrico da célula
poderão, inevitavelmente, serem acompanhadas por mudanças no volume do protoplasto bem
como mudanças no Ψw, no Ψs e, especialmente, no Ψp.
O Ψs de células de plantas é devido, principalmente, ao conteúdo de solutos dissolvidos
nos grandes vacúolos centrais. Com exceção de células meristemáticas e outras células
especializadas, os vacúolos das células diferenciadas ocupam de 50 a 80% do volume da
célula, no qual se encontram dissolvidos uma variedade de solutos (íons minerais, açúcares,
pigmentos, etc.). Uma redução no Ψs devido ao acúmulo de solutos, reduz o Ψw interno e
permite a absorção de água pela célula. Essa absorção de água gera uma pressão positiva
exercida contra a parede celular, conhecida como pressão de turgescência (Ψp). Assim,
dependendo do valor do Ψp, a célula poderá estar túrgida (Ψp >0) ou flácida (Ψp = 0).
Uma célula com Ψp = 0 se encontra no ponto conhecido como plasmólise incipiente.
Neste ponto, nenhuma pressão acima da atmosférica é exercida contra a parede celular, porém
o protoplasto fica preso à parede, quando podemos assumir que o volume é igual a 1,0. Nesse
ponto, Ψp = 0 e o Ψw = Ψs
Se uma célula em plasmólise incipiente é colocada em uma solução hipertônica (solução
com Ψs menor que o da célula) ela perderá água para a solução e se tornará plasmolisada, com
volume menor que 1,0. Isto acarreta a contração do sulco vacuolar, diminuindo
consideravelmente o Ψs (e o Ψw, visto que Ψw = Ψs). Por outro lado, se uma célula em
plasmólise incipiente é banhada por uma solução hipotônica (solução com Ψs maior que o da
célula), a célula absorve água do meio, ocorrendo aumento do volume do protoplasto, diluição
do conteúdo vacuolar (aumento do Ψa), e a geração de uma pressão de turgescência. O Ψp
pode, teoricamente, atingir o valor do Ψs, ponto em que o Ψw = 0. Isto, entretanto, não ocorre
normalmente nas plantas, ou seja, em termos de magnitude o Ψs é superior ao Ψp, de modo
que o valor do Ψw é quase sempre negativo.
A questão que surge nesse ponto é: A plasmólise é um fenômeno comum na natureza? A
plasmólise ocorre quando as células são embebidas em uma solução hipertônica. Isso pode
acontecer quando os sais se acumulam abruptamente na zona radicular, em decorrência de
adubações pesadas com KCl em cultivos ou em condições extremas de estresse hídrico ou
50
salino (choque osmótico), como ocorre nas vegetações inundadas pelas águas dos mares. Esse
fenômeno de plasmólise, portanto, é um fenômeno raro.
Na maioria dos casos, as células tanto da raiz quanto da folha não estão imersas em
soluções salinas concentradas. No entanto, elas são constantemente expostas ao déficit de
água que ocorre quando o solo ou o ar vão perdendo umidade com o tempo. Nesse caso,
ocorre um fenômeno conhecido como murcha ou citorrese. Por causa da extrema tensão
superficial, a água nos pequenos poros da parede celular resiste à entrada de ar, à medida que
o solo vai secando, de modo que o protoplasto em colapso permanece em contato com a
parede celular. Isto tende a puxar a parede para dentro e uma substancial pressão negativa
pode se desenvolver. O potencial hídrico da célula murcha torna-se ainda mais negativo, visto
que ele é a soma do Ψs (negativo) e da tensão que foi criada. No entanto, a capacidade de
recuperação das funções biológicas é muito maior para células que sofreram a murcha
(citorrese) do que para células que sofreram plasmólise.
O Processo de Absorção de Água pelas Raízes
A raiz cresce dentro do solo buscando dar estabilidade à parte aérea e, ao mesmo tempo,
buscando água e nutrientes necessários ao desenvolvimento vegetal. Evidente que as últimas
funções são atribuídas às raízes jovens, principalmente nas suas parte apicais. Á medida que
se distancia do ápice, a taxa de absorção de água decresce em virtude da presença de camadas
de materiais hidrofóbicos, as quais dificultam a passagem da água (Tabela 6.1). Entretanto,
em plantas nativas de regiões frias e secas a percentagem de raízes não suberizadas é pequena,
de modo que se pode observar absorção de água em raízes mais velhas (talvez através de
fendas).
O contato entre a superfície das raízes e o solo providencia a área superficial para a
absorção de água, a qual é maximizada pelo crescimento das raízes e dos pêlos radiculares
(microscópicas extensões das células epidérmicas que aumentam grandemente a superfície de
absorção de íons e de água) dentro do solo. O rompimento abrupto desse contato solo-raiz
pode levar a planta a um rápido murchamento, pois a capacidade de absorção de água é
afetada. É por esta razão que plântulas transplantadas precisam ser protegidas da perda de
água nos primeiros dias do transplantio. As novas raízes crescendo re-estabelecem o contato
solo – raiz, e a planta pode melhor resistir ao estresse hídrico.
Tabela 6.1 – Taxa de absorção de água em diferentes posições ao
longo de raízes de pumpkin (dados de Kramer & Boyer, 1995)
Distância a Partir do
Taxa de abosrção de água
Ápice (mm)
(µL h-1)
20
0,80
40
1,20
60
1,40
120
0,20
240
0,18
51
Como já comentamos anteriormente, a água se move no solo primordialmente por fluxo
em massa. No entanto, quando ela atinge a superfície radicular ela deixa de enfrentar a
tortuosidade dos poros do solo, e passa a enfrentar as diferentes camadas de células que
separam a superfície da raiz do tecido condutor (xilema). Devemos inicialmente relembrar
que uma raiz jovem apresenta, em corte transversal, as seguintes partes de fora para dentro:
Epiderme, córtex, endoderme e cilindro central contendo xilema e floema. O transporte de
água no sentido radial pode seguir três vias distintas (Figura 6.2):
-
Via apoplasto – a água move-se continuamente na região das paredes celulares e nos
espaços intercelulares até a endoderme.
Via simplasto – o simplasto consiste de uma rede inteira de citoplasmas de células
interconectados pelos plasmodesmas. Neste caso, a água move-se de célula em célula,
através dos plasmodesmas.
Via transmembrana – neste caso, a água move-se de célula em célula cruzando a
membrana plasmática e podendo cruzar, também, a membrana do vacúolo (tonoplasto). O
transporte de água através das membranas pode ocorrer pela bicamada fosfolipídica ou
através de canais. As proteínas que formam canais para o transporte de água são chamadas
de AQUOPORINAS
Figura 6.2 – Movimento de água nas raízes via apoplasto, simplasto e transmembrana (Taiz &
Zeiger, 1998)
52
Na endoderme, o movimento de água através do apoplasto pode ser obstruído pelas
estrias de Caspary. Estas consistem de deposição de uma substância hidrofóbica, conhecida
como suberina, nas paredes radiais das células da endoderme. Esta suberina age como uma
barreira ao movimento de água e de íons. A entrada de água no cilindro central se dá, então,
via simplasto ou via transmembrana.
Observe que, nesse item, se discutiu apenas as vias anatômicas de absorção de água.
Como veremos nas unidades seguintes, a taxa de absorção de água é definida pela taxa de
transpiração ou pelo acúmulo de solutos no xilema da raiz.
2. TRANSPORTE DE ÁGUA PARA A PARTE AÉREA
O Tecido Condutor
Na maioria das plantas, o xilema constitui o principal local de transporte de água. As
células condutoras do xilema têm uma anatomia especializada que possibilita o transporte de
grande quantidade de água com alta eficiência. Este tecido é constituído de fibras, células do
parênquima e os elementos traqueários. As fibras são células mortas, muito longas, com
parede secundária lignificada e que funcionam como suporte estrutural para a planta. As
células do parênquima, por sua vez, são importantes no armazenamento de reservas nutritivas
e estão relacionadas com a transferência lateral de solutos. Estas células são vivas.
Os elementos traqueários são células longas que estão envolvidos diretamente com o
transporte de água. Estas células são mortas quando funcionais, com paredes secundárias
lignificadas e não apresentam membranas e organelas. Os elementos traqueários do xilema
podem ser de dois tipos: os elementos de vasos são encontrados nas Angiospermas e em um
pequeno grupo de Gimnospermas; já os traqueídeos estão presentes tanto nas Angiospermas
como nas Gimnospermas. As terminações dos elementos de vaso são abertas o que diminui a
resistência ao fluxo de água no xilema. O tecido condutor, portanto, é formado pela conexão
de vários elementos de vasos ou traqueídeos, de modo semelhante a uma instalação
hidráulica.
O movimento de água das raízes para a folha, via xilema, pode ocorrer devido a uma
pressão positiva na base (raiz) ou a uma pressão negativa (tensão) no topo (folha)
Mecanismo de Pressão Radicular (explica a gutação)
Algumas plantas exibem um processo conhecido como pressão radicular. Esta pressão
radicular pode ser entendida como uma pressão hidrostática positiva no xilema. As raízes
absorvem íons da solução do solo diluída e transportam-lhes para dentro do xilema. Os íons
no xilema não podem retornar facilmente para a solução do solo devido à presença das estrias
de Caspary da endoderme e, com isso, os íons se acumulam no xilema. O acúmulo de solutos
no xilema produz um decréscimo no potencial osmótico e conseqüentemente, no potencial
hídrico do xilema. Ocorre, então, o movimento de água da superfície radicular até o xilema da
raiz por diferença de Ψw (movimento radial de água por osmose). A entrada de água, por sua
vez, produz uma pressão positiva no xilema. Esta pressão positiva na raiz provoca a ascensão
da seiva para a parte aérea, via xilema.
A pressão de raiz é mais proeminente em plantas bem irrigadas e sob condições de alta
umidade relativa do ar, quando a transpiração é baixa. Sob condições de alta demanda
evaporativa do ar, quando as taxas de transpiração são altas, a água é tomada tão rapidamente
pelas folhas e perdida para a atmosfera que uma pressão positiva no xilema nunca se
53
desenvolve. Na realidade, o fluxo transpiratório previne, de certo modo, o acúmulo de íons no
xilema da raiz.
Plantas que desenvolvem pressão radicular podem exibir a exsudação de líquido pela
folha, um fenômeno conhecido como gutação. A pressão positiva no xilema provoca
exsudação da seiva através dos hidatódios, estruturas localizadas próximo aos traqueídeos
terminais do feixe na margem das folhas. As gotas de gutação podem ser vistas nos ápices e
margens de folhas, principalmente quando a umidade relativa do ar é alta, tal como ocorre
durante as primeiras horas do dia. Esse processo é mais comum em plantas de baixo porte,
visto que as pressões produzidas não são de grandes magnitudes.
OBS: cuidado para não confundir com Orvalho.
Teoria Tensão-Coesão (explica a transpiração)
Quando as plantas estão transpirando, o fluxo de água do solo para as folhas (Jw) é
proporcional ao gradiente de potencial hídrico (∆Ψw) e inversamente proporcional ao
somatório das resistências (ΣR), como mostrado no esquema semelhante aquele utilizado para
fluxos de corrente na elétrica (Figura 6.3).
Jw = ∆Ψw/ΣR
Figura 6.3 – Diagrama comparando o fluxo de água através do continuum solo-planta
atmosfera com o fluxo de uma corrente elétrica ao longo de um gradiente de potencial e
através de uma série de resistências (Ferreira, 1992).
54
Se nós considerarmos que o fluxo de água é constante, então podemos escrever a equação
anterior para cada etapa do transporte:
Jw = Ψws - Ψwr = Ψwr - Ψwf = Ψwf - Ψwar
Rr
Rx
Rf
Em que: Ψws = potencial hídrico do solo; Ψwr = potencial hídrico da raiz;
Ψwf = potencial hídrico da folha; Ψwar = potencial hídrico da atmosfera; Rr, Rx e Rf
representam as resistências na raiz, no xilema e na folha, respectivamente.
Utilizando-se valores típicos de Ψw para os diversos compartimentos envolvidos (soloraiz, folha e atmosfera), mostrados na figura 6.4, teremos:
Jw = -0,3 – (-0,6) = -0,6 – (-0,8) = -0,8 – (-95,2)
Rr
Rx
Rf
Com esses dados obtemos que:
Rf ≡ 315 x Rr
Rf = 472 x Rx
Figura 6.4 – Contínuo solo-planta-atmosfera, mostrando os valores de Ψw e de seus
componentes em diferentes pontos do sistema (Taiz & Zeiger, 1998)
55
Observamos inicialmente que a resistência da folha é bem maior que as demais
resistências. No entanto, a resistência da folha pode ser subdividida em outras duas:
Rf = Rf1 e Rf2 , sendo:
Rf1 = resistência ao movimento de água dentro da folha (resistência do mesofilo)
Rf2 = Resistência ao movimento da água das superfícies celulares para a atmosfera
exterior (como veremos a Rf2 é a soma da resistência estomática mais a resistência da camada
de ar limítrofe). Nós podemos estimar a importância relativa de Rf1 e Rf2, considerando a
seguinte relação:
Jw = Ψws - Ψwf
= Ψwf - Ψwar
Rr + Rx + Rf1
Rf2
Considerando novamente os valores da figura 8.2, teremos:
Jw = -0,3 - (-0,8)
= -0,8 - (-95,2)
Rr + Rx + Rf1
Rf2
Rf2 = 188 x (Rr + Rx + Rf1)
Portanto, a resistência ao movimento de água das paredes celulares (na folha) para a
atmosfera exterior é bem maior que o somatório das demais resistências. Na realidade, a
maior resistência coincide com a maior diferença de potencial hídrico que existe entre as
paredes das células do mesofilo foliar e o ar exterior (Figura 6.4). Do exposto acima, concluise que o fator limitante para o movimento de água através da planta é a resistência ao
movimento de água das paredes celulares para os espaços intercelulares, câmara subestomática, estômatos e camada de vapor d’água adjacente à folha. Portanto, a transpiração
(perda de água na forma de vapor) deve desempenhar papel fundamental no movimento de
água através do sistema solo-planta-atmosfera.
As idéias expostas acima levaram à teoria de coesão-tensão, proposta originalmente por
Dixon & Joly (1894). De acordo com essa teoria, a evaporação da água das paredes celulares,
devido ao gradiente de Ψw entre a folha e o ar exterior, torna a superfície ar-água curvada,
formando meniscos microscópicos, e a tensão superficial da água produz uma tensão, ou
pressão negativa, no sistema (Figura 6.5). Quanto maior for a retirada de água, menor será o
raio de curvatura do menisco e mais negativa é a pressão (P = - 2T/r). Como conseqüência
disto, as células do mesofilo foliar (principalmente o apoplasto), retiram água do xilema,
deixando-o, então, sob tensão.
56
Figura 6.5 – Diagrama ilustrando a formação de tensão superficial pela evaporação da
água e conseqüente redução no raio de curvatura do menisco (Hopkins, 2000)
A tensão no xilema é transmitida até as raízes devido às propriedades de coesão da
água em vasos de dimensões capilares. Este Ψw bastante negativo é transferido, finalmente,
para as raízes e solo, fazendo com que as raízes absorvam mais água.
A existência de uma pressão negativa no xilema tem sido confirmada
experimentalmente. As paredes lignificadas dos elementos do xilema parecem resistir a
esta tensão. No entanto, a quebra da coluna de água e, conseqüente formação de bolhas,
têm sido verificadas em plantas, um fenômeno conhecido como cavitação. Esse fenômeno
ocorre principalmente nas horas de maior taxa de transpiração e é mais comum em plantas
de grande porte. Porém, os poros (pequenos) das placas de perfuração que une dois
elementos de vaso, parecem prevenir a expansão das bolhas de ar. As bolhas podem ser
eliminadas, também, durante a noite, quando a transpiração é baixa e ocorre a re-hidrataçao
dos tecidos.
57
UNIDADE 7. TRANSPIRAÇÃO, EVAPOTRANSPIRAÇÃO, PRODUTIVIDADE E
EFICIÊNCIA NO USO DA ÁGUA
1. CONCEITOS E FUNÇÕES
Transpiração
A trajetória final do movimento de água através da folha denomina-se transpiração, a
qual pode ser definida, também, como a evaporação da água das superfícies celulares para os
espaços intercelulares e destes para a atmosfera (Figura 7.1).
Figura 7.1 – A estrutura da folha mostrando a presença da cutícula e de estômatos na
superfície abaxial (Taiz & Zeiger, 1998).
A transpiração pode ocorrer através dos estômatos e da cutícula, porém estima-se que
somente cerca de 5% da perda de água da folha ocorre através da cutícula. O restante da perda
de água ocorre por difusão através dos poros do aparelho estomatal, os quais são geralmente
mais abundantes na superfície abaxial (inferior) da folha. A cutícula que cobre a superfície
exposta da planta serve como uma barreira efetiva para evitar a perda de água e, assim,
protege a planta da dessecação (Figura 7.1). Os estômatos, por sua vez, acoplam a absorção de
CO2 (fotossíntese) com a perda de água na forma de vapor (transpiração). A perda de água,
58
entretanto, torna-se mais expressiva em função do maior gradiente de vapor d’água entre a
folha e a atmosfera externa.
O processo de transpiração contribui para o resfriamento das folhas e para a absorção e
transporte de água e minerais para a parte aérea. A evaporação de um grama de água da folha
absorve de 2,4 a 2,5 KJ de energia da folha e do ambiente. Assim, a transpiração contribui
para reduzir a temperatura da folha (resfriar), o que é fundamental durante o dia, quando folha
está absorvendo grande quantidade de energia do sol. Alguns autores acreditam, no entanto,
que a transpiração poderia ser simplesmente um mal necessário. Esses autores defendem que
os estômatos foram feitos para captar CO2 e não para perder água para a atmosfera.
Evapotranspiração
Evapotranspiração Potencial (ETP): a quantidade de água utilizada por uma extensa
área vegetada, em crescimento ativo, sob condições ótimas de umidade do solo. A
evapotranspiração potencial seria a altura pluviométrica ideal para atender as necessidades de
água de uma superfície vegetada, não trazendo nem excedentes, nem deficiência de umidade
do solo, durante o ano.
A evapotranspiração de Referência (ETo): foi definida, por Doorenbos & Pruitt, em
1977, como a água utilizada por uma extensa superfície de grama, em crescimento ativo, com
altura de 0,08 a 0,15 m, cobrindo totalmente o solo e sem deficiência de água.
Jensen, em 1973, propôs como cultura referencial à alfafa e definiu como
evapotranspiração de referência a que se verifica em uma área sem deficiência hídrica, com
bordadura mínima de 100 m, sendo que a alfafa deve apresentar um porte de 0,30 a 0,50 m de
altura.
Evapotranspiração da Cultura (ETc): é a quantidade de água utilizada por uma
cultura agronômica, livre de doenças, desenvolvendo-se em uma área cultivada de um ou mais
hectares, sob condições otimizadas de solo, incluindo água e fertilidade. Muitos pesquisadores
denominam esta definição da ETc de ETm, evapotranspiração máxima da cultura.
Evapotranspiração Real (ETR): A evapotranspiração real ou atual (ETR) é aquela
que ocorre em uma superfície vegetada, independentemente de sua área e das condições de
umidade do solo. Em outras palavras é a perca de água que uma cultura sofre em um
momento qualquer.
Caso a cultura esteja sob as condições preconizadas para a ETc, a ETR é a própria ETc. À
medida que ocorre restrição de água, a ETR diminui ocorrendo redução da transpiração.
A Evapotranspiração de Oásis (ETO): é a quantidade de água utilizada por uma área
vegetada, irrigada adequadamente, circundada por uma extensa área seca de onde provém
adicional de energia por advecção (vento seco). Em função da advecção, a ETO é maior do
que a ETP.
Em uma grande área úmida, a evapotranspiração de Oásis (ETO, área irrigada)
equivale a evapotranspiração real (ETR, área de sequeiro) e a evapotranspiração potencial
(ETP, extensa área úmida). Quando a disponibilidade hídrica regional vai diminuindo, não
ocorre mais a ETP e a ETR vai se reduzindo. Já na área irrigada, a ETO vai aumentando à
59
medida que a disponibilidade hídrica regional diminui. Em uma situação extrema, em que o
solo está com baixa pequena disponibilidade hídrica a ETO pode apresentar valor
correspondente a duas vezes o valor da evapotranspiração preconizada para a condição
potencial.
2. A FORÇA MOTRIZ E AS RESISTÊNCIAS AO FLUXO TRANSPIRATÓRIO
A taxa de transpiração depende de dois principais fatores: a diferença na concentração
de vapor entre a folha e o ar exterior; e a resistência difusional (Rf2 ou simplesmente r). Esta
resistência pode ser dividida em resistência estomática (rs) e resistência devido á camada de ar
sem turbulência na superfície da folha, a conhecida camada de ar limítrofe (rb). Assim, a taxa
de transpiração (E), em mol m-2 s-1, é relacionada à diferença de concentração de vapor
(mol m-3) e às resistências ao fluxo de vapor (s m-1), pela seguinte equação:
E = (Cwv folha - Cwv ar)/(rs + rb)
A força determinante da perda de água por transpiração é a diferença na concentração
de vapor entre a folha e o ar (Cwv folha - Cwv ar). Em muitos casos, utiliza-se a pressão de
vapor medida em quilopascal (kpa), a qual é proporcional à concentração de vapor d’água:
E = (es - ea)/(rs + rb)
Essa diferença de pressão de vapor (es – ea) é chamada de déficit de pressão de vapor
d’água (DPV). A concentração de vapor d’água (Cwv), a pressão de vapor d’água (e), a
umidade relativa (RH) e o potencial hídrico estão intimamente relacionados (tabela 7.1).
A concentração de vapor d’água no ar é facilmente mensurável, porém a da folha é bem
mais difícil. Esta última pode ser estimada, assumindo que o potencial hídrico do ar dentro da
folha está em equilíbrio com o potencial hídrico das superfícies das paredes celulares, de onde
a água está evaporando.
A temperatura do ar afeta consideravelmente a concentração de vapor d’água na
saturação. A temperatura tende a aumentar o gradiente de pressão de vapor entre a folha e o ar
exterior e, conseqüentemente, a taxa de transpiração. Em geral, plantas bem irrigadas
apresentam maiores taxas de transpiração nas horas mais quentes do dia, quando o déficit de
pressão de vapor (DPV) é elevado.
O segundo fator que controla a perda de água por transpiração é formado pelas
resistências ao fluxo de vapor. A primeira, e mais importante, é a resistência associada à
difusão através dos estômatos, a resistência estomática (rs). A resistência estomática indica o
grau de abertura dos estômatos, sendo que quanto maior a resistência estomática, menor o
grau de abertura. Em muitos livros é comum se observar o termo condutância estomática (gs),
sendo esta exatamente o inverso da resistência.
A segunda resistência está associada a uma camada de ar saturado e não sujeito a
turbulências que surge na interface da folha com o ar. Esta camada é conhecida como camada
limítrofe e, por conseguinte, diz-se a resistência da camada de ar limítrofe (rb). A espessura
dessa camada de ar limítrofe é definida, principalmente, pelo tamanho da folha e pela
60
velocidade do vento. Ela aumenta com o aumento do tamanho da folha e diminui quando a
velocidade do vento aumenta. A presença de pelos nas folhas diminui o efeito do vento sobre
a camada de ar limítrofe, favorecendo a sua manutenção e, conseqüentemente, a ocorrência de
menores taxas de transpiração.
Tabela 7.1 – Relação entre a concentração de vapor d’água (Cwv), a pressão de vapor
d’água (e), a umidade relativa (RH) e o potencial hídrico (Taiz & Zeiger, 1998)
Cwv
e
-3
1
RH/100
Ψw
(MPa)1
(mol m )
(kPa)
0,961
2,34
1,00
0,00
0,957
2,33
0,996
-0,54
0,951
2,32
0,990
-1,36
0,923
2,25
0,960
-5,51
0,865
2,11
0,900
-14,20
0,480
1,17
0,500
-93,60
0
0
0
-infinito
O ψw foi calculado de acordo com a equação: Ψw = RT ln (ea/es)
Vw
3. FISIOLOGIA DOS ESTÔMATOS
Distribuição e Estrutura dos Estômatos
Duas células-guardas, células subsidiárias e o poro formam coletivamente o complexo
estomático (Figura 7.2).
As células-guarda são células epidérmicas que mostram organização especializada da
estrutura da parede celular, as quais são importantes no mecanismo de abertura e fechamento
estomático. Por exemplo, as extremidades das células-guarda de gramíneas possuem paredes
delgadas, enquanto, a região mediana possui parede bem espessa. Em adição, as célulasguarda de mono e dicotiledôneas possuem as chamadas micelações radiais (cintas de
microfibrilas de celulose que envolvem as células-guardas). Estas células são menores e,
também, são mais ricas em organelas (cloroplastos, retículo endoplasmático, mitocôndrias,
etc.), do que as demais células da epiderme. Todas estas características parecem contribuir
para o movimento estomático.
61
Figura 7.2 – Um diagrama mostrando dois tipos de células-guarda (Taiz & Zeiger, 1998)
Os estômatos podem ser encontrados na epiderme de todos os órgãos da parte aérea
(caules herbáceos, pecíolos, flores, alguns frutos, folhas), porém, são muito mais abundantes
nas folhas, órgão especializado nas trocas gasosas. Dependendo da espécie vegetal, os
estômatos podem estar localizados na superfície superior (adaxial), na superfície inferior
(abaxial) ou nas duas superfícies foliares (Tabela 7.2). As folhas que apresentam a quase
totalidade dos seus estômatos na superfície adaxial são ditas epiestomáticas; as folhas que
apresentam estômatos bem distribuídos nas duas superfícies são ditas anfiestomáticas; e
aquelas que possuem estômatos principalmente na superfície abaxial são ditas
62
hipoestomáticas. Em geral, as plantas de regiões de climas áridos e semi-áridos e as espécies
de grande porte tendem a ter folhas hipoestomáticas, característica que certamente contribui
ou contribuiu para a adaptação da espécie a esses ambientes. Deve-se ter em mente, no
entanto, que as plantas desenvolveram inúmeros outros mecanismos de adaptação à falta de
água.
Tabela 7.2 – Frequência de estômatos nas superfícies superior (adaxial) e inferior (abaxial)
da folha (Hopkins, 2000)
Gêneros
Número de Estômatos por mm2
Superfície Superior
Superfície Inferior
Allium (cebola)
175
175
Hordeum (cevada)
70
85
Trticum (trigo)
50
40
Helianthus (girasol)
120
175
Medicago (alfafa)
169
188
Pelargonium (gerânio)
29
179
Aesculus (castanha-daíndia)
-
210
Quercus (carvalho)
-
340
Tilia
-
370
Monocotiledôneas
Dicotiledôneas Herbáceas
Dicotiledôneas Arbóreas
Mecanismos de Abertura e Fechamento Estomático
•
Segue abaixo as etapas observadas na quase totalidade das plantas:
Luz → Fotossíntese → Queda na concentração interna de CO2 → Abertura Estomática
•
Nas plantas CAM:
No escuro → Fixação do CO2 → Queda na concentração → Abertura Estomática
Em malato
interna de CO2
63
Na Luz → Descarboxilaçao → Aumento na concentração → Fechamento Estomática
Do malato
interna de CO2
Nas plantas CAM os estômatos abrem durante a noite e no final do dia. A abertura no
final do dia deve-se, provavelmente, à diminuição na concentração interna de CO2, devido ao
processo fotossintético ter consumido o CO2 incorporado durante a noite. Nas demais plantas,
os estômatos permanecem fechados durante a noite, quando as plantas apenas respiram. Essas
observações parecem indicar que a abertura estomatal parece depender da concentração
interna de CO2, sugerindo que os estômatos foram desenvolvidos realmente para a captação
de CO2 para a fotossíntese.
O mecanismo fisiológico que provoca a abertura estomática está ligado diretamente à
absorção de água pelas células-guarda. Quando as folhas são expostas à luz ou ao ar livre de
CO2, ocorre um aumento significativo na concentração de K+ nestas células. Paralelamente,
outros solutos, inclusive solutos orgânicos sintetizados nestas células, também se acumulam.
Isto causa um decréscimo no Ψs e, conseqüentemente no Ψw . Com isso, a água move-se para
dentro das células-guarda provocando aumento na sua turgescência. O aumento na
turgescência, associado ao espessamento diferenciado das paredes celulares e ao arranjo radial
das microfibrilas de celulose, leva à abertura estomática.
A absorção e perda de água pelas células guardas mudam sua turgescência e modulam a
abertura e fechamento estomático. Como as células guardas são expostas à atmosfera, elas
podem perder água diretamente por evaporação, levando a perda de turgescência e o
fechamento estomático. Esse mecanismo é conhecido como fechamento hidropassivo e corre
quando a umidade do ar é muito baixa e a perda de água por evaporação é muito alta.
O segundo mecanismo, conhecido como fechamento hidroativo, promove o
fechamento estomático quando ocorre deficiência hídrica no solo e ele depende de processos
metabólicos nas células-guarda. Este mecanismo é promovido pela redução do Ψw foliar
(mesofilo) e parece ser regulado pelo hormônio acido abscisico (ABA). O aumento nos níveis
de ABA nas células guardas, induzido pelo estresse hídrico, induz, através de vias de
transdução de sinais, o efluxo (saída) de K+ e de outros íons das células guardas, produzindo
um aumento no Ψs e, conseqüentemente, no Ψw destas células. Com isso, as células guardas
perdem água para as células vizinhas, levando a um decréscimo na sua turgescência e,
finalmente, o estômato fecha.
4. COMPORTAMENTO ESTOMÁTICO E EFICIÊNCIA NO USO DA ÁGUA
As células guardas funcionam como uma válvula hidráulica multisensorial. Fatores
ambientais, tais como, intensidade e qualidade de luz, temperatura, velocidade do vento,
umidade do solo, umidade relativa do ar e concentração interna de CO2, são sentidos por estas
células e, estes sinais, são integrados em uma resposta estomática bem definida. Como já
mencionado anteriormente, os diversos fatores podem afetar a força motriz, ou seja, o déficit
de pressão de vapor entre a folha e a atmosfera externa, e as resistências ao fluxo
transpiratório.
A figura 7.3 resume os efeitos dos fatores ambientais sobre a abertura estomática. Notase na figura 7.3 (parte superior) que os estômatos permanecem fechados durante a noite,
64
porém a baixa concentração de CO2 (ar livre de CO2) provoca a abertura estomática mesmo
no escuro, em plantas bem irrigadas. Durante o dia os estômatos abrem, sendo que o grau de
abertura será maior quanto maior a intensidade luminosa. No entanto, temperaturas muito
elevadas, aumento na concentração de CO2 e déficit de água podem reduzir o grau de abertura
estomática.
Na figura 7.3 (parte inferior) pode-se observar o comportamento estomático de
diferentes espécies ao longo de 24 horas. Uma planta típica bem irrigada, em um dia de sol
intenso, abre os seus estômatos no início do período de luz e apresentam uma curva
característica com máximos nas horas de maior demanda evaporativa do ar (maior DPV). Nos
dias nublados a curva apresenta o mesmo comportamento, porém, o grau de abertura
estomática é consideravelmente maior, e as plantas apresentam, conseqüentemente, menores
taxas de transpiração e de fotossíntese. Algumas plantas podem apresentar uma queda no grau
de abertura estomática ao meio dia, para evitar o dessecamento excessivo devido à alta
demanda evaporativa do ar. Quando as plantas estão sob deficiência de água, ou seja, o
suprimento de água no solo é baixo, os estômatos somente abrem nas horas mais amenas do
dia. Por outro lado, as plantas CAM (suculentas) abrem seus estômatos à noite e nas horas
mais amenas do dia, de modo que elas conseguem sobreviver em ambientes áridos e semiáridos.
Na maioria das plantas, os estômatos se abrem durante o dia quando a absorção de CO2
é necessária para a fotossíntese e, paralelamente, a perda de água por transpiração é elevada.
Particularmente nas plantas conhecidas como C3 (a grande maioria das espécies vegetais), o
grau de abertura é elevado, de modo que a captação de CO2 para o processo fotossintético é
acompanhada por grande perda de água. No entanto, um número considerável de espécies
vegetais desenvolveu mecanismos que promovem a concentração de CO2 (plantas C4, como
milho, sorgo e cana-de-açúcar), que permite o funcionamento normal da fotossíntese com
uma menor condutância estomática (menor abertura) e, portanto, menor perda de água. Já as
plantas CAM (plantas que apresentam o metabolismo ácido das crassuláceas, como as
próprias Crassuláceas e as Cactáceas), abrem os estômatos e aprisionam o CO2 durante a
noite, prevenindo as perdas de água durante o dia, quando os estômatos permanecem
fechados.
65
Figura 7.3 – Diagrama resumido das respostas dos estômatos a alguns fatores ambientais
(Salisbury & Ross, 1991)
A comparação das plantas em relação às perdas de água via transpiração pode ser obtida
calculando-se a razão de transpiração (RT) ou uso eficiente da água, dada por:
RT = g de água perdida/g de matéria seca produzida
As plantas C3, exemplos são o feijão, a soja, arroz, praticamente todas as árvores, etc.,
são as menos eficientes, com valores de RT variando de 450 a 950; nas plantas C4 a RT varia
de 250 a 350 e nas plantas CAM de 18 a 125.
66
A eficiência no uso da água também pode ser expressa das seguintes formas:
- Eficiência no uso da água (WUE)
WUE = g de matéria seca produzida/g de água perdida
- Eficiência momentânea no uso da água (MWUE)
WUE = taxa fotossintética/taxa de transpiração
- Eficiência intrínseca no uso da água
IWUE = taxa de fotossíntese/condutância estomática
A discriminação do isótopo de carbono 13 em relação ao carbono 12 também apresentação
relção com a eficiência no uso da água. Detalhes em: FARQUHAR, G.D.; RICHARDS, R.A.
Isotopic composition of plantcarbon correlates with water-use efficiency of wheat genotypes.
Field Crops, v.11, p.539-552, 1984.
5. QUANTIFICAÇÃO DA TRANSPIRAÇÃO E EVAPOTRANSPIRAÇÃO
Taxa de Transpiração com Porômetros e IRGAS
Os equipamentos conhecidos como porômetros são utilizados para mensuração das taxas
de transpiração, considerando que a mesma é influenciada basicamente pelas modificações na
abertura estomática. Esses equipamentos possuem sensores para captar valores de temperatura
do ar, temperatura da folha, radiação e umidade atmosférica. Eles também fornecem medidas
das taxas de transpiração e de resistência ou condutância estomática.
Os porômetros de umidade constante são equipamentos ventilados, cujo princípio de
funcionamento é o de manter a umidade do interior da câmara, onde a folha é colocada,
constante, pela injeção de ar seco, o qual contrabalança o aumento da umidade provocado
pela transpiração da folha. A resistência estomática é calculada usando os valores da umidade
reinante dentro da câmara, fluxo de ar seco necessário para manter a umidade constante no
interior da câmara, a área foliar usada na medição, e as temperaturas no interior da câmara e
da superfície da folha.
Os porômetros são equipamentos portáteis que permitem obtenção de resultados
momentâneos em folhas, apresentando bons indicadores do estado hídrico da planta. Em
geral, apresentam custos elevados e são utilizados principalmente na realização de pesquisas.
Os equipamentos conhecidos como IRGA (Infra Red Gás Analyser) são os mais utilizados
atualmente para a medição das trocas gasosas de plantas. Eles permitem a medição das taxas
de fotossíntese, transpiração, condutância estomática, temperatura foliar, concentrações
interna e externa de CO2, etc. São equipamentos transportáveis, que podem ser utilizado
tanto no campo como no laboratório. Os modelos mais recentes apresentam tecnologia, sendo
67
que informações sobre diversos modelos podem ser vistos nos sites dos principais fabricantes
(Li-COR, ADC, Campbell Scientific).
Fluxos de Seiva
O fluxo de seiva no xilema é diretamente associado à taxa de transpiração das plantas, e
pode ser medido por métodos termométricos. Segue abaixo o método de Granier utilizado
para espécies lenhosas do Cerrado (Rev. Bras. Fisiol. Veg., 12:119-134, 2000).
O dispositivo utilizado para medir o fluxo de seiva consta de duas sondas de 2 mm de
diâmetro e 2 cm de comprimento, que são inseridas no xilema de árvores, separadas por uma
distância vertical de 15 cm. Cada sonda contem um termopar de cobre-constantã no centro de
uma agulha hipodérmica. Além do termopar, a sonda superior possui uma resistência elétrica
alimentada por uma bateria de 12 volts, a qual provoca um aumento de temperatura no local
de inserção da sonda. Desta maneira se estabelece uma diferença de temperatura entre a sonda
superior e a inferior, que é função do fluxo de seiva pelos vasos intactos. Não havendo fluxo,
a diferença entre as sondas é máxima e, se houver fluxo o calor é dissipado por convecção e a
diferença de temperatura entre as sondas diminui.
A densidade de fluxo “u” pode ser calculada pela seguinte relação empírica determinada
para várias espécies, em m s-1:
u = 119 x 10-2 x K1,23
O valor de K é estimado pela seguinte equação:
K = (∆Tmax – ∆T)/ ∆T
∆Tmax e ∆T representam as diferenças de temperatura quando o fluxo é nulo e maior que
zero, respectivamente.
O fluxo (F) em litros por hora, foi calculado multiplicando-se a densidade de fluxo pela área
do xilema ativo (Sa), medida na altura da sonda superior.
F = u x Sa
Medição da Evapotranspiração
A evapotranspiração pode ser obtida através de métodos diretos (lisímetros) ou
indiretos (equações com uso de dados meteorológicos). A utilização de lisímetros ocorre
normalmente em condições experimentais, pois a sua medição requer instrumental
meteorológico caro e de difícil manuseio. Os instrumentais mais utilizados na medição da
evapotranspiração são os lisímetros: equipamentos constituídos de uma caixa impermeável,
preenchida com solo, assemelhando-se ao máximo possível às camadas externas de solo, e
localizados de maneira a representar o ambiente observado.
Os lisímetros podem apresentar diversos formatos e tamanhos, e são classificados de
acordo com o modo de medição do total evapotranspirado em: de pesagem, de drenagem, de
lençol freático de nível constante e de flutuação. Quando adequadamente preenchidos, os
lisímetros apresentam valores de evapotranspiração representativos da área circundante.
68
Lisímetro de pesagem.
O lisímetro de pesagem é constituído de uma caixa impermeável, preenchida com
solo, sob a qual é instalada uma balança ou uma célula de carga, para medir a sua variação de
peso. A conexão do lisímetro de pesagem, através da célula de carga ou da balança, a um
sistema de aquisição de dados possibilita a observação da variação de peso do mesmo durante
o período desejado.
Após a confecção e preenchimento do lisímetro, deve-se proceder a sua calibração
através da adição de pesos conhecidos. Em seguida, deve-se estimar o seu coeficiente de
calibração através da regressão originária das variações: do peso real e do peso registrado no
lisímetro. O total evapotranspirado corresponde à diferença de peso entre dois dias seguidos
multiplicada pelo coeficiente de calibração. Para áreas do lisímetro diferentes de 1,0 m2 faz-se
a devida correção, afim de calcular o total evapotranspirado. Em seguida, adiciona-se a
altura(s) de precipitação(ões) que possam ter ocorrido no período analisado.
Lisímetro de drenagem.
Os lisímetros de drenagem são, normalmente, constituídos de grandes caixas com
paredes impermeáveis enterradas até o nível do solo, plantados com vegetação idêntica à do
terreno circundante, tendo no fundo da caixa um dreno, conectado a um vaso, no qual o
excesso de água percolado é captado e medido. O solo deve ser mantido próximo a
capacidade de campo, através de aplicação artificial de água, para não mascarar os resultados
obtidos e possibilitar a percolação.
O total evapotranspirado, em um período, corresponde à diferença entre o volume de
água colocado e o volume coletado, dividido pela área do lisímetro. Os lisímetros de
drenagem são recomendados para medir a evapotranspiração em períodos maiores que um
dia, como por exemplo: de 5 em 5 dias, pois em períodos menores, a percolação pode não se
efetuar adequadamente, alterando os resultados a serem obtidos. Calcula-se a
evapotranspiração média diária dividindo-se o total evapotranspirado no período pelo número
de dias do mesmo.
69
UNIDADE 8 – DÉFICIT HÍDRICO E CRESCIMENTO VEGETAL I: MECANISMOS
FISIOLÓGICOS, PROCESSOS E FENOLOGIA
1. DÉFICIT HÍDRICO DIÁRIO: uma condição normal das plantas
A aquisição de água pela planta depende de inúmeros fatores referentes à planta, à
atmosfera e ao solo. Na realidade, em qualquer lugar que as plantas cresçam, elas estarão
sujeitas às condições de múltiplos estresses, os quais limitarão seu desenvolvimento e suas
chances de sobrevivência. Nos cultivos agrícolas e nos ambientes naturais, as plantas estão
constantemente expostas a diferentes fatores abióticos e bióticos, os quais podem, sob
determinadas circunstâncias, produzir estresses com graus suaves, moderados ou severos.
Dentre esses fatores, a deficiência hídrica e a salinidade do solo ocupam lugar de destaque,
particularmente nas condições semi-áridas.
Na natureza ocorrem flutuações diárias no estado interno de água das plantas. Isto
acontece mesmo quando as plantas estão com suas raízes mergulhadas em um solo com
bastante umidade. Em 1937, Paul J. Kramer demonstrou o que acabamos de afirmar. Durante
o dia, embora a taxa de absorção de água seja alta ela é menor que a taxa de transpiração, ou
seja, a planta experimenta um déficit hídrico durante o dia (Figura 8.1). Isto indica, também,
que a alta taxa de transpiração é a responsável pela absorção de água durante o dia, como já
discutimos anteriormente. Durante a noite a planta praticamente não transpira e a taxa de
absorção de água, embora seja pequena, mantém-se maior que a transpiração, promovendo a
re-hidratação dos tecidos. Isto é aparentemente confirmado por observações que mostram
variações no conteúdo de água de caules, folhas e raízes, sendo os menores valores obtidos
nas horas mais quentes e os maiores durante a noite e início do dia. Esse déficit hídrico diário
pode não comprometer o crescimento da planta.
Figura 8.1 – Absorção e transpiração de quatro diferentes espécies durante o dia e a noite
70
Quando as plantas não recebem água em dias consecutivos elas passam a sofrer um
déficit que pode comprometer seu desenvolvimento e produtividade. A Figura 8.2 mostra
esse relacionamento, sendo que o rendimento da cultura decresce a medida que o consumo
real de água também decresce.
Figura 8.2 – Relacionamento geral entre o rendimento de uma cultura e a
disponibilidade hídrica no solo (Kirkham, 2005)
71
2. CARACTERIZAÇÃO E OCORRÊNCIA DA SECA
Um solo saturado não é adequado para o crescimento das plantas, pois pode afetar a
disponibilidade de oxigênio para a respiração das células das raízes. À medida que o solo vai
secando ele atinge inicialmente a capacidade de campo, a constante que representa o conteúdo
de água que o solo retém contra a ação da gravidade. Nesse ponto, podemos assumir que a
água fica retida nos microporos e o ar fica nas bolhas do volume do solo ocupado pelos
macroporos. Para a maioria dos solos, a tensão de água no solo na capacidade de campo varia
de –0,01 a –0,03 MPa. À medida que o solo vai secando uma tensão (potencial mátrico) de
maior magnitude pode se desenvolver, ficando a água mais fortemente retida. O estresse
hídrico (seca) é caracterizado, portanto, pela redução no componente mátrico do potencial
hídrico do solo, a qual aumenta as dificuldades da planta para retirar água do solo.
Como a água é o constituinte mais abundante no protoplasma, executando inúmeras
funções vitais, sua falta ou deficiência limita o crescimento e inúmeros processos fisiológicos,
reduzindo de maneira drástica a produtividade agrícola e a produtividade de ecossistemas
naturais. Por exemplo, em cultivos de sequeiro em regiões áridas e semi-áridas é comum a
ocorrência de estresses moderados e severos, os quais acarretam reduções consideráveis na
produção agrícola. O grau de redução na produtividade dependerá do nível de redução do
potencial hídrico do solo, da tolerância da espécie ou da variedade, do estádio de
desenvolvimento da cultura, dentre outros fatores. É importante destacar que as plantas não
estão completamente livres de estresse hídrico em cultivos irrigados. Nestes casos, o estresse
é geralmente suave e pode ocorrer no final do intervalo de irrigação em períodos de elevada
demanda evaporativa do ar. Também, não podemos esquecer que durante as horas de maior
demanda evaporativa do ar podemos observar um déficit hídrico nas plantas, quando a
transpiração nas folhas excede em muito a absorção de água pelas raízes.
3. MECANISMOS DE RESISTÊNCIA À SECA
Existem, basicamente, três mecanismos adaptativos de resistência à seca (Tabela 8.1):
fuga ou escape à seca (fuga ou escape do fator de estresse), adiamento da desidratação dos
tecidos (essas plantas evitam ou retardam a desidratação dos tecidos) e tolerância à
desidratação (tolerância protoplasmática a baixos níveis de potencial hídrico nos tecidos).
As espécies que fogem ou escapam da seca possuem a habilidade de completar seu ciclo
vital antes que os tecidos atinjam um déficit hídrico de tal magnitude que possa afetar seu
desenvolvimento normal. Nas comunidades encontradas nos desertos e em algumas regiões
semi-áridas, existem várias espécies, conhecidas como efêmeras, que com o advento das
chuvas, germinam, crescem, florescem e produzem sementes rapidamente, de modo que
conseguem completar todo seu desenvolvimento fenológico antes que o teor de umidade do
solo caia a níveis que possam causar-lhes danos. Algumas destas efêmeras conseguem
produzir flores com um mínimo de desenvolvimento vegetativo. Quando chove pouco, elas
produzem poucas folhas, um número reduzido de flores e de sementes; mas se a
disponibilidade de água no solo é grande elas apresentam vigoroso crescimento vegetativo e
produzem muitas flores e sementes. A esta versatilidade de desenvolvimento deu-se a
denominação de plasticidade de desenvolvimento.
72
Tabela 8.1 – Mecanismos adaptativos de resistência à seca1
MECANISMOS
FUGA OU ESCAPE À SECA
Rápido Desenvolvimento Fenológico
Plasticidade de Desenvolvimento
ADIAMENTO OU RETARDAMENTO DA DESIDRATAÇÃO
Manutenção da Absorção de Água
Aumento da profundidade do sistema radicular
Aumento da condutância do sistema radicular
Ajustamento osmótico
Redução da Perda de Água
Queda de folhas
Redução da área foliar (os espinhos de cactáceas)
Aumento da resistência estomatal e cuticular
Redução na radiação absorvida pelas folhas
Metabolismo ácido das crassuláceas (CAM)
Aumento no Módulo de Elasticidade da Parede Celular
TOLERANCIA À DESIDRATAÇÃO
1
Turner, N.C. Advances in Agronomy, 39:1-51, 1986, citado por Prisco (1990).
Algumas espécies de plantas cultivadas, que possuem crescimento indeterminado, como
o feijão-de-corda e o sorgo (perfilha), podem apresentar um mecanismo de resistência à seca
que muito se assemelha ao de plasticidade de desenvolvimento. Essas espécies, no entanto,
apresentam outros mecanismos que retardam a desidratação dos tecidos, tais como,
fechamento estomático, queda de folhas, enrolamento de folhas (em sorgo), etc., e, portanto,
não devem ser vistas como espécies que escapam à seca.
Algumas palmeiras que crescem nos “oásis”, onde suas raízes alcançam o lençol de
água, ou outras plantas tais como mesquita (Prosopis glandulosa) e alfafa (Medicago sativa)
que estendem suas raízes em profundidades de 7 a 10 metros, nunca são submetidas a
potenciais hídricos muito negativos. Estas plantas adiam ou evitam a desidratação dos tecidos
mantendo a absorção de água. Evidente que existe um limite para esse mecanismo. Por outro
lado, plantas como as cactáceas apresentam taxas extremamente baixas de perda de água,
evitando que seus tecidos sejam submetidos a baixos valores de potencial hídrico. Estas
plantas apresentam características morfológicas (como a presença de espinhos) e fisiológicas
(como o metabolismo CAM, suculência, etc.), que garantem a sobrevivência das espécies em
condições de aridez e semi-aridez.
73
O mais impressionante mecanismo de resistência à seca é o encontrado nas plantas que
toleram a seca, que são referidas como euxerófitas. Tais plantas exibem tolerância à
desidratação. Por exemplo, o cresoto bush (Larrea divaricata), um arbusto encontrado nos
desertos das Américas do Norte e do Sul, pode reduzir o seu conteúdo de água para valores de
cerca de 30% do peso fresco, com as folhas permanecendo vivas. Para se ter uma idéia de
comparação, valores de 50 a 75 % são letais para a maioria das plantas.
4. REAÇÕES DAS PLANTAS AO ESTRESSE HÍDRICO
a) Redução da área foliar
A expansão celular é um processo que depende do potencial de turgescência e é
extremamente sensível ao déficit hídrico. A expansão celular pode ser descrita pela
seguinte relação:
GR = m (Ψp – Y)
Em que, GR = taxa de crescimento (growth rate), m é a extensibilidade da parede, Ψp =
potencial de turgescência e Y = pressão limite. Esta equação mostra que um decréscimo na
turgescência causa um decréscimo na taxa de crescimento. Em folhas intactas, o estresse
hídrico não reduz apenas a turgescência mais também pode decrescer m e aumentar Y. Em
plantas não estressadas, a extensibilidade da parede (m) é normalmente maior quando a
solução na região da parede é ligeiramente ácida. O estresse decresce m, em parte, por que
inibe o transporte de prótons sobre a membrana celular, aumentando o pH da parede celular.
Os efeitos do estresse sobre Y são bem menos entendidos, porém envolvem,
presumivelmente, mudanças complexas na estrutura da parede.
A inibição da expansão celular resulta na inibição da expansão foliar, particularmente
por que a expansão foliar depende principalmente da expansão de suas células. A redução na
área foliar resulta em menores perdas de água por transpiração, podendo ser considerada a
primeira linha de defesa da planta contra a seca.
b) Fechamento estomático
A absorção e perda de água pelas células guardas mudam sua turgescência e modulam a
abertura e fechamento estomático e esses processos parecem ser controlados pelo hormônio
ácido abscísico. Em algumas plantas tem sido observado que os níveis de ABA nas folhas
aumentam até 100 vezes quando as plantas são expostas a estresse hídrico e, paralelamente, se
observa aumento na resistência estomática. Os níveis de ABA e a resistência estomática
retornam para valores normais quando a irrigação é retomada.
c) Redução da taxa fotossintética
A fotossíntese pode ser afetada pelo estresse hídrico de duas maneiras:
• Pelo fechamento estomático, reduzindo a captação de CO2 da atmosfera (limitações
estomáticas)
• Pelos efeitos diretos do baixo Ψw celular sobre a integridade da maquinaria
fotossintética (limitações não estomáticas).
74
As limitações estomáticas podem ser sobrepujadas pelo aumento da concentração de
CO2, porém os efeitos diretos do estresse hídrico sobre o as membranas dos tilacóides
(limitações não estomáticas) podem não ser sobrepujados pelo aumento na concentração desse
gás.
Como observamos na figura 8.2, a expansão foliar é bem mais sensível ao estresse
hídrico do que a taxa fotossintética. Assim, na maioria dos casos, pode se observar uma
redução na capacidade produtiva da planta mais pela redução da área foliar do que na taxa de
fotossíntese.
Figura 8.2 – Efeito do estresse hídrico sobre a taxa fotossintética e sobre a expansão foliar de
plantas de girassol.
d) Ajustamento osmótico
Uma outra resposta ao estresse hídrico em muitas plantas é um decréscimo no Ψs
resultante do acúmulo de solutos. Este processo é conhecido como ajustamento osmótico e
envolve o acúmulo de íons (especialmente K+) e de solutos orgânicos compatíveis (não
afetam o metabolismo mesmo quando presentes em altas concentrações) e osmoticamente
ativos (açúcares, prolina, betaína, sorbitol, aminoácidos, etc.). Vale salientar que o
ajustamento osmótico é decorrente do acúmulo de solutos devido a processos metabólicos e
não deve ser confundido com o aumento da concentração de solutos decorrente da redução do
volume celular.
A redução do Ψw da folha pelo acúmulo de solutos favorece a manutenção da absorção
de água e a manutenção da turgescência das células. O ajustamento osmótico nas células das
raízes e das folhas garante o adiamento das reações ao estresse, notadamente da síntese de
ABA que resultaria no fechamento estomático. Estas plantas podem apresentar maior
captação de CO2.
75
Embora o ajustamento osmótico pareça ser uma resposta generalizada em plantas sob
estresse hídrico, nem todas as espécies são capazes de se ajustarem. Em plantas de beterraba
açucareira (sugarbeet), por exemplo, se observa acúmulo de grandes quantidades de betaína e
estas plantas mostram grande redução no seu Ψw devido ao acúmulo de solutos. Em feijão-decorda, por outro lado, o ajustamento osmótico é mínimo. As plantas desta espécie possuem
estômatos muito sensíveis e evitam a dessecação pelo fechamento estomático e manutenção
de um Ψw relativamente alto na folha.
Deve-se ressaltar que o ajustamento osmótico tem um custo relativamente alto.
Basicamente, a síntese de moléculas orgânicas para o ajustamento desvia energia e esqueletos
de carbono que poderiam ser utilizados no crescimento.
e) Ajustamento da área foliar
Muitas plantas maduras, como as plantas da caatinga e plantas cultivadas, quando
submetidos a estresse hídrico prolongado, poderão responder pela aceleração na senescência e
abscisão das folhas mais velhas. Esse processo, algumas vezes referido como ajustamento da
área foliar, é outro mecanismo para reduzir a área foliar e a perda de água por transpiração
durante o período de limitada perda de água. Esse processo de abscisão foliar está associado
com o aumento da síntese do hormônio etileno em resposta ao estresse hídrico.
f) Ajustamento da relação parte aérea/raízes
Um dos efeitos iniciais do estresse hídrico é a redução no crescimento vegetativo. O
crescimento da parte aérea e, especialmente, o crescimento foliar, é geralmente mais sensível
ao estresse do que o crescimento da raiz. Aparentemente, a planta busca reduzir a área foliar
para reduzir a transpiração sem afetar bruscamente a capacidade de absorção de água pelas
raízes.
A relação parte aérea/raízes parece ser governada pelo balanço funcional. De acordo
com essa visão teleológica, quando algum material essencial para o crescimento da planta está
em nível sub ótimo, o órgão mais próximo da fonte do material, isto é, aquele responsável por
adquiri-lo, poderá receber proporcionalmente mais carbono. Muitas observações têm
mostrado que quando as plantas são submetidas ao estresse hídrico, a expansão foliar é
afetada muito mais do que a taxa fotossintética. A inibição do crescimento foliar reduz o
consumo de carbono e energia, de modo que maior proporção de fotoassimilados pode ser
distribuída para o sistema radicular, favorecendo o seu crescimento. Esse crescimento da raiz,
à medida que o solo vai secando, é preferencialmente em profundidade, o que constitui uma
outra linha de defesa da planta contra a seca.
O processo de translocação de fotoassimilados é pouco sensível ao estresse hídrico.
Experimentos têm mostrado que a translocação não é afetada até o final do período de
estresse, quando outros processos, como fotossíntese, já têm sido fortemente inibidos (Figura
8.3). Esta relativa insensibilidade do processo de translocação ao estresse hídrico, permite que
a planta mobilize e utilize as reservas nos locais onde ela necessita (semente, órgão
subterrâneo de reserva, crescimento do sistema radicular, etc.), mesmo quando o estresse é
extremamente severo.
É importante destacar que a área foliar da planta sob estresse hídrico é reduzida, de
modo que a capacidade produtiva da planta sob estresse é menor do que em plantas não
estressadas. Assim, a raiz sofre redução no seu crescimento, o grau de redução é, porém,
menor do que o da parte aérea.
76
Figura 8.3– Efeitos relativos do estresse hídrico sobre a fotossíntese e a translocação em
plantas de sorgo (Taiz & Zeiger, 1998).
g) Outras reações das plantas ao estresse hídrico
• Redução do tamanho da folha – folhas menores possuem menores camadas de ar
limítrofes, o que facilita as trocas de calor por convecção entre a folha e o ar. Isso permite a
manutenção da temperatura da folha igual ou menor que a temperatura do ar, mesmo quando
a transpiração é muito baixa (estômatos fechados).
• Mudanças na orientação das folhas –Muitas espécies vegetais (alfafa, algodão, soja, feijão,
espécies selvagens de Malvaceae, Lupinus succulentus, dentre muitas outras) controlam a
absorção de luz ajustando a orientação do seu limbo de tal forma que ele fique perpendicular
aos raios solares (Solar Tracking). Assim, estas espécies conseguem manter a máxima taxa
fotossintética permitida ao longo do dia, inclusive pela manhã e no final da tarde. Isto é
importante, pois permite que a planta fotossintetize em taxas aceitáveis nas horas mais
amenas do dia (no início e no final do período de luz), o que pode uma vantagem para plantas
que estão crescimento em regiões áridas. De modo contrário, algumas outras plantas movem
suas folhas de modo que elas evitam a exposição completa à luz do sol, minimizando, desta
forma, a absorção de calor e a perda de água. Este movimento de folhas induzido pelo sol é
conhecido como “HELIOTROPISMO”. As folhas que maximizam a absorção de luz são
conhecidas como diaheliotrópicas e as que minimizam são paraheliotrópicas.
• Enrolamento das folhas – característica comum em gramíneas, e que se deve à presença
das células buliformes nas folhas destas plantas. Aumento da espessura da cutícula – aumenta
a resistência cuticular à perda de água.
• Mudança de C3 para CAM – Ocorre em algumas plantas conhecidas como CAM
facultativas. Quando sob estresse hídrico ela passa de C3 para CAM. Estas últimas abrem os
estômatos durante a noite e apresentam alta eficiência no uso da água.
• Aumento em processos de dissipação de energia como a fluorescência da clorofila, a
fotorrespiração e a oxidase alternativa.
77
BIBLIOGRAFIA
BELHASSEN, E. Drought Tolerance in Higher Plants: genetical, physiological and
molecular biological analysis. Dordretch: Kluwer Academic Publishers, 1997. 103 p.
BUCHANAM, B. B., GRUISSEM, W., JONES, R. L. Biochemistry & Molecular Biology
of Plants. Rockvile, Maryland: American Society of Plant Physiologists, 2000, 1367p.
ESAU, K. Anatomia Vegetal. Barcelona, Espanha, Edicions Omega, 1972. 779p.
FAHN, A. Plant Anatomy. 4th ed. Oxford: Pergamon Press, Inc., 1990, 588p.
FERREIRA, L. G. R. Fisiologia Vegetal: Relações Hídricas. 1st ed. Fortaleza: Edições UFC,
1992, 138p.
FERRI, M. G. (Coord.) Fisiologia Vegetal, v. 1. 2nd ed. São Paulo: EPU, 1985, 361p.
KIEHL, E. J. Manual de Edafologia: Relações Solo-Planta. São Paulo, Editora Agronômica
Ceres, 1979, 262p.
KIRKHAM, M. B Principles of Soil and Plant Water Relations. Amsterdam: Elsevier
Academic Press, 2005. 519p.
KRAMER, P. J. & BOYER, J. S. Water Relations of Plants and Soils. Academic Press,
San Diego, 1995. 495 P.
LARCHER, W. Ecofisiologia Vegetal. São Carlos, riMa Artes e Textos, 2000. 531p.
HOPKINS, W. G. Introduction to Plant Physiology. 2nd ed. New York: John Wiley & Sons,
Inc., 2000, 512p.
PRISCO, J. T. Agricultura de sequeiro no semi-árido (palestra proferida durante a XII
Semana de Agronomia/UFC). Fortaleza, CE, 1995, 12p.
REICHARDT, K. A Água em Sistemas Agrícolas. Piracicaba, Editora Manole, 1990, 188p.
SALISBURY, F. B., ROSS, C. W. Plant Physiology. 4th ed. Califórnia: Wadsworth
Publishing Company, Inc., 1991, 682p.
SLATYER, R. O. Plant-Water Relatioships. Academic Press, 1967.
TAIZ, L., ZEIGER, E. Plant Physiology. 3rd ed. California: Sinauer Associates, Inc., (1998),
2002, 690p.
VIANA, T. V. A. ; AZEVEDO, B. M. . Meteorologia e climatologia agrícolas - Parte III (3a
edição). Fortalexza: Universidade Federal do Ceará, 2006 (Apóstila).
78