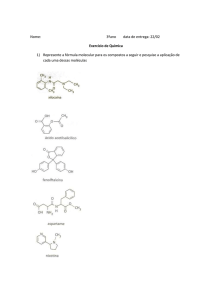
ITS – Química do Petróleo
3° Módulo: Prof.ª Mônica Fonseca
Química Orgânica: É a parte da Química que estuda os compostos do carbono.
→Compostos orgânicos naturais: as principais fontes de compostos orgânicos naturais são o
petróleo, o carvão mineral, o gás natural.
→Compostos orgânicos sintéticos: produzidos artificialmente pelas indústrias químicas.
Ex: plásticos, fibras têxteis, medicamentos, corantes, inseticidas entre outros.
Observação:
Existem compostos que apesar de apresentarem carbono na fórmula, não são classificados
como orgânicos.
Carbonatos – CO-23, Bicarbonatos - HCO3, Cianetos, Cianatos, Isocianetos, Isocianatos - HCN,
CNO, NC, NCO, CO2, CO, H2CO3, HNO, entre outros.
Propriedades dos compostos orgânicos
Elevado número de compostos.
Predominância da ligação covalente.
Pequena estabilidade ao calor.
A grande maioria é combustível (inflamável).
A grande maioria é insolúvel em água.
PF/PE baixos comparados aos inorgânicos iônicos.
Maus condutores de calor e eletricidade (compostos moleculares)
→Características do átomo de carbono:
O carbono é tetravalente, apresenta quatro elétrons em sua camada de valência, realiza quatro
ligações do tipo covalente de acordo com as formas abaixo:
Elementos Organógenos - são os elementos químicos que formam a maioria dos compostos
orgânicos.
Carbono (C), Hidrogênio (H), Oxigênio (O) e Nitrogênio (N).
Esses elementos não são tetravalentes como o carbono:
Hidrogênio é monovalente, efetua somente uma ligação: ─ H
Oxigênio é bivalente, efetua duas ligações: ─ O ─, ═ O
Nitrogênio é trivalente, efetua três ligações: ─ N ─; ─ N ═; ≡ N
O carbono é um dos elementos químicos com capacidade de formar cadeias, ligando-se entre
si e com outros elementos químicos.
Exemplos:
Heteroátomo: É um átomo diferente do carbono situado entre dois átomos de carbono. Os
principais heteroátomos são: O, N, S e P.
Quanto ao tipo de ligações químicas
Saturado: carbono com quatro ligações simples.
Insaturado: carbono com pelo menos uma ligação dupla ou tripla.
Tipo de
ligação
entre C
4 ligações
simples
1 ligação
dupla
1 ligação
tripla
2 ligações
duplas
Ligações
estabelecidas
Hibridação
Geometria
do carbono
Exemplo
tetraedro
Ângulo
entre as
ligações
109º28’
4 (sigma)
sp3
3e1
(ligação pi)
2e2
sp2
triangular
120º
H2C = O
sp
linear
180º
sp
linear
180º
H–C
N
O=C=
O
2e2
CH4
Ligação sigma (σ): São formadas pela superposição frontal dos orbitais sendo por este
motivo uma ligação forte muito estável e com um pequeno poder energético.
Ligação pi (π): São formadas quando entre os átomos ligantes já existente uma ligação
sigma, logo, a superposição dos orbitais, sempre do tipo p, ocorre lateralmente, dando origem a
uma ligação fraca, pouca estável e muito energética:
Ligação simples: quando ligados por um vértice.
Ligações duplas: quando ligados por dois vértices,
Ligações triplas: quando ligados por três vértices.
Fórmula Eletrônica de Lewis: os átomos se ligavam por meio de pares eletrônicos da camada
de valência. O tipo de ligação em que os átomos se unem por meio dos pares eletrônicos é
chamada de ligação covalente.
Fórmula de linha
Simplificação por índice
Simplificando a representação dos carbonos: C2H5 - O - C2H5
H3C –Simplificando a representação dos hidrogênio:CH2 - O - CH2 - CH3
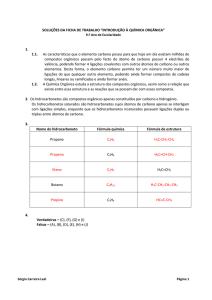
Classificação do carbono na cadeia carbônica:
Classificação
C primário
Conceito
Ligado a apenas outro
átomo de carbono
Ligado a dois átomos de
carbono
Ligado a três átomos de
carbono
C secundário
C terciário
C quaternário
Ligado a quatro átomos
de carbono (o número
máximo de ligações que
o carbono admite).
Exemplo
C–C
C–C–C
C–C–C
C
C
C–C–C
C
Exemplo:
C1
C1 – C2 – C3 – C4 – C1
C1
C1
1 carbonos primários
2 carbono secundário
3 carbono terciário
4 carbono quaternário
Exercícios
1-Complete as seguintes cadeias com átomos de hidrogênio:
2-Uma das substâncias responsáveis pelo cheiro agradável de morango pode ser representada
de uma forma simplificada por:
Com base na estrutura responda:
a) Quantos átomos de hidrogênio completam corretamente a estrutura?
b) Escreva sua fórmula molecular.
c) Classifique os carbonos da estrutura
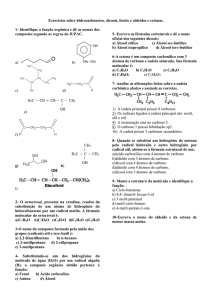
3- Utilizando ligações simples (—), dupla (═) e tripla (≡) entre os átomos de carbono, complete
corretamente as seguintes estruturas.
4- ―O pau-brasil ocupou o centro da história brasileira durante todo o primeiro século da
colonização. Essa árvore, abundante na época da chegada dos portugueses e hoje quase extinta,
só é encontrada em jardins botânicos, como o do Rio de Janeiro, e em parques nacionais,
plantada vez ou outra em cerimônias patrióticas. Coube a Robert Robinson, prêmio Nobel de
Química de 1947, o privilégio de chegar à estrutura química da brasilina, substância responsável
pela cor vermelha do pau-brasil‖.
(Fonte:http://www.sbq.org.br/filiais/adm/Upload/subconteudo/pdf/Historias_Interessantes_
de_Produtos_Naturais07.pdf)
A estrutura da brasilina também pode ser representada por:
Com base na estrutura,
a) escreva sua fórmula molecular;
b) indique o número de carbonos primários, secundários, terciários e quaternários presentes na
molécula de brasilina.
5-(PUC - RJ) Quantas ligações pi, no total, existem no composto representado pela fórmula
abaixo:
a) 2
b) 3
c) 4
d) 5
e) 6
6-(Vunesp) Na molécula do propino, o número de ligações sigma e de ligações pi são,
respectivamente:
a) 2 e 2
b) 5 e 1
c) 5 e 2
d) 6 e 2
e) 7 e 1
7-(ITE Bauru - SP) O composto orgânico de fórmula plana abaixo possui:
a) 5 carbonos primários, 3 secundários, 1 terciário e 2 quaternários
b) 3 carbonos primários, 3 secundários, 1 terciário e 1 quaternário.
c) 5 carbonos primários, 1 secundário, 1 terciário e 1 quaternário.
d) 4 carbonos primários, 1 secundário, 2 terciários e 1 quaternário.
8-Determine o número de carbonos primários, secundários, terciários e quaternários existentes
em cada uma das estruturas a seguir e escreva suas fórmulas moleculares:
9- (Mackenzie-SP): Sobre o limoneno, substância obtida do óleo de limão, representada acima,
é INCORRETO afirmar que:
a) apresenta uma cadeia cíclica e ramificada.
b) apresenta duas ligações covalentes pi.
c) apresenta um carbono quaternário.
d) sua fórmula molecular é C10H16•
e) apresenta três carbonos terciários.
10. (Puc-RJ) A fórmula molecular de um hidrocarboneto com cadeia carbônica é:
a) C9H8
b) C9H7
c) C9H10•
d) C9H12
e) C9H
Referências: sites
http://professorh9.dominiotemporario.com/doc/apostila_de_quimica_organica__1_bimestre_2011_-_2series.pdf.
www.tecnicodepetroleo.ufpr.br/...do.../introducao_quimica_org.pdf
http://www.colegiodinamico.com.br/paginas/aluno/o_professor/arquivos/arilson/arilson_2011_3o_a
no_aula1_introducao_a_quimica_organica_opt.pdf
http://luizclaudionovaes.sites.uol.com.br/orgc.htm. acesso em 25/02/12 as 14:00h
http://www.brasilescola.com/quimica/formulas-estruturais-carbono.htm. acesso em 25/02/12
http://www.educacional.com.br/upload/.../aula1obim.
http://www.profpc.com.br/qo_classifica.htm
http://www.md.cefetpr.br/cardoso/quimica/exercicio.htlm.
http://www.portalimpacto.com.br/09/material2010/medio_e_vest/docs/vest/qui/f4/aula1_introducao
_a_quimica_organica.pdf