NOME:
PROF:
TASSO
LISTA 1
ORGÂNICA
Questão 01)
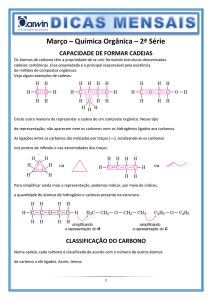
Detergentes são agentes tensoativos, que são constituídos por
moléculas contendo uma parte orgânica apolar e um grupo
polar. Os primeiros destes detergentes foram sintetizados na
década 50 e eram os alquilbenzeno-sulfonatos lineares de
fórmula típica representada abaixo:
_
_
_
_
_
_
_
_
_
_
_
_
_
CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH CH3
-
SO3 Na+
considerando a fórmula acima, marque a afirmativa correta:
a) existem somente 5 átomos de carbono com hibridação do
tipo sp3;
b) o átomo de enxofre se encontra com hibridação do tipo sp;
c) existem somente 6 átomos de carbono com hibridação do
tipo sp2;
d) o carbono e o sódio têm percentualmente pesos iguais;
e) o alquilbenzeno-sulfonato é insolúvel em água.
Questão 02)
Nos compostos C2H2, C2H6 e C2H4 as hibridizações dos átomos
de carbono são, respectivamente:
b) sp2, sp, sp3
a) sp, sp2, sp3
3
2
c) sp, sp , sp
d) sp3, sp, sp2
3
2
e) sp , sp , sp
_
_
_
_
Questão 03)
O tingimento na cor azul de tecidos de algodão com o corante
índigo, feito com o produto natural ou com o obtido
sinteticamente, foi o responsável pelo sucesso do jeans em
vários países.
Observe a estrutura desse corante:
O
H
N
C
_
C C
C
N
O
H
Nessa substância, encontramos um número de ligações pi (π)
correspondente a:
a) 3
b) 6
c) 9
d) 12
Questão 04)
Considerando as transformações:
a. C(grafite) + O2 → CO2
I
II
b. CO2 + H2O → H2CO3
III
Os átomos de carbono em I, II e III apresentam,
respectivamente, geometrias:
a) digonal, digonal, trigonal.
b) trigonal, digonal, trigonal.
c) trigonal, digonal tetraédrica.
d) tetraédrica, digonal, trigonal.
e) trigonal, tetraédrica e digonal.
Questão 05)
A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula
de metano (CH4) pode(m) ser interpretada(s) como sendo
formada(s) pela interpretação frontal dos orbitais atômicos s do
átomo de hidrogênio, com os seguintes orbitais atômicos do
átomo de carbono:
a) Quatro orbitais p.
b)Quatro orbitais híbridos sp3.
3
c) Um orbital híbrido sp . d)Um orbital s e três orbitais p.
e) Um orbital p e três orbitais sp2.
DATA: 01 / 03 / 2010
(Introdução à química orgânica)
Questão 06)
De acordo com o tipo de orbital híbrido que participa na
formação da ligação química, pode-se ter vários tipos de
ligações covalentes. Com base nessa informação, assinale a
alternativa correta.
a) Todas as ligações sigma entre os átomos de carbono do
1,3 - butadieno são do tipo sp2-sp2.
b) As ligações entre os átomos de carbono e hidrogênio no
benzeno são do tipo sigma sp-s.
c) As ligações entre os átomos de carbono e hidrogênio no
1,3 - butadieno são do tipo sigma sp3-s e sp2-s.
d) Na molécula do etino existem duas ligações entre os
átomos de carbono do tipo sigma sp–sp.
e) Na molécula do etino não existem ligações do tipo sigma
entre os átomos de carbono, apenas duas ligações do tipo
pi.
Questão 07)
A síntese da uréia a partir de cianato de amônio, segundo a
equação
NH 4+ CNO − aqueciment
o → CO(NH 2 ) 2
desenvolvida por Wöhler, em 1828, foi um marco na história
da Química porque:
a) provou a possibilidade de se sintetizarem compostos
orgânicos a partir de inorgânicos.
b) foi a primeira síntese realizada em laboratório.
c) demonstrou que os compostos iônicos geram substâncias
moleculares quando aquecidos.
d) se trata do primeiro caso de equilíbrio químico
homogêneo descoberto.
e) provou que o sal de amônio possui estrutura interna
covalente.
Questão 08)
Observe o composto cuja fórmula estrutural plana é mostrada
abaixo, onde α e l referem-se ao ângulo o ao comprimento de
ligação respectivamente.
l1
H
C
α1
H
C
H
H α2H H α 3
C C C H
l3
l2
H H
Pode-se afirmar que
a) l > l2 > l3 e α1> α2 = α3
b) l3 > l1 > l2 e α1= α2 < α3
c) l1 = l2 = l3 e α1> α2 = α3
d) l1 > l2 > l3 e α1> α2 > α3
e) l1 = l2 = l3 e α1 = α2 = α3
Questão 09)
Os compostos orgânicos distinguem-se dos inorgânicos por
uma série de características que nos permite identificá-los com
segurança. Complete os espaços abaixo com O quando as
propriedades mencionadas forem relativas a compostos
orgânicos e com I, quando forem inorgânicos.
( ) Seguem a regra semelhante dissolve semelhante.
( ) Apresentam geralmente baixa estabilidade diante de
agentes energéticos, como temperatura, pressão, ácidos
concentrados etc. .
( ) São muito solúveis em água.
( ) Reagem, na maioria dos casos, lentamente com formação
de subprodutos e requerem geralmente o uso de
catalisadores.
( ) Apresentam altos pontos de fusão e ebulição.
( ) Não conduzem corrente elétrica em solução aquosa.
Marque, a alternativa correta:
a)
c)
e)
O, O, I, I, O, I
I, O, I, O, I, I
O, O, I, O, I, O
b) O, I, I, O, I, I
d) I, O, O, O, O, O
Questão 10)
A pentoxiverina é utilizada como produto terapêutico no
combate à tosse. Indique a alternativa cujos itens relacionam-se
com a estrutura fornecida:
O
O
O
a)
b)
c)
d)
e)
8 elétrons π, 12
carbonos sp3.
6 elétrons π, 12
carbonos sp3.
6 elétrons π, 14
carbonos sp3.
8 elétrons π, 14
carbonos sp3.
8 elétrons π, 12
carbonos sp3.
N
Questão 13)
O programa nacional de biocombustíveis tem despertado
diferentes reações ao redor do mundo. Enquanto países como
Estados Unidos e Japão consideram o etanol brasileiro uma
alternativa viável aos combustíveis derivados de petróleo,
Venezuela e Cuba criticam tanto a produção de álcool quanto a
de biodiesel. Analisando a molécula de etanol (C2H6O),
podemos considerar que as ligações hidrogêniocarbono e a
ligação carbono-carbono são formadas pela interpenetração
frontal de orbitais atômicos e híbridos, respectivamente, do tipo
a) s – sp; sp – sp.
b) s – sp2; sp2 – sp2.
3
3
3
c) s – sp ; sp – sp .
d) s – sp3; sp2 – sp2.
2
e) s – sp ; sp – sp.
elétrons não-ligantes, 7 carbonos sp2 e 12
elétrons não-ligantes, 7 carbonos sp2 e 12
elétrons não-ligantes, 6 carbonos sp2 e 12
elétrons não-ligantes, 7 carbonos sp2 e 13
Questão 14)
A vitamina C, também chamada de ácido ascórbico, é a mais
conhecida das vitaminas. Ela está presente principalmente nos
vegetais frescos, sendo mais abundante nas frutas cítricas (a
acerola é uma das que possui maior teor de vitamina C). Com
base na fórmula estrutural da vitamina C (ao lado), analise as
seguintes afirmações:
CH2OH
elétrons não-ligantes, 6 carbonos sp2 e 13
H
Questão 11)
"Segundo a WWF, três novos estudos científicos mostram que
as mudanças biológicas nos sistemas hormonais e
imunológicos dos ursos polares estão ligadas a poluentes
tóxicos em seus corpos. Entre os produtos químicos mais
perigosos estão os PCBs - bifenilas policloradas, substâncias
industriais que foram banidas nos anos 80, mas que ainda são
encontradas nas águas, no gelo e no solo do Ártico."
JB online, 2004
A figura abaixo apresenta um exemplo de bifenila policlorada.
Cl
Cl Cl
Cl
Cl
2,3,2',3',4' pentaclorobifenila
Assinale a opção que apresenta o número total de átomos de
carbono com hibridação sp2 no composto.
a) 6
b) 8
c) 10
d) 12
e) 14
Questão 12)
A resina uréia/formaldeído possui várias aplicações industriais
importantes, as mais comuns na forma de impermeabilizantes e
adesivo para madeiras. Com base na parte da estrutura da
resina uréia/formaldeído abaixo, desconsiderando tensões
estruturais, identifique a hibridização e os ângulos de ligação
que o carbono da carbonila e o nitrogênio apresentam.
Números atômicos: C = 6 e N = 7.
C
O
N
CH2 N
N
CH2
C
O
C
C
O
CH2 N
C
O
HO
OH
O número de carbono com hibridização do tipo sp3 é igual
ao número de carbono com hibridização do tipo sp2.
II. O anel da molécula apresenta 5 orbitais moleculares σ e 1
orbital π .
III. O carbono da função orgânica éster possui hibridização de
tipo sp3.
Dentre as afirmativas acima, está(ão) CORRETA(S):
a) I, II e III .
b) I e III.
c) I e II.
d) III.
e) II e III.
I.
Questão 15)
No hidrocarboneto de fórmula estrutural representada abaixo,
os átomos de carbono estão numerados de 1 a 7.
H
H
H
H
H
C
C
C
6
5
C4
7
H
H
C
3
H
C
2
C1
H
H
Sobre esse hidrocarboneto são feitas as seguintes afirmativas:
I. O total de ligações π (pi) na estrutura é igual a 3.
II. O átomo de carbono 2 forma 3 ligações π (pi) e 1 ligação
σ (sigma).
III. O átomo de carbono 5 forma 3 ligações σ (sigma) e 1
ligação π (pi).
IV. O átomo de carbono 1 forma 4 ligações σ (sigma).
São CORRETAS apenas as afirmativas:
a) I, III e IV.
b) II e IV.
c) I e II.
d) I, II e IV.
GABARITO:
O
n
Assinale a alternativa correta.
a) C = sp2 e 120°; N = sp3 e 104°.
b) C = sp2 e 120°; N = sp2 e 120°.
c) C = sp3 e 109°; N = sp2 e 120°.
d) C = sp e 180°; N = sp3 e 104°.
e) C = d2sp3 e 90°; N = sp2 e 120°.
OH
O
O
CH2 N
N
C
1) C
2) C
3) C
4) B
5) B
6) A
7) A
8) B
9) E
10) D
11) D
12)
13)
14)
15)
A
C
C
A
2