IX Olimpíada Catarinense de Química - 2013
1º Ano
IX Olimpíada Catarinense de Química – 2013
Etapa I - Colégios
Imagem: Oxidação
Fonte:Gilson Rocha Reynaldo, 2013
Primeiro Ano
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
1
IX Olimpíada Catarinense de Química - 2013
1º Ano
01 - Alguns cientistas acreditam que possa ocorrer falta de água potável em um futuro próximo. A
partir desta afirmação, assinale a resposta que melhor possa justifica-la:
A) (
B) (
C) (
D) (
E) (
) Restam apenas 20% de água potável no planeta e, a cada ano, ficam mais poluídas.
) Apenas 0,7% de toda a água existente na Terra é potável, e parte dela se encontra poluída.
) A utilização industrial de água é crescente e irreversível.
) A população consome e polui demasiadamente a água existente a, apenas 10% é potável.
) A poluição das águas é constante apenas 70% é potável.
02 – É comum ouvirmos que alguns alimentos industrializados não são saudáveis, pois contêm muitas
"substâncias químicas". Qual das afirmações abaixo é a mais adequada diante da afirmação anterior?
A) ( ) Os alimentos industrializados são nocivos à saúde humana. Em tempos passados eles não existiam
e as pessoas viviam de forma mais saudável com maior longevidade.
B) ( ) Tudo é formado por substâncias químicas. Entretanto, os compostos sintéticos, isto é, elaborados
em laboratório, são nocivos à saúde humana e, quando nos alimentos, podem fazer mal.
C) ( ) Os alimentos industrializados sofrem modificações após a sua fabricação e, essas modificações
poderão ser nocivas à saúde humana.
D) ( ) As substâncias químicas existem em tudo e, algumas são prejudiciais à saúde. No entanto, os
alimentos são produzidos com os cuidados necessários para evitar o uso incorreto e prejuízos ao
homem.
E) ( ) As substâncias químicas não causam danos à saúde humana. No entanto, os alimentos são
perecíveis e, quando ingeridos após a validade, fazem mal às pessoas.
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
2
IX Olimpíada Catarinense de Química - 2013
1º Ano
03 – A água, diferentemente da maioria dos materiais, aumenta a densidade com o aumento da sua
temperatura, enquanto essa variação estiver entre 0 °C e 4 °C. Esse comportamento é conhecido como
"comportamento anômalo da água". Por que cubos de gelo flutuam na água líquida?
A) (
B) (
C) (
D) (
E) (
) Porque a água não apresenta pureza absoluta e, por isso, o gelo não fica no fundo.
) Em função do Princípio de Arquimedes o gelo flutua.
) Porque é menos denso que a água líquida, devido ao comportamento anômalo da água.
) Em função da baixa temperatura sem relação com o comportamento anômalo da água.
) Porque o gelo não apresenta pureza absoluta, por isso, flutua.
04 – A aparelhagem representada a seguir é utilizada em laboratório na separação de misturas
heterogêneas.
Podemos usar este equipamento, por exemplo, num sistema formado por água e óleo. Como é
chamado este método de separação de misturas e como ocorre a separação de uma mistura
heterogênea formada por água e óleo?
A) ( ) Este método de separação é chamado de decantação líquido-líquido e a água, por ser mais
densa, localiza-se na parte inferior do funil e é escoada abrindo-se a torneira (ou válvula) de modo
controlado.
B) ( ) Este método de separação é chamado de decantação líquido-líquido e a água, por ser menos
densa, localiza-se na parte inferior do funil e é escoada abrindo-se a torneira (ou válvula) de modo
controlado.
C) ( ) Este método de separação é chamado de filtração líquido-líquido e a água, por ser menos densa,
localiza-se na parte superior do funil e é aspirada, pela parte superior, através de uma pipeta.
D) ( ) Este método de separação é chamado de filtração líquido-líquido e a água, por ser mais densa,
localiza-se na parte inferior do funil e o óleo aspirado, pela parte superior, através de uma pipeta.
E) ( ) Este método de separação é chamado de decantação líquido-líquido e a água, por ser menos
densa, localiza-se na parte superior do funil e o óleo é escoado abrindo-se a torneira (ou válvula) de
modo controlado.
05 – A respeito do átomo, assinale a alternativa INCORRETA.
A) ( ) Os elétrons descrevem, ao redor do núcleo, órbitas circulares e elípticas com diferentes
conteúdos de energia.
B) ( ) Quanto mais próxima ao núcleo, mais energética a camada atômica.
C) ( ) Quando um elétron recebe energia suficiente, ele salta para uma camada mais externa. Após
essa transição, o elétron tende a voltar à sua órbita original e libera energia na forma de luz ou calor.
D) ( ) Nos átomos conhecidos existem sete camadas possíveis de energia.
E) ( ) Nenhuma das respostas acima.
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
3
IX Olimpíada Catarinense de Química - 2013
1º Ano
06 – O ferro (do latim ferrum) é um elemento químico, símbolo Fe, de número atômico 26 e massa
atômica 56 u. À temperatura ambiente, o ferro encontra-se no estado sólido. É extraído da natureza
sob a forma de minério de ferro que, depois de passado para o estágio de ferro-gusa, através de
processos de transformação, é usado na forma de lingotes. Adicionando-se carbono dá-se origem a
várias formas de aço. É o quarto elemento mais abundante da crosta terrestre (cerca de 5%) e um dos
elementos mais abundantes do Universo; o núcleo da Terra é formado principalmente por ferro e
níquel. O ferro, hoje em dia, é utilizado extensivamente na produção de aço para a produção de
ferramentas, máquinas, veículos de transporte (automóveis, navios, etc.), como elemento estrutural
de pontes, edifícios e uma infinidade de outras aplicações.
+
A partir do exposto, quantos nêutrons, prótons e elétrons existem no íon Fe3 formado a partir desse
isótopo?
A) (
B) (
C) (
D) (
E) (
) 26 prótons, 30 nêutrons, 26 elétrons.
) 23 elétrons, 30 prótons e 26 nêutrons.
) 23 elétrons, 26 prótons e 30 nêutrons.
) 26 prótons, 26 nêutrons, 23 elétrons.
) 26 elétrons, 30 prótons e 26 nêutrons.
07 – Dados dois elementos: X (Z = 17) e Y (Z = 20), responda, nesta ordem: Qual tem o maior raio
atômico; Qual é o mais eletronegativo; Qual tem maior potencial de ionização; Qual possui caráter
metálico?
A) (
B) (
C) (
D) (
E) (
) X; X; Y; Y
) Y; Y; X; Y
) Y; X; X; X
) Y; X; Y; Y
) Y; X; X; Y
08 – O que determina o caráter metálico de um material e quais são suas principais características?
A) ( ) O caráter metálico de um material é determinado pela sua capacidade de perder elétrons.
Quanto maior o tamanho do átomo, menor seu potencial de ionização, menor sua eletronegatividade e,
consequentemente, maior o seu caráter metálico.
B) ( ) O caráter metálico de um material é determinado pela sua capacidade de receber elétrons.
Quanto menor o tamanho do átomo, maior seu potencial de ionização, menor sua eletronegatividade e,
consequentemente, maior o seu caráter metálico.
C) ( ) O caráter metálico de um material é determinado pela sua capacidade de perder elétrons. Quanto
menor o tamanho do átomo, maior seu potencial de ionização, maior sua eletronegatividade e,
consequentemente, maior o seu caráter metálico.
D) ( ) O caráter metálico de um material é determinado pela sua capacidade de perder elétrons.
Quanto maior o tamanho do átomo, maior seu potencial de ionização, maior sua eletronegatividade e,
consequentemente, maior o seu caráter metálico.
E) ( ) O caráter metálico de um material não é determinado pela sua capacidade de perder elétrons.
Quanto menor o tamanho do átomo, maior seu potencial de ionização, menor sua eletronegatividade e,
consequentemente, maior o seu caráter metálico.
09 – A partir da análise dos seguintes óxidos, nas condições-padrão (1atm e 25 ºC):
I. Na2O
II. CaO
III. CO2
IV. SO3
V. NO
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
4
IX Olimpíada Catarinense de Química - 2013
1º Ano
Determine qual deles, ao ser colocado em contato com a água, produzirá um ácido forte.
A) (
B) (
C) (
D) (
E) (
) I
) II
) III
) IV
)V
10 – Determine qual das moléculas a seguir é polar ou apolar, na ordem: SO2; H2O; BF3; NH3; CO2; BCl3.
A) (
B) (
C) (
D) (
E) (
) Polar; polar; apolar; polar; apolar e apolar.
) Apolar; polar; polar; polar; apolar e apolar.
) Polar; polar; polar; apolar; polar e apolar.
) Polar; polar; apolar; polar; polar e polar.
) Polar; apolar; polar; polar; apolar e polar.
11 – O ácido clorídrico é produzido no estômago e sua função é auxiliar na digestão dos alimentos. A
produção excessiva desse ácido pode nos causar algum desconforto, como a azia. Para combater a
azia utiliza-se um medicamento denominado antiácido. A qual função química pertence esse
medicamento? Qual o nome da reação que ocorre entre o medicamento e o ácido estomacal?
A) ( ) O antiácido pertence à função química óxido e sofre uma reação de adição com o ácido clorídrico.
B) ( ) O antiácido pertence à função química base e sofre uma reação de análise com o ácido clorídrico.
C) ( ) O antiácido pertence à função química sal e sofre uma reação de neutralização com o ácido
clorídrico.
D) ( ) O antiácido pertence à função química sal e sofre uma reação de substituição com o ácido
clorídrico.
E) ( ) O antiácido pertence à função química base e sofre uma reação de neutralização com o ácido
clorídrico.
12 – Quantos hidrogênios ionizáveis existem nos ácidos: H2SO4; H3PO4; HCl; H3PO3; H3PO2; HBr.
A) (
B) (
C) (
D) (
E) (
) 2; 3; 1; 1; 2; 1.
) 2; 3; 1; 2; 1; 1.
) 1; 3; 1; 2; 1; 1.
) 2; 3; 1; 2; 2; 1.
) 2; 3; 1; 1; 1; 1.
13 – Analise a frase: “A análise de uma amostra de água de chuva e a análise de uma amostra de água
de torneira têm o mesmo resultado para o valor de porcentagem de oxigênio.” A Lei que segue a frase
abaixo é a da:
A) (
B) (
C) (
D) (
E) (
) Lei da Conservação das Massas;
) Lei da Conservação de Energia;
) Lei das Proporções Constantes;
) Lei de Lavoisier;
) Lei das Proporções Recíprocas.
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
5
IX Olimpíada Catarinense de Química - 2013
1º Ano
14 – Um composto orgânico de largo emprego industrial possui a seguinte fórmula percentual:
C40%H6,67%O53,33%. Sabemos que sua massa molecular vale 180 u. A fórmula mínima e a fórmula
molecular deste composto são respectivamente: (Dados: C = 12 u; H = 1 u e O = 16 u.)
A) (
B) (
C) (
D) (
E) (
) CH2O e C12H22O11
) C2HO e C7H14O7
) CH2O e C6H8O6
) CH2O e C6H1206
) CHO e C8H12O8
15 – Observe os sistemas dados a seguir:
I – Alumínio metálico imerso em solução de hidróxido de sódio.
II – Prata metálica imersa em ácido clorídrico diluído.
III – Ferro metálico imerso em ácido sulfúrico diluído.
IV – Sódio metálico imerso em álcool etílico.
V – Magnésio metálico em vapor de água.
Qual deles NÃO irá formar hidrogênio gasoso?
A) (
B) (
C) (
D) (
E) (
)
)
)
)
)
I
II
III
IV
V
16 – O que diferencia uma solução, uma suspensão e uma dispersão coloidal?
A) ( ) São diferenciadas em relação do raio médio das partículas dispersas.
B) ( ) Soluções possuem diâmetro médio acima de 100 nm, entre 1 e 100 nm temos dispersões e
suspensões até 1 nm.
C) ( ) Soluções e dispersões raio médio até a nm e suspensões acima de 1 nm.
D) ( ) Suspensões e dispersões diâmetro médio até 1 nm e soluções acima de 1 nm.
E) ( ) São diferenciadas em relação ao diâmetro médio das espécies dispersas.
17 – O que você entende por coeficiente de solubilidade?
A) (
) É a quantidade de soluto que não pode ser dissolvida completamente em determinada
quantidade de solvente.
B) ( ) Determina-se como a quantidade de soluto que precipita ao efetuarmos uma dada mistura em
determinada temperatura.
C) ( ) É a máxima quantidade de solvente que pode ser diluída completamente em determinada
quantidade de soluto.
D) ( ) É a máxima quantidade de soluto, em massa, que é dissolvida completamente em determinada
quantidade de solvente.
E) ( ) Determina-se como o máximo de soluto, em massa, que pode ser acrescentada em uma solução
quando há um aumento na temperatura da solução.
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
6
IX Olimpíada Catarinense de Química - 2013
1º Ano
18 – Dada a seguinte reação de oxi–redução:
Bi2O3 + NaClO → NaBiO3 + NaCl + H2O
Qual átomo sofreu oxidação, redução, qual é o agente redutor e qual o agente oxidante, nessa
ordem?
A) (
B) (
C) (
D) (
E) (
) Cloro; Bismuto; Bi2O3; NaClO
) Bismuto; Cloro; NaClO; Bi2O3
) Bismuto; Cloro; Bi2O3; NaClO
) Cloro; Bismuto; NaClO; Bi2O3
) Bismuto; Bismuto;Bi2O3; NaClO
19 – A respeito das soluções, assinale a alternativa INCORRETA.
A) ( ) Ao se adicionar solvente, a concentração de uma solução diminui.
B) ( ) Ao se adicionar soluto, a concentração de uma solução aumenta.
C) ( ) O aquecimento pode promover uma diminuição na concentração de uma solução.
D) ( ) Os termos diluído e concentrado estão estritamente relacionados com a relação entre a
quantidade de soluto e de solvente presentes em uma solução.
E) ( ) Uma solução diluída pode se tornar concentrada pela adição de uma solução com mesmo soluto
e mesmo solvente.
20 – Determine a pressão exercida por uma mistura gasosa de 1,3 mol de metano, 2,5 mol de oxigênio e
0,7 mol de hidrogênio, contida em um recipiente fechado de 70 L, a uma temperatura de 27 ºC.
A) (
B) (
C) (
D) (
E) (
) 0,58 atm
) 1,58 atm
) 2,58 atm
) 0,058 atm
) 3,58 atm
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
7
IX Olimpíada Catarinense de Química - 2013
1º Ano
FOLHA DE RESPOSTAS – PRIMEIRO ANO
Preencha com caneta preta ou azul. Qualquer rasura anulará a questão. Caso
necessite, solicite um novo cartão resposta ao seu Professor. Assinale apenas uma
resposta para cada questão.
Data:___/___/_____
Horário início: _________
Questões
a
b
c
d
Horário término:_________
e
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
8
IX Olimpíada Catarinense de Química - 2013
1º Ano
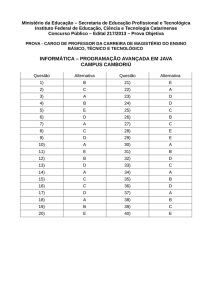
GABARITO – PRIMEIRO ANO
Questões
A
B
C
X
02
X
03
X
X
05
X
06
X
07
08
X
X
09
10
X
X
11
12
X
X
13
X
14
15
X
X
16
X
17
X
18
X
19
20
E
X
01
04
D
X
Universidade do Sul de Santa Catarina – Unisul
Conselho Regional de Química – CRQ XIII
9