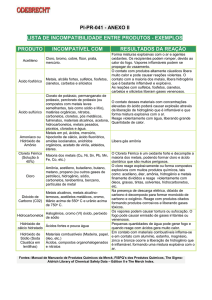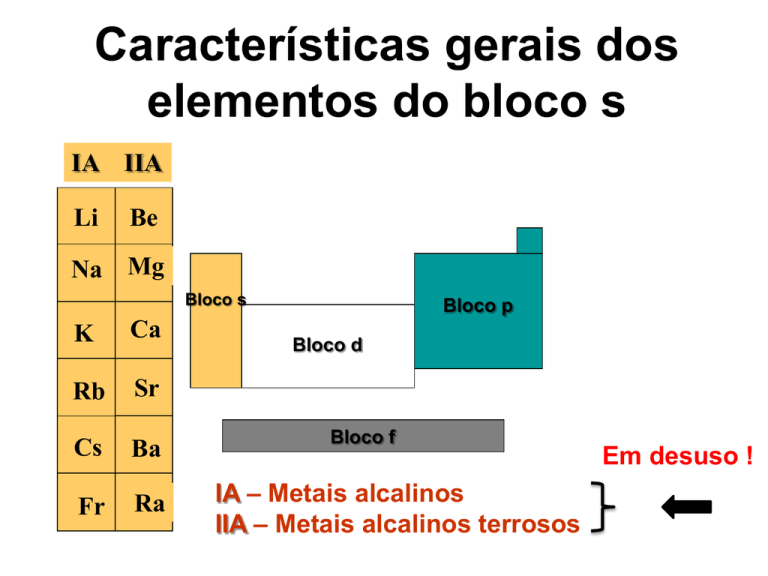
Características gerais dos
elementos do bloco s
IA IIA
Li
Be
Na Mg
Bloco s
K
Ca
Rb
Sr
Cs
Ba
Fr
Ra
Bloco p
Bloco d
Bloco f
IA – Metais alcalinos
IIA – Metais alcalinos terrosos
Em desuso !
Características gerais dos
elementos do bloco s
Possuem grande tendência para perder e- e formar íons positivos.
O caráter metálico aumenta à medida que se desce nos grupos.
Características gerais dos
elementos do bloco s
Eletronegatividade relativa
Baixa atração nuclear dos
e- mais externos.
Fortemente
eletropositivos.
Fracamente
eletronegativos.
Grupo I
Grupo II
Li
1.0
Be
Na
0.9
Mg 1.2
K
0.8
Ca
1.0
Rb
0.8
Sr
1.0
Cs
0.7
Ba
0.9
Fr
0.7
Ra
0.9
1.5
Raio Atômico (nm)
Li
0,152
Be
0,112
Na
0,186
Mg
0,160
Fr
K
0,231
Ca
0,197
Rb
0,244
Sr
0,215
Cs
0,262
Ba
0,217
Fr
0,270
Ra
0.220
Li
Be
Ra
Entalpia de ionização
1a E.I.
1a E.I.
2000
600
Be+
Li
500
400
Na
1500
2nd IE
K
Rb
Cs
Ca+
1000
300
Ba+
Be
500
Ca
Ba
Entalpia de ionização
Elementos do Grupo 1
1. Têm 1a E. I. baixas devido à blindagem dos
elétrons internos.
2. A remoção do segundo elétron é difícil, pois isso
envolve a remoção do elétrons internos dos
elementos.
3. As E. I. diminuem de cima para baixo nos grupos.
Entalpia de ionização
Elementos do Grupo 2
1. Têm 1as e 2as E.I. baixas.
2. A remoção do 3o e- é muito mais difícil, pois envolve a remoção
dos e- internos.
3. As E.I. diminuem de cima para baixo no grupo.
4. As E.I. são tipicamente maiores em relação às do grupo 1.
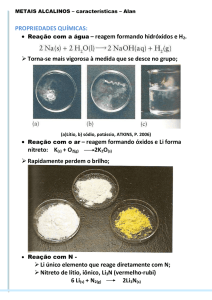
Reações com oxigênio
Os elementos do bloco s são fortes agentes redutores.
Seus poderes redutores aumentam à medida que se desce
nos grupos, pois fica mais fácil remover o(s) eletron(s) de
valência.
Os elementos do bloco s reagem facilmente
com oxigênio.
As exceções são o Be e o Mg
Reações com oxigênio
Óxido
Normal
Estrutura de
Lewis
Elementos
que formam
.. 2:O:
..
Li e demais
elementos do
grupo 2
Peróxido
.. .. 2:O-O:
.. ..
Na e Ba
Superóxido
. .:O:.O:
.. ..
K, Rb, Cs
Os peróxidos contém o íon [-O-O-]2-, são diamagnéticos
(todos os elétrons estão emparelhados). Os superóxidos são
paramagnéticos, com 1 e- desemparelhado em um orbital π*
antiligante.
Os peróxidos são agentes oxidantes e reagem com água ou ácido,
formando peróxido de hidrogênio
Na2O2 + 2H2O → 2NaOH + H2O2
O Na2O2 é utilizado em recintos confinados para absorver o CO2
Na2O2 + CO → Na2CO3
Na2O2 + 2CO2 → 2Na2CO3 + O2
Reações de óxidos e hidróxidos
1. Todos os óxidos do grupo 1 reagem com água
para formar hidróxidos.
Oxido: O2- + H2O 2OHPeróxido: O22- + 2H2O H2O2 + 2OHSuperóxide: 2O2- + 2H2O 2OH- + H2O2 + O2
2. Todos os óxidos/hidróxidos são básicos e suas basicidades
aumentam à medida que se desce no grupo.
3. Os óxidos/hidróxidos do grupo 2 são geralmente menos básicos
em relação aos do grupo 1. Os óxidos/idróxidos de Be são
anfotéricos.
Reações de óxidos e hidróxidos
Óxidos
Hidróxidos
Óxidos
Hidróxidos
Li2O
LiOH
BeO
Be(OH)2
Na2O,
Na2O2
K2O2, KO2
NaOH
MgO
Mg(OH)2
CaO
Ca(OH)2
Rb2O2,
RbO2
Cs2O2,
CsO2
RbOH
SrO
Sr(OH)2
BaO, Ba2O2
Ba(OH)2
KOH
CsOH
Características gerais dos
elementos do bloco s
Hidróxidos do
Grupo I
Li
Na
K
Rb
Cs
Aumento da força básica.
Hidróxidos do
Grupo II
Be
Mg
Ca
Sr
Aumento da força básica
Ba
Reação com hidrogênio
Todos os elementos do bloco s reagem com hidrogênio para formarem
hidretos. A exceção é o Be.
2Na(s) + H2(g) 2NaH(s)
Ca(s) + H2(g) CaH2(s)
A reatividade aumenta à medida que se desce no grupo.
Todos os hidretos são iônicos, com as exceções de BeH2 e MgH2 , que são
covalentes.
Reações de hidretos
Todos eles reagem com água para produzir hidróxidos do
metal e hidrogênio, devido às fortes propriedades básicas
do íons hidreto H:-
H:-(s)+ H2O(l) H2(g)+ OH-(aq)
Os hidretos também são bons agentes redutores.
Eles são usados para preparar compostos complexos, como o
LiAlH4 (hidreto de lítio e alumínio) e NaBH4 (hidreto de boro e
sódio, ou boroidreto de sódio), os quais são usados como
agentes redutores de grupos C=O em sínteses orgânicas.
Solubilidade dos compostos dos grupos 1 e 2
Alguns conceitos importantes:
(1ª) Entalpia reticular (ΔHret): quando um soluto se dissolve na água, a primeira
etapa é a de separação de seus íons que estão num retículo cristalino. Para
romper as ligações entre os íons é necessário que se forneça energia ao sistema.
Portanto, esse primeiro processo é endotérmico, pois absorve energia; sendo
sua entalpia positiva (ΔH > 0).
(2ª) Entalpia de hidratação (ΔHhid): depois da separação dos íons, eles são
envolvidos pelas moléculas do solvente. No caso da água, ela é o solvente e
dizemos que está ocorrendo uma hidratação. Os dipolos da água são atraídos
respectivamente pelos íons de carga oposta; assim, para que haja essa
interação, é necessária a liberação de energia. Desse modo, na hidratação a
entalpia será negativa (ΔH < 0), pois o processo é exotérmico.
A variação de entalpia da solução (ΔHsol) será determinada pela somatória
dessas duas entalpias. Se o resultado der positivo, significa que a entalpia reticular
é maior, portanto a entalpia de dissolução indicará que o processo é endotérmico.
O diagrama de entalpia de uma dissolução endotérmica é representado a seguir:
Isso é indicado pelo caso da dissolução do iodeto de
potássio mostrado a seguir:
Se o resultado for positivo, a entalpia de
hidratação será maior que a reticular e o
processo é exotérmico.
Solubilidade dos compostos dos grupos 1 e 2
Todos os sais simples dos metais alcalinos são solúveis
A solubilidade em água da maioria dos sais do grupo 1 decresce
de cima para baixo.
A energia reticular (E.R.) dos metais diminui ligeiramente no
grupo.
A energia hidratação varia mais acentuadamente de cima para baixo.
E.R. α 1/ (r+ + r-). A energia reticular deve variar mais quando r- é
pequeno, e deve variar menos quando r- for grande.
Solubilidade dos compostos dos grupos 1 e 2
MX(s)
H2O
M+(aq) + X-(aq)
H sol
H hidratação
-H ret
M+(g) + X-(g)
H sol
= -H ret
+
H hidratação
Solubilidade dos compostos dos
grupos 1 e 2
Os compostos do grupo 1 são mais solúveis do que os do grupo 2,
pois os íons dos elementos do grupo 1 têm cargas menores e
tamanhos maiores. Além disso, eles apresentam entalpias de
redes cristalinas (Hret) menores e entalpias de solução (Hsol)
mais exotérmicas.
Solubilidade dos compostos dos
grupos 1 e 2
3. Os hidróxidos dos grupos 1 e 2 são tipicamente iônicos.
Descendo-se nos grupos, menores entalpias são necessárias para
desfazer os retículos cristalinos à medida que o tamanho dos cátions
aumenta. Contudo, a mudança da entalpia de solução é bem menor,
devido aos menores valores do termo 1/r. Como resultados, a
entalpia de solução torna-se mais exotérmica e a solubilidade
aumenta, descendo nos grupos.
Reações de aquecimento dos
elementos do bloco s
Na+ Cl- (g) Na (g) + Cl (g)
Na(g) Na* (g)
Na*(g) Na(g) + h (589nm, amarelo)
Características gerais dos
elementos do bloco s
Ca - Vermelho tijolo
Sr - Vermelho sangue
Ba - Verde amarelado
Li - Vermelho escuro
Na - Amarelo
K - Lilás
Rb - Vermelho pálido
Cs - Azul
HCl(aq)
Amostra
Características gerais dos
elementos do bloco s
M(s) M+(aq) + eH2O(l) + e- OH-(aq) + ½ H2(g)
Li
Na
K
Rb
Cs
-3.05 volt
-2.71
-2.93
-2.99
-3.20
Be -1.85 volt
Mg -2.38
Ca -2.87
Sr -2.89
Ba -2.90
Os potenciais padrão dos metais alcalinos e alcalino-terrosos (tabela) sugerem
que eles são todos capazes de serem oxidados pela água.
Entalpia de hidratação
M+(g) + H2O M+(aq) + calor
M+
-2250
-2000
-600
-1750
H2O
-300
-1500
Be2+ Mg2+ Ca2+ Sr2+ Ba2+
Li+ Na+ K+
Rb+ Cs+
Entalpia de hidratação
Tendências gerais:
1. Descendo-se nos grupos, as E.H. diminuem.
(À medida que os íons tornam-se maiores, a densidade de
carga aumenta e a atração eletrostática entre os íons e as
moléculas de água torna-se progressivamente menor.
2. Os íons do grupo 2 têm E.H. maiores que os do grupo 1.
Os cátios desse grupo apresentam o dobro da carga, porém
com tamanhos menores.
Características gerais dos
elementos do bloco s
+
Poder
polarizante,
aumento do
caráter iônico
-
+
-
+
-
Estabilidade
dos íons
Série de reatividade dos metais
Li,K,Rb, Cs,Ba,Sr,Ca,Na,Mg,Al,Mn,Zn,Fe,Co,Ni,Sn,Pb,H,Cu,Ag,Pd,Pt,Au
Reatividade aumenta
A série de reatividade é uma lista em ordem crescente de reatividade
química de diversas espécies químicas, entre elas metais. Ela é
organizada com base nos potenciais padrões de redução, de acordo com
uma tendência crescente a se oxidarem. No caso dos metais, à direita
estão os metais com menor tendência a se oxidar e à esquerda os com
maior tendência a se oxidar. Na presença de uma solução aquosa, a
reação de oxidação desses metais pode ser representada pela seguinte
equação química:
Me(s)
Men+(aq) + ne-
Série de reatividade dos metais
Li,K,Rb, Cs,Ba,Sr,Ca,Na,Mg,Al,Mn,Zn,Fe,Co,Ni,Sn,Pb,H,Cu,Ag,Pd,Pt,Au
Os metais à esquerda são extremamente reativos, ou seja, a reação de
oxidação acima, têm grande tendência a ocorrer. Já os metais à direita
não são reativos e os metais no meio da lista são moderadamente
reativos. Portanto, os metais à esquerda são fortes agentes redutores,
pois têm grande tendência a se oxidar. O hidrogênio é incluído nesta
listagem, apesar de não ser um metal, pois sua posição na lista separa
os metais que reagem com ácido liberando hidrogênio gasoso (metais à
esquerda do hidrogênio, na lista) daqueles que não reagem com ácido
liberando hidrogênio (metais à direita do hidrogênio, na lista):
H+(aq) + e-
H2(g)
Os metais à esquerda do Mg são tão reativos que eles reagem
diretamente com água fria. Por exemplo:
2Na(s) + 2H2O(l)
2Na+(aq) + 2OH-(aq) + H2(g)
Série de reatividade dos metais
Li,K,Rb, Cs,Ba,Sr,Ca,Na,Mg,Al,Mn,Zn,Fe,Co,Ni,Sn,Pb,H,Cu,Ag,Pd,Pt,Au
Os metais desde o ferro até o magnésio somente reagem com água em
ebulição ou com vapor d’água, liberando hidrogênio gasoso. Os metais
à esquerda do ferro, mas à direita do hidrogênio são menos reativos e
liberam hidrogênio de ácidos, mas não de água; por exemplo:
2Sn(s) + 2HCl(l)
SnCl2(aq) + H2(g)
Série de reatividade dos metais
Em contato com HCl:
Mg: Reagirá imediatamente e bastante vigorosamente, liberando
hidrogênio e "desaparecendo" (os íons magnésio ficam dissolvidos,
gerando uma solução de cloreto de magnésio).
Zn: Reagirá um pouco menos vigorosamente que o Mg.
Al: Reagirá vigorosamente, mas somente após um certo tempo (o
alumínio metálico está recoberto com um filme protetor de óxido de
alumínio, resultante da reação do alumínio com o oxigênio do ar; a
demora na reação do alumínio com o ácido deve-se ao tempo que
leva para o ácido reagir com o filme de óxido, assim removendo-o.
Série de reatividade dos metais
Em contato com HCl:
Fe: Reagirá bem mais lentamente com HCl. Somente depois de um certo
tempo é que algumas bolhas de hidrogênio se tornarão visíveis, juntamente
com uma coloração amarela decorrente da formação do íon ferro (III), Fe3+.
Sn: Reação será visível na forma de pequenas bolhas de hidrogênio na
superfície do metal, mas somente depois de 10 minutos a 15 minutos.
Cu: Não reagirá, embora uma leve coloração amarela possa ser observada
na solução em decorrência da formação do íon complexo CuCl42-(aq),
resultante da reação do ácido com o fino filme de óxido que recobre o
cobre. O hidrogênio tem maior tendência a se oxidar que o cobre.