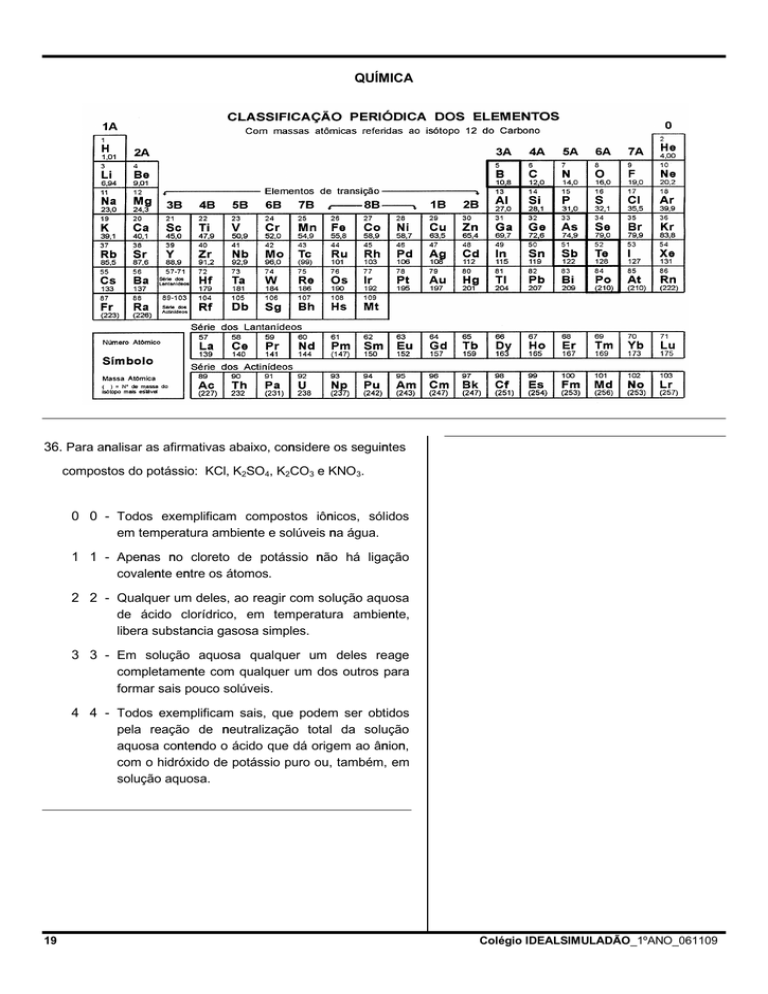
QUÍMICA
36. Para analisar as afirmativas abaixo, considere os seguintes
compostos do potássio: KCl, K2SO4, K2CO3 e KNO3.
0 0 - Todos exemplificam compostos iônicos, sólidos
em temperatura ambiente e solúveis na água.
1 1 - Apenas no cloreto de potássio não há ligação
covalente entre os átomos.
2 2 - Qualquer um deles, ao reagir com solução aquosa
de ácido clorídrico, em temperatura ambiente,
libera substancia gasosa simples.
3 3 - Em solução aquosa qualquer um deles reage
completamente com qualquer um dos outros para
formar sais pouco solúveis.
4 4 - Todos exemplificam sais, que podem ser obtidos
pela reação de neutralização total da solução
aquosa contendo o ácido que dá origem ao ânion,
com o hidróxido de potássio puro ou, também, em
solução aquosa.
19
Colégio IDEALSIMULADÃO_1ºANO_061109
37. Sobre tabela periódica, massas atômicas de elementos e
de seus isótopos, e propriedades de átomos e íons,
afirma-se que:
0 0 - Apenas o isótopo de número de massa 12 do
carbono
(C-12)
tem
massa
atômica
numéricamente igual ao número de massa do
isótopo mais estável desse elemento.
1 1 - A quantidade de prótons de um átomo é a mesma
que existe no seu(s) íon(s) simples. Entretanto, a
quantidade de elétrons nessas espécies é,
obrigatoriamente, diferente.
2 2 - Nas famílias de elementos as densidades
aumentam, em geral, com o aumento da massa
atômica.
3 3 - Quando um átomo não metálico se converte em
ânion, estabilizando-se, sofre oxidação. Ao
contrário,quando um átomo metálico se converte
em cátion,estabilizando-se, sofre redução.
4 4 - A massa de 1 mol de átomos de alumínio é menor
que a de 6,0 x 1023 moléculas de água.
38. Julgue as afirmações que seguem sobre as propriedades
da matéria, suas transformações e constituição.
0 0 - Na combustão da gasolina, quanto menor a
proporção de ar em relação ao combustível, maior
a possibilidade de formação de gás carbônico e
menor a quantidade de gasolina sem queimar.
1 1 - As densidades do álcool comum e do ácido
sulfúrico puro são próximas de 0,8 g/ mL e de 1,8
g / mL, respectivamente. Assim, para massas
iguais dos dois líquidos, há um maior volume de
álcool.
2 2 - Quando 32 gramas de gás oxigênio (O2) são
convertidos totalmente em ozônio (O3), obtem-se
48 gramas deste gás.
3 3 - Admitindo que um minério de chumbo contenha
20% de PbS,o teor do metal deverá ser pouco
maior que 17%.
4 4 - Segundo Arrhenius, na reação em fase gasosa
entre HCl e NH3 ,onde se forma cloreto de amônio
sólido, a amônia é uma base porque aceita o
próton doado pelo HCl.
20
Colégio IDEALSIMULADÃO_1ºANO_061109
39. Considerando as propriedades dos compostos inorgânicos
e as funções a que pertencem, analise as proposições
abaixo.
0 0 - Sabe-se que Fe3O4, um óxido salino, reage com
solução aquosa de HCl para formar água e dois
sais,FeCl2 e FeCl3.A reação completa é de
oxirredução e cada mol do óxido exige 6 mols de
moléculas do ácido.
1 1 - O sulfato de certo metal M tem fórmula MSO4.
Portanto,
na
menor
partícula
do
bicarbonato(hidrogenocarbonato) do metal M,há
um cátion M2+ e dois ânions HCO3-.
2 2 - A amônia é gás em temperatura ambiente e suas
moléculas polares têm estrutura piramidal.
Portanto, nas condições ambientais, as moléculas
de amônia encontram-se unidas por pontes de
hidrogênio.
3 3 - Soluções aquosas de ácidos fortes reagem, em
temperatura ambiente, com sais contendo ânions
de ácidos fracos (e de ácidos voláteis), para
formar esses ácidos. Sendo assim, ao reagir com
cianeto de sódio, HNO3 deve liberar gás cianídrico,
HCN.
4 4 - Irá ocorrer desprendimento de gás cloro quando
pregos de aço (ferro) são adicionados a uma
solução aquosa de ácido clorídrico.
40. Julgue verdadeiro ou falso.
0 0 - As idéias de Niels Bohr sobre o átomo de
hidrogênio basearam-se principalmente
no
movimento do elétron em órbitas circulares, cujos
raios e energias tinham valores bem definidos. Ao
passar para uma órbita mais afastada o elétron
absorveria uma certa quantidade de energia.Essa
energia,sob a forma de luz, seria devolvida
quando o elétron retornasse à órbita primitiva.
1 1 - Ao aquecer uma massa m1 de palha de aço
durante algum tempo, ela se converte numa
massa m2 de óxido de ferro, onde m1 > m2.
2 2 - Os principais componentes do gesso e do
mármore são sulfato de cálcio (CaSO4) e
carbonato de cálcio(CaCO3),respectivamente.
21
Colégio IDEALSIMULADÃO_1ºANO_061109
3 3 - A idéia de que o átomo não seria a menor
partícula da matéria, surgiu com a experiência
das lâminas de ouro, realizada por Rutherford e
colaboradores,em 1911.
4 4 - É possível deduzir da tabela periódica, que o
composto formado entre um elemento
calcogênio (C) e outro, alcalino (A) seja iônico,
de fórmula empírica A2C onde, para cada ânion
C2-, há dois cátions A+.
22
Colégio IDEALSIMULADÃO_1ºANO_061109