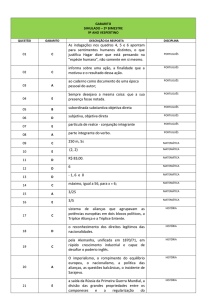
ESCOLA TÉCNICA ESTADUAL FREDERICO GUILHERME SCHMIDT
Rua Bento Gonçalves, 1171 – Telefone: 3592.1795 - CEP: 93010-220 – São Leopoldo – RS
NOME: _______________________________________ TURMA:________
DISCIPLINA: Química/ Ciências da Natureza PROFESSORA: Águeda Lista de revisão 1° ano
01 - Classifique cada um dos seguintes itens como substância pura ou mistura, no caso de uma mistura,
indique se é homogênea ou heterogênea:
a) arroz-doce
b) água do mar c) magnésio
d)gasolina
e) ar
02 - Caracterize cada um dos seguintes itens como um processo físico ou químico:
a) Corrosão do alumínio
b) fusão do gelo
c) trituração da asperina d) digestão de uma bala
e) explosão da nitroglicerina
03 - Observe a tabela que apresenta as temperaturas de fusão e de ebulição de algumas substâncias.
Substância
Temperatura
de fusão (ºC)
Temperatura
de ebulição (ºC)
I
- 117,3
78,5
II
- 93,9
65
III
801
IV
3550
V
- 95
Em relação aos estados físicos das substâncias, a alternativa correta é:
a)
I é sólido a 25ºC.
b)
II é líquido a 80ºC.
c)
III é líquido a 1000ºC.
d)
IV é gasoso a 3500ºC.
e)
V é sólido a 100ºC.
1413
4827
110,6
04 - Os gráficos seguintes correspondem a diagramas de mudança de estado físico. (TE = temperatura de
ebulição, TF = temperatura de fusão).
Na análise destes gráficos podemos afirmar:
a)
b)
c)
d)
e)
Os gráficos A e C correspondem aos diagramas de misturas.
Os gráficos A, B e C correspondem aos diagramas de substâncias simples.
Os gráficos B e C correspondem aos diagramas de misturas de substâncias.
Os gráficos B e C correspondem aos diagramas de mistura eutéticas.
Os gráficos B e C correspondem aos diagramas de misturas azeotrópicas.
05 - O esquema representa 3 tubos de ensaio de mesmo diâmetro, contendo cada um a mesma massa dos seguintes
líquidos incolores: água, acetona e clorofórmio.
I
Dadas as densidades:
II
III
d H 2O 1,00g / cm3 , d acetona 0,80 g / cm3 , dclorofórmio 1,50 g / cm3 .
* Podemos afirmar que os tubos I, II e III contêm, respectivamente:
06 - Um sistema formado por água, açúcar dissolvido, álcool comum, limalha de ferro e carvão apresenta
quantas fases? ___________________________________________
07 - Os átomos de um elemento químico possuem a seguinte distribuição de elétrons em subníveis e níveis,
em torno do núcleo:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3
A localização do elemento (período e grupo) na tabela periódica é:
a)terceiro período, grupo 9 ou 8B. b)quarto período, grupo 13 ou 13A. c)quarto período, grupo 10 ou 7B.
d)
quinto período, grupo 13 ou 3A. e)quinto período, grupo 15 ou 5A.
08 - O cálcio é o elemento da rigidez e da construção: é o cátion dos ossos do nosso esqueleto, das
conchas dos moluscos, do concreto, da argamassa e da pedra calcária das nossas construções. Sabendo
que o átomo de cálcio tem número atômico 20 e número de massa 40, é correto afirmar que o cátion
Ca2+ tem:
a) 18 prótons. b) 18 nêutrons. c) 20 elétrons.
d)configuração eletrônica igual à do íon K+ (Z = 19). e)configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2.
08 - Considere a tabela abaixo, que fornece características de cinco átomos (I, II, III, IV e V).
Número de elétrons
Átomo
Número
atômico
Número
de massa
I
11
23
de valência
1
na camada
II
11
24
1
III
IV
19
20
40
40
1
2
V
40
90
2
São isótopos entre si os átomos
a)
I e I I. b)I I. e III. c)I, I I. e III. d)III e IV. e)IV e V.
09 - Considerando os elementos químicos representados por 19A42, 19B40 e
correto V e falso F.
( ) Os elementos A e B são isótopos.
( ) Os elementos A e C são isóbaros.
( ) Os elementos B e C são isótonos.
( ) O elemento A é o que possui maior número de nêutrons no núcleo.
42
21C ,
assinale o que for
10 - Os trabalhos de Joseph John Thomson e Ernest Rutherford resultaram em importantes contribuições
na história da evolução dos modelos atômicos e no estudo de fenômenos relacionados à matéria. Das
alternativas abaixo, aquela que apresenta corretamente o autor e uma de suas contribuições é:
a)
Thomson - Concluiu que o átomo e suas partículas formam um modelo semelhante ao sistema
solar.
b) Thomson - Constatou a indivisibilidade do átomo.
c) Rutherford - Pela primeira vez, constatou a natureza elétrica da matéria.
d) Thomson - A partir de experimentos com raios catódicos, comprovou a existência de partículas
subatômicas.
e) Rutherford - Reconheceu a existência das partículas nucleares sem carga elétrica, denominadas
nêutrons.
11 - Até algum tempo atrás, adolescentes colecionavam figurinhas que brilhavam no escuro. Essas figuras
apresentam em sua composição uma substância chamada sulfeto de zinco (ZnS). Este fenômeno ocorre
porque alguns elétrons que compõe os átomos desta substância absorvem energia luminosa e “saltam” para
níveis de energia mais externos. No escuro, estes elétrons retornam aos seus níveis de origem liberando
energia luminosa e fazendo a figurinha brilhar. Este fenômeno pode ser explicado considerando o modelo
atômico proposto por
a)
Thomson. b)
Dalton. c)Lavoisier. d) Bohr. e)Linus Pauling.
12 - Leia o texto a seguir.
A aceitação histórica da ideia de que a matéria é composta de átomos foi lenta e gradual. Na Grécia antiga,
Leucipo e Demócrito são lembrados por terem introduzido o conceito de átomo, mas suas propostas foram
rejeitadas por outros filósofos e caíram no esquecimento. No final do século XVIII e início do século XIX,
quando as ideias de Lavoisier ganhavam aceitação generalizada, surgiu a primeira teoria atômica moderna,
proposta por _______. Essa teoria postulava que os elementos eram constituídos de um único tipo de átomo,
enquanto que as substâncias compostas eram combinações de diferentes átomos segundo proporções
determinadas. Quase cem anos depois, estudos com raios catódicos levaram J. J. Thomson à descoberta do
_______, uma partícula de massa muito pequena e carga elétrica _______, presente em todos os materiais
conhecidos. Alguns anos depois, por meio de experimentos em que uma fina folha de ouro foi bombardeada
com partículas alfa, Rutherford chegou à conclusão de que o átomo possui em seu centro um _______
pequeno, porém de massa considerável.
As palavras que preenchem as lacunas correta e respectivamente estão reunidas em
a)Dalton – elétron – negativa – núcleo b) Bohr – cátion – positiva – elétron
c)Dalton – nêutron – neutra – próton d) Bohr – fóton – negativa – ânion
e)Dalton – próton – positiva – núcleo
13 - Assinale abaixo a alternativa que representa, de forma correta, as quantidades de prótons, nêutrons e
2
elétrons, respectivamente, do íon 138
56 Ba
a)56, 54 e 82 b) 56, 82 e 54 c)54, 82 e 56 d)56, 138 e 56 e) 54, 82 e 138
14 - A mudança de fase denominada sublimação ocorre quando
a)o gelo seco é exposto ao ar ambiente. b) o gelo comum é retirado do congelador.
c)um prego se enferruja com a exposição ao ar úmido. d)uma porção de açúcar comum é aquecida até
carbonizar-se. e) uma estátua de mármore é corroída pela chuva ácida.
15 - O aspirador de pó é um eletrodoméstico que permite separar misturas do tipo sólido-gás por
a)centrifugação. b)filtração. c)destilação. d)decantação. e) levigação.
16 - A separação de misturas é uma das principais operações realizadas em pequena escala em laboratórios, e
em grande escala em indústrias nos diversos setores. Para separar de maneira eficiente as misturas querosene
e água (1), álcool e água (2) e hidróxido de sódio e água (3), os procedimentos corretos, na ordem 1, 2, 3, são:
a)decantação, destilação e destilação. b)filtração, sifonação e precipitação. c)decantação, destilação e
filtração. d)
destilação, decantação e decantação. e)destilação, sifonação e filtração.
17 - Durante a realização de uma aula prática, a respeito da separação de misturas, o professor trouxe aos
alunos três frascos A, B e C, contendo as seguintes misturas binárias:
A: Líquida homogênea, cujos pontos de ebulição diferem em 25ºC.
B: Sólida heterogênea, composta por naftalina (naftaleno) moída e areia.
C: Sólido-líquida homogênea, composta por NaCl e água.
Assinale a alternativa que contém, respectivamente, os processos utilizados para a separação inequívoca
dos componentes das misturas A, B e C.
a)destilação simples, sublimação e filtração. b) evaporação, catação e destilação fracionada.
c)destilação fracionada, separação magnética e destilação simples. d)destilação fracionada, sublimação e
destilação simples. e)destilação simples, evaporação e destilação fracionada.
18 - A figura representa a curva de aquecimento de uma amostra, em que S, L e G significam,
respectivamente, sólido, líquido e gasoso. Com base nas informações da figura é CORRETO afirmar que
a amostra consiste em uma
a)
b)
c)
d)
e)
substância pura.
mistura coloidal.
mistura heterogênea.
mistura homogênea azeotrópica.
mistura homogênea eutética.
19 - Em um experimento na aula de laboratório de química, um grupo de alunos misturou em um
recipiente aberto, à temperatura ambiente, quatro substâncias diferentes:
Nas anotações dos alunos, consta a informação correta de que o número de fases formadas no recipiente
e sua ordem crescente de densidade foram, respectivamente:
a) 2; mistura de água e etanol; mistura de grafite e polietileno.
b) 3; polietileno; mistura de água e etanol; grafite.
c) 3; mistura de polietileno e etanol; água; grafite.
d) 4; etanol; polietileno; água; grafite.
e) 4; grafite; água; polietileno; etanol.
20 - A famosa experiência de Rutherford levou-o a propor um novo modelo de átomo. Segundo esse modelo,
o átomo:
a) é uma esfera contendo cargas positivas e negativas, distribuidas uniformemente;
b) é uma esfera maciça, homogênea, indivisível, indestrutível e imutável;
c) possui certo número de órbitas, com energia constante, nas quais o elétron pode movimentar-se sem ganhar
ou perder energia;
d) possui regiões ao redor do núcleo onde é mais provável de se encontrar um dado elétron, denominadas
orbitais;
e) apresenta uma região central, extremamente densa, denominada núcleo, onde se concentra a sua carga
positiva.
21 – Diferencie fenômeno químico de fenômeno físico e exemplifique.