PONTIFÍCIA UNIVERSIDADE CATÓLICA DE MINAS GERAIS
Instituto de Ciências Biológicas e da Saúde
Departamento de Medicina Veterinária
Curso de Medicina Veterinária em Betim
Lorena Costa Mourão
DOENÇAS BACTERIANAS EM TILÁPIAS DO NILO
(Oreochromis niloticus) CULTIVADAS EM
SISTEMA INTENSIVO
Betim
2013
Lorena Costa Mourão
DOENÇAS BACTERIANAS EM TILÁPIAS DO NILO
(Oreochromis niloticus) CULTIVADAS EM
SISTEMA INTENSIVO
Monografia apresentada ao Curso de Medicina
Veterinária em Betim da Pontifícia Universidade
Católica de Minas Gerais, como requisito parcial
para obtenção do título de Bacharel em Medicina
Veterinária.
Orientador: Marco Túlio Diniz Peixoto
Betim
2013
Lorena Costa Mourão
DOENÇAS BACTERIANAS EM TILÁPIAS DO NILO
(Oreochromis niloticus) CULTIVADAS EM
SISTEMA INTENSIVO
Monografia apresentada ao Curso de Medicina
Veterinária em Betim da Pontifícia Universidade
Católica de Minas Gerais, como requisito parcial
para obtenção do título de Bacharel em Medicina
Veterinária.
____________________________________________
Marco Túlio Diniz Peixoto (Orientador) – PUC Minas
____________________________________________
Isabella Bias Fortes – PUC Minas
____________________________________________
Guilherme Campos Tavares – UFMG
Betim, 21 de julho de 2013
AGRADECIMENTOS
A todos que contribuíram para a realização deste trabalho, fica expressa aqui a minha
gratidão, especialmente:
Ao professor Marco Túlio, pela orientação, aprendizado e por tornar possível a
realização deste trabalho.
Ao Guilherme Tavares pelo auxílio nas dúvidas e ajuda em todos os momentos
necessários.
A Andréia pela paciência e ajuda na realização desse trabalho. A professora Isabel
pela cooperação.
Aos meus pais, irmã e amigos pelo carinho, incentivo e pelo apoio constantes.
A todos que, de alguma forma, contribuíram para esta construção.
RESUMO
O Brasil reúne condições extremamente favoráveis para a aquicultura, principalmente devido
ao seu grande potencial hídrico. Dentre as espécies de peixes cultivadas no Brasil, a que
possui maior produção e importância na aquicultura nacional é a tilápia do Nilo (Oreochromis
niloticus). O aumento significativo das atividades relacionadas à aquicultura levou a uma
maior intensificação do manuseio, altas taxas de estocagem, problemas na qualidade da água e
maior estresse aos peixes. Isso favorece a ocorrência de infecções por organismos
patogênicos, trazendo como consequência grandes perdas e prejuízos econômicos na
produção. Treze peixes provenientes de quatro pisciculturas distintas foram submetidos ao
exame de diagnostico bacteriológico de fragmentos do fígado, rins, cérebro, baço, intestino,
pele e ovário. Foi identificado Aeromonas sp., Streptococcus agalactiae, Streptococcus spp.,
Escherichia coli, Klebsiella spp. e Clostridium sp. O isolado de Aeromonas sp. apresentou
sensibilidades a todos os antibióticos testados, os isolados S. agalactiae apresentaram
resistência frente aos antibióticos cloranfenicol, sulfametoxazol + trimetoprim e sulfonamida
em uma propriedade e em outra apresentou resistência a oxacilina e
sulfametoxazol +
trimetoprim. As bactérias isoladas nesse estudo são ambientais, mas de grande importância
para a aquicultura nacional, pois podem representar risco para a saúde das tilápias e do
próprio consumidor.
Palavras chave: Tilápias do Nilo, piscicultura, bacterioses, sanidade.
ABSTRACT
Brazil has extremely favorable conditions for aquaculture, mainly due to its large hydro
potential. Among the fish species cultivated in Brazil, has the highest production and national
importance in aquaculture is the tilapia (Oreochromis niloticus). The significant increase in
the activities related to aquaculture led to further intensification of handling, high stocking
rates, problems in water quality and increased stress on fish. This favors the occurrence of
infections by pathogenic organisms, as a result bringing huge losses and economic losses in
production. Thirteen fish from four different fish farms underwent diagnostic bacteriological
examination fragments of liver, kidney, brain, spleen, bowel, skin, and ovary. Was identified
Aeromonas sp., Streptococcus agalactiae, Streptococcus spp., Escherichia coli, Klebsiella
spp. and Clostridium sp.. The isolate of Aeromonas spp. showed sensitivity to all tested
antibiotics, isolates S. agalactiae were resistant against antibiotics chloramphenicol,
sulfamethoxazole and trimethoprim sulfonamide in a property and another showed resistance
to oxacillin and trimethoprim-sulfamethoxazole. The bacteria isolated in this study are
environmental, but of great importance to the national aquaculture, as they may pose a risk to
the health of tilapia and consumers themselves.
Keywords: Nile tilapia, pisciculture, bacterial diseases, sanity.
LISTA DE FIGURAS
FIGURA 1 -
Produção de pescado (t) nacional da aquicultura (marinha e
continental) de 1980 a 2010..................................................................... 14
FIGURA 2-
Produção da aquicultura e distribuição das principais espécies por
região do Brasil........................................................................................ 14
FIGURA 3 -
Distribuição percentual e o volume de produção das principais espécies
da piscicultura no Brasil........................................................................... 15
FIGURA 4-
Tilapia rendalli.........................................................................................
16
FIGURA 5-
Tilápia do Nilo (Oreochromis niloticus)..................................................
16
FIGURA 6 -
Evolução da produção de tilápia cultivada no Brasil...............................
17
FIGURA 7 -
Estruturas básicas que compõem um tanque-
19
rede....................................
FIGURA 8 -
Trato digestivo de duas tilápias do mesmo tamanho................................
FIGURA 9 -
Mortalidade de tilápias em tanque rede.................................................... 23
FIGURA 10 -
Olho da tilápia apresentando a córnea ulcerada e hemorrágica...............
24
FIGURA 11 -
Nadadeira peitoral normal e com lesão....................................................
24
FIGURA 12 -
Sintomas nervosos - natação errática e perda de equilíbrio na água........
27
FIGURA 13 -
Escurecimento do corpo – peixe sadio (de cima) x peixe doente (de
baixo)........................................................................................................ 27
FIGURA 14 -
Tilápia à direita com distensão abdominal (ascite)..................................
28
FIGURA 15 -
Exoftalmia causada por estreptocose.......................................................
28
FIGURA 16 -
Mancha despigmentada na pele (perda de escama) que pode evoluir
para Úlcera............................................................................................... 31
FIGURA 17 -
Lesão ulcerativa em tilápia: infecção por Aeromonas.............................. 31
FIGURA 18 -
Hemorragias difusas: infecção por Aeromonas........................................
FIGURA 19 -
Tilápia apresentando fígado aumentado e vesícula biliar repleta de
Bílis........................................................................................................... 31
FIGURA 20 -
Tilápia apresentando opacidade da córnea...............................................
33
FIGURA 21 -
Tilápia com septicemia provocada por Edwardsiella tarda.....................
33
FIGURA 22 -
Manchas descoloridas e localizadas na pele............................................. 37
FIGURA 23 -
Podridão das nadadeiras em tilápia causada por Flavobacterium
columnare.................................................................................................
37
Tilápia com o rim e baço aumentado e presença de numerosos nódulos
brancos em ambos os órgãos....................................................................
38
FIGURA 24 -
23
31
FIGURA 25 -
Corte histológico do baço com granulomas (A) e tecidos normais do
baço (B)....................................................................................................
39
FIGURA 26 –
Tilápia do Nilo........................................................................................
54
FIGURA 27 -
Necropsia do peixe..................................................................................
55
FIGURA 28 -
Coleta de material para semeadura em meios de cultura.........................
55
FIGURA 29 -
Colônias de bactérias em amostras do baço.............................................
57
FIGURA 30 -
Resultado do PCR das amostras testadas para S. agalactiae, dos peixes
2 e 3 da piscicultura A, localizada na cidade de Morada Nova de
Minas, MG................................................................................................
FIGURA 31 -
58
Resultado do PCR da amostra testada para S. agalactiae, do peixe da
piscicultura B, localizada na cidade de Morada Nova de Minas,
MG............................................................................................................
61
LISTA DE QUADROS
QUADRO 1 -
Principais bactérias patogênicas na tilapicultura...................................... 22
QUADRO 2 -
Resultado da cultura bacteriológica dos peixes 1, 2 e 3 da piscicultura
A, localizada na cidade de Morada Nova de Minas, MG.........................
QUADRO 3 -
Resultado da cultura bacteriológica do peixe da piscicultura B,
localizada na cidade de Morada Nova de Minas, MG.............................
QUADRO 4 -
60
Resultado cultura bacteriológica do peixe 1 e 2 da piscicultura C,
localizada na cidade de Morada Nova de Minas, MG.............................
QUADRO 5 -
57
62
Resultado cultura bacteriológica dos alevinos, fêmea e reprodutor da
piscicultura D, localizada na cidade de Morada Nova de Minas,
MG....................................................................................................
63
LISTA DE TABELAS
TABELA 1 -
Produção de pescados (t) da aquicultura continental por espécie............
TABELA 2 -
Resultado do antibiograma do peixe 1 da piscicultura A, localizada na
cidade de Morada Nova de Minas, MG...................................................
TABELA 3 -
59
Resultado do antibiograma do peixe 3 da piscicultura A, localizada na
cidade de Morada Nova de Minas, MG...................................................
TABELA 5 -
59
Resultado do antibiograma do peixe 2 da piscicultura A, localizada na
cidade de Morada Nova de Minas, MG...................................................
TABELA 4 -
15
59
Resultado do antibiograma da amostra de Aeromonas sp. isolada do
peixe da piscicultura B, localizada na cidade de Morada Nova de
Minas, MG..........................................................................................
TABELA 6 -
61
Resultado do antibiograma da amostra de Streptococcus agalactiae
isolada do peixe da piscicultura B, localizada na cidade de Morada
Nova de Minas, MG.................................................................................
62
LISTA DE ABREVIATURAS E SIGLAS
BHI
Brain heart infusion
b.i
Banho de imersão
DGGE
Eletroforese em gel com gradiente desnaturante
DNA
Ácido desoxirribonucleico
DNOCS
Departamento Nacional de Obras Contra as Secas
FAO
Organização das Nações Unidas para Alimentação e Agricultura
FRLP
Polimorfismo no comprimento de fragmento de restrição
g
Grama
GIFT
Genetically Improved Farmed Tilapia
ha
Hectare
hab
Habitante
i.p
Injeção intraperitoneal
Kcal
Quilocaloria
Kg
Quilograma
Km
Quilômetro
m3
Metro cúbico
MAPA
Ministério da Agricultura, Pecuária e Abastecimento
mg
Miligramas
ml
Mililitro
MPA
Ministério da Pesca e Aquicultura
OMS
Organização Mundial da Saúde
PCR
Reação em Cadeia da Polimerase
PFGE
Eletroforese em campo pulsado
pH
Potencial hidrogeniônico
pv
Peso vivo
RAPD
Amplificação aleatória de DNA polimórfico
RNAr
Ácido ribonucleico ribossômico
t
Toneladas
TGGE
Eletroforese em gel com gradiente de temperatura
TSA
Tryptic Soy Agar
v.o
Via oral
µm
Micrometro
SUMÁRIO
1 INTRODUÇÃO............................................................................................................. 12
2 REVISÃO DA LITERATURA....................................................................................
2.1 Aquicultura nacional.................................................................................................
2.2 O cultivo de tilápias...................................................................................................
2.2.1 Sistemas de criação..................................................................................................
2.3 Enfermidades em tilapicultura.................................................................................
2.3.1 Doenças bacterianas................................................................................................
2.3.1.1 Estreptococoses ...................................................................................................
2.3.1.2 Septicemia móvel causada por Aeromonas........................................................
2.3.1.3 Edwardsiellose……………………………………………………………..........
2.3.1.4 Escherichia coli e Klebsiella sp………………………………………………....
2.3.1.5 Columnariose.......................................................................................................
2.3.1.6 Francisella sp.......................................................................................................
2.3.1.7 Clostridiose...........................................................................................................
2.3.2 Tratamento das principais enfermidades bacterianas em tilápias.........................
2.3.3 Controle das enfermidades bacterianas..................................................................
2.3.4 Certificação sanitária na aquicultura.....................................................................
13
13
16
18
20
21
25
29
32
33
35
37
39
45
48
52
3 CASUÍSTICA................................................................................................................
3.1 Material e métodos.....................................................................................................
3.2 Resultados...................................................................................................................
3.2.1 Piscicultura A...........................................................................................................
3.2.2 Piscicultura B...........................................................................................................
3.2.3 Piscicultura C...........................................................................................................
3.2.4 Piscicultura D...........................................................................................................
53
53
56
56
60
62
63
4 DISCUSSÃO.................................................................................................................. 63
5 CONCLUSÃO............................................................................................................... 66
REFERÊNCIAS............................................................................................................... 67
12
1
INTRODUÇÃO
Nos últimos anos, a aquicultura vem se firmando como atividade pecuária e é
apontada como o segmento responsável pelo aumento da oferta mundial de pescado, sendo
este, a primeira fonte de proteína de origem animal no mundo. A elevada taxa de crescimento
da aquicultura, e mais especificamente da piscicultura pode ser explicada simultaneamente
pela tendência de aumento da demanda por carnes brancas associadas à redução dos estoques
mundiais de pescados disponíveis em ambiente natural.
Dentre as espécies de peixes cultivadas no Brasil, a que possui maior produção e
importância na aquicultura nacional é a tilápia do Nilo (Oreochromis niloticus). Esta espécie,
proveniente da África, foi introduzida em nosso país devido ao seu excelente desempenho em
ganho de peso, crescimento, grande adaptação a diferentes tipos de ambientes e sistema de
produção, resistência a enfermidades, reproduzirem facilmente, além de ser uma carne de
excelente qualidade nutricional e possuir boa aceitação por parte dos consumidores (JÚNIOR;
JÚNIO, 2008; TAVARES; PALHARES, 2011).
O mais antigo e tradicional sistema de produção de tilápias praticado no Brasil é em
viveiros escavados, mas, o sistema de cultivo normalmente utilizado é o intensivo em tanques
rede, caracterizado por alta taxa de estocagem de peixes e, consequentemente, arraçoamento
intensivo, o que pode resultar em diminuição da qualidade da água e aumentar o estresse entre
os animais, tornando-os susceptíveis às enfermidades infecciosas (LONGHI et al, 2012).
A intensificação dos cultivos traz como consequência elevação da matéria orgânica,
que por sua vez, favorece a multiplicação de microrganismos. Dentre eles, destacam-se as
bactérias, por se proliferarem rapidamente em ambiente aquáticos e persistirem em
hospedeiros, sem provocar a doença, até que ocorram alterações capazes de causar danos ao
sistema imune do animal (MEIRELLES, 2010).
Os fatores que influenciam a susceptibilidade das tilápias às doenças são: espécie ou
linhagem envolvida, condições de qualidade da agua e carga orgânica nas unidades de
produção, estado nutricional dos peixes e condições de temperatura da agua, já que este fator
influencia diretamente a resposta imunológica das tilápias.
As principias espécies de bactérias patogênicas para tilápias são: Aeromonas sp.,
Flavobacterium columnare, Edwardsiella tarda e Streptococcus sp. (KUBITZA, 2008).
O surgimento de enfermidades nos diferentes sistemas de cultivo de tilápias representa
um importante fator de impacto na sanidade afetando, sobretudo no rendimento da produção e
na qualidade do produto que chega a mesa do consumidor (MEIRELLES, 2010).
13
2
REVISÃO DA LITERATURA
2.1
Aquicultura Nacional
Formado por 8.400 km de costa marítima e 5.500.000 hectares em reservatórios de
águas doces, o Brasil comporta aproximadamente 12 % da água doce disponível no planeta e
apresenta um grande potencial para o desenvolvimento da aquicultura (CREPALDI et al,
2006).
O Brasil é um dos líderes mundiais na produção e exportação de frango, carne suína e
bovina. Mesmo possuindo uma grande superfície de água disponível para a criação de peixes,
o pescado nunca ocupou um papel de destaque na produção de proteína animal no país, e isso
pode ser justificado devido ao baixo consumo anual de peixes pela população brasileira, que é
de 9,75 kg/hab./ano, comparado com o consumo per capita mundial de 18 kg/hab./ano, sendo
que o consumo recomendado pela OMS é de 12 kg/hab./ano (PROCHMANN; MICHELS,
2003; FAO, 2010).
No entanto, nas últimas quatro décadas, o consumo de peixes no Brasil e no mundo
vem aumentando, pois a população vem buscando, cada vez mais, produtos com perfil
nutricional adequado e, o pescado ganha destaque por possuir carne muito nutritiva, com
baixo teor de gordura, rica em proteínas, aminoácidos, vitaminas e minerais, além de possuir
elevados teores de ômega-3, trazendo benefícios à saúde humana (CREPALDI et al, 2006).
De acordo com a Organização das Nações Unidas para Alimentação e Agricultura
(FAO), a produção aquícola brasileira teve início em 1968, quando foram reportadas menos
de 0,5 t. Desde então, a aquicultura nacional tem mostrado um crescimento gradual, atingindo
o pico de produção em 2003, com 273.268 t (Figura 1). Após uma pequena queda nos anos de
2004 e 2005, a produção retomou o crescimento, registrando os maiores valores em 2008,
2009 e 2010, com 365.367 t, 415.649 t e 479.398 t, respectivamente (MPA, 2010). Nos
últimos 10 anos a aquicultura nacional cresceu a uma taxa média de 10% ao ano, contra um
crescimento mundial de 6% ao ano no mesmo período (KUBITZA et al, 2012).
Figura 1: Produção de pescado (t) nacional da aquicultura
(marinha e continental) de 1980 a 2010.
14
Fonte: MPA, 2010.
As regiões sul e nordeste são as principais regiões produtoras, respondendo juntas por
61% da produção aquícola nacional (Figura 2). As regiões sudeste e centro-oeste são
responsáveis por 30% da produção e a região norte tem a menor participação na produção
nacional, com 9% (KUBITZA et al, 2012).
Figura 2: Produção da aquicultura e distribuição das
principais espécies por região do Brasil
Fonte: KUBITZA et al, 2012
15
O perfil da aquicultura brasileira em termos da representatividade das espécies
cultivadas, de acordo com os dados do Ministério da Pesca e Aquicultura (MPA) entre o ano
de 2008 e 2010, está discriminado na Tabela 1.
Tabela 1: Produção de pescados em (t) da aquicultura continental por espécie.
Espécie
Carpa
Tilápia
Tambaqui
Pacu
Pirapitinga
Pintado
Tambacu
Piau
Traíra
Truta
Outros
2008
67.624,2
111.145,3
38.833,0
15.190,0
560,2
1.777,8
15.459,0
5.227,0
190,4
3.662,6
8.122,0
Produção (t)
2009
80.895,5
132.958,3
46.454,1
18.171,0
670,2
2.126,7
18.492,8
6.252,0
227,7
4.381,4
9.715,9
2010
94.579,0
155.450,8
54.313,1
21.245,1
783,6
2.486,5
21.621,4
7.227,6
266,3
5.122,7
11.359,6
Fonte: MPA, 2010
A tilápia, espécie pouco valorizada até meados da década de 90, é hoje a principal
espécie cultivada no Brasil com 155.450 toneladas em 2010 (KUBITZA et al, 2012). Os
peixes redondos, grupo que reúne o tambaqui, o pacu, a pirapitinga e os diferentes híbridos
entre essas espécies, somaram 102.880 toneladas em 2010 (figura 3) (KUBITZA et al, 2012).
Figura 3: Distribuição percentual e o volume de produção das principais espécies da
piscicultura no Brasil.
Fonte: KUBITZA et al, 2012.
16
2.2 O cultivo de tilápias
A tilápia é uma das espécies de peixes mais produzidas em todo o mundo, e no Brasil é
o peixe mais cultivado (BRISTOT, 2008). Apesar de sua introdução em caráter experimental
no Brasil, ainda na metade do século passado, somente em 1971, através do Departamento
Nacional de Obras Contra as Secas (DNOCS), foi implementado um programa oficial de
produção de alevinos de tilápia do Nilo, com origem na Costa do Marfim, para povoamento
dos reservatórios públicos da região Nordeste (JÚNIOR; JÚNIO, 2008). No entanto, apenas
no início da década de 90 a tilapicultura começou a ganhar importância nos estados do Sul e
Sudeste do país, particularmente após os produtores adotarem a tecnologia de reversão sexual
(masculinização) dos alevinos. Os Estados de São Paulo e Minas Gerais, através de suas
companhias hidrelétricas, também produziram neste período significativa quantidade de
alevinos para povoamento de seus reservatórios, venda e distribuição a produtores rurais
(JÚNIOR; JÚNIO, 2008; KUBITZA, 2011).
Existem várias espécies de tilápia, cada uma com características próprias de adaptação
e reprodução, o que leva os produtores a estabelecerem preferências de acordo com a região e
as condições do ambiente de cultivo. No Brasil introduziu-se inicialmente a Tilapia rendalli
(figura 4) em açudes do Nordeste, no qual, devido ao baixo desempenho em termos de
crescimento, foi substituída gradativamente pela tilápia do Nilo (Oreochromis niloticus),
(figura 5) sendo esta última espécie a mais utilizada nos criatórios do país devido ao seu
excelente desempenho em ganho de peso, crescimento e por possuir boa aceitação por parte
dos consumidores (JÚNIOR; JÚNIO, 2008).
Figura 4: Tilápia rendalli
Figura 5: Tilápia do Nilo (Oreochromis niloticus)
Fonte: OLIVER, 1997.
Fonte: KUBITZA et al, 2012.
17
A tilápia do Nilo (O. niloticus) pertencente à família dos ciclídeos, é originária da
bacia do rio Nilo, no Leste da África, encontrando-se amplamente disseminada nas regiões
tropicais e subtropicais, como em Israel, no Sudeste Asiático (Indonésia, Filipinas e Formosa)
e no Continente Americano (USA, México, Panamá e toda a América do Sul). É uma espécie
tropical cuja temperatura ideal para seu desenvolvimento varia entre 25 e 30°C, seu
crescimento é afetado em temperaturas abaixo de 15°C e não resiste a temperaturas por volta
de 9°C (AYROZA, 2009).
A tilápia do Nilo destaca-se por sua resistência a doenças, tolerância ao cultivo em
altas densidades e em ambientes hostis e estressantes, desovas durante todo o ano, possuem
carne saborosa, com baixo teor de gordura (0,9%) e calorias (172 Kcal/100 g de carne), não
possuem espinhos em forma de “Y” e apresentam rendimento de filés que variam entre 30 e
40%, o que as tornam bastantes atrativas para a industrialização (TEIXEIRA, 2006;
NOGUEIRA; RODRIGUES, 2007).
As estatísticas oficiais brasileiras mostram que a tilapicultura cresceu de 12.000 para
155.450 toneladas de 1995 a 2010. Nos últimos 10 anos a produção de tilápia aumentou a
uma taxa média de 17% ao ano e representa cerca de 40% da produção da piscicultura
brasileira (Figura 6) (KUBITZA, 2011).
Figura 6: Evolução da produção de tilápia cultivada no Brasil.
Fonte: KUBITZA, 2011
Os principais fatores que contribuíram com o desenvolvimento da tilapicultura no
Brasil foram: melhoria na qualidade dos alevinos, através da reversão sexual e do uso de
linhagens melhoradas, como a tailandesa e, mais recentemente, a GIFT – (Genetically
Improved Farmed Tilapia); a adoção da tecnologia de criação em tanques-rede, que
18
possibilitou uma rápida expansão da criação em diversos estados, aproveitando os
reservatórios disponíveis; a resposta rápida da indústria de ração na elaboração de linhas
completas para tilápias; o grande mercado interno no país, que rapidamente enxergou a
qualidade dos produtos de tilápia ofertados pelos frigoríficos e produtores (KUBITZA, 2011).
2.2.1 Sistemas de criação
No Brasil a tilápia é produzida basicamente em tanques de terra (viveiros) e em
tanques-rede de pequeno volume. O peso comercial de 600 g a 1 kg é atingido em 6 a 10
meses, a partir de alevinos de 0,5 g (KUBITZA, 2011).
A criação em viveiros escavados é o mais antigo e tradicional sistema de produção de
tilápias praticado no Brasil. Mesmo demandando maior investimento na implantação das
fazendas de produção, traz importantes vantagens competitivas sobre a criação em tanquesrede, como menor incidência de doenças, impondo menor risco ao desenvolvimento da
atividade; contribuição do alimento natural no crescimento da biomassa, fixando carbono e
aumentando os níveis de ômega-3 nos produtos; conversões alimentares mais eficientes,
reduzindo o uso de ração e o custo da alimentação por quilo de tilápia produzida; melhor
aproveitamento de alevinos e maior sobrevivência durante a recria e engorda (KUBITZA,
2009).
Os desafios da criação de tilápias em tanques escavados são: dificuldade de despesca e
problemas com “off-flavor” ou mau sabor nos peixes (estes podem apresentar gosto de terra,
particularmente quando há uma proliferação muito intensa de fitoplâncton). Tais desafios
podem ser superados com criatividade, equipamentos, instalações adequadas e estratégia de
produção (KUBITZA, 2009).
A criação de peixes em tanques-rede teve início na década de 1980. É uma forma
intensiva de criação, que utiliza o meio ambiente com alta produtividade de forma sustentável,
com elevadas taxas de estocagem, em que os organismos são mantidos num volume limitado,
possibilitando a livre e constante circulação de água (Figura 7). Esse sistema é hoje, um dos
mais utilizados e, também, o mais produtivo por unidade de cultivo (MORI, 2012).
Figura 7: Estruturas básicas que compõem um tanque-rede:
19
Fonte: CODEVASF, 2010
Dentre as vantagens do sistema de tanques-rede, pode-se destacar menor custo de
implantação em comparação aos sistemas de cultivo intensivo em viveiros escavados e
Raceway; maior facilidade e rapidez na montagem da infraestrutura de produção; maior
facilidade e rapidez para expansão da capacidade de produção; maior facilidade de controle e
monitoramento do processo de cultivo; maior facilidade e controle no processo de despesca;
maior proteção contra predadores naturais e o aproveitamento de ambientes de grandes lagos
e barragens, dispensando desmatamento de áreas e movimentações de terras, evitando
processos de erosão e assoreamento de rios e lagos, podendo ser implantado em diferentes
escalas de produção atendendo desta forma a pequenos, médios e grandes produtores
(TEIXEIRA, 2006; CODEVASF, 2010; MORI, 2012).
Como desvantagens observam-se a necessidade de fluxo constante de água através das
redes; dependência total do sistema ao arraçoamento; risco de encrustamento e rompimento
da tela da gaiola com perda da produção; possibilidade de introdução de doenças e/ou peixes
no ambiente prejudicando a população natural e acúmulo de fezes e metabólitos embaixo dos
tanques-rede promovendo impacto ambiental (TEIXEIRA, 2006; CODEVASF, 2010).
A produtividade em tanques de terra varia de 8 a 10 toneladas/ha/ciclo (sob condições
de baixa renovação de água) a até, 60 a 80 toneladas/ha/ciclo (em tanques com até 20 a 30%
de renovação de água). O custo de produção em viveiros varia entre R$ 1,70 a 2,40/kg
(KUBITZA, 2009; 2011).
Em tanques-rede de pequeno volume a produtividade varia entre 80 e 250 kg/m3 por
ciclo. Devido à ausência de alimento natural, ao maior custo da ração e mortalidade durante o
20
cultivo, o custo de produção em tanques-rede é mais elevado (R$ 2,70 a 3,40/kg) do que em
viveiros. Até o momento os tanques-rede de pequeno volume têm sido mais usados,
aproveitando áreas mais abrigadas dos reservatórios. No entanto, com o aumento no volume
de produção dos empreendimentos haverá uma tendência de aumento no tamanho/volume dos
tanques-rede e a expansão dos projetos para áreas mais expostas dos reservatórios
(KUBITZA, 2009; 2011)
2.3 Enfermidades em tilapicultura
As tilápias sempre foram reconhecidas por sua grande rusticidade, capacidade de
tolerar o manuseio e condições adversas de qualidade de água. Dificilmente eram registradas
doenças ou deficiências nutricionais nos cultivos, que em sua maioria eram conduzidos em
tanques escavados com a presença de plâncton. No entanto, nas últimas décadas os cultivos de
tilápia se intensificaram impulsionados tanto pela consolidação da tilápia como um peixe de
aceitação global e pelo desenvolvimento de sólidos mercados locais (KUBITZA, 2005).
O aumento na pressão de produção, a maior dependência do uso de alimentos
formulados, a intensificação do manuseio e a maior ocorrência de problemas de qualidade de
água nestes cultivos intensivos, trouxe como consequência a elevação da matéria orgânica,
que por sua vez, favorece a multiplicação de microrganismos (KUBITZA, 2005;
MEIRELLES, 2010). As tilápias, apesar de sua natureza resistente, começaram a apresentar
problemas nutricionais e mortalidade atribuída a organismos patogênicos. Desta forma, nos
sistemas de produção intensiva de peixes, a sanidade passou a ser um dos aspectos mais
relevantes para a criação comercial de qualquer espécie (ZAGO, 2012).
No tanque de piscicultura deve haver equilíbrio entre a saúde do hospedeiro, a
proliferação de agentes patógenos e as condições do ambiente aquático (ZANOLO;
YAMAMURA, 2006). Se houver algum desequilíbrio ou estresse, como a deterioração da
qualidade da água, a redução de oxigênio dissolvido, elevação do dióxido de carbono,
alterações bruscas de temperatura, alta densidade de peixes, manejo inadequado, nutrição
desequilibrada e infestação por parasitos, a ocorrência de doenças bacterianas, fúngicas e
virais são favorecidas (ZANOLO; YAMAMURA, 2006; BARAÚNA, 2008; KUBITZA et al,
2013).
Pelo fato de serem encontradas na superfície ou no intestino dos animais, possuírem
fácil disseminação e por apresentarem caráter oportunista, as bactérias são importantes
21
patógenos na piscicultura intensiva, uma vez que podem ocasionar impacto econômico
considerável devido às doenças que provocam nos peixes (BARAÚNA, 2008; ZAGO, 2012).
Especial atenção também deve ser dada as doenças parasitárias, que consistem em
uma das maiores causas de perdas na piscicultura industrial e esportiva e servem como “porta
de entrada” para agentes bacterianos e fúngicos, comprometendo o desempenho zootécnico e
a reprodução dos peixes, além de disseminar agentes patogênicos para o ambiente, que geram
prejuízos ao produtor e riscos à saúde pública (MORI, 2012; ZAGO, 2012)
Os danos causados ao hospedeiro por doenças parasitárias dependem de vários fatores,
como: o grupo do parasita em questão, a sua localização e o modo particular como atuam
sobre o hospedeiro. Dentro deste contexto, as lesões branquiais são particularmente
importantes, uma vez que esse órgão reage fortemente à presença de parasitas, provocando
uma acentuada proliferação celular e implicando na diminuição ou perda da respectiva
atividade respiratória que, nos casos mais graves, pode provocar a morte do hospedeiro por
asfixia (ZANOLO, 2006; KUBITZA, 2008).
Diversas espécies de peixes são acometidas por doenças virais, alguma delas de
notificação obrigatória em diversos países. Com a tilápia isso ainda não ocorreu. Geralmente
há uma carência de profissionais treinados ou de laboratórios equipados para a identificação
de viroses em peixes em diversos países tropicais onde se cultiva a tilápia (KUBITZA, 2008).
Isso faz com que episódios de mortandade que possam ter sido primariamente desencadeados
por infecções virais passem sem diagnóstico, ou seja, atribuídos exclusivamente a outros
agentes infecciosos (bactérias, por exemplo) isolados dos peixes doentes (KUBITZA, 2005;
2008).
2.3.1 Doenças bacterianas
A água é um ambiente extremamente favorável para a proliferação de determinados
patógenos, com rapidez e eficiência. Em condições normais de criação, as bactérias
encontram-se na água sem causar qualquer dano à saúde do peixe. Porém, fatores ambientais,
nutricionais, genéticos e sanitários interferem no ambiente de cultivo, tornando as tilápias
mais susceptíveis a doenças, e fazendo com que estas mesmas bactérias, que coexistiam sem
causar qualquer dano, provocassem um impacto direto na saúde do peixe, passando a agir
como agente oportunista (TAVARES; PALHARES, 2011; ROBERTS, 2012).
Os fatores que favorecem a ocorrência de doenças bacterianas em peixes são:
deterioração da qualidade da água; excessivo acúmulo de matéria orgânica; nutrição
22
deficiente; excessiva alimentação dos peixes; temperatura da água muito elevada; estresse
físico e fisiológico no manuseio e transporte; excessiva estocagem nos tanques de cultivo e
infestações por parasitos, potenciais vetores de doença (KUBTIZA, 2008; MEIRELLES,
2010).
Diversas bacterioses em tilápia que, há alguns anos eram de pouca expressão ou
sequer haviam sido diagnosticadas no Brasil, hoje, impõem consideráveis prejuízos
econômicos ao setor (Quadro 1). A globalização da tilapicultura, com transferência de póslarvas, alevinos e matrizes entre diversos países, tem favorecido a rápida disseminação de
agentes patogênicos juntos aos principais centros de cultivo.
O estudo das doenças
bacterianas de peixes torna-se difícil com a atual falta de compreensão adequada das
interações que ocorrem entre as bactérias, seus hospedeiros e do ecossistema aquático em
geral (KUBITZA, 2008).
Quadro 1: Principais bactérias patogênicas na tilapicultura
Bactéria
Nome da doença
Flavobacterium
Columnariose;
columnare
podridão
Aeromonas
espécies
(diversas
isoladas
Sinais clínicos típicos da doença
ou
Podridão da nadadeira caudal e das brânquias; lesões
das
esbranquiçadas ou com aspecto de tufo de algodão sobre o
nadadeiras; ou boca de
corpo e boca (semelhante a infecção por fungos); lesões
algodão; ou podridão
profundas na cabeça com exposição da musculatura e
de brânquias.
ossos.
Septicemia móvel.
Lesões ulcerativas sobre o corpo; hemorragia na base das
nadadeiras e aspecto de ulcera sobre o corpo; abdômen
em
distendido; escamas eriçadas, olhos hemorrágicos.
tilápias)
Streptococcus iniae
Estreptococose (doença
Peixes com natação espiralada; corpo escurecido e de
S. agalactiae
da natação espiralada)
aspecto curvado em forma de “s”; olhos opacos e às vezes
saltados.
S. dysgalactiae
Edwardsiella tarda
Edwardsiellose
Lesões com exposição da musculatura; abcessos na
musculatura com presença de gás e mau odor.
Francisella sp.
Granuloma visceral das
Órgãos internos (baço, rim e coração) e brânquias
tilápias
apresentando numerosos nódulos brancos (granulomas).
Fonte: KUBITZA, 2008
Os principais sinais clínicos de bacterioses nos peixes são: perda de apetite (Figura 8)
e letargia; ocorrência de mortalidade crônica (todos os dias aparecem peixes mortos nos
tanques) (Figura 9); natação errática e com movimentos espiralados; hemorragia nas
nadadeiras e no corpo; hemorragias nos olhos (figura 10) e no ânus; podridão (necrose) das
nadadeiras (figura 11); lesões na pele (manchas brancas, lesões com aspecto inflamado ou
23
ainda lesões na forma de úlceras ou furúnculos); abdômen distendido (ascite) geralmente
devido ao acúmulo de fluido na cavidade abdominal; escamas eriçadas, em função da
excessiva distensão do abdômen; hemorragia nas vísceras e órgãos internos; baço aumentado
e de coloração escura; nódulos brancos no baço, fígado e rins; intestino com fluido
sanguinolento (KUBITZA, 2000; 2008; SILVA, 2010).
Figura 8: Trato digestivo de duas tilápias do mesmo tamanho
*Legenda: Lado esquerdo – trato digestivo de um peixe doente que deixou de se alimentar. Apresenta
estômago e intestino vazios e a vesícula biliar repleta com bile de cor verde escuro. Lado direito – peixe
sadio com estomago e intestino repleto e vesícula não muito cheia com bile de cor verde claro.
Fonte: KUBITZA, 2000
Figura 9: Mortalidade de tilápias em tanque rede
Fonte: KUBITZA, 2000
Figura 10: Olho da tilápia apresentando a córnea ulcerada e hemorrágica
24
Fonte: KUBITZA, 2000
Figura 11: Nadadeira peitoral normal e com lesão
.
*Legenda: Em cima - peixe apresentando podridão e hemorragia da nadadeira peitoral.
Em baixo: Peixe sadio – aspecto normal da nadadeira
Fonte: KUBITZA, 2000
O diagnóstico das bacterioses é realizado através da associação dos sinais clínicos,
isolamento das bactérias, técnicas bioquímicas e moleculares (por exemplo, o PCR). O
diagnóstico definitivo das bacterioses é dado através da cultura bacteriana a partir de lesões da
pele e/ou órgãos internos, uma vez que os sinais clínicos são raramente patognomônicos. As
amostras devem ser submetidas a um laboratório que esteja familiarizado com a cultura de
espécies bacterianas aquáticas, já que muitos desses patógenos têm necessidades especiais.
Estas devem ser incubadas na temperatura ambiente (25 – 28 0C) e não a 37 0C como é feito
habitualmente nos laboratórios comerciais de microbiologia, pois alguns patógenos podem
não crescer ou crescem pouco a 37 0C (NOGA, 2010).
As lesões cutâneas são particularmente um desafio no diagnóstico, pois podem
apresentar vários patógenos e frequentemente torna-se difícil determinar o agente que
desencadeou a enfermidade, isto é, o principal patógeno. Na cultura de órgãos internos várias
espécies bacterianas também podem estar presentes. O rim é o melhor tecido para isolamento
de rotina de patógenos sistêmicos, no entanto, outros tecidos podem ser preferíveis para certos
25
patógenos ou para identificar portadores assintomáticos. As infecções múltiplas são comuns, e
determinar todos os agentes patogénicos envolvidos é importante (NOGA, 2010).
Técnicas de biologia molecular na piscicultura vêm se desenvolvendo amplamente,
tornando-se possível o estudo mais detalhado de genes, para pesquisas de diversas finalidades,
como a melhoria de aspectos produtivos, sanitários e ambientais, seja de peixes cultivados ou
nativos (FIGUEIREDO et al, 2010).
Como a maioria das bactérias estão amplamente disseminadas em ambientes aquáticos
ou possuem variantes incapazes de causar doença, ao realizar o diagnóstico, este deve ser
capaz de distinguir se a bactéria identificada é realmente um patógeno ou se faz parte da
microbiota normal dos peixes. Dessa forma, os fatores de virulência (capacidade de um
microrganismo causar uma enfermidade) devem ser analisados, para poder diferenciar
bactérias patogênicas das não patogênicas. O diagnóstico correto tem forte impacto nos
procedimentos a serem adotados tanto na prevenção de surtos (como a recomendação do uso
de vacinas), quanto para o controle desses surtos (como o uso de antibióticos) (FIGUEIREDO
et al, 2010).
2.3.1.1 Estreptococose
A estreptococose em peixes é uma doença comum em várias partes do mundo
podendo infectar diversas espécies de peixes de água doce e marinhos. O primeiro relato de
estreptococos causando doença em peixes foi no Japão, no ano de 1958. As principais
espécies dessa bactéria que causam infecção em peixes são o Streptococcus iniae, S.
agalactiae, S. dysgalactiae e S. ictaluri. No Brasil os isolamentos até agora obtidos são de S.
agalactiae, S. iniae e S. dysgalactiae (FIGUEIREDO et al, 2007b; TAVARES; PALHARES,
2011).
As
bactérias
do
gênero
Streptococcus
são
cocos
Gram-positivos,
com
aproximadamente um (1) µm de diâmetro, formam cadeias, são catalase-negativas, anaeróbias
facultativas e imóveis. Crescem muito bem em meios de cultura ágar sangue e ágar BHI
(brain heart infusion) (QUINN et al., 2005; ROBERTS, 2012).
Streptococcus agalactiae (Grupo B Lancefield, GBS), é um importante patógeno
emergente que tem sido ligado à morbidade e mortalidade nas pisciculturas de todo o mundo.
É frequentemente associado com meningoencefalite em peixes, mastite em vacas e meningite
neonatal em humanos (FIGUEIREDO; LEAL, 2008d; PEREIRA et al, 2010).
26
O primeiro relato de infecção por Streptococcus iniae, foi descrita em uma espécie de
golfinho de água doce, o Inia geoffrensis. Atualmente essa bactéria é um dos patógenos de
maior relevância para a produção de peixes na América do Norte (Canadá, Caribe e EUA),
Ásia-pacífico (Austrália, China, Japão, Singapura e Taiwan) e Oriente Médio (Bahrein e
Israel). No Brasil, o primeiro relato da doença foi em 2008, em uma tilapicultura do Paraná,
onde os animais eram cultivados em tanques rede e submetidos a altas densidades de
estocagem (FIGUEIREDO et al, 2009b; 2012).
Streptococcus dysgalactiae é caracterizado como responsável por casos de faringite
(“dor de garganta”) em seres humanos e mamite em bovinos. Nos anos 90, essa bactéria foi
responsável por causar surtos de mortalidades em fazendas de peixes marinhos,
principalmente do gênero Seriola, e não tinha ocorrência aparente em peixes de água doce.
No ano de 2007, foi realizado o primeiro relato de surto dessa bactéria em uma fazenda de
tilápias localizada no Nordeste do Brasil, estado do Ceará (NETTO et al, 2011).
A transmissão da estreptococose ocorre de forma horizontal por contato direto entre
peixes infectados com peixes sadios, e por contato indireto, pela bactéria presente na água,
permitindo que a doença se manifeste gradativamente em diferentes tanques-rede de uma
mesma propriedade e/ou por meio de fômites, que pode ser qualquer objeto inanimado ou
substância capaz de absorver, reter e transportar organismos infecciosos de um local para
outro, como baldes, puçás, classificadores, etc. (SALVADOR 2008; MIAN et al, 2009).
Esta doença apresenta mortalidade elevada, principalmente em peixes cultivados em
tanques-rede, quando há manejo inadequado, ocasionando estresse físico e fisiológico,
deterioração da qualidade da água, nutrição deficiente, infestação por parasitas e excessivas
estocagens. A temperatura elevada da água de cultivo durante o verão pode ser também um
fator que aumenta a frequência da doença (FIGUEIREDO et al., 2007c; KUBITZA, 2008).
Em condições naturais a doença pode ser observada em peixes com peso variando
entre 50 gramas até matrizes com peso acima de um (1) quilo, mas predomina na fase de
engorda, sendo os peixes entre 400 e 600 gramas, os mais acometidos (FIGUEIREDO et al,
2007b). Os alevinos e juvenis parecem não manifestar a doença, mas isso não descarta a
possibilidade dos peixes jovens serem portadores assintomáticos e a principal fonte de
infecção para as fases de crescimento e engorda (FIGUEIREDO et al, 2007b; PÁDUA et al,
2012).
Os peixes infectados por estreptococos desenvolvem uma doença septicêmica, ou seja,
a bactéria passa a se multiplicar na corrente sanguínea do peixe e em diversos órgãos, como
fígado, baço e rim, contudo, o cérebro parece ser o principal alvo da bactéria. Além da
27
septicemia temos uma encefalite instalada e como consequência os peixes podem apresentar
natação alterada, com rodopios e perda de equilíbrio na água (Figura 12) (FIGUEIREDO et
al, 2007b; MIAN et al, 2009).
Outros sinais clínicos perceptíveis são: lesões de pele e músculo semelhantes à
abcessos, pontos avermelhados na superfície corporal, principalmente ao redor da boca,
opérculo e nadadeiras, anorexia, escurecimento do corpo (Figura 13), distensão abdominal
(Figura 14), olhos opacos ou de coloração esbranquiçadas e exoftalmia unilateral ou bilateral
(figura 15) (KUBITZA, 2000; LEMOS et al, 2006; PRETTO-GIORDANO et al, 2010)
Figura 12: Sintomas nervosos - natação
errática e perda de equilíbrio na água.
.
Figura 13: Escurecimento do corpo –
peixe sadio (de cima) x peixe doente (2
de baixo)
.
Fonte: KUBITZA, 2005
Figura 14: Tilápia à direita com
distensão abdominal (ascite).
.
Fonte: KUBITZA, 2000.
Figura 15: Exoftalmia causada por
estreptococose
.
28
Fonte: KUBITZA, 2005
Fonte: TAVARES, 2011
Internamente podem ser observado acúmulo de líquido hemorrágico na cavidade
abdominal, esplenomegalia, fluido intestinal sanguinolento e fígado pálido. No crânio
verifica--se congestão difusa cerebral com líquido cefalorraquidiano hemorrágico.
Histologicamente ocorre severa inflamação granulomatosa, panoftalmite (inflamação
generalizada do olho), meningoencefalite, necrose e vacuolização de hepatócitos e congestão
e necrose esplênica (FIGUEIREDO et al, 2006; SALVADOR, 2008; PRETTO-GIORDANO
et al, 2010)
Nos casos de infecção por Streptococcus dysgalactiae os peixes podem apresentar,
além dos sinais clássicos de infecção por estreptococos, um aumento de volume na região
caudal (Abcesso). Essa formação de abcesso pode estar relacionada a processo de infecção
crônica, onde os peixes infectados não morrem e desenvolvem as lesões somente com o
passar do tempo, pois em infecções experimentais com S. dysgalactiae, os peixes infectados
adoeceram e a mortalidade foi elevada, contudo, diferentemente do observado no campo, os
peixes não apresentaram abcessos na região caudal (NETTO et al, 2011).
O diagnóstico da estreptococose é realizado através da associação dos sinais clínicos e
achado laboratorial. São coletados fragmentos de rim e cérebro de peixes doentes para
isolamento da bactéria em meios de cultivo seletivos como o ágar sangue, BHI e TSA. Após o
isolamento de colônias de bactérias, essas serão identificadas por meio de provas bioquímicas
padronizadas (kits API 20 STREP), pela determinação do chamado “grupo de Lancefield”
(que é um método sorológico de classificação com base na substância C grupo-específica polissacarídeo da parede celular) e por técnicas de biologia molecular (PCR) (QUINN et al,
2005; FIGUEIREDO et al, 2007b).
Para diagnostico do S. iniae, é realizado PCR específico, já que, as colônias suspeitas
não podem ser identificadas com o uso de testes bioquímicos como o kit API 20 STREP
(FIGUEIREDO et al, 2009b). Como em condições de campo a coleta de amostras torna-se
difícil devido à contaminação com bactérias ambientais, pode ser enviado para o laboratório o
peixe inteiro vivo ou resfriado em caixa térmica com gelo (MIAN et al, 2009).
29
Os problemas com estreptococos podem ser minimizados assegurando boas práticas de
manejo como: adequada qualidade da água, correta nutrição, evitar manipulação excessiva nas
operações rotineiras e nas transferências dos mesmos, remoção imediata de peixes
moribundos e mortos, evitar excesso de estocagem e acúmulo excessivo de matéria orgânica
nos tanques (LEMOS et al, 2006).
2.3.1.2 Septicemia móvel causado por Aeromonas
Septicemia por Aeromonas móveis é a denominação conferida à doença causada por
bactérias desse gênero em peixes. As infecções por essas bactérias são de ocorrência mundial
e provavelmente é a doença bacteriana mais comum em peixes de água doce. Atualmente 17
espécies bacterianas são classificadas como membro do gênero Aeromonas. Dentre elas, as
principais espécies patogênicas para peixes são a Aeromonas hydrophila, A. caviae e A.
sobria. (FIGUEIREDO et al, 2008a).
Aeromonas são bactérias gram-negativas, bastonete curto, anaeróbica facultativa,
móvel por flagelo polar, catalase positivo, oxidase positivos, reduz nitrato em nitrito,
mesofílica, podem ou não produzir gás e é adaptada ao crescimento em temperaturas que
variam de 5 0C a 37 0C, com crescimento ideal na temperatura de 28 0C (QUINN et al., 2005).
São encontradas em diversos habitats, tanto em ambiente aquático e terrestres, e fazem
parte da flora intestinal normal dos peixes (ROBERTS, 2012). A transmissão do agente se dá
de modo horizontal, estando o mesmo presente na água ou no sedimento, sendo transmitidos
por descarga do trato intestinal dos peixes ou lesões na pele. São considerados patógenos
facultativos, ou oportunistas, que só irão causar a doença quando os peixes forem submetidos
a fatores estressantes (PAVANELLI et al, 2002; COSTA, 2003; TAVARES; PALHARES,
2011).
A septicemia por Aeromonas em tilápias ocorrem com maior frequência em períodos
de temperaturas baixas ou amenas, quando a resposta imunológica dos peixes é mais reduzida.
Porém o aumento da temperatura acima de 30 0C, pode também predispor a ocorrência de
surtos. Nestas condições a mortalidade e os prejuízos podem ser consideráveis (KUBITZA,
2000; FIGUEIREDO et al, 2008a).
Algumas espécies de Aeromonas têm sido associadas a doenças em seres humanos,
sendo classificadas pela Organização Mundial da Saúde (OMS) como patógenos de interesse
emergente à saúde pública, veiculados pela água, por alimentos contaminados (leite e
derivados, carcaças de frangos, vegetais e pescado) ou por via cutânea (manipuladores de
30
alimentos, trabalhadores de piscicultura, aquaristas, etc.) (HIRSCH et al, 2006). As infecções
em seres humanos são caracterizadas por quadros de gastroenterite, septicemia, síndrome
urêmica hemolítica, peritonite, infecção respiratória, feridas e pústulas cutâneas
(FIGUEIREDO et al, 2008a).
Nos peixes a enfermidade ocasionada por esses agentes provoca quadros septicêmicos,
agudos e crônicos. Pode ainda apresentar na forma de doença ulcerativa, caracterizada pelo
aparecimento de lesões cutâneas (úlceras) localizadas. Os principais órgãos acometidos são
rins, fígado, baço, pâncreas, brânquias, musculatura esquelética e cérebro (COSTA, 2003;
FIGUEIREDO et al, 2008a).
Os sinais mais comuns da doença são: falta de apetite (anorexia), letargia (natação
vagarosa) com peixes se posicionando nas áreas mais rasas dos tanques, escurecimento
corporal, perda de equilíbrio, palidez de brânquias e mucosas (indicativo de anemia), perda de
escamas, erosão ou destruição das nadadeiras, lesões sobre o corpo evoluindo para ulcerações
(Figuras 16 e 17), hemorragia difusa, observadas também na base das nadadeiras peitorais,
pélvica e caudal (Figura 18), exoftalmia, olhos opacos e hemorrágicos, ascite com líquido
abdominal opaco a sanguinolento, conteúdo intestinal amarelado a sanguinolento, hemorragia
petequial visceral, hepatomegalia (figura 19), esplenomegalia, rins hiperplásicos e friáveis e
pontos hemorrágicos na parede interna da cavidade abdominal (KUBTIZA, 2000;
PAVANELLI et al, 2002; FIGUEIREDO et al, 2008a; ROBERTS, 2012).
Figura 16: Mancha despigmentada
na pele (perda de escama) que pode
evoluir para úlcera
Figura 17: Lesão ulcerativa em
tilápia: infecção por Aeromonas
31
Fonte: KUBITZA, 2005
Figura 18: Hemorragias difusas:
infecção por Aeromonas
Fonte: KUBITZA, 2000
Fonte: KUBITZA, 2005
Figura 19: Tilápia apresentando fígado
aumentado e vesícula biliar repleta de
bílis
Fonte: KUBITZA, 2000
Como a sintomatologia nervosa e a septicemia podem ser confundidas com os
sintomas ocasionados pelas estreptococoses e realmente são semelhantes, torna-se necessário
o diagnostico laboratorial, pois só ele conseguirá determinar qual o agente causador da doença
(FIGUEIREDO et al, 2008a). Sendo assim, para diagnóstico laboratorial é realizado o
isolamento da bactéria através de amostras de órgãos ou sangue, em meios de cultura
específicos (Rimler-Shotts, águar sangue e TSA) e técnicas bioquímicas. Para a detecção do
fator de virulência e confirmação de que o isolado seja realmente de A. hydrophila, é
necessário o uso de técnicas moleculares (PCR), pois a identificação bioquímica não é
suficiente para essa confirmação. Devem ser coletados peixes com sintomatologia clinica da
32
doença e enviados vivos ou refrigerada ao laboratório imediatamente (KUBTIZA, 2000,
FIGUEIREDO et al, 2008a).
O controle da infecção causada por Aeromonas esta ligado ao controle de fatores que
facilitam a invasão dos hospedeiros.
2.3.1.3 Edwardsiellose
Edwardsiella
tarda
é
uma
bactéria
Gram-negativa,
membro
da
família
Enterobacteriaceae, anaeróbica facultativa, móveis com flagelo periféricos, catalase positivo,
fermentadora de glicose, reduzem nitrato a nitrito e oxidase negativo (QUINN et al, 2005;
BARAÚNA, 2008; ROBERTS, 2012).
Edwardsiella tarda é frequentemente isolada do trato digestório de carpas, bagres,
tilápias e outros peixes de criação, em fezes humanas e também em cobras, rãs, tartarugas e
aves.
Além disso, ocorre na água e no sedimento dos tanques de criação. Ela se manifesta
especialmente no verão, quando a temperatura da água esta em média 30 0C, há grande
quantidade de matéria orgânica na água e os hospedeiros estão em situação de estresse
(ALBINATI et al, 2006).
Essa bactéria tem caráter zoonótico, pois pode ser transmitida ao homem pela ingestão
da carne de peixes contaminados, causando meningite, abscessos hepáticos, infecções de
feridas pelo manuseio de material contaminado e mais comumente gastroenterites
(ALEXANDRINO et al, 1999; BARAÚNA, 2008; LIMA et al, 2008).
O mecanismo de transmissão dessa bactéria durante surtos não está completamente
esclarecido, no entanto, a infecção é conhecida por permanecer latente nos tecidos de peixes
(NOGA, 2010). Em cultivo intensivo a transmissão é facilitada, devido ao maior aporte de
fezes e acúmulo de matéria orgânica nos tanques, bem como pelas altas densidades de
estocagem, que facilitam o contato entre os peixes (ALEXANDRINO et al, 1999; ALBINATI
et al., 2006; BARAÚNA, 2008).
Os sinais clínicos manifestados em casos de edwardsiellose são pequenas lesões na
cabeça, musculatura e cauda, que podem originar abcessos de maiores dimensões nos
músculos laterais e na cauda, despigmentação cutânea, nódulos nas brânquias, necrose de
linha lateral, opacidade de córnea (Figura 20) e lesões hemorrágicas cutâneas que podem
evoluir para abcessos com tecido necrótico e odor desagradável (Figura 21). As lesões
cutâneas também podem se estender à musculatura interna, causando peritonite fibrinosa de
evolução rápida e necrose do tecido hepático e renal. Podem ser encontrados bolhas gasosas
33
de odor fétido na musculatura e no rim e um exsudato fibrinoso que cobre o fígado, tornandoo friável (ALBINATI et al, 2006; BARAÚNA, 2008; ROBERTS, 2012).
Figura 20: Tilápia apresentando
opacidade da córnea
Fonte: KUBITZA, 2008
Figura 21: Tilápia com septicemia
provocada por Edwardsiella tarda
Fonte: KUBITZA, 2000
Em casos septicêmicos, observa-se ascite, distensão da cavidade visceral, exoftalmia,
prolapso anal e nódulos brancos no fígado, rins e baço. Apresenta mortalidade entre 5% e
30% e morbidade entre 5 e 70% (MURATORI et al, 2001; BARAÚNA, 2008).
O diagnóstico é feito através da sintomatologia e a confirmação é obtida através do
isolamento bacteriano pela semeadura em placas de ágar sangue, ágar MacConkey ou caldo
triptose, incubados a 28 0C por 24-48 horas (PAVANELLI et al, 2002; ALBINATI et al,
2006; LIMA et al, 2008).
O melhor método profilático consiste em evitar o estresse dos peixes de cultivo,
mantendo-os em baixas densidades populacionais e evitar um grande acúmulo de matéria
orgânica na água (PAVANELLI et al, 2002; BARAÚNA, 2008).
2.3.1.4 Escherichia coli e Klebsiella sp.
Escherichia coli é uma bactéria pertencente à família Enterobacteriaceae. São
geralmente móveis, com flagelos peritríquios, fermentadores de lactose, oxidase negativo,
catalase positivo, anaeróbios facultativos, crescem em meios não enriquecidos e produzem
colônias de cor rosa em ágar MacConkey. Essas bactérias tem distribuição mundial e habitam
o trato intestinal de animais e de humanos e contaminam a vegetação, o solo e a água
(QUINN et al., 2005).
34
Em geral as estirpes de E. coli que colonizam o trato gastrointestinal são comensais
inofensivas ou desempenham um papel importante na manutenção da fisiologia intestinal
(HUSS, 1997). Muitas linhagens de E. coli são de baixa virulência, mas podem causar
infecções oportunistas em localização extra intestinal, como glândula mamária e trato
urinário. Linhagens patogênicas da E. coli possuem fatores de virulência que permitem a
colonização das superfícies mucosas e a subsequente produção de doença (QUINN et al.,
2005). E. coli causadoras de gastrenterites podem ser divididas de acordo com os sintomas
clínicos e mecanismos da patogenicidade nos seguintes grupos: E. coli enteropatogênica
(EPEC),
E.
coli enterotoxigênica
(ETEC),
E.
coli verotoxigênica
(VTEC),
E.
coli enterohemorrágica (EHEC), E. coli enteroagregativa (EaggEC) e E. coli enteroinvasiva
(EIEC) (QUINN et al., 2005; VALLANDRO, 2010).
Infecções por E. coli em animais jovens (como bezerros, leitões, cães) podem estar
limitadas aos intestinos (colibacilose entérica, diarréia neonatal), ou podem manifestar-se
como septicemia (colissepticemia, colibacilose sistêmica) ou toxemia (toxemia colibacilar).
Em animais adultos, infecções não entéricas localizadas, muitas ocasionadas por invasão
oportunista, podem envolver o trato urinário (cistite principalmente em cadela), as glândulas
mamárias (mastite em vacas e porcas) e o útero (piometra em cadela e cervídeos) (QUINN et
al., 2005).
Patógenos ou indicadores de poluição fecal são raramente encontrados nos pescados
recém-capturados. A maior parte das infecções parece estar relacionada com a contaminação
da água ou com o manuseio do produto alimentar de forma inadequada já que, após a captura,
a microbiota inicial é alterada e a incidência de microrganismos nos pescados é dependente
das condições de transporte, manipulação, contato com o gelo, superfície e equipamentos,
estocagem e comercialização. Aliado e esses fatores existem a falta de medidas que priorizem
a qualidade do pescado por parte de pescadores e produtores, que negligenciam o aspecto
higiênico de produção e comercialização, tornando o pescado uma fonte de infecção de E. coli
para humanos e outros animais (MURATORI et al, 1994; LIBRELATO; SHIKIDA, 2005).
A E. coli pode, sem dúvida, ser isolada de ambientes poluídos por material fecal ou
esgotos e o organismo pode multiplicar e sobreviver durante um longo período neste
ambiente. No entanto, foi demonstrado, recentemente, que a E. coli pode ser igualmente
encontrada em águas tropicais quentes não poluídas, onde pode sobreviver indefinidamente
(HUSS, 1997). Os estudos epidemiológicos para distinguir os vários tipos de E. coli recorrem
de técnicas de isolamento em ágar sangue ou ágar MacConkey, métodos imunológicos,
35
técnicas moleculares como o PCR e detecção de genes que codificam toxinas (QUINN et al.,
2005).
Klebsiella sp. é também uma bactéria pertencente a família Enterobacteriaceae e
fazem parte do grupo dos patógenos oportunistas, ou seja, raramente causam infecção entérica
em animais domésticos, estando algumas vezes envolvidos em infecções oportunistas com
diferentes localizações anatômicas (QUINN et al., 2005). A contaminação fecal do meio
ambiente explica a ampla distribuição dos microrganismos e contribui para a ocorrência de
infecções
oportunistas.
Fatores
predisponentes
incluem
infecções
intercorrentes,
desvitalização tecidual e vulnerabilidade inerente de certos órgãos (HUSS, 1997).
Klebsiella sp. é comumente encontrado em mastite por coliformes em vacas,
endometrite em égua, pneumonia em bezerros e potros e infecção do trato urinário em cães.
Podem ser encontradas em peixes contaminados através da manipulação em condições
inadequadas de higiene e nos que vivem em ambientes aquáticos contaminados (QUINN et
al., 2005).
O diagnóstico é realizado através do isolamento da bactéria em ágar sangue ou ágar
MacConkey, e identificação através de testes bioquímicos. O tratamento é realizado com
terapia antibiótica, de acordo com o teste de sensibilidade a antimicrobianos e as causas
predisponentes e fontes de infecção devem ser identificadas e, se possível, eliminadas
(QUINN et al., 2005).
2.3.1.5 Columnariose
Flavobacterium columnare é o agente etiológico de uma doença conhecida como
“columnariose” ou “doença da boca de algodão ou podridão das nadadeiras”. É uma bactéria
Gram-negativa, na forma de bacilos alongados (bastonetes) e móveis, mensurado cerca de
cinco (5) µm de comprimento e um (1) µm de largura. Suas colônias são amareladas, rizóides,
planas e dispostas em forma de colunas, daí a denominação “Columnare” e não cresce em
meios convencionais de microbiologia (TAVARES; PALHARES, 2011; ZAGO, 2012).
F. columnare habita os sistemas aquáticos e convive em pleno equilíbrio com os
peixes. Para que ocorra a enfermidade é necessário que haja algum distúrbio ambiental
(mudança rápida na temperatura da água, piora na qualidade da água com elevação de nitrito e
queda do teor de oxigênio dissolvido), pressão de manejo (excessiva densidade de estocagem
e inadequado manuseio, provocando feridas nos peixes) e queda na resistência dos peixes
(KUBITZA, 2000; 2012).
36
A maior incidência ocorre no verão, onde a temperatura da água varia entre 28 e 30 0C
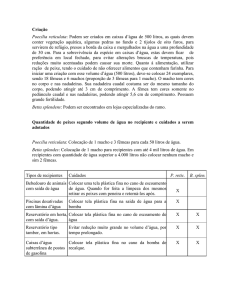
e pode causar mortalidade acima de 80% ainda na primeira semana após a estocagem dos
alevinos (KUBITZA et al, 2013; ZAGO, 2012). Essa mortalidade ocorre em uma etapa do
cultivo onde os peixes ainda são pequenos e o custo direto associado a esses alevinos ainda é
relativamente baixo. Isso faz com que muitos produtores subestimem a importância dessas
perdas nos resultados econômicos do cultivo, mas em longo prazo, essas perdas prejudicam a
formação de estoque de juvenis, consequentemente os tanques de engorda acabam vazios ou
sub estocados, diminuindo a produção anual da piscicultura (KUBITZA et al, 2013).
Apesar de a columnariose ser observada em animais adultos, as pós-larvas e alevinos
são as faixas etárias de maior susceptibilidade, uma vez que seus mecanismos específicos de
defesa não estão completamente desenvolvidos, não respondendo rapidamente às infecções
(FIGUEIREDO, 2007a; SEBASTIÃO et al, 2010; KUBITZA et al, 2013).
Os sinais clínicos observados são perda de apetite e natação vagarosa, asfixia (devido
à infecção da bactéria nas brânquias), manchas descoloridas e localizadas na pele (Figura 22),
lesões nas margens das nadadeiras (principalmente na caudal) com aspecto de apodrecimento
(Figura 23), lesões esbranquiçadas a amareladas ao redor da boca, apresentando crescimento
bacteriano com aspecto de tufos de algodão, áreas necróticas amareladas nas brânquias
(colônias de bactérias), indicando a destruição do epitélio branquial, o que dificulta a
respiração e causa a morte dos peixes por asfixia (KUBITZA, 2000; ROBERTS, 2012;
ZAGO, 2012).
Figura 22: Manchas descoloridas
e localizadas na pele
Figura 23: Podridão das nadadeiras em
tilápia causada por Flavobacterium
columnare
G-PLOUGH, 2007
37
Fonte: KUBITZA, 2005
Em alevinos, pode ser observada a lesão em “sela”, que são lesões esbranquiçadas ao
longo da nadadeira dorsal, nas laterais do animal e cabeça, que podem ser vista em alguns
alevinos no inicio do surto, mas que, infelizmente não são sinais exclusivos da columnariose
(FIGUEIREDO, 2007a). Mesmo não havendo lesões típicas é importante saber que as
brânquias são locais comuns de infecção pela bactéria, e que muitas vezes essas serão as
portas de entrada para que o F. columnare atinja órgãos internos do peixe, como o rim e o
fígado (FIGUEIREDO, 2007a).
O diagnóstico tem por base os sinais clínicos característicos da doença e a
confirmação é feita através da microscopia direta, isolamento bacteriano em meios de cultura
específicos e técnicas de biologia molecular (PCR) (TAVARES; PALHARES, 2011).
A prevenção e o controle da columnariose devem ser feitos por uma associação de
medidas que visam sempre a diminuição da carga infectante do F. columnare no ambiente, ou
seja, que permita convivência com o agente no ambiente da piscicultura, mas sem a
ocorrência de casos clínicos significativos (FIGUEIREDO, 2007a).
2.3.1.6 Francisella sp.
As bactérias do gênero Francisella sp. são responsáveis por causar a doença conhecida
como granuloma visceral das tilápias É uma bactéria gram-positiva, aeróbio obrigatório,
imóvel, oxidase negativa e catalase positivo fraco. São microrganismos fastidiosos que
requerem a adição de cisteína ao ágar sangue para crescimento e não crescem em ágar
MacConkey. É adaptada ao crescimento em temperaturas que variam 6 a 28 0C, com
crescimento ideal na temperatura de 17 a 220C (QUINN et al, 2005; SOTO, 2010;
ROBERTS, 2012)
Essa bactéria é extremamente virulenta para diversas espécies de peixes marinhos e de
água doce, causando também, doença em mamíferos (incluindo humanos) (BOWEN et al,
2008; KUBITZA, 2008).
38
A maior incidência da doença ocorre no inverno e a transmissão ocorre por contato
direto com animais infectados, através da água ou alimentos contaminados ou por vetores, tais
como insetos. A infecção por Francisella sp. caracteriza-se como uma síndrome aguda (com
poucos sinais clínicos e alta mortalidade) subaguda ou crônica (com sinais clínicos
inespecíficos com variados graus de mortalidade) (SOTO et al, 2010; COLQUHOUN;
DUODU, 2011).
Os sinais clínicos não específicos dessa bacteriose incluem perda do apetite,
comportamento letárgico, natação errática e exoftalmia. Internamente é observado sinais mais
específicos da doença, que é a presença de um grande número de nódulos brancos nas
brânquias, baço, rim e gônodas, e, ocasionalmente, no fígado e coração (Figura 24) (BOWEN
et al, 2008; KUBITZA, 2008; JEFFERY et al, 2010; COLQUHOUN; DUODU, 2011).
Histologicamente pode ser observada extensa inflamação granulomatosa, com núcleo
necrótico e infiltração de células mononucleares (Figura 25).
Figura 24: Tilápia com o rim e baço aumentado e presença de numerosos nódulos
brancos em ambos os órgãos
Fonte: BOWEN et al, 2008
Figura 25: Corte histológico do baço com granulomas (A)
e tecidos normais do baço (B)
39
Fonte: BOWEN et al, 2008
O diagnostico é realizado através dos sinais clínicos e a confirmação do agente é
obtida através da cultura bacteriana em meios específicos, associado com a histopatologia e
técnicas de biologia moleculares (PCR) (JEFFERY et al, 2010; COLQUHOUN; DUODU,
2011).
A Francisella é de difícil tratamento, mas estudos experimentais têm demonstrado que
o uso do florfenicol administrado na ração na dosagem de 15mg/kg/pv durante 10 dias ou a
oxitetraciclina na dosagem de 30-50 mg/kg/pv durante 10 – 14 dias, pode ser eficaz (BOWEN
et al, 2008; JEFFERY et al, 2010).
2.3.1.7 Clostrídiose
Os Clostrídios são bactérias Gram positivas, grandes, anaeróbios, fermentativas, que
requerem meios enriquecidos para crescer, são bacilos retos ou levemente curvos, catalase
negativo, oxidase negativa e a maioria possui motilidade pela presença de flagelos peritríquios
(QUINN et al, 2005).
Embora mais de 100 espécies de clostrídios sejam reconhecidas, menos de 20 são
patogênicas, sendo agrupadas em quatro categorias: três baseadas na atividade tóxica
(neurotóxicos, histotóxicos e enterotóxicos) e tecidos afetados e a quarta contendo patógenos
de menor importância, que causam doença esporádica, geralmente afetando animais de modo
individual. Os clostrídios neurotóxicos, como Clostridium tetani e C. botulinum, afetam a
40
função neuromuscular sem indução observável de lesão tecidual. Em contraste, os clostrídios
histotóxicos como os C. perfringens (tipo A), C. chauvoei, C. septicum, C. haemolyticum e C.
novyi (Tipo A-B), produzem lesões relativamente localizadas em tecidos (como nos músculos
e no fígado) e podem subsequentemente causar toxemia. Já os C. perfringens (tipo A-E), são
enterotóxicos e produzem lesões inflamatórias no trato gastrintestinal juntamente com
enterotoxemia (QUINN et al, 2005).
Os clostrídios são saprófitos encontrados no solo, na água fresca ou em sedimentos
marinhos. As espécies de Clostridium produzem endósporos que são corpos dormentes
altamente resistentes que garantem a sobrevivência durante condições ambientais adversas. A
diferenciação das espécies pode ser realizada através do tamanho, forma e localização dos
endósporos (ROBERTS, 2012).
Clostridium perfringens são classificados em cinco genótipos (A a E) que produzem
várias exotoxinas potentes e imunologicamente distintas, que causam efeitos locais e
sistêmicos encontrados nas enterotoxemia. C. perfringens tipo B, C, D e E são
particularmente significativos em animais domésticos e podem sobreviver no solo por vários
meses como esporos. C. perfringens tipo A, que constituem parte da flora intestinal normal,
estão amplamente distribuídos no solo (QUINN et al, 2005).
Em revisão da literatura, observou-se que a investigação sobre o envolvimento de C.
perfringens em peixes de água doce é limitada. Contudo, a carne crua ou processada e
armazenada em condições inadequadas, constituem em uma importante fonte de
contaminação por C. perfringens para humanos ou outros animais que venha a consumir esta
(DAS; JAIN, 2012).
Clostridium difficile causa doença em seres humanos e animais que vão desde a
colonização assintomática a diarreia e colite (GOULD; LIMGABO, 2010). Em pesquisa
realizada por RAMIREZ e DIXON (2003), foi demonstrada a associação de C. difficile com
uma doença conhecida como ''Malawi bloat'' (no qual o peixe infectado apresenta o abdômen
distendido) em ciclídeos africanos, mas não ficou comprovado que esta seja o principal
patógeno desencadeante dessa doença.
Botulismo é uma intoxicação grave, potencialmente fatal para o homem e animais,
adquirida pela ingestão de toxina produzida pela bactéria Clostridium botulinum (EKLUND,
et al, 1982; HANNETT et al, 2011). Oito tipos de C. botulinum são reconhecidos com base na
especificidade sorológica das toxinas que produzem (A, B, C α, C β D, E, F, G) (EKLUND, et
al, 1982; 1984; QUINN et al, 2005; YULE et al, 2006). Os tipos C e D causam a maioria dos
surtos de botulismo em animais domésticos, que ocorrem mais comumente em aves aquáticas,
41
bovinos, equinos, ovinos, martas, aves domésticas e peixes cultivados (QUINN et al, 2005). O
tipo E é o mais prevalente em ambientes marinho e de água doce do hemisfério norte
(EKLUND, et al, 1982; 1984).
Os esporos do Clostridium botulinum são as formas mais resistentes que se têm
encontrado entre os agentes bacterianos, podendo sobreviver por mais de 30 anos em meio
líquido e, provavelmente, mais tempo ainda em estado seco, tolerando temperaturas de 100ºC
por horas. Para destruir os esporos, os alimentos contaminados devem ser aquecidos a 121ºC
por 30 minutos. Além disso, os esporos do C. botulinum tipo E são capazes de germinar em
temperaturas inferiores a 3ºC e frequentemente estão associados com frutos do mar
refrigerados (CERESER et al, 2008).
C. botulinum é encontrado no solo, fezes, decomposição matéria orgânica e
sedimentos aquáticos. São comuns também no trato intestinal de peixes e podem ser isolados
a partir de sedimentos de tanques de terra em algumas áreas (YULE et al, 2006; AUSTIN;
AUSTIN, 2007; HANNETT et al, 2011; ROBERTS, 2012).
Em humanos a toxina causa quatro tipos reconhecidos de enfermidades, incluindo
botulismo alimentar, botulismo por feridas, colonização intestinal em adultos e botulismo
infantil. O botulismo alimentar ocorre pela ingestão da toxina pré-formada, enquanto que, nos
outros três tipos, a enfermidade ocorre pela infecção, multiplicação e produção de toxinas por
microrganismos clostridiais em feridas ou no trato gastrintestinal (EKLUND et al, 1982;
CERESER et al, 2008)
Um grama de toxina botulínica é suficiente para matar 30 milhões de camundongos. A
dose letal da toxina botulínica para o ser humano não é conhecida, mas pode ser estimada
extrapolando-se os resultados encontrados para primatas. Tem-se, por exemplo, uma dose
letal para toxina tipo A em um homem de 70kg igual a 0,09-0,15μg, por via intravenosa ou
intramuscular, de 0,70-0,90μg por inalação, ou ainda de 70μg por via oral (CERESER et al,
2008).
As toxinas botulínicas são as mais potentes toxinas biológicas conhecidas. Estas não
atingem o sistema nervoso central devido à barreira hematoencefálica, não ocorrendo,
portanto, perturbações de ordem central, permanecendo o infectado, comumente, consciente
durante a evolução do quadro. As toxinas atuam nas junções neuromusculares, provocando
paralisia funcional motora sem a interferência com a função sensorial. Os efeitos
farmacológicos das toxinas acometem principalmente os nervos periféricos, os quais têm a
acetilcolina como mediador. As toxinas ligam-se na membrana nervosa bloqueando a
liberação da acetilcolina, causando a paralisia flácida que evolui para a morte, devido à
42
paralisia dos músculos respiratórios, sem o desenvolvimento de lesões histológicas (QUINN
et al, 2005; CERESER et al, 2008).
O primeiro relato de ocorrência de botulismo como uma doença em peixes ocorreu em
1974, em um cultivo de trutas arco-íris (Oncorhynchus mykiss) na Dinamarca. Através desse
relato foi demonstrado que o botulismo é uma doença crônica, que teve como agente causal
reconhecido o C. botulinum tipo E, e foi chamada pelos piscicultores de "Doença da falência”
em resposta a significativa mortalidade e grande perda econômica que ocasionou (EKLUND
et al, 1982; YULE et al, 2006; AUSTIN; AUSTIN, 2007). Posteriormente surtos semelhantes
foram relatados nos Estados Unidos em 1979 e em trutas na Grã-Bretanha em 1982. Vários
outros surtos de botulismos em viveiros de peixes, tem sido documentadas, principalmente em
países do hemisfério norte, mas poucas pesquisas sobre a toxicologia da neurotoxina
botulínica em peixes têm sido conduzidas (EKLUND et al, 1984; AUSTIN; AUSTIN, 2007;
ROBERTS, 2012).
Botulismo por C. botulinum tipo E em humanos é associado com o consumo de peixe
e de mamíferos aquáticos contaminados (HANNETT et al, 2011). Os peixes são suspeitos de
abrigar as bactérias no seu trato gastrointestinal, onde a toxina é subsequentemente formada,
possivelmente quando submetidos a certas condições de estresse. NOL et al. (2004) suspeita
que a tilápia (Oreochromis mossambicus) quando esta sujeita a uma variedade de infecções
bacterianas, pode ter experimentado um aumento da susceptibilidade à formação de toxina ou
presença da toxina dentro de seu trato gastrointestinal devido o seu estado geral estar
comprometido.
Nos Grandes Lagos da América do Norte, a grande mortalidade de aves provocada
pela ingestão de peixes contaminados por Clostridium botulinum toxina tipo E levou a
estudos sobre a distribuição da toxina no intestinos dos peixes e de sua toxicidade para eles
(ROBERTS, 2012).
A fonte de infecção para os peixes não esta completamente esclarecida, mas em
estudos realizados para verificar a presença de botulismos em peixes, foi demonstrado que os
peixes mortos e em deterioração na água favorecem a germinação e proliferação de bactérias
e subsequente produção de neurotoxinas (os numerosos esporos produzidos podem
permanecer latentes nos sedimentos por muitos anos), sendo uma das principais fontes de
infecção, uma vez que peixes como o salmão coho e truta, alimentam de tecidos moles de
peixes mortos (canibalismo), onde muitas vezes esta concentrada as toxinas (EKLUND et al,
1982; 1984; YULE et al, 2006). A utilização de restos de peixes mortos como alimentos para
os outros animais, assim como ração e/ou outros alimentos armazenados inadequadamente,
43
podem constituir em outra importante fonte de infecção para os peixes (AUSTIN; AUSTIN,
2007). Os invertebrados também podem ser vetores da toxina E, já que foi demonstrada a
presença dessa toxina em caracóis, minhocas e pequenos nematoides (EKLUND et al, 1984;
YULE et al, 2006).
EKLUND et al. (1984) relataram que os surtos de botulismo ocorreram geralmente
durante o verão ou outono, quando a temperatura da água é maior. Em temperaturas elevadas,
maiores que 15 a 20 0C, os esporos podem germinar, crescer e produzir milhões de células
adicionais do tipo E no peixe morto e os peixes vivos pode começar a exibir os sintomas de
botulismo quando a temperatura aumenta a 23 0C ou mais. Quando a temperatura da água
caiu abaixo dos 10 0C, os sustos assim como a taxa de crescimento das bactérias diminuíram.
Os peixes afetados geralmente apresentam cor escura (hiperpigmentação), corpo
ligeiramente inchado, flutua apaticamente na superfície e em seguida afundam e nadam
erraticamente à superfície.
Os sinais patológicos incluem palidez das brânquias, ligeiro
edema abdominal, e, em geral, apresentam trato digestivo vazio. Não apresentam alterações
histopatológicas óbvias, a menos que ocorra uma infecção bacteriana concomitante (AUSTIN;
AUSTIN, 2007; ROBERTS, 2012).
Em um estudo experimental, no qual foi testada a toxicidade da neurotoxina botulínica
do tipo E para peixes dos grandes lagos na América do norte, YULE et al. (2006) verificaram
que as características predominantes dos peixes afetados foram mudanças comportamentais
(perda da função motora, apresentando perda de equilíbrio, natação errática e decúbito dorsal)
e alteração na pigmentação.
Em outro estudo realizado no qual foi pesquisado botulismo tipo E em salmonídeos,
EKLUND et al. (1984) observaram que pouco antes do desenvolvimento dos sinais de
botulismo, os peixes tornaram-se hipersensíveis e nervosos e, com a progressão da doença, os
músculos peitoral, pélvico, anal e das nadadeiras dorsais foram paralisados devido à ação da
neurotoxina tipo E do C. botulinum. Isso começou com a nadadeira peitoral e a paralisia
continuou progressiva em direção caudal. A nadadeira caudal, no entanto, permaneceu ativa,
o que permitiu o peixe se movimentar, mas a sua incapacidade para controlar as outras
nadadeiras resultou em perda de equilíbrio e direção. Após a morte, foi observado que na
porção final do trato intestinal dos peixes continha muito material fecal viscoso, sugerindo um
estado de constipação, uma condição frequentemente associada com o botulismo em outros
animais e em humanos, assim como o característico sinal da progressão dos sintomas de
forma cranial-caudal.
44
Para diagnóstico de botulismo é realizado o isolamento da bactéria, bioensaio em
camundongos para avaliar a presença de fatores tóxicos e técnicas de biologia molecular. O
isolamento da bactéria pode ser conseguido através da utilização de técnicas anaeróbicas, já
que o C. botulinum é anaeróbico estrito. Amostras do conteúdo intestinal, o que,
provavelmente, suportam uma microflora residente anaeróbia e órgãos internos devem ser
homogeneizadas em tampão de fosfato a 1% de peptona, a pH 7, e diluída cinco vezes. Estas
amostras diluídas devem ser inoculadas em 100 ml ou 200 ml alíquotas de caldo de carne de
Robertson, com a subsequente incubação anaeróbica a 30 ° C por até 6 dias (AUSTIN;
AUSTIN, 2007).
A presença de C. botulinum e a sua toxicidade pode ser avaliada através da inoculação
de filtrados de cultura estéreis em ratos e / ou o peixe e a toxina especifica é identificada por
testes de neutralização com anti-soros monovalentes (ROBERTS, 2012).
Recentemente existem vários estudos sobre a análise de bactérias intestinais de peixes
que combinam métodos moleculares com os métodos tradicionais bacteriológicos.
Consequentemente, as técnicas moleculares têm sido desenvolvidas e são utilizadas com mais
frequência para estudar e obter informações mais detalhadas sobre a microflora intestinal dos
peixes. Essas técnicas incluem métodos de impressão digital baseados na utilização do gene
RNAr 16S, reação em cadeia polimerase (PCR), eletroforese em gel com gradiente
desnaturante (DGGE), eletroforese em gel com gradiente de temperatura (TGGE),
polimorfismo no comprimento de fragmento de restrições (FRLP), amplificação aleatória de
DNA polimórfico (RAPD) e eletroforese em campo pulsado (PFGE) são as ferramentas que
têm sido utilizado para determinar a relação genética entre Cepas de C. botulinum tipo E
(SUGITA et al, 1996; HANNETT et al, 2011).
Botulismo é uma condição de muito baixa incidência em fazendas de criação que se
limita a peixes cultivados em tanques de terra ou tanques rede. Geralmente, ela está associada
com condições de estresse provocada aos peixes como altas densidades nos tanques, nutrição
deficiente e principalmente a não retirada dos peixes mortos e moribundos diariamente. Sendo
assim, cabe a todos os piscicultores o dever de manter os padrões de criação adequados, que
impedem o seu desenvolvimento e a propagação da doença a outros animais e aos seres
humanos (EKLUND et al, 1982; 1984; ROBERTS, 2012).
Os funcionários devem ser informados de que C. botulinum e sua toxina são
potencialmente perigosos para si e suas famílias. Se os clostrídios são trazidos para dentro de
casa, especialmente em grandes números, através da roupa suja ou mãos impropriamente
lavadas, podem ser introduzida em carnes cozidas ou cruas, peixes e legumes. Portanto, é
45
essencial que os funcionários usem roupas de proteção e luvas sempre que trabalhar com o
peixe doente e que seja realizada uma boa higiene após o contato com esses peixes (EKLUND
et al, 1982).
Peixes mortos, como citado acima, são sujeitos à decomposição e proliferação das
bactérias tornando uma das principais fontes infecção para os outros peixes, portanto, não
deve ser permitido acumular nos fundos dos viveiros ou tanques. Os peixes mortos devem ser
incinerados ou colocados em trincheiras longe do abastecimento doméstico de água e
enterrados sob uma camada de solo e cal. Caso contrário, surto de botulismo em peixes
poderia ser estendido a outras populações de animais e ao próprio homem (EKLUND et al,
1982; 1984).
Nos viveiros onde ocorreram surtos de botulismo, os sedimentos não devem ser
usados como fertilizantes ou para outros fins, já que podem conter uma grande população de
organismos de C. botulinum. Em vez disso os sedimentos devem ser enterrados na mesma
maneira como recomendado para peixes mortos (EKLUND et al, 1982; 1984).
Não há tratamento eficaz para estoque em sistemas contaminados (daí o nome "doença
da falência”). Pode ser utilizadas medidas de controle como a correta eliminação dos peixes
moribundos e mortos e aplicação de boas praticas de manejo, evitando, por exemplo, altas
taxas de densidades nos tanques e viveiros de criação (ROBERTS, 2012).
2.3.2 Tratamentos das principais enfermidades bacterianas em tilápias
O tratamento das enfermidades bacterianas na aquicultura é realizado através da
administração de antibióticos aos peixes. Atualmente temos poucas opções de farmoquímicos
autorizados oficialmente disponíveis para conduzir uma intervenção terapêutica em situações
de surtos em pisciculturas. O florfenicol, a oxitetraciclina e a neomicina (este ultimo é
destinado a peixes ornamentais) são as opções de antibióticos liberados pelo Ministério da
Agricultura, Pecuária e abastecimento (MAPA) para uso na aquicultura. No entanto, na
prática são empregadas muitas outras moléculas de forma indiscriminada e sem conhecimento
dos potenciais riscos à saúde humana, dos peixes e de toda a biota aquática (PÁDUA et al,
2012).
Os antibióticos podem ser administrados via injeção, misturados à ração ou através do
banho de imersão. A injeção é a maneira mais eficiente de garantir que a dose de antibiótico
desejada chegue até a corrente sanguínea, porém, esse processo é trabalhoso e impraticável
para tratamento de peixes na fase de recria e engorda, sendo utilizado, em alguns casos, em
46
peixes reprodutores. O banho de imersão possui a desvantagem de precisar de maiores doses
de antibiótico para alcançar o efeito desejado. Na pratica é utilizado em poucas situações,
como por exemplo, no transporte de alevinos em sacos plásticos ou nas caixas de caminhões
especializadas ou em sistemas fechados como laboratórios ou larviculturas, onde o volume de
água é menor e o fluxo pode ser controlado. A via mais utilizada é a incorporação dos
antibióticos à ração. Essa incorporação pode ser feita na fabrica de ração ou na propriedade
(FIGUEIREDO et al, 2008b).
O
florfenicol
(FFC)
(D-(threo)-1-(methylsulfonylphenyl)2-dichloroacetamide-3-
fluoro-1-propanol) é caracterizado por ter alta disponibilidade em peixes, boa penetração nos
tecidos e rápida eliminação (CARRASCHI, 2010). Ele apresenta amplo espectro, que atua
sobre bactérias gram negativas e gram positivas, inibindo o metabolismo bacteriano através da
interferência no processo da síntese de proteína. Possui a capacidade de atravessar a barreira
hematoencefálica (o que não ocorre com a tetraciclina), sendo indicado para o tratamento de
doenças bacterianas que acometem o cérebro (FIGUEIREDO et al, 2007b).
A oxitetraciclina é um antibiótico do grupo das tetraciclinas e vem sendo utilizado por
décadas no tratamento de bacterioses, principalmente por ser eficaz, de baixo custo, de amplo
espectro de ação e possuir a capacidade de difusão em fluidos e tecidos corpóreos
(CARRASCHI, 2010).
O tratamento da estreptococose é realizado administrando antibiótico a base de
florfenicol, na dose de 10mg/kg/pv combinado com sulfa-trimetoprim na dose de 25
mg/kg/pv por um período recomendado de 10 dias (TAVARES; PALHARES, 2011;
FIGUEIREDO et al, 2012).
De acordo com a literatura, Edwardsiella tarda é sensível a uma ampla variedade de
agentes antimicrobianos e, portanto, o tratamento ainda é efetuado através do uso de
antibióticos (LIMA et al, 2008). O uso de oxitetraciclina, 55mg/kg de peixe/dia, durante 10
dias, ou 60 mg/kg de peixe/dia, durante quatro (4) a cinco (5) dias, tem-se revelado um
tratamento muito eficaz (PAVANELLI et al, 2002).
Flavobacterium columnare é uma bactéria que apresenta boa sensibilidade aos
antibióticos e ao NaCl. Por isso a utilização de oxitetraciclina na ração em quantidade
suficiente para consumo ao redor de 50 a 75 mg/kg/pv, durante 10 dias costuma ser eficaz.
Outra opção de tratamento é o banho com permanganato de potássio por 30 minutos à uma
hora na concentração de 5-10 mg/litro (KUBITZA, 2000).
Os antibióticos podem ser utilizados como tratamento profilático das enfermidades
geralmente um tempo e por um período após manejo como durante o transporte de animais,
47
repicagem, entre outros. Apesar de essa prática parecer vantajosa, ela pode trazer prejuízos
para o sistema de médio a longo prazo, pois o uso indevido e indiscriminado desses
antibióticos pode selecionar microrganismos resistentes aos medicamentos usados, e, em
casos de surtos, esses não serão mais eficientes (PÁDUA et al, 2012; FIGUEIREDO et al,
2008b).
Além do impacto direto na produção, o uso inadequado de antibióticos pode ser
altamente nocivo para o meio ambiente, principalmente em culturas realizadas em tanques
rede onde estão localizadas em grandes bolsões de água como represas, lagos e rios, pois parte
do antibiótico incorporado à ração se dissolvem na água e podem depositar no sedimento ou
serem ingeridas por outros animais ali presentes, alterando o perfil de microrganismos e
induzindo a seleção daqueles que são resistentes à droga (CARRASCHI, 2010;
FIGUEIREDO et al, 2008b).
Sendo assim, a forma mais coerente para a utilização dos antibióticos é quando ocorre
um surto no local. De preferência esses devem ser usados no inicio do caso, quando os
primeiros sinais começam a aparecer e sempre realizar um antibiograma para determinar qual
o melhor antibiótico. Como um dos primeiros sinais clínicos é a falta de apetite, é importante
ter a consciência de que o tratamento com uso de ração medicada com antibióticos, só será
efetiva para os animais que ainda estiverem saudáveis ou em fases bem iniciais da infecção.
As mortalidades não cessarão imediatamente, pois a parcela de peixes que já estiver doente
provavelmente morrerá (FIGUEIREDO et al, 2008b).
2.3.3 Controle das enfermidades bacterianas
O sucesso dos empreendimentos aquícolas depende de vários fatores, sendo que um
dos mais importantes é a condição sanitária dos animais que estão sendo cultivados. Dessa
forma, o monitoramento do estado de saúde dos peixes é essencial para garantir a produção de
animais saudáveis e evitar perdas na atividade. Ademais, o conhecimento da distribuição
sazonal dos organismos causadores de enfermidades, assim como, da complexa relação entre
fatores ambientais, hospedeiros e patógenos são importantes para que se possa intervir no
sistema, com técnicas profiláticas adequadas, através de programas preventivos de controle
destas enfermidades (ROBERTS, 2012).
48
O controle das enfermidades bacterianas deve ser feito através de uma associação de
medidas que visam à diminuição da carga infectante do patógeno no ambiente. As boas
praticas de manejo devem ser implementadas como preventivo para a introdução de doenças
na piscicultura, as principais medidas a serem adotadas são:
Contínuo monitoramento e correção da qualidade da água;
Assegurar uma correta nutrição através do uso de rações de qualidade adequada às
condições do cultivo, evitando o uso de resíduos animais na alimentação dos peixes,
pois podem favorecer a ocorrência de doenças;
Prover adequado manejo alimentar, evitando alimentar o peixe de maneira excessiva;
Manter adequada condições de estocagem;
Tomar cuidado na introdução de alevinos, juvenis e reprodutores, dar preferência para
a aquisição desses animais com fornecedores idôneos e atentos ao manejo sanitário
dos seus estoques (alevinos são as principais fontes de infecção para as fases de
crescimento e engorda);
Realizar quarentena antes da introdução de novos exemplares;
Realizar isolamento das unidades de produção, manter o setor de berçário isolados dos
outros setores;
Ficar atento a qualquer alteração no comportamento dos peixes e dos sinais indicativos
de anormalidades e doenças;
Remover diariamente peixes mortos e moribundos dos tanques de cultivo e
disponibilizar local adequado para a disposição dos mesmos;
Realizar inspeção sanitária de rotina mesmo em lotes de peixes aparentemente sadio
(inspeção externa e interna, exames parasitológicos e microbiológicos);
Realizar desinfecção de equipamentos e utensílios de uso rotineiro;
Manter sob controle a população de outros animais na piscicultura, pois estes podem
servir de vetores de doenças ou zoonoses e ainda atuar como hospedeiro intermediário
de alguns parasitos;
Evitar o uso indiscriminado de terapêuticos, pois podem causar resistência dos
patógenos a determinados tratamentos;
Ter apoio de profissional especializado para o estabelecimento de diagnóstico e
devidas ações para controle das doenças (KUBITZA et al, 2008; 2013; PÁDUA et al,
2012).
49
O uso de antibióticos incorporados às rações como medicamento preventivo
(profilático) é prejudicial, pois pode levar à seleção de microrganismos resistentes, provocar
impacto ambiental, gerar resíduos e aumentar o custo de produção (FIGUEIREDO et al,
2009a). Uma das alternativas que o meio técnico e científico vem buscando na perspectiva
diminuir o uso de antibióticos na aquicultura diz respeito à substituição desses produtos por
probióticos e prebióticos em rações para peixes, tendo-se a expectativa de se prevenir doenças
(MOURIÑO et al, 2010).
Os probióticos podem ser definidos como microrganismos vivos que ao serem
ministrados a tanques de cultivo, atuam beneficamente no organismo aquático de interesse,
seja melhorando o consumo ou absorção da ração, o sistema imunológico, balanço de
bactérias benéficas e patogênicas no trato intestinal, ou o ambiente de cultivo (MEURER et
al, 2008; MOURIÑO et al, 2010). O uso de probióticos em rações para peixes tem mostrado
resultados promissores quando os animais são submetidos a algum tipo de estresse. No
entanto, um sistema aquícola que apresente as condições necessárias para bom desempenho
dos peixes (manejo nutricional e sanitário) não se faz necessária a utilização de probióticos, já
que o contato com microrganismos patogênicos é mínimo (FERREIRA et al, 2012).
Já os prebióticos são substâncias não digeríveis que beneficiam o balanço das bactérias
no trato intestinal, promovendo o crescimento específico das cepas probióticas, ou seja, ele
beneficia seletivamente a composição da microbiota, fornecendo aos probióticos e/ou
bactérias benéficas, vantagens competitivas sobre outras bactérias existentes no trato intestinal
(MOURIÑO et al, 2011). Ambos têm uma atividade complementar, mas apesar dos seus
efeitos benéficos para a saúde dos peixes, alguns resultados observados em estudos são
contraditórios, fato que exige dos meios técnico e científico mais estudos que possam
contribuir com a viabilização desses produtos na alimentação de peixes (MEURER et al,
2008; MOURIÑO et al, 2010; FERREIRA et al, 2012).
O sal marinho, composto basicamente por cloreto de sódio (NaCl), é amplamente
disponível, de baixo custo, seguro para os peixes e para quem o manipula e pode ser usado em
diversas situações nas pisciculturas: na prevenção e controle de doenças; como alívio do
estresse relacionado às despescas, biometrias, classificações por tamanho, transferências dos
peixes e confinamento durante a depuração; no alívio do estresse do transporte de curta e
longa duração; e como amenizador de condições ambientais adversas (toxidez por nitrito,
inflamação das brânquias, entre outros) (KUBITZA, 2007).
Durante a depuração dos peixes para o transporte (pós-larvas, alevinos e reprodutores),
o uso do sal, na concentração de 0,3 a 0,6% (3 a 6g/litro ou 3 a 6kg/1.000litros), previne o
50
aparecimento de lesões (manchas brancas) e a infecção por fungos e bactérias externas (como
a Flavobacterium columnare - que causa podridão das nadadeiras nos peixes). É fundamental
a adição do sal à água de transporte também, em concentrações entre 0,5 e 0,8% (5 a 8g/litro
ou 5 a 8kg/1.000litros) para evitar significativa mortalidade e supressão do sistema
imunológico causado pelo estresse (KUBITZA, 2007).
Para controle da columnariose, podem ser aplicados banhos preventivos com sal no
recebimento dos alevinos e após as operações de manejo. Nesse caso devem ser dados banhos
de sal na concentração de 5% (50 g/litro ou 50 kg/1.000 litros) por 30 segundos a 2 minutos;
ou banhos em água com 2 a 3% de sal (20 a 30 g/ litro = 20 a 30 kg/1.000 litros) por 2 a 20
minutos; ou banhos prolongados, entre 4 a 12 horas, com sal na concentração de 1,0 a 1,2%
(10 a 12 g/litro ou 10 a 12 kg/1.000 litros). Essas concentrações e tempos de exposição ao sal
nos banhos podem ser usados também como controle de doenças parasitárias e fúngicas
(FIGUEIREDO, 2007a; KUBITZA, 2007; PÁDUA et al, 2012).
Em todo mundo o uso de vacinas como método imunoprofilático na aquicultura tem
aumentado
significativamente,
seguindo
a
tendência
de
expansão
da
atividade
(FIGUEIREDO; LEAL, 2008d). As primeiras vacinas para peixes foram comercializadas no
mercado mundial no final da década de 1970, e foram concebidas para prevenção contra
infecção por Vibrio anguillarum, Vibrio ordalli e Yersinia ruckeri. Atualmente, existem
diversas vacinas comerciais para diversas espécies de peixes e contra grande parte dos
patógenos de importância para atividade (FIGUEIREDO et al, 2009a).
Vacinas vivas, inativadas e de DNA (menor frequência) são os principais tipos
utilizados. Devido aos benefícios econômicos, as vacinas produzidas a partir de células
inativadas dos microrganismos, são os tipos mais comuns e as principais vacinas utilizadas
para prevenção e controle de doenças bacterianas na aquicultura (LONGHI et al, 2012). Os
peixes podem ser imunizados por via injetável, preferencialmente por injeção intraperitoneal
(i.p.); por banhos de imersão (b.i), onde os animais são imersos em solução aquosa contendo
os antígenos vacinais; ou pela administração oral (v.o.) das vacinas. Esses métodos
apresentam diferentes vantagens e desvantagens quanto à eficiência da imunização,
praticidade, efeitos colaterais e custo – benefício (FIGUEIREDO; LEAL, 2008d; LONGHI et
al, 2012).
A via injetável é o método mais laborioso e demorado, uma vez que exige a
administração do produto em cada um dos peixes, sendo que estes devem ser sedados e é
necessário um número elevado para a realização do procedimento. Porém, são as que induzem
51
melhores respostas imunes, sendo essas mais intensas e duradouras (FIGUEIREDO et al,
2009a).
O banho de imersão é vantajoso para a escala de produção, uma vez que o produtor
pode vacinar um grande número de peixes de uma vez, com menor manipulação dos peixes
em relação à vacinação intraperitoneal, mas, esse tipo de via promove menor resposta imune e
por tempo mais curto que a via injetável (FIGUEIREDO et al, 2009a). A vacinação oral é boa
alternativa para a vacinação, pois não há manipulação dos peixes, reduzindo o estresse e de
fácil administração (as vacinas são misturadas à ração), sendo apropriada para a imunização
de grandes quantidades de peixe. Entretanto, há poucas vacinas orais comercializadas, devido
à grande quantidade de antígeno requerido para estimular a resposta imune e a falta de
duração adequada da proteção ao longo do cultivo, além disso, não se tem controle da
dosagem individual de cada peixe (SILVA, 2008).
No Brasil, em 2011, foi aprovada a primeira vacina de Streptococcus agalactiae
inativada para tilápias, a Aquavac® STREP Sa, de aplicação i.p. (LONGHI et al, 2012). Os
estudos epidemiológicos patrocinados pela MSD Saúde Animal em todo o mundo
demonstraram a presença de dois grupos ou biótipos diferentes de S. agalactiae (ou seja, I e
II). Os isolados de tilápia de diferentes regiões no mundo mostram que 26% dos estreptococos
foram identificados como S. agalactiae Biótipo I, enquanto 56% eram S. agalactiae Biótipo
II, o mais prevalente no mundo, encontrado principalmente na China, Indonésia, Vietnã,
Filipinas e América Latina. No Brasil, os estudos sorológicos mostram 100% de sorologia
positiva para o S. agalactiae Biótipo II (SALVADOR et al, 2011).
A vacina Aquavac® STREP SA, contem bactérias inativadas de S. agalactiae biótipo
II (sorotipo Ib). Ela deve ser administrada na dose de 0,05mL por peixe, através da via
intraperitoneal a uma distância de meia nadadeira na frente das nadadeiras pélvicas de tilápias
pesando pelo menos 15 gramas. Estudos laboratoriais demonstraram que a proteção tem início
em aproximadamente 28 dias e dura até 7 (sete) meses após a vacinação (ZANOLO et al,
2011).
A avaliação da vacina AquaVac® Strep Sa em condições experimentais induziu a
proteção efetiva na tilápia do Nilo e mostrou uma redução significativa do índice de
mortalidade nos peixes vacinados, demonstrando ser valiosa e altamente eficaz. Uma dose
única da vacina pode constituir em uma ferramenta indispensável para melhorar a
produtividade, o desempenho, a viabilidade econômica e servir de prevenção e controle da
estreptococose na produção de tilápias no Brasil (SALVADOR et al, 2011; ZANOLO et al,
2011).
52
2.3.4 Certificação Sanitária
Atualmente, peixes e outros produtos aquícolas são as principais fontes de proteína de
origem animal no mundo, e a maior parte dessa demanda é suprida pela aquicultura
comercial. Para manter velhos clientes e conquistar novos mercados é necessária uma
produção eficiente e economicamente viável, visando um produto de qualidade a um preço
competitivo. Para isso, o controle sanitário é importante, uma vez que tem como finalidade a
obtenção de animais ou produtos atestadamente livres de doença importantes e o animal
estando saudável, o desempenho produtivo será melhor, a um custo baixo, originando
produtos com boas características e sem risco à saúde do consumidor (FIGUEIREDO; LEAL,
2008c).
Para que isso funcione, deve ser instalado um programa sanitário especifico (devido a
grande diversidade de sistemas de cultivos), que envolve diversos procedimentos e práticas,
aplicadas de acordo com a realidade observada na propriedade ou empresa (KUBITZA et al,
2013).
O primeiro passo para a certificação sanitária é a identificação dos principais
problemas vigentes na propriedade, realizando levantamento de informações sobre a
produção, índices produtivos, manejo, etc., bem como coleta de material e realização de
exames laboratoriais para o diagnóstico de doenças. A partir disso, inicia-se o controle e
erradicação das doenças, que envolve o descarte de animais e tratamentos terapêuticos com
antibióticos e substâncias desinfetantes (FIGUEIREDO; LEAL, 2008c).
Logo após essas etapas partimos para a implantação das práticas de biossegurança, que
tem como objetivo impedir a recorrência das doenças e evitar a entrada de novos patógenos e
parasitas na propriedade. Estas incluem o monitoramento contínuo da qualidade da água, uso
de ração de alta qualidade, adequado manejo dos peixes, etc. Entre as medidas a serem
tomadas, umas das principais é a realização do treinamento de funcionários, para eles sejam
capazes de identificar o menor sinal de problema e realizar os procedimentos básicos para
controlar ou conter as possíveis eventualidades até a chegada do profissional responsável
(FIGUEIREDO; LEAL, 2008c, KUBITZA et al, 2013).
Para o sucesso do programa sanitário, deve ser realizada constantemente a avaliação
deste quanto ao seu funcionamento, eficiência e resultados obtidos, detectando as falhas que
estão ocorrendo ou podem vir a ocorrer, comprometendo todo o trabalho realizado
(FIGUEIREDO; LEAL, 2008c).
53
A adoção de práticas de biossegurança não implica em grandes investimentos e
aumento demasiado nos custos operacionais do empreendimento. A elevação do custo de
produção decorrente de problemas sanitários nas pisciculturas e a redução nos lucros dos
empreendimentos que esses problemas provocam, supera em muito o valor de implantação a
aplicação de práticas de biossegurança e de manejo da produção, no entanto, a decisão final
cabe ao produtor (KUBITZA et al, 2013).
3
CASUÍSTICA
3.1 Material e métodos
Na cidade de Morada Nova de Minas, localizada na região central de Minas Gerais, as
margens do lago da represa de Três Marias, foi realizado o diagnóstico bacteriológico de
quatro pisciculturas com cultivo de tilápias do Nilo (Oreochromis niloticus) (Figura 26). As
propriedades foram nomeadas em A, B, C e D. As pisciculturas A, B e C apresentam sistema
de criação intensiva em tanques rede, com animais na fase recria e engorda utilizando o corpo
hídrico do reservatório de três Marias, enquanto que a piscicultura D caracteriza-se pela
produção de alevinos de tilápia do Nilo.
Figura 26: Tilápia do Nilo
Fonte: Fotos da autora
Na piscicultura A foram coletados três peixes. O peixe 1 era o menor entre os
coletados e apresentava lesão superficial, hemorrágica e edema. Os peixes 2 e 3 apresentavam
sinais de letargia, perda da capacidade natatória e exoftalmia. Na piscicultura B foi coletado
um peixe na fase de engorda com peso de 400 g e com sinal de lesão na pele. Na piscicultura
54
C, dois peixes sem lesões na pele, mas com suspeita de enterotoxemia foram encaminhados
ao laboratório, e, na piscicultura D foram enviados dois peixes adultos (uma fêmea e um
reprodutor macho) e cinco alevinos para exame laboratorial de rotina já que estes não
apresentaram lesões ou outros sinais clínicos evidentes.
Os peixes foram coletados no verão e foram transportados inteiros e resfriados para o
Centro de Diagnóstico e Monitoramento Animal (CDMA), localizado em Belo Horizonte,
onde foram examinados. No laboratório, os peixes foram examinados quanto ao aspecto físico
e morfológico, e, posteriormente realizado a necropsia destes. Quanto ao aspecto morfológico
foram observados os olhos (posicionamento, retração ou protusão do globo), a pele (muco,
injúrias, hemorragias, abscessos, úlceras, edemas, cicatrizes, descoloração e formação de
nódulos), nadadeiras (malformações, injúrias, necrose, inflamações, cicatrizes, perda de fios),
linha lateral (bifurcações e deformidades). A musculatura foi observada quanto à consistência
e forma. Cabeça e boca foram examinadas quanto à presença de perfurações, cicatrizes,
formações calosas, saliências, depressões ou malformações e as brânquias observando se há
aumento de secreção do muco, edemas, sangramentos, descolorações, necrose, descamação,
cicatrizes, malformações.
A necropsia consistiu na abertura da cavidade visceral através de uma incisão ventral,
começando na região do ânus, prolongando-a até a região anterior e rebatendo logo em
seguida as paredes laterais da cavidade visceral para expor os órgãos internos (Figura 27).
Durante a necropsia foi observada a presença de qualquer alteração nos órgãos internos
quanto à coloração, tamanho, aspecto, presença de aderências e de líquidos. As possíveis
alterações macroscópicas foram anotadas e procedidas às coletas do material para exames
bacteriológicos do fígado, rins, cérebro, baço, intestino, pele (áreas de lesão, superfície e
debaixo da escama) e ovário.
Figura 27: Necropsia do peixe
55
Fonte: Fotos da autora
O material foi semeado em meios de cultura ágar sangue, ágar MacConkey e
incubados a 280C durante 24 a 48 horas (figura 28). Após o período de incubação, procedeuse a caracterização das estirpes isoladas através da morfologia das colônias, hemólise, teste de
Gram, oxidase e catalase.
Figura 28: Coleta de material para semeadura em meios de cultura
Fonte: Fotos da autora
Foram realizados, em todos os peixes, exames de bacteriologia com métodos de
cultura bacteriológica, identificação bacteriana com testes bioquímicos e PCR (Reação em
Cadeia da Polimerase) de acordo com o descrito por MATA et al, 2004.
Na piscicultura A também foi realizado a bacterioscopia das amostras e histopatologia
do fígado.
Nas pisciculturas A e B os isolados foram submetidos ao teste de sensibilidade a
antimicrobianos. Na piscicultura A foi utilizado os seguintes antibióticos: ciprofloxacin,
florfenicol, enrofloxacin, eritromicina, oxacilina, sulfametoxazol + trimetoprim e tetraciclina
e a piscicultura B os antibióticos: cloranfenicol, enrofloxacin, eritromicina, florfenicol,
sulfametoxazol + trimetoprim e tetraciclina. Ambos foram determinadas utilizando o método
de Kirby-Bauer que consiste na colocação de discos de papel filtro contendo quantidades
apropriadas do agente antibacteriano em ágar uniformemente semeados com a bactéria a ser
testada. Logo após o diâmetro das zonas de inibição são medidos em milímetros e os
resultados são comparados a tabelas padrão para determinar a sensibilidade ou resistência do
isolado, sendo classificados em resistente, intermediário ou sensível.
56
3.2 Resultados
3.2.1 Piscicultura A
Na bacterioscopia realizada na piscicultura A, foram observados no cérebro
numerosos cocos gram positivos, sugerindo Streptococcus spp.. Na cultura bacteriológica do
peixe 1, no fígado, rins e cérebro foram negativo para o crescimento bacteriano, já no baço,
superfície da pele e debaixo da escama houve crescimento bacteriano de Streptococcus spp..
No peixe 2 houve crescimento de Escherichia coli alfa hemolítica no fígado e Streptococcus
agalactiae (cultura pura e abundante) em amostras dos rins, cérebro e baço. No peixe 3 nas
amostras dos rins, baço e lesão da pele houve crescimento de Streptococcus agalactiae
(cultura pura e abundante), no fígado crescimento de Escherichia coli alfa hemolítica e no
intestino de Klebsiella spp. (Quadro 2).
Quadro 2: Resultado da cultura bacteriológica dos peixes 1, 2 e 3 da piscicultura
A, localizada na cidade de Morada Nova de Minas, MG.
Cultura bacteriológica
Peixe 1
Fígado
Rins
Cérebro
Baço
Superfície
Debaixo escamas
Peixe 2
Fígado
Rins
Cérebro
Baço
Peixe 3
Fígado
Rins
Cérebro
Baço
Intestino
Lesão pele
Fonte: CDMA
Resultados
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Streptococcus spp.
Streptococcus spp.
Streptococcus spp.
Escherichia coli alfa hemolítica
Streptococcus agalactiae (cultura pura e abundante)
Streptococcus agalactiae (cultura pura e abundante)
Streptococcus agalactiae (cultura pura e abundante)
Escherichia coli alfa hemolítica
Streptococcus agalactiae (cultura pura e abundante)
Ausência de crescimento bacteriano
Streptococcus agalactiae (cultura pura e abundante)
Klebsiella spp.
Streptococcus agalactiae (cultura pura e abundante)
57
Na identificação bacteriana foram observadas colônias puras (Figura 29),
caracterizados como cocos gram positivos, catalase negativos e oxidase negativos, das
amostras de peixe 2 e 3, foram submetidas a testes primários de caracterização e o grupo de
Lancefield foi determinado com o uso do kit comercial SLIDEX Strepto Plus (BioMerieux,
França).
Figura 29: Colônias de bactérias em amostras do baço
Fonte: Fotos da autora
Os isolados bacterianos foram caracterizados por PCR espécie-específica para
Streptococcus agalactiae e esta representada na figura 30.
Figura 30: Resultado do PCR das amostras testadas para S. agalactiae, dos peixes 2 e 3
da piscicultura A, localizada na cidade de Morada Nova de Minas, MG.
58
*Legenda do gel fotodocumentado:
Canaleta 1 – Marcador (100 Kb)
Canaleta 4 e 5 – Peixe 3
Canaleta 8 e 9 – Controle negativo
Fonte: CDMA
Canaleta 2 e 3 – Controle positivo
Canaleta 6 e 7 – Peixe 2
Canaleta 10 – Marcador (100 Kb)
Na histopatologia do fígado, foi observado que a maioria das células hepáticas eram
morfologicamente normal, com citoplasma esponjoso (rico em glicogênio), contendo núcleos
arredondados de cromatina frouxa e nucléolos proeminentes. Entretanto, algumas células
hepáticas mostraram vacúolos no citoplasma (degeneração hidrópica ou gordurosa). Foram
observados ainda, focos de células pancreáticas normais e junto a estas alguns macrófagos
com pigmentos escuros no citoplasma (melanina) e moderado infiltrado linfohistiocitário ao
redor de condutos biliares.
No antibiograma realizado na propriedade o peixe pequeno (1) com diagnóstico de
Streptococcus spp apresentou sensibilidade a todos os antibióticos testados (tabela 2), já as
amostras de S. agalactiae dos peixes 2 e 3 apresentaram resistentes aos antibióticos oxacilina
e sulfametoxazol + trimetoprim e foram sensíveis ao florfenicol, enrofloxacin e eritromicina
(tabela 3 e 4).
Tabela 2: Resultado do antibiograma do peixe 1 da piscicultura A, localizada na cidade
de Morada Nova de Minas, MG
Fonte: CDMA
Tabela 3: Resultado do antibiograma do peixe 2 da piscicultura A, localizada na cidade
59
de Morada Nova de Minas, MG
Fonte: CDMA
Tabela 4: Resultado do antibiograma do peixe 3 da piscicultura A, localizada na cidade
de Morada Nova de Minas, MG
*Legenda: S (Sensível), R (Resistente), I (Intermediário).
Fonte: CDMA
3.2.2 Piscicultura B
Na bacteriologia da piscicultura B realizada em uma amostra de peixe com lesão na
pele, foi diagnosticado crescimento de colônias de bactérias do gênero Aeromonas sp. em
amostras do fígado e cérebro. Nos rins houve crescimento de bactérias do gênero
Streptococcus agalactiae e ausência de crescimento bacteriano em amostras do baço e pele
(quadro 3).
Quadro 3: Resultado da cultura bacteriológica do peixe da piscicultura B, localizada na
cidade de Morada Nova de Minas, MG
Peixe 400gr
Fígado
Rins
Cérebro
Baço
Pele
Cultura bacteriológica
Resultados
Aeromonas sp.
Streptococcus agalactiae
Aeromonas sp.
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Fonte: CDMA
Na identificação bacteriana foram observadas colônias puras, caracterizadas como
cocos gram positivos, catalase negativo e oxidase negativa, da amostra dos rins do peixe,
60
foram submetidas também a testes primários de caracterização e o grupo de Lancefield
determinado com o uso do kit comercial SLIDEX Strepto Plus (BioMerieux, França). Os
isolados foram caracterizados por PCR espécie-especifica para Streptococcus agalactiae de
acordo com a figura 31.
Figura 31: Resultado do PCR da amostra testada para S. agalactiae, do peixe da
piscicultura B, localizada na cidade de Morada Nova de Minas, MG
Fonte: CDMA
Na propriedade B foi testada a sensibilidade das bactérias Aeromonas sp. e S.
agalactiae, isoladas de um único peixe. A amostra de Aeromonas sp. apresentou sensibilidade
a quase todos os antibióticos testados e foi intermediário a eritromicina (tabela 5), já o S.
61
agalactiae apresentou resistência ao cloranfenicol, sulfametoxazol + trimetoprim a e
sulfonamida e foi sensível a eritromicina e o florfenicol (tabela 6)
Tabela 5: Resultado do antibiograma da amostra de Aeromonas sp. isolada do peixe da
piscicultura B, localizada na cidade de Morada Nova de Minas, MG
Fonte: CDMA
Tabela 6: Resultado do antibiograma da amostra de Streptococcus agalactiae isolada do
peixe da piscicultura B, localizada na cidade de Morada Nova de Minas, MG
*Legenda: S (Sensível), R (Resistente), I (Intermediário).
Fonte: CDMA
3.2.3 Piscicultura C
Na piscicultura C, a cultura bacteriológica realizada em dois peixes com suspeita de
enterotoxemia obteve resultado positivo para o crescimento de colônias de Clostridium sp. em
amostras do intestino e ausência de crescimento bacteriano no fígado, rins, cérebro e baço
(quadro 4).
Os resultados de identificação bacteriana e PCR ainda estão em andamento.
62
Quadro 4: Resultado cultura bacteriológica do peixe 1 e 2 da piscicultura C,
localizada na cidade de Morada Nova de Minas, MG
Peixe 1
Fígado
Rins
Cérebro
Baço
Intestino
Peixe 2
Fígado
Rins
Cérebro
Baço
Intestino
Cultura bacteriológica
Resultados
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Clostridium sp.
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Ausência de crescimento bacteriano
Clostridium sp.
Fonte: CDMA
3.2.4 Piscicultura D
Na piscicultura D o resultado obtido da cultura bacteriológica com pesquisa de
aeróbios e anaeróbios foi ausência de crescimento bacteriano em todas as amostras dos peixes
(alevinos, fêmea e reprodutor) (quadro 5).
Quadro 5: Resultado cultura bacteriológica dos alevinos, fêmea e reprodutor da
piscicultura D, localizada na cidade de Morada Nova de Minas, MG
Alevinos (1 a 5)
Fígado
Rins
Cérebro
Baço
Intestino
Fêmea
Fígado
Rins
Cérebro
Baço
Intestino
Ovário
Reprodutor
Fígado
Rins
Cérebro
Baço
Intestino
Cultura bacteriológica
Aeróbios
Anaeróbios
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
-
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
Negativo
63
Fonte: CDMA
4
DISCUSSÃO
Na aquicultura mundial o Streptococcus agalactiae é um patógeno importante que tem
sido associada com morbidade e mortalidade em pisciculturas em todo o mundo (PEREIRA et
al., 2010). Segundo ZAGO (2012), diversos fatores predispõem os peixes a infecções
bacterianas, tais como: má nutrição, acúmulo de resíduos orgânicos nos tanques ou viveiros,
estresse causado pelo manejo ou transporte, qualidade inadequada da água e mudança abrupta
da temperatura.
Nesse relato, foi diagnosticado em duas pisciculturas, A e B, a presença de S.
agalactiae em peixes que estavam na fase de engorda. De acordo com FIGUEIREDO et al.
(2007), em condições naturais a doença pode ser observada em peixes com peso variando
entre 50 gramas até matrizes com peso acima de um (1) quilo, mas predomina na fase de
engorda, sendo os peixes entre 400 e 600 gramas, os mais acometidos.
Os peixes dessas pisciculturas apresentavam como sinais clínicos lesão superficial
hemorrágica com edema, perda da capacidade natatória, letargia e exoftalmia que são
característicos e suspeitos de infecções causadas por bacterioses descritas por KUBITZA
(2008) e SILVA (2010).
As amostras desses peixes foram colhidas na época de verão, onde são observadas
temperaturas mais elevadas, e isso pode ter contribuído para uma maior ocorrência do
diagnóstico de Streptococcus nessas duas propriedades (A e B), pois segundo FIGUEIREDO
et al. (2007) e KUBITZA (2008), a temperatura elevada da água de cultivo durante o verão
pode ser também um fator que aumenta a frequência da doença.
Além do diagnóstico de S. agalactiae, na propriedade A também foi diagnosticado a
presença de Escherichia coli alfa hemolítica (peixe 2 e 3) e Klebsiella spp. (peixe 3). Essas
bactérias, pertencentes à família Enterobacteriaceae, apresentam distribuição mundial e
habitam o trato intestinal de animais e de humanos e contaminam a vegetação, o solo e a água
(QUINN et al., 2005). De acordo com LIBRELATO e SHIKIDA (2005), a maior parte da
infecção de peixes por essas bactérias, é proveniente de ambientes aquáticos contaminados ou
manuseio em condições higiênicas inadequadas. Não foi encontrado relatos dessas bactérias
causando sinais clínicos em peixes, mas o seu diagnóstico é fundamental, pois podem causar
enfermidades em seres humanos ou outros animais através de pescados contaminados.
64
As bactérias dos gêneros Aeromonas podem ser frequentemente isoladas de peixes
saudáveis, uma vez que são de ocorrência comum no solo e na água. ZAGO (2012) descreve
que infecções por estas bactérias geralmente são causadas quando há algum distúrbio
ambiental ou pressão de manejo, podendo levar a um quadro de infecção generalizada
(septicemia hemorrágica) em peixes. No presente estudo, apenas a propriedade B apresentou
um exemplar infectado por Aeromonas sp..
Os antibióticos liberados pelo Ministério da Agricultura, Pecuária e abastecimento
(MAPA) para uso na aquicultura são o florfenicol, a oxitetraciclina e a neomicina (este ultimo
é destinado a peixes ornamentais), no entanto, na prática são utilizadas muitas outras
moléculas (PÁDUA et al, 2012).
De acordo com TAVARES e PALHARES (2011) e FIGUEIREDO et al. (2012), o
tratamento da estreptococose é realizado administrando antibiótico a base de florfenicol, na
dose de 10mg/kg/pv combinado com sulfa-trimetoprim na dose de 25 mg/kg/pv por um
período recomendado de 10 dias. O florfenicol é indicado para o tratamento de doenças
bacterianas que acometem o cérebro por possui a capacidade de atravessar a barreira
hematoencefálica (o que não ocorre com a tetraciclina) (FIGUEIREDO et al., 2007).
Todas as amostras de S. agalactiae foram sensíveis ao florfenicol, mas apresentaram
resistência sulfametoxazol + trimetoprim. A tetraciclina, outro medicamento liberado pelo
MAPA, apresentou eficaz para o tratamento de Aeromonas sp. (piscicultura B) e
Streptococcus spp. (piscicultura A), e foi intermediário para tratamento de S. agalactiae das
propriedades A e B. Segundo FIGUEIREDO et al. (2008) e ZAGO (2012), o ambiente
aquícola consiste em um importante meio para a seleção de espécies bacterianas resistentes a
vários antibióticos, devido à utilização, muitas vezes de forma indiscriminada de tais
substâncias no tratamento e profilaxia de determinadas doenças e em casos de surtos, esses
não serão mais eficientes.
De acordo com PÁDUA et al. (2012), os alevinos constituem-se como uma das
principais fontes de infecção para as fases de crescimento e engorda, sendo assim, é de
extrema importância à adoção de manejo sanitário nas propriedades produtoras de alevinos
para evitar a propagação de doenças e perdas na produção. Na propriedade D, todas as
amostras, tanto os alevinos como os dois peixes adultos (Fêmea e o reprodutor) apresentaram
resultado negativo para a pesquisa de bactérias aeróbias e anaeróbias. Por ser tratar de uma
empresa produtora de alevinos, o resultado negativo pode ser atribuída a adoção de práticas de
manejo sanitário nessa propriedade, dada a importância dessa prática como citado acima.
65
Na propriedade C, a bacteriologia de dois peixes apresentou resultado positivo para
Clostridium sp.. YULE et al. (2006), AUSTIN e AUSTIN (2007), HANNETT et al. (2011) e
ROBERTS (2012) relataram que o Clostridium sp. pode ser encontrado no solo, fezes,
decomposição de matéria orgânica e sedimentos aquáticos, sendo comuns também no trato
intestinal de peixes e podem ser isolados a partir de sedimentos de tanques de terra em
algumas áreas. Segundo AUSTIN e AUSTIN (2007) e ROBERTS (2012) os peixes afetados
geralmente apresentam cor escura (hiperpigmentação), corpo ligeiramente inchado, flutua
apaticamente na superfície e em seguida afundam e nadam erraticamente à superfície, sinais
que podem ser confundidos com outras bacterioses. Os peixes analisados não apresentavam
sinais clínicos evidentes, apenas uma suspeita de enterotoxemia.
Os exames de identificação bacteriana e PCR foram encaminhados ao Laboratório de
Doenças de Animais Aquáticos (Aquavet), para uma análise detalhada das colônias isoladas.
Se for confirmado que essas colônias são de bactérias patogênicas para os peixes, esse será o
primeiro relato de infecção por Clostridium sp. em tilápias no Brasil.
5
CONCLUSÃO
Doenças bacterianas afetam pisciculturas de todo mundo provocando grandes perdas
na produção e prejuízos econômicos. Nos ambientes de criação deve haver equilíbrio entre a
saúde do hospedeiro, a proliferação de agentes patogênicos e as condições do ambiente
aquático. Desse modo, fatores que promovem estresse físico e fisiológico aos peixes devem
ser evitados, pois favorecem a ocorrência de doenças. A associação de medidas como boas
práticas de manejo, controle eficaz, certificação sanitária e exame diagnóstico de rotina são
fundamentais para evitar a introdução e propagação de doenças nas pisciculturas brasileiras.
Torna-se fundamental também o aprofundamento de pesquisas relacionadas com
outros agentes infecciosos, como os vírus, pois, muitas vezes, produções de todo o país não
conseguem chegar a um diagnóstico definitivo ou mortalidades crônicas são atribuídas
somente às bactérias, quando na verdade muitos outros agentes podem estar envolvidos.
66
REFERÊNCIAS
ALBINATI, A. C. L.; ALBINATI, R. C. B.; OLIVEIRA, E. M. D.; et al. Edwardsielose em
Tilápias do Nilo (Oreochromis Niloticus). Rev. Bras. Saúde e Produção Animal, v.7, n. 2, p.
164-168, 2006.
ALEXANDRINO, A. C.; OKUMURA, M. P. M; BALDASSI, L.; et al. Ocorrência de
infecção por Edwardsiella tarda em truta arco-iris (Oncorhynchus mykiss) em cultivo
intensivo. Boletim do Instituto de Pesca, São Paulo, 25 (único), p. 121 - 123, 1999.
AUSTIN, B.; AUSTIN, D. A. Bacterial fish pathogens: disease of farmed and wild fish. 2
ed. Dordrecht: Springer; Chichester: Praxis Publishing, 2007, 552p.
AYROZA, Luiz Marques Da Silva. Criação de Tilápia-do-Nilo, Oreochromis Niloticus,
Em Tanques-rede, na Usina Hidrelétrica de Chavantes, Rio Paranapanema, Sp/Pr.
Universidade
Estadual
Paulista.
Jaboticabal
-SP,
2009.
Disponível
em:
<http://www.caunesp.unesp.br/publicacoes/dissertacoes_teses
/teses/Tese%20Luiz%20Marques%20da%20Silva%20Ayroza.pdf>. Acesso em: 05 fev. 2013.
BARAÚNA, L. da C. R. I.. Utilização de megadoses de vitamina C na ração de alevinos
de tilápia do Nilo (Oreochromis niloticus) submetidos à infecção experimental por
Edwardsiella tarda. 2008. 52f. Dissertação (Mestrado em Ciência Animal nos Trópicos) –
Universidade Federal da Bahia, Escola de Medicina Veterinária, Salvador.
BOWEN, R. E. K.; TAMARU, C. S.; HOPKINS, K. M.; et al.. Francisellosis in Tilapia.
CTSA
Publication,
2008.
Disponível
em:
<
http://www.ctsa.org/files/publications/Biosecurity_Pub158.pdf>. Acesso em: 02 jun. 2013
BRISTOT, Pedro Primo. Mapeamento e análise da cadeia produtiva da criação de tilápia
em
Santa
Catarina.
Florianópolis,
2008.
Disponível
em:
<http://tcc.bu.ufsc.br/Economia291929>. Acesso em: 05 fev. 2013.
67
CARRASCHI, S. P.. Ecotoxicidade e eficácia da oxitetraciclina e do florfenicol contra
infecção experimental por Aeromonas hydrophila e aspectos histopatológicos em pacu
(Piaractus mesopotamicus). 2010. 62f. Dissertação (Mestrado em Aquicultura) Universidade Estadual Paulista, Centro de Aquicultura, Jaboticabal.
CERESER, N. D.; COSTA, F. M. R.; JUNIOR, O. D. R.; et al. Botulismo de origem
alimentar. Ciência Rural, v.38, n.1, p.280-287, jan./fev. 2008.
CODEVASF. Manual de Criação de Peixes em Tanques-Rede. Brasília, 2010. Disponível
em:
<http://www.codevasf.gov.br/principal/publicacoes/publicacoes-atuais/novo-manualpiscicultura_2011.pdf/view?searchterm=manual>. Acesso em: 08 fev. 2013.
COLQUHOUN, D. J.; DUODU, S.. Francisella infections in farmed and wild aquatic
organisms.
Veterinary
Research,
p.42-47,
2011.
Disponível
em:
<
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3060124/pdf/1297-9716-42-47.pdf>. Acesso
em: 02. Jun. 2013
COSTA, A. B.. Caracterização de bactérias do complexo Aeromonas isoladas de peixes
de água doce e sua atividade patogênica. 2003. 54 f. Tese (Doutorado em Agronomia) –
Universidade de São Paulo, Escola Superior de Agricultura Luiz de Queiroz, Piracicaba.
CREPALDI, Daniel V.; FARIA, Paulo M.C.; TEIXEIRA, Edgar de A. et al.. A situação da
Aquacultura e da pesca no Brasil e no mundo. Rev Bras Reprod Anim, Belo Horizonte,
v.30,
n.3/4,
p.81-85,
jul./dez.
2006.
Disponível
em:
<
http://www.cbra.org.br/pages/publicacoes/rbra/download/RB142%20%20Crepaldi%20(%20S
itucao%20da%20aquicultura)%20pag%2081-85.pdf> Acesso em: 05 fev. 2013.
DAS, A.; JAIN, A. Genotyping of clostridium perfringens from fresh water fish and fish
pickles. Journal of Microbiology, Biotechnology and Food Sciences. V.2, p.162-174,
2012.Disponível em: < http://www.jmbfs.org/wp-content/uploads/2012/07/jmbfs-0153das.pdf> Acesso em: 03 abr. 2013.
EKLUND, M. W.; PETERSON, M. E.; POYSKY, F. T.; et al. Botulism in juvenile Coho
salmon (Oncorhynchus kisutch) in the United States. Aquaculture, v.27, p.1-11, 1982.
EKLUND, M. W.; POYSKY, F. T.; PETERSON, M. E.; et al. Type E botulism in Salmonids
and conditions contributing to outbreaks. Aquaculture, v.41, p.293-309, 1984.
FAO – Organização das Nações Unidas para a Agricultura e Alimentação. The State of
World
Fisheries
and
Aquaculture,
2010.
Disponível
em:
<http://www.fao.org/fishery/sofia/en>. Acesso em: 17 fev. 2013.
FERREIRA, A. H. C.; ARARIPE, M. N. B. A.; MONTEIRO, C. A. B.; et al. Uso de
probióticos na aquicultura – revisão. Revista Eletrônica Nutritime, v.9, n.05, p.1965-1980,
set./out.
2012.
Disponível
em:
<http://www.nutritime.com.br/arquivos_internos/artigos/Nutritime%20%20artigo%20176_.pdf>. Acesso em: 05 mar. 2013.
68
FIGUEIREDO, H. C. P.; CARNEIRO, D. O.; FARIA, F. C.; et al. Streptococcus agalactiae
associado à meningoencefalite e infecção sistêmica em tilápia do nilo (Oreochromis niloticus)
no Brasil. Arq. Bras. Med. Vet. Zootec., v.58, n.4, p.678-680, 2006.
FIGUEIREDO, H. C. P.; CASTRO, G. A. C.; LEAL, C. A. G. Patogênicos ou nãopatogênicos: como determinar o real agente causador de uma doença. Panorama da
aquicultura, v.20, n.118, mar./abr. 2010.
FIGUEIREDO, H. C. P.; CASTRO, G. A. C.; LEAL, C. A. G.; et al. Quem tem medo de
Aeromonas?. Panorama da Aquicultura, v. 17, n. 108, p. 26- 31, jul./ago. 2008a.
FIGUEIREDO, H. C. P.; CASTRO, G. A. C.; LEAL, C. A. G.; et al. Uso de vacinas na
piscicultura: verdades, mitos e perspectivas. Panorama da Aquicultura, v.19, n.115, p.2231, set./out. 2009a.
FIGUEIREDO, H. C. P.. Columnariose: Doença da piscicultura moderna. Panorama da
aquicultura, v. 17, n. 101, p. 32-37, mai./jun. 2007a.
FIGUEIREDO, H. C. P.; GODOY, D. T.; LEAL, C. A. G.. Antibióticos na aquicultura.
Panorama da Aquicultura, v.18, n.105, p.42-49, jan./fev. 2008b.
FIGUEIREDO, H. C. P.; LEAL, C. A. G.; CASTRO, G. A. de C.. Infecção por Streptococcus
dysgalactiae. Panorama da Aquicultura, v.21, n.123, p.42-49, jan./fev. 2011.
FIGUEIREDO, H. C. P.; LEAL, C. A. G.. Certificação sanitária na aquicultura. Panorama
da Aquicultura, v.18, n.107, p.14-20, mai./jun. 2008c.
FIGUEIREDO, H. C. P.; LEAL, C. A. G. Tecnologias aplicadas em sanidade de peixes.
Revista Brasileira de Zootecnia, v. 37, p. 8-14, 2008d.
FIGUEIREDO, H. C. P.; MIAN, G. F.; GODOY, D. T.. Estreptococose em tilápia do Nilo parte 1. Panorama da Aquicultura, v. 19, n. 103, p. 36-38, set./ out. 2007b.
FIGUEIREDO, H. C. P.; MIAN, G. F.; GODOY, D. T.; et al. Estreptococose em tilápia do
Nilo - parte 2. Panorama da Aquicultura, v. 17, n. 104, p. 42-45, nov./ dez. 2007c.
FIGUEIREDO, H. C. P.; NETTO, L. N.; LEAL, C. A. G. Streptococcus iniae: um grande
vilão da aquicultura mundial identificado no Brasil. Panorama da Aquicultura, v. 19, n.
112, p. 26-29, mar./abr. 2009b.
FIGUEIREDO, H. C. P.; NETTO, L. N.; LEAL, C. A. G.; et al. Streptococcus iniae outbreaks
in brazilian nile tilapia (Oreochromis niloticus l.) farms. Brazilian Journal of Microbiology,
p. 576-580, 2012.
GOULD, L. H.; LIMGABO, B. Clostridium difficile in Food and Domestic Animals: A New
Foodborne Pathogen?. Clinical infectious diseases. v.51, p.577-582, Set. 2010. Disponível
em: < http://cid.oxfordjournals.org/content/51/5/577.full.pdf+html> Acessado em: 02 Abr.
2013
69
HANNETT, G. E.; STONE, W. B.; DAVIS, S. W.; et al.. Biodiversity of Clostridium
botulinum Type E Associated with a Large Outbreak of Botulism in Wildlife from Lake Erie
and Lake Ontario. Applied and environmental microbiology, v.77, n.3, p.1061-1068, 2011.
HIRSCH, D.; JÚNIOR, D. J. P.; LOGATO, P. V. R.; et al. Identificação e resistência a
antimicrobianos de espécies de Aeromonas móveis isoladas de peixes e ambientes aquáticos.
Ciênc. Agrotec., Lavras, v.30, n.6, p.1211-1217, nov./dez., 2006.
HUSS, H. H..Garantia da qualidade dos produtos da pesca. FAO Documento técnico sobre
as pescas, Roma, n.334, 1997, 176p.
JEFFERY, K. R.; STONE, D.; FEIST, S. W.; et al.. An outbreak of disease caused by
Francisella sp. in Nile tilapia Oreochromis niloticus at a recirculation fish farm in the UK.
Diseases of aquatic organisms, v.91, p.161-165, 2010
JÚNIOR, C. A. F.; JÚNIO, A. S. V.. Cultivo de tilápias no Brasil: origens e cenário atual.
Rio Branco – AC. Jul. 2008. Disponível em: <http://www.sober.org.br/palestra/9/178.pdf>.
Acesso em: 10 fev. 2013.
KUBITZA, F.. Antecipando-se às doenças na tilapicultura. Panorama da aquicultura, v.15,
n.89, p.15-23, mai/jun 2005.
KUBITZA, F.. A versatilidade do sal na piscicultura. Panorama da aquicultura, v.17, n.103,
p.14-23, set./out. 2007.
KUBITZA, F.. O status atual e as tendências da tilapicultura no Brasil. Panorama da
aquicultura, v.21, n.124, p.10-19, mar./abr. 2011.
KUBITZA, F.; CAMPOS, J. L.; ONO, E. A.. Panorama da piscicultura no Brasil: Estatísticas,
espécies, pólos de produção e fatores limitantes à expansão da atividade.
Panorama da aquicultura, v.22, n.132, p.14-25, jul./ago. 2012.
KUBITZA, F.; CAMPOS, J. L.; ONO, E. A.; et al. Panorama da piscicultura no Brasil: A
sanidade na piscicultura, do ponto de vista dos produtores e técnicos. Panorama da
Aquicultura, v.33, n.136, p.16-26, jan./fev. 2013.
KUBITZA, F. Principais parasitoses e doenças em tilápias. Panorama da Aquicultura, Rio
de Janeiro, v.10, n.60, p.39-53, jul./ago. 2000.
KUBITZA, F.. Produção de tilápias em tanques de terra estratégias avançadas no manejo.
Panorama da aquicultura, v.19, n.115, p.14-21, set./out. 2009.
KUBITZA, F.. Tilápias na mira dos patógenos. Panorama da aquicultura, v.18, n.107, p.2837, mai./jun. 2008.
LEMOS, J. B.; RODRIGUES, M. E. B.; LOPES, J. P. Diagnóstico de ectoparasitas e
bactérias em tilápias (Oreochromis niloticus) cultivadas na região de Paulo Afonso, Bahia.
Revista Brasileira de Engenharia da Pesca, v. 1, n.1, p. 75-90, Agosto de 2006.
70
LIBRELATO, F. R.; SHIKIDA, S. A. R. L. Segurança alimentar: um estudo
multidisciplinar da qualidade do filé de tilápia comercializado no município de Toledo –
PR. Disponível em: < http://e-revista.unioeste.br/index.php/gepec/article/view/309/0>.
Acesso em: 02 Abr. 2013.
LIMA, L. C.; FERNANDES, A. A.; COSTA, A. A. P.; et al. Isolation and characterizaton of
Edwardsiella tarda from Pacu Myleus micans. Arq. Bras. Med. Vet. Zootec., v.60, n.1,
p.275-277, 2008.
LONGHI, E.; PRETTO-GIORDANO, L. G.; MÜLLER, E. E.. Avaliação da eficácia de
vacina autóctone de Streptococcus agalactiae inativado aplicada por banho de imersão em
tilápia do Nilo (Oreochromis niloticus). Semina: Ciências Agrárias, v.33, p.3191-3200,
2012.
MEIRELLES, F. S. de. Estudo epidemiológico das infecções bacterianas em tilápias
Oreochromis niloticus (Linnaeus, 1758), cultivadas em Pernambuco. 2010. 77f. Tese (Pósgraduação de Ciência Veterinária) – Universidade Rural de Pernambuco, Departamento de
Medicina Veterinária, Recife.
MEURER, F.; HAYASHI, C.; COSTA, M. M.; et al. Levedura como probiótico na reversão
sexual da tilápia do Nilo. Rev. Bras. Saúde Prod. An., v.9, n.4, p. 804-812, out./dez. 2008.
MIAN, G. F.; GODOY, D. T.; LEAL, C. A. G.; et al. Aspects of the natural history and
virulence of S. agalactiae infection in Nile tilapia. Veterinary Microbiology. p.180-183,
2009.
MORI, R. H.. Prevalência de ectoparasitos e diagnóstico bacteriológico em tilápia do nilo
(Oreochromis niloticus) da variedade gift, cultivadas em tanques-rede no rio do corvo –
PR. 2012. 36f. Dissertação (Mestrado em Zootecnia) – Universidade Estadual de Maringá,
Área de concentração: produção animal, Maringá.
MOURIÑO, J. L. P.; JATOBÁ, A.; SILVA, B. C.; et al. Utilização de probióticos na
aquicultura. Panorama da aquicultura, v.20, n.117, p. 52-59, jan./fev. 2010.
MOURIÑO, J. L. P.; VIEIRA, F. N.; SILVA, B. C.; et al. Prebióticos na aquicultura.
Panorama da Aquicultura, v.21, n.128, p.42-49, nov./dez. 2011.
MPA. Boletim estatístico da pesca e aquicultura - 2010. Brasília, fevereiro de 2012.
Disponível
em:
<http://www.mpa.gov.br/images/Docs/Informacoes_
e_Estatisticas/Boletim%20Estat%C3%ADstico%20MPA%202010.pdf>. Acesso em: 01 fev.
2013.
MURATORI, M. C. S.; MARTINS, N. E.; PEIXOTO, M. T . D.; et al. Mortalidade por
“septicemia dos peixes tropicais” em tilápias criadas em consorciação com suínos. Arq. Bras.
Med. Vet. Zootec., v.53, n.6, p.658-662, 2001.
MURATORI, M. C. S.; PEREIRA, M. M. G.; SOARES, L. R. Pesquisa de bactérias
potencialmente patogênicas em pescados comercializados no mercado central de Teresina –
PI. Boletim CEPPA, Curitiba, v.12, n.1, p.33-38, Jan./Jun. 1994.
71
NETTO, L. N.; LEAL, C.A.G.; FIGUEIREDO, H. C. P.. Streptococcus dysgalactiae as an
agent of septicaemia in Nile tilapia, Oreochromis niloticus. Journal of Fish Diseases, n.34,
p.251-254, 2011.
NOGUEIRA, A.; RODRIGUES, T. Criação de tilápias em tanques-rede. SEBRAE, Salvador,
Bahia. 2007.
NOGA, E. J. Fish disease: diagnosis and treatment. 2 ed, St Louis: Mosby-Year Book,
2010.
NOL, P.; WILLIAMSON, J. L.; ROCKE, T. E.; et al. Detection of Clostridium botulinum
Type C Cells in the Gastrointestinal Tracts of Mozambique Tilapia (Oreochromis
mossambicus) by Polymerase Chain Reaction. Journal of Wildlife Diseases, v.40, n.4,
p.749–753, Out. 2004.
OLIVER,
M.
K..
Tilápia
rendalli.
Disponível
<http://malawicichlids.com/mw10003.htm>. Acesso em: 02 Abr. 2013.
em:
PÁDUA, S. B.; FILHO, R. N. M.; CRUZ, C.. Alevinos saudáveis: o ponto de partida para
uma produção estável. Panorama da Aquicultura. p.30-37, nov./dez. 2012.
PAVANELLI, G. C.; EIRAS, J. C.; TAKEMOTO, R. M.. Doenças de peixes: profilaxia,
diagnóstico e tratamento. 2. ed. Maringá: Eduem, 2002.
PEREIRA, U. P.; MIAN, G. F.; OLIVEIRA, I. C. M.; et al. Genotyping of Streptococcus
agalactiae strains isolated from fish, human and cattle and their virulence potential in Nile
tilapia. Veterinary Microbiology. p. 186- 192, 2010.
PRETTO-GIORDANO, L. G.; MÜLLER, E. E.; FREITAS, J. C.; et al. Evaluation on the
Pathogenesis of Streptococcus agalactiae in Nile Tilapia (Oreochromis niloticus). Braz.
Arch. Biol. Techno, v.53, n.1, p. 87-92, Jan./Fev. 2010.
PROCHMANN, Â. M.; MICHELS, I. L.. Estudo das cadeias produtivas de Mato Grosso
do Sul: Piscicultura. Universidade Federal De Mato Grosso Do Sul - Fundação Cândido
Rondon. Campo Grande, 2003. Disponível em: <http://pt.scribd.com/doc/14791838/CadeiaProdutiva-Da-Piscicultura-Em-MS-2003>. Acesso em: 09 fev. 2013.
QUINN, P. J.; MARKEY, B. K.; CARTER, M. E.; et al. Microbiologia veterinária e
doenças infecciosas. Porto Alegre: Artmed, 2005.
RAMIREZ, R. F.; DIXON, B. A.. Enzyme production by obligate intestinal anaerobic
bacteria isolated from Oscars (Astronotus ocellatus), Angelfish (Pterophyllum scalare) and
Southern flounder (Paralichthys lethostigma). Aquaculture, v.227, p.417-426, 2003.
ROBERTS, R. J.. Fish Pathology. In: ROBERTS, R. J.. The Bacteriology of Teleosts. 4. ed.
Edinburgh: W. B. Saunders, 2012. p. 339-382.
SALVADOR, R.. Imunização e inflamação por Streptococcus agalactiae em tilápia do
Nilo (Oreochromis niloticus) alimentadas com ração suplementada com parede celular
72
de Saccharomyces cerevisiae. 2008. 136f. Tese (Doutorado em Aquicultura) - Universidade
Estadual Paulista, Centro de Aquicultura, Jaboticabal.
SALVADOR, R.; ZANOLO, R.; CERICATO, L.. O impacto da Estreptococose em
Tilápias no Brasil e a eficácia da vacina AquaVac® Strep Sa na prevenção da doença
sob condições controladas. In: Conferência da Sociedade Mundial de Aquicultura, 2011,
Natal.
Disponível
em:
<http://aqua.merck-animalhealth.com/binaries/WAS_POR_Pro_v8_5_tcm56-34217.pdf>. Acesso em: 06 mar. 2013.
SEBASTIÃO, F. A.; PILARSKI, F.; LEMOS, M. V. F.. Caracterização molecular de isolados
de Flavobacterium columnare de tilápia do Nilo e Piracanjuba por meio de RAPD – PCR.
Bol. Inst. Pesca, São Paulo, p. 325-331, 2010.
SCHERING-PLOUGH. Principais doenças bacterianas em criações comerciais de peixes
no Brasil. Boletim Técnico. 2007. 8p.
SILVA, B. C.. Resposta hematológica e imunológica de tilápia do Nilo após aplicação de
vacina polivalente por banho de imersão, injeção intraperitoneal e administração oral.
2008. 34f. Monografia (Graduação em Engenharia de Aquicultura) – Universidade Federal de
Santa Catarina, Centro de Ciências Agrárias, Florianópolis.
SILVA, B. C.. Septicemia hemorrágica em Surubim híbrido (Pseudoplatystoma
corruscans macho x P. fasciatum fêmea) causada por Aeromonas hydrophila. 2010. 62f.
Dissertação (Mestrado em Aquicultura) – Universidade Federal de Santa Catarina, Centro de
Ciências Agrárias, Florianópolis.
SOTO, E.; FERNANDEZ, D.; THUNE, R.; et al.. Interaction of Francisella asiatica with
Tilapia (Oreochromis niloticus) Innate Immunity. Infection and immunity, v.78, n.5,
p.2070-2078, mai/2010
SOTO, E.. In vivo and in vitro pathogenesis of Francisella asiatica in tilápia nilótica
(Oreochromis niloticus). 2010. 187f. Dissertation (Doctor of Philosophy) - Louisiana State
University, Department of Pathobiological Sciences, Mississippi
SUGITA, H.; SHIBUYA, K.; SHIMOOKA, H.; et al. Antibacterial abilities of intestinal
bacteria in freshwater cultured fish. Aquaculture, v.145, p.195-203, 1996
TAVARES, G. C.; PALHARES, M. M.. Epidemiologia, diagnóstico e controle das principais
bacterioses que afetam a tilapicultura no Brasil. Revista veterinária e zootecnia em Minas.
Ano XXI, Jul./ago./set. 2011.
TEIXEIRA, A. L. de C. M. Estudo da viabilidade técnica e econômica do cultivo de
tilápia do nilo Oreochromis niloticus, linhagem chitralada, em tanques-rede com duas
densidades de estocagem. Universidade Federal Rural de Pernambuco. Ago. 2006.
Disponível em: <http://www.pgpa.ufrpe.br/Trabalhos/2006/T2006alcmt.pdf>. Acesso em: 12
fev. 2013.
VALLANDRO, M. J. Avaliação da qualidade microbiológica de sashimis a base de
Salmão, preparados em restaurantes especializados em culinária japonesa na cidade de
73
Porto Alegre – RS. 2010. 67f. Dissertação (Mestrado em Ciência Veterinária) – Universidade
Federal do Rio Grande do Sul, Porto Alegre.
ZAGO, Aline Cristina. Análise parasitológica e microbiológica de tilápias do Nilo
(Oreochromis niloticus) criadas em tanques-rede no reservatório de Água Vermelha - SP
e suas inter-relações com as variáveis limnológicas e fase de criação. 2012. 69f.
Dissertação (Pós-graduação em Ciências Biológicas) – Universidade Estadual Paulista,
Instituto de Biociências, Botucatu.
ZANOLO, R.; CERICATO, L.; SALVADOR, R.; et al. A eficácia da vacina AquaVac®
Strep Sa no controle da estreptococose em criações intensivas de Tilápia-do-Nilo
(Oreochromis niloticus) no Brasil: desempenho produtivo e lucros. In: Conferência da
Sociedade Mundial de Aquicultura, 2011, Natal. Disponível em: <http://aqua.merck-animalhealth.com/binaries/WAS_POR_Pro_v8_5_tcm56-34217.pdf>. Acesso em: 06 mar. 2013.
ZANOLO, R.; YAMAMURA, M. H.. Parasitas em tilápias do Nilo criadas em sistema de
tanques-rede. Semina: Ciências Agrárias, Londrina, v. 27, n. 2, p. 281-288, abr./jun. 2006.
YULE, A. M.; BARKER, I. K.; AUSTIN, J. W.; et al. Toxicity of Clostridium botulinum type
e neurotoxin to great lakes fish: implications for avian botulism. Journal of Wildlife
Diseases, v.42, n.3, p.479-493, Jul. 2006.