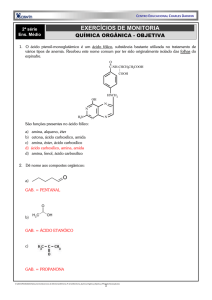
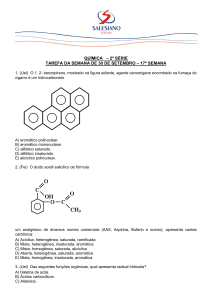
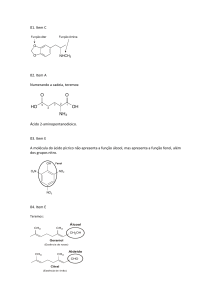
Recuperação final 2º ano – MOICANO
01_O preparo da cal hidratada, Ca(OH)2, utilizada nas argamassas para assentar azulejos,
pode ser realizado segundo a reação da cal virgem com água, de acordo com a equação
CaO + H2O = Ca(OH)2
56 g
18 g
74 g
Conforme a relação de massas demonstrada na equação, para preparar 18,5 kg de cal
hidratada, é necessária uma massa, em kg, de óxido de cálcio, CaO, de
(A) 7.
(B) 14.
(C) 21.
(D) 28.
(E) 35.
02_Para obter o ferro nas siderúrgicas, é necessário utilizar um alto-forno, que utiliza o carvão.
Uma das reações que acontece no alto-forno está representada pela equação não balanceada
a seguir.
C + O2 = CO
Os coeficientes estequiométricos inteiros que completam corretamente a equação são,
respectivamente:
(A) 1; 1; 1.
(B) 1; 2; 1.
(C) 1; 1; 2.
(D) 2; 1; 1.
(E) 2; 1; 2.
03_Na produção industrial de ferro em altos-fornos, um dos minérios de ferro utilizados é a
hematita (Fe2O3).
Fe2O3 → 2Fe + 1,5O2
Considere a massa molar do ferro 56 g·mol–1, a massa molar do oxigênio 16 g·mol–1
e o grau de pureza do minério e o rendimento da reação iguais a 100%. A massa, em gramas,
de ferro metálico obtida em um alto-forno, a partir de 1,0 kg de hematita, é:
(A) 350.
(B) 700.
(C) 500.
(D) 160.
(E) 125.
04_A produção industrial do ácido sulfúrico é realizada a partir do enxofre, extraído de jazidas
localizadas normalmente em zonas vulcânicas.
O enxofre extraído é queimado ao ar atmosférico produzindo o anidrido sulfuroso (etapa I).
Após essa reação, o anidrido sulfuroso é oxidado a anidrido sulfúrico, em alta temperatura e
presença de um catalisador adequado (etapa II).
Em seguida, o anidrido sulfúrico é borbulhado em água, formando o ácido sulfúrico (etapa III).
As reações referentes a cada uma das etapas do processo encontram-se abaixo
equacionadas:
Etapa I. S(s) + O2(g) SO2(g)
Etapa II. 2 SO2(g) + O2(g) 2 SO3(g)
Etapa III. SO3(g) + H2O(l) H2SO4(l)
Desse modo, ao serem extraídos 200,0 kg de enxofre com 80% de pureza de uma jazida,
considerando-se que o rendimento global do processo seja de 90%, a massa máxima de ácido
sulfúrico que pode ser produzida será de:
Dados: massas molares (g/mol): H = 1, O = 16 e S = 32.
05_O ácido acetilsalicílico (AAS), comumente chamado de aspirina, é obtido a partir da reação
do ácido salicílico com anidrido acético. Essa reação é esquematizada do seguinte modo:
Massas molares (g/mol): H 1; C 12 e O 16
a) Qual é o reagente limitante da reação, partindo-se de 690g de ácido salicílico e 1020g de
anidrido acético? Justifique sua resposta apresentando os cálculos.
b) Foram obtidos 1440g de AAS. Calcule o rendimento da reação.
06_Admite-se que as cenouras sejam originárias da região do atual Afeganistão, tendo sido
levadas para outras partes do mundo por viajantes ou invasores.
Com base em relatos escritos, pode-se dizer que as cenouras devem ter sido levadas à Europa
no século XII e, às Américas, no início do século XVII.
Em escritos anteriores ao século XVI, há referência apenas a cenouras de cor roxa, amarela ou
vermelha. É possível que as cenouras de cor laranja sejam originárias dos Países Baixos, e
que tenham sido desenvolvidas, inicialmente, à época do Príncipe de Orange (1533-1584).
No Brasil, são comuns apenas as cenouras laranja, cuja cor se deve à presença do pigmento
betacaroteno, representado a seguir.
Com base no descrito acima, e considerando corretas as hipóteses ali aventadas, é possível
afirmar que as cenouras de coloração laranja
a) podem ter sido levadas à Europa pela Companhia das Índias Ocidentais e contêm um
pigmento que é um polifenol insaturado.
b) podem ter sido levadas à Europa por rotas comerciais norte-africanas e contêm um
pigmento cuja molécula possui apenas duplas ligações cis.
c) podem ter sido levadas à Europa pelos chineses e contêm um pigmento natural que é um
poliéster saturado.
d) podem ter sido trazidas ao Brasil pelos primeiros degredados e contêm um pigmento que é
um polímero natural cujo monômero é o etileno.
e) podem ter sido trazidas a Pernambuco durante a invasão holandesa e contêm um pigmento
natural que é um hidrocarboneto insaturado.
Gab: E
07_A borracha é obtida por meio do monômero isopreno, cuja estrutura está representada a
seguir.
A massa molar, em g/mol, do isopreno é igual a
Dados: Massas molares (g/mol): C = 12; H = 1
a) 60
b) 68
c) 84
d) 91
e) 99 Gab: B
08_Um dos parâmetros utilizados para avaliar a qualidade da gasolina é o índice de octano.
Esse índice é estabelecido com base em uma escala arbitrária em que ao composto (I) é
atribuído o valor 0 (zero) e ao composto (II) o valor 100 (cem).
Os nomes, de acordo com a IUPAC, dos compostos (I) e (II) são, respectivamente:
a) 1-metil-4-etilbutano e 1,1,3,3-tetrametilbutano.
b) heptano e 2,2,4-trimetilpentano.
c) 1-etil-4-metilbutano e 2,2,4,4-tetrametilbutano.
d) heptano e 2,4,4-trimetilpentano.
e) 4-etil-1-metilbutano e 1,1,3,3-tetrametilbutano.
Gab: B
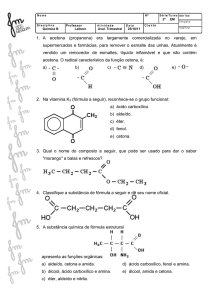
09_ Analise o composto representado na figura abaixo:
CH3
H3C
C
CH2
CH3
C
CH3
Sobre o composto, é correto afirmar que:
a) o seu nome é 2,2,4- trimetil-pent-2-eno.
b) apresenta dois carbonos terciários.
c) é um alcino ramificado de cadeia aberta.
d) é um hidrocarboneto ramificado de cadeia aberta.
e) apresenta seis carbonos primários.
Gab: A
10_ A nomenclatura oficial (Iupac. do composto é:
a) 1-metil-3-etil-ciclo-butano.
b) 1,1-dimetil-3-etil-butano.
c) 1-etil-3,3-dimetil-butano.
d) 1,1-metil-3-etil-butano.
e) 1,1-dimetil-3-etil-ciclo-butano.
Gab: E
CH2
11_ Assinale a alternativa que indica o nome do composto abaixo:
a) 3,3-dimetil-4-propil-hexano
b) 3,3-dimetil-4-propil-dodecano
c) 4-etil-3,3-dimetil-dodecano
d) 4-etil-3,3-dimetil-heptano
e) 5,5-dimetil-4-etil-heptano
Gab: D
12_[...] Era o carro do Fábio que tinha acabado o freio. Mandei que ele apertasse o pedal e vi
que ia até o fundo. Percebi que era falta de fluido. [...] Perguntei ao Luis se ele tinha fluido de
freio e ele disse que não tinha. E ninguém tinha. Então falei com o Antonino que o jeito era tirar
um pouco de cada carro, colocar naquele e ir assim até chegar numa cidade.”
FRANÇA JÚNIOR, Oswaldo. Jorge, um brasileiro.
Rio de Janeiro: Nova Fronteira, 1988. p. 155-156.
O fluido para freios, ou óleo de freio, é responsável por transmitir às pastilhas e lonas do
sistema de freios a força exercida sobre o pedal do automóvel quando se deseja frear. Em
sua composição básica há glicois e inibidores de corrosão.
Disponível em: <http://www.inmetro.gov.br/consumidor/produtos/fluidos.asp> [Adaptado]
Acesso em: 26 out. 2011.
Considere as informações acima e os dados da tabela abaixo, obtidos sob pressão de 1
atm e temperatura de 20 0C:
Escreva:
a)
o nome da função orgânica presente nos compostos apresentados na tabela.
b)
a fórmula estrutural de cada um dos compostos, conforme a ordem da tabela I, II e III.
c)
o nome da força intermolecular responsável pelo elevado valor do ponto de ebulição
dos compostos citados.
13_ Para evitar a ação do tempo nos alimentos, as indústrias se valem de agentes que
preservam a integridade do produto, aumentando a sua data de validade. Existem dois grandes
grupos: os antioxidantes e os antimicrobiais. Os antioxidantes são compostos que previnem a
deterioração dos alimentos por mecanismos oxidativos. Esses antioxidantes incluem os
naturais, tais como o -tocoferol (vitamina E), cuja fórmula estrutural está representada a
seguir e os sintéticos.
(Revista eletrônica do Departamento de Química – UFSC. Adaptado)
Indique a alternativa que apresenta os grupos funcionais presentes no -tocoferol.
a)
Éter e ácido carboxílico.
b)
Fenol e cetona.
c)
Aldeído e álcool.
d)
Éter e fenol.
e)
Cetona e éster.
Gab: D
14_ No século V a.C., Hipócrates, médico grego, escreveu que um produto da casca do
salgueiro aliviava dores e diminuía a febre. Esse mesmo produto, um pó ácido, é mencionado
inclusive em textos das civilizações antigas do Oriente Médio, da Suméria, do Egito e da
Assíria. Os nativos americanos usavam-no também contra dores de cabeça, febre, reumatismo
e tremores. Esse medicamento é um precursor da aspirina, cuja estrutura química está
representada abaixo.
O
OH
O
O
As funções orgânicas presentes na estrutura da aspirina, acima representada, são
a)
ácido carboxílico e éster.
b)
álcool e éter.
c)
amina e amida.
d)
amina e éter.
e)
aminoácido e álcool. Gab: A
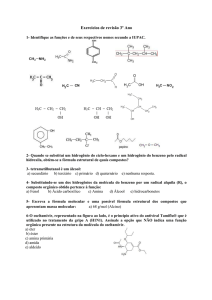
15_ O sesterpenóide manoalido, isolado de uma esponja do Pacífico (Luffariella variablis), é
um inibidor irreversível de fosfolipase A2 (PLA2). Dessa forma, é um alvo terapêutico para ser
usado no tratamento de doenças inflamatórias. Na representação de uma de suas formas
tautoméricas, a seguir, podemos encontrar respectivamente as seguintes funções orgânicas:
a)
ácido carboxílico, fenol, éster, álcool.
b)
ácido carboxílico, éster, amina, álcool.
c)
álcool, ácido carboxílico, éter, aldeído.
d)
ácido carboxílico, éter, fenol, álcool.
e)
álcool, fenol, éster, éter.
Gab: C
16_ A estrutura representada na figura corresponde à fórmula estrutural do aciclovir,
medicamento genérico utilizado no tratamento de infecções cutâneas pelo vírus do
herpes simples, cuja venda é feita sob prescrição médica.
O
N
HN
H2N
N
N
OH
O
Na estrutura dessa molécula são encontradas as funções orgânicas
a) álcool, amida, amina e éter.
b) álcool, amida, amina e éster.
c) álcool, cetona, amida e éter.
d) aldeído, amida, amina e éster.
e) aldeído, amina, cetona e éter.
Gab: A
17_ As fórmulas estruturais de alguns componentes de óleos essenciais, responsáveis pelo
aroma de certas ervas e flores, são:
CH 3
OH
H 3C
CH 3
H 3C
CH 3
O
CH3
CH 3
CH 3
OH
O
H
O
eugenol
linalol
citronelal
H 3C
anetol
Dentre esses compostos, são isômeros:
a) anetol e linalol.
b) eugenol e linalol.
c) citronelal e eugenol.
d) linalol e citronelal.
e) eugenol e anetol.
Gab: D
18_ Nas figuras estão representadas as estruturas de dois pares de compostos.
É correto afirmar que os tipos de isomeria encontrada nos pares x e y são, respectivamente,
a) compensação e posição.
b) função e posição.
c) compensação e função.
d) função e compensação.
e) função e geométrica.
Gab: B
19_
N
A
NH2
B
Os compostos A e B mostrados acima pertencem à mesma função química. Após a análise de
suas estruturas, responda aos itens a seguir:
a) Os dois compostos são isômeros? Explique.
b) Se apresentarem isomeria, qual o tipo de isomeria apresentam? Justifique.
20_ O ácido oleico, cuja estrutura química está representada abaixo, forma-se durante a
decomposição de formigas mortas, sendo um sinal químico para que as outras formigas as
retirem do ninho.
Analise a veracidade (V) ou falsidade (F) das proposições abaixo, sobre o ácido oleico.
( ) De acordo com a nomenclatura IUPAC, ele é denominado ácido cis-octadec-9-enoico.
( ) Ele possui dois átomos de carbono primário e quatorze átomos de carbono
secundário.
( ) Ele apresenta cadeia aberta, normal, insaturada e heterogênea.
Assinale a alternativa que preenche corretamente os parênteses, de cima para baixo.
a)
F–V–V
b)
V–F–F
c)
V–F–V
d)
F–F–F
e)
V–V–F
Gab: B