Enviado por
common.user11893
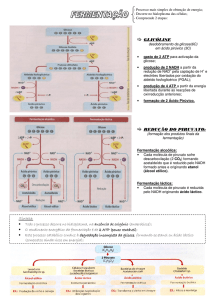
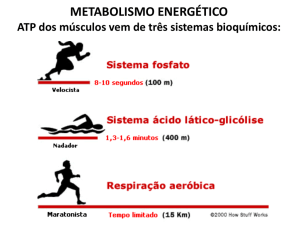
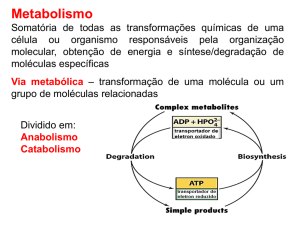
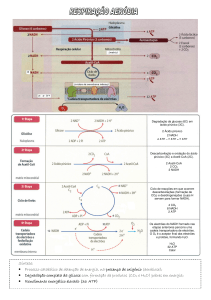
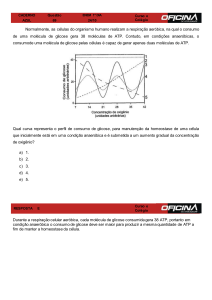
BIONERGÉTICA

BIONERGÉTICA Metabolismo Conjunto de reações químicas que ocorrem em um organismo vivo Metabolismo (do grego metabolismos, μεταβολισμός, que significa "mudança", troca) é o conjunto de transformações que as substâncias químicas sofrem no interior dos organismos vivos. A expressão metabolismo celular é usada em referência ao conjunto de todas as reações químicas que ocorrem nas células. Estas reações são responsáveis pelos processos de síntese e degradação dos nutrientes na célula e constituem a base da vida, permitindo o crescimento e reprodução das células, mantendo as suas estruturas e adequando respostas aos seus ambientes. Estrutura do trifosfato de adenosina, uma intermediária central no metabolismo energético. As reações químicas do metabolismo estão organizadas em vias metabólicas, que são sequências de reações em que o produto de uma reação é utilizado como reagente na reação seguinte. Diferentes enzimas catalisam diferentes passos de vias metabólicas, agindo de forma concertada de modo a não interromper o fluxo nessas vias. As enzimas são vitais para o metabolismo porque permitem a realização de reações desejáveis, mas termodinamicamente desfavoráveis, ao acoplá-las a reações mais favoráveis. As enzimas regulam as vias metabólicas em resposta a mudanças no ambiente celular ou a sinais de outras células. O metabolismo é normalmente dividido em dois grupos: anabolismo e catabolismo. Reações anabólicas, ou reações de síntese, são reações químicas que produzem nova matéria orgânica nos seres vivos. Sintetizam-se novos compostos (moléculas mais complexas) a partir de moléculas simples (com consumo de energia sob a forma de ATP). Reações catabólicas, ou reações de decomposição/degradação, são reações químicas que produzem grandes quantidades de energia (ATP) a partir da decomposição ou degradação de moléculas mais complexas (matéria orgânica). Quando o catabolismo supera em atividade o anabolismo, o organismo perde massa, o que acontece em períodos de jejum ou doença; mas se o anabolismo superar o catabolismo, o organismo cresce ou ganha massa. Se ambos os processos estão em equilíbrio, o organismo encontra-se em equilíbrio dinâmico ou homeostase. O metabolismo é fundamentalmente estudado pela Bioquímica, usando muitas vezes também técnicas ligadas à Biologia Molecular e à Genética. Características gerais O metabolismo de um organismo determina quais substâncias são nutricionais e quais são tóxicas. Por exemplo, alguns procariontes utilizam ácido sulfídrico como nutriente; este gás é, no entanto venenoso para animais. A taxa metabólica basal de um organismo é a medida da quantidade de energia consumida por todas essas reações químicas que o corpo precisa para funcionar. Uma característica do metabolismo é a semelhança de vias metabólicas básicas entre espécies muito diferentes. Por exemplo, o conjunto de intermediários reacionais encontrados no ciclo dos ácidos tricarboxílicos é encontrado de forma universal, em células tão diferentes como a bactéria Escherichia coli ou o elefante. Esta estrutura metabólica semelhante está provavelmente associada à grande eficiência dessas vias e na sua antiguidade na história da evolução. História Santorio Santorio sentado na sua cadeira-balança. De Ars de statica medecina, publicado pela primeira vez em 1614. A história do estudo científico do metabolismo estende-se por quatro séculos, tendo evoluído da observação de organismos animais inteiros até ao estudo de reações metabólicas individuais na Bioquímica moderna. As primeiras experiências conduzidas de forma controlada foram publicadas por Santorio Santorio em 1614 no seu livro Ars de statica medecina. Neste, Santorio descreveu como determinou o seu próprio peso antes e depois de comer, beber, dormir, trabalhar, ter relações sexuais, jejuar e excretar. Ele descobriu que a maior parte da comida ingerida era perdida no que ele chamou de "perspiração insensível". Nestes estudos iniciais, os mecanismos destes processos metabólicos não eram conhecidos; pensava-se que o tecido vivo era animado por uma "força vital". No século XIX, enquanto estudava a fermentação do açúcar a álcool por leveduras, Louis Pasteur concluiu que a fermentação era catalisada por substâncias dentro das células de levedura, a que ele chamou de "fermentos". Pasteur escreveu que "a fermentação alcoólica é um acto correlacionado com a vida e organização das células de levedura, não com a morte ou putrefação das células." Esta descoberta, junto com a publicação da síntese química da ureia por Friedrich Wöhler em 1828, provou que os compostos orgânicos e as reações químicas existentes nas células partilham o mesmo princípio que qualquer outra área da Química. A descoberta das enzimas no início do século XX, por Eduard Buchner, separou o estudo das reações químicas do metabolismo do estudo biológico das células, marcando o início da Bioquímica como ciência independente. A quantidade de conhecimento bioquímico cresceu rapidamente durante o início do século XX. Um dos bioquímicos mais prolíficos dessa época foi Hans Krebs, que fez diversas contribuições no estudo do metabolismo. Ele descobriu o ciclo da ureia e, mais tarde, junto com Hans Kornberg, o ciclo dos ácidos tricarboxílicos (também conhecido por esta razão como ciclo de Krebs) e o ciclo do glioxilato. A investigação bioquímica moderna tem sido ajudada com a invenção e desenvolvimento de diversas técnicas, como a cromatografia, a difração de raios X, a espectroscopia de ressonância magnética nuclear, a marcação isotópica, a microscopia electrónica e simulações de dinâmica molecular. Estas técnicas permitiram a descoberta e análise detalhada de diversas moléculas e vias metabólicas nas células. Substâncias bioquímicas relevantes Estrutura de um triacilglicerol. A maioria das estruturas que compõem os seres vivos é fabricada a partir de três classes básicas de moléculas: aminoácidos, glícidos e lípidos. Como estas moléculas são vitais, o metabolismo concentra-se na fabricação destas, na construção de células e tecidos ou na sua degradação para uso como fonte de energia. Muitos compostos bioquímicos podem ser ligados entre si formando polímeros, como o ADN e as proteínas. Estas macromoléculas são parte essencial de todos os organismos vivos. Alguns dos polímeros mais comuns estão listados abaixo: Mais informação: Tipo de molécula, Nome da forma monomérica ... Tipo de molécula Nome da forma monomérica Nome da forma polimérica Exemplos de formas poliméricas Aminoácidos Aminoácidos Proteínas (ou polipéptidos) Proteínas fibrilares e proteínas globulares Glícidos Monossacarídeos Polissacarídeos Ácidos nucleicos Nucleótidos Polinucleótidos Amido, glicogénio e celulose ADN e ARN Aminoácidos e proteínas As proteínas são compostas por aminoácidos dispostos numa cadeia linear e ligados entre si por ligações peptídicas. Muitas proteínas são as enzimas que catalisam as reações químicas no metabolismo. Outras proteínas têm funções estruturais ou mecânicas, como o sistema de armação celular usado para manter a forma da célula, o citoesqueleto. As proteínas têm também papéis importantes na sinalização celular, resposta imunitária, adesão celular, transporte activo através de membranas e no ciclo celular. Lípidos Os lípidos são o grupo mais diversificado de compostos bioquímicos. Constituem grande parte das membranas biológicas, tais como a membrana celular; além desta função estrutural, também servem como fonte de energia. Os lípidos são normalmente definidos como moléculas biológicas hidrofóbicas ou anfipáticas solúveis em solventes orgânicos como o benzeno ou o clorofórmio. As gorduras são um grande grupo de compostos que inclui os ácidos gordos e o glicerol; uma molécula de glicerol ligada a três ácidos gordos por uma ligação éster é um triacilglicerol. Existem diversas variações desta estrutura básica, incluindo a presença de estruturas como a esfingosina em esfingolípidos e grupos hidrofílicos como o fosfato nos fosfolípidos. Os esteroides, como o colesterol, são outro grupo significativo de lípidos sintetizados em células. Glícidos Os glícidos são aldeídos ou cetonas contendo diversos grupos funcionais hidroxilo. Os glícidos simples podem existir numa forma linear ou numa forma cíclica. São as moléculas biológicas mais abundantes e possuem funções muito diversificadas, como o armazenamento e transporte de energia (sob a forma de amido e glicogénio) e construção de elementos estruturais (como a celulose em plantas e a quitina em animais). Estrutura da glicose convertida da projeção de Fisher (linear) para a de Haworth (cíclica). Os glícidos mais simples são os monossacarídeos, que incluem a galactose, a frutose e a glicose. Os monossacarídeos podem formar polímeros designados polissacarídeos de formas muito diversas. Ácidos nucleicos Os polímeros ADN e ARN são longas cadeias de nucleótidos. Estas macromoléculas são essenciais no armazenamento e uso da informação genética, através dos processos de transcrição e síntese proteica. Esta informação é protegida por mecanismos de reparação do ADN e propagada através da replicação do ADN. Alguns vírus têm um genoma constituído por ARN (por exemplo, o HIV), e usam transcrição reversa para sintetizar ADN a partir desse ARN. O ARN de ribozimas (como o spliceossoma e ribossomas) apresenta actividade enzimática tal como as enzimas proteicas, pois pode catalisar reações químicas. Os nucleósidos são sintetizados a partir da ligação de uma base azotada a uma ribose. Estas bases são anéis heterocíclicos contendo azoto, classificados como purinas ou pirimidinas. Os nucleótidos também atuam como coenzimas em reações de transferência de grupos químicos. Coenzimas Estrutura da coenzima acetil-CoA. O grupo acetilo encontra-se ligado ao átomo de enxofre, na extremidade esquerda. O metabolismo envolve um vasto conjunto de reações químicas, mas a maioria cai dentro de alguns tipos básicos de transferências de grupos funcionais. Esta química comum permite às células usarem um conjunto relativamente pequeno de intermediários metabólicos no transporte de grupos químicos de uma reação para a seguinte. Estes intermediários de transferência de grupos são as coenzimas. Cada classe de reação de transferência de grupos corresponde a uma determinada coenzima, servindo de substrato para um conjunto de enzimas que a produz e que a consome. Assim, as coenzimas são continuamente produzidas, consumidas e então recicladas. A coenzima mais central é o trifosfato de adenosina (ATP), a moeda de troca energética universal das células. O ATP é utilizado para transferir energia química entre diferentes reações químicas. Existe uma pequena quantidade de ATP permanentemente presente nas células, mas como é constantemente regenerado, o corpo humano é capaz de utilizar o seu peso em ATP por dia. O ATP age como uma ponte entre catabolismo e anabolismo, tendo as reações catabólicas como produtoras de ATP e as anabólicas como consumidoras. Também serve como um transportador de grupos fosfato em reações de fosforilação. As vitaminas são compostos orgânicos necessários em pequenas quantidades e que não podem ser sintetizados pelas células. Na nutrição humana, a maioria das vitaminas funciona como coenzimas após sofrerem uma modificação química; por exemplo, todas as vitaminas hidrossolúveis são fosforiladas ou ligadas a nucleótidos para a sua utilização intracelular. O dinucleótido de nicotinamida-adenina (NADH), um derivado da vitamina B3 (niacina), é uma coenzima importante que age como aceitador de hidrogénio. Centenas de diferentes tipos de desidrogenases retiram electrões dos seus substratos e reduzem NAD+ a NADH. Esta forma reduzida da coenzima é então substrato para redutases celulares que necessitem de reduzir os seus substratos. O dinucleótido de nicotinamida-adenina existe também sob uma forma fosfatada, NADPH. O par redox NAD+/NADH é mais importante no catabolismo, enquanto que o par NADP+/NADPH é mais usado no anabolismo. Minerais e cofactores Estrutura da hemoglobina (PDB 1GZX). As subunidades da proteínas encontram-se coloridas a vermelho e azul, encontrando-se os grupos hemo a verde. Cerca de 99% da massa dos mamíferos é constituída pelos elementos carbono, azoto, hidrogénio, oxigénio, cálcio, magnésio, sódio, potássio, cloro e enxofre. Destes, são considerados "inorgânicos" os metais, o enxofre e o cloro. Enquanto que alguns dos elementos inorgânicos são abundantes em sistemas vivos (como o sódio e o potássio), outros encontram-se em quantidades vestigiais. Os compostos orgânicos (proteínas, lípidos, glícidos) contêm a maioria do carbono e azoto; a maioria do oxigénio e hidrogénio encontra-se sob a forma de água. Os elementos inorgânicos mais abundantes atuam como electrólitos. Os iões mais importantes são o sódio, potássio, cálcio, magnésio, cloreto, fosfato e o ião orgânico bicarbonato. A existência de gradientes iónicos através de membranas celulares mantém a pressão osmótica e o pH. Os iões são também vitais para nervos e músculos, pois os potenciais de ação usados nestes tecidos são produzidos através da troca de electrólitos entre o fluido extracelular e o citoplasma. Os electrólitos entram e saem das células através de proteínas transmembranares denominadas canais iónicos. Por exemplo, a contração muscular depende do movimento de cálcio, sódio e potássio através de canais iónicos na membrana celular e túbulos-T. Os metais de transição são normalmente elementos vestigiais em organismos, sendo o zinco e o ferro os mais abundantes. Estes metais são usados por algumas proteínas como cofactores e são essenciais para a actividade de metaloenzimas como a catalase e proteínas de transporte de dioxigénio como a hemoglobina. Tais metais atuam como cofatores quer estando ligados diretamente à cadeia polipeptídica, quer estejam integrados em moléculas orgânicas complexas que por sua vez se encontram ligadas à cadeia polipeptídica. Os cofatores sofrem modificações durante a catálise enzimática mas voltam sempre ao seu estado inicial no fim de um ciclo catalítico. Os metais de transição são absorvidos pelos organismos usando transportadores específicos e ligam-se a proteínas de armazenamento como a ferritina e a metalotioneína quando não é necessária a sua disponibilidade para intervir no metabolismo. Catabolismo O catabolismo é o conjunto das reações metabólicas que libertam energia. Tais reações incluem a degradação e oxidação de moléculas encontradas em alimentos, assim como reações que captam a energia luminosa da luz solar. As reações catabólicas providenciam energia e componentes necessários às reações anabólicas. A natureza exata destas reações catabólicas difere de organismo para organismo: organismos organotróficos usam moléculas orgânicas como fonte de energia, enquanto litotróficos usam substratos inorgânicos e fototróficos captam energia solar, transformando-a em energia química. Todas estas diferentes formas de metabolismo dependem de reações redox que envolvem a transferência de electrões de moléculas doadoras reduzidas, como moléculas orgânicas, água, amoníaco, ácido sulfídrico ou os iões ferrosos (Fe2+), para moléculas aceitadoras, como o dioxigénio (O2), o nitrato (NO3−) ou o sulfato (SO42-). Em animais, estas reações envolvem a degradação de moléculas orgânicas complexas a moléculas mais simples, como dióxido de carbono (CO2) e água (H2O). Em organismos fotossintéticos, como as plantas e cianobactérias, estas reações de transferência electrónica não libertam energia, sendo antes utilizadas como forma de armazenar energia absorvida da luz solar. O conjunto de reações catabólicas mais comum em animais pode ser separado em três etapas diferentes. Na primeira etapa, moléculas orgânicas complexas como as proteínas, polissacarídeos ou lípidos são degradados nos seus componentes fora das células. Na etapa seguinte, estas moléculas de menor tamanho são importadas pelas células e convertidas a moléculas menores, normalmente o acetil-CoA, num processo que liberta energia. Na última etapa, o grupo acetilo do acetil-CoA é oxidado a água e dióxido de carbono, libertando energia que é armazenada através da redução da coenzima dinucleótido de nicotinamida-adenina, NAD+, a NADH. Um esquema simplificado do catabolismo de proteínas, polissacarídeos e lípidos. Digestão Macromoléculas como o amido ou as proteínas não podem ser rapidamente assimilados pelas células, tendo de ser degradados nos seus componentes de menor tamanho antes de poderem ser utilizados no metabolismo celular. A digestão destes polímeros é feita por diversas classes de enzimas. Estas enzimas digestivas incluem as proteases, que digerem proteínas a aminoácidos, e glicosídeo hidrolases, que digerem polissacarídeos a monossacarídeos. Os microorganismos excretam enzimas digestivas para o ambiente ao seu redor, enquanto que os animais segregam estas enzimas em células especializadas do sistema digestivo. Os aminoácidos ou açúcares libertados por estas enzimas extracelulares são então assimiladas pelas células através de proteínas específicas usando transporte activo. Energia de compostos orgânicos O catabolismo de glícidos consiste na degradação de glícidos complexos em unidades de menor tamanho. Os glícidos são normalmente assimilados pelas células após a sua digestão a monossacarídeos. Após entrada na célula, a principal via de degradação é a glicólise, em que açúcares como a glucose e a frutose são convertidos a piruvato, com formação em simultâneo de ATP. O piruvato é um intermediário de diversas vias metabólicas, mas a maioria é convertida a acetil-CoA, que entra no ciclo dos ácidos tricarboxílicos (ciclo de Krebs). Embora haja mais alguma formação de ATP neste ciclo, o produto principal deste é o NADH, resultante da redução do NAD+ quando o acetil-CoA é oxidado. Esta oxidação liberta dióxido de carbono (CO2). Uma via alternativa de degradação da glicose é a Via das pentoses-fosfato, que reduz a coenzima NADPH e produz pentoses como a ribose, o açúcar componente dos ácidos nucleicos. As gorduras são catabolizadas por hidrólise a ácidos gordos livres e glicerol. O glicerol entra na glicólise e os ácidos gordos são degradados por beta-oxidação a acetil-CoA, que entra então no ciclo dos ácidos tricarboxílicos. Devido à sua grande proporção de grupos metileno e pelo facto de os glícidos possuírem mais oxigénio nas suas estruturas químicas, os ácidos gordos libertam mais energia que os glícidos quando oxidados. Os aminoácidos são utilizados na síntese de proteínas e outras biomoléculas, ou oxidados a ureia e dióxido de carbono para obtenção de energia. A via de oxidação começa com a remoção do grupo amina por uma transaminase, deixando um esqueleto de carbono sob a forma de um cetoácido; o grupo amina é então metabolizado no ciclo da ureia. Vários cetoácidos obtidos através da desaminação de aminoácidos são também intermediários no ciclo dos ácidos tricarboxílicos: por exemplo, a desaminação do glutamato forma α-cetoglutarato. Os aminoácidos glucogénicos também podem ser convertidos a glicose, através da gluconeogénese. Fosforilação oxidativa Estrutura da ATP sintase. O canal de protões encontra-se a azul e a subunidade com actividade de sintase a vermelho. Na fosforilação oxidativa, os electrões obtidos na oxidação de moléculas em diversas vias metabólicas, como por exemplo o ciclo dos ácidos tricarboxílicos, são transferidos para o dioxigénio, e a energia libertada é usada na produção de ATP. Em eucariontes, este processo é feito por uma série de proteínas, a cadeia de transporte eletrónico, que se encontram nas membranas mitocondriais. Em procariontes, estas proteínas encontram-se na membrana celular interna. Estas proteínas utilizam a energia obtida da oxidação de NADH para transportar protões através da membrana. O transporte de protões para o exterior da mitocôndria cria uma diferença de concentração de protões entre os dois compartimentos, criando um gradiente electroquímico. A presença deste gradiente força os protões a regressarem ao interior da mitocôndria através da ATP sintase. O fluxo de protões provoca a rotação da subunidade inferior da ATP sintase, o que causa a fosforilação de difosfato de adenosina (ADP) a trifosfato de adenosina (ATP). Energia de compostos inorgânicos A quimiolitotrofia é um tipo de metabolismo encontrado em procariontes, em que a energia é obtida a partir da oxidação de compostos inorgânicos. Estes organismos podem usar hidrogénio, compostos reduzidos de enxofre (como sulfuretos, ácido sulfídrico e tiossulfato), óxidos de ferro (II), ou amoníaco como fontes de agentes redutores, ganhando energia a partir da oxidação destes compostos com aceitadores de electrões como o oxigénio ou o nitrito. Estes processos microbiológicos são importantes em ciclos biogeoquímicos como a acetogénese, a nitrificação e a desnitrificação e são de importância crítica para a fertilidade do solo. Energia luminosa A energia da luz solar é captada por plantas, cianobactérias, alguns tipos de bactérias e de protistas. Este processo está frequentemente associado à fixação de dióxido de carbono em compostos orgânicos, que é um processo integrante da fotossíntese. Os sistemas de captura de energia e de fixação de carbono podem trabalhar separadamente em procariontes, como acontece com as bactérias púrpura e as bactérias verdes sulfurosas. Estas bactérias usam a luz solar como fonte de energia mas alternam o seu metabolismo entre a fixação de carbono e a fermentação de compostos orgânicos. A captação de energia solar é um processo semelhante à fosforilação oxidativa, pois ambos os processos envolvem o armazenamento de energia sob a forma de um gradiente de protões, que leva à síntese de ATP. No caso da fotossíntese, os electrões necessários para o funcionamento da cadeia de transporte electrónico provêm de proteínas colectoras de luz denominadas centros reacionais fotossintéticos. Estas estruturas dividem-se em dois tipos dependendo do pigmento fotossintético presente; a maioria das bactéria fotossintéticas possui apenas um tipo de centro, enquanto as plantas e as cianobactérias possuem dois. Em plantas, o fotossistema II usa energia luminosa para remover electrões da água, libertando oxigénio no processo. Os electrões movem-se então para o complexo do citocromo b6f, que usa a sua energia para transportar protões através das membranas dos tilacoides nos cloroplastos. Estes protões regressam ao interior dos tilacoides através da ATP sintase, num processo semelhante ao descrito nas mitocôndrias. Estes electrões podem então entrar no fotossistema I e ser utilizados na redução de NADP+, no ciclo de Calvin ou reciclados para gerar ainda mais ATP. Anabolismo O anabolismo é o conjunto de reações metabólicas de síntese em que a energia libertada pelo catabolismo é utilizada para construir moléculas complexas. Em geral, as moléculas complexas que constituem estruturas celulares são construídas passo a passo a partir de precursores mais simples. O anabolismo divide-se em três etapas fundamentais: a síntese de precursores como aminoácidos, monossacarídeos, isoprenoides e nucleótidos, a activação destes precursores a formas reactivas usando energia proveniente do ATP e finalmente a construção de moléculas complexas, tais como proteínas, polissacarídeos, lípidos e ácidos nucleicos, a partir destes precursores activados. Os organismos diferem entre si na quantidade de diferentes moléculas que conseguem sintetizar. Os seres autotróficos, como as plantas, podem construir moléculas complexas (polissacarídeos e proteínas) a partir de moléculas muito simples como o dióxido de carbono e a água. Os seres heterotróficos necessitam de fontes alimentares para providenciar monossacarídeos e aminoácidos, para poder produzir macromoléculas. Os organismos podem ainda ser classificados segundo a fonte primária da sua energia: fotoautotróficos e foto-heterotróficos obtém energia a partir da luz solar, enquanto que organismos quimioautotróficos e quimioheterotróficos obtêm energia a partir de reações de oxidação. Fixação de carbono Células vegetais apresentando cloroplastos (a verde), que são os organelos em que ocorre a fotossíntese. A fotossíntese é o processo em que ocorre síntese de glicose a partir da luz solar, dióxido de carbono e água, havendo produção de oxigénio. Este processo utiliza ATP e NADPH produzido pelos centros reacionais fotossintéticos para converter CO2 em glicerol-3-fosfato, que pode ser então convertido a glicose. Esta reação de fixação de carbono é catalisada pela enzima RuBisCO e é parte integrante do ciclo de Calvin. Ocorrem três tipos de fotossíntese em plantas: fixação de carbono em plantas C3, fixação de carbono em plantas C4 e fotossíntese CAM. Estes tipos de fotossíntese diferem na via que o CO2 toma até ao ciclo de Calvin: as plantas C3 fixam o CO2 directamente, enquanto que as C4 e CAM incorporam-no noutros compostos de forma a adaptar a condições de alta luminosidade e dessecação. Algas e plantas aquáticas usam microcompartimentos subcelulares chamados pirenoides. Os mecanismos de fixação de carbono em procariontes fotossintéticos são mais diversificados. O CO2 pode ser fixado através do ciclo de Calvin, de um ciclo dos ácidos tricarboxílicos inverso ou através da carboxilação do acetil-CoA. Procariontes quimioautotróficos também utilizam o ciclo de Calvin para a fixação de carbono mas a energia usada nas reações provém de compostos inorgânicos. Glícidos No anabolismo de glícidos, ácidos orgânicos simples podem ser convertidos a monossacarídeos como a glicose, sendo então usados para sintetizar polissacarídeos como o amido. A produção de glicose a partir de compostos como o piruvato, o lactato, o glicerol, o glicerol-3-fosfato e aminoácidos é chamada gluconeogénese. Na gluconeogénese, o piruvato é convertido a glicose-6-fosfato usando diversos intermediários, muitos deles comuns à glicólise. No entanto, esta via não se resume a uma inversão da glicólise, pois diversos passos são catalisados por enzimas não-glicolíticas. Este é um aspecto importante pois permite a regulação separada da formação e da degradação da glicose, evitando que ambas as vias funcionem em simultâneo num ciclo fútil. Embora a gordura seja um modo comum de armazenamento de energia, em vertebrados, como os humanos, os ácidos gordos não podem ser convertidos a glicose através da gluconeogénese, pois estes organismos são incapazes de transformar acetil-CoA em piruvato. Por essa razão, após um longo jejum os vertebrados necessitam de produzir corpos cetónicos a partir de ácidos gordos para substituir a glicose em falta em tecidos e órgãos que não conseguem metabolizar ácidos gordos, como o cérebro. Noutros organismos, como plantas e bactérias, este problema metabólico é ultrapassado utilizando o ciclo do glioxilato, que evita o passo de descarboxilação no ciclo dos ácidos tricarboxílicos e permite a transformação de acetil-CoA a oxaloacetato, que pode ser então utilizado na produção de glicose. Os polissacarídeos e os glicanos são sintetizados através da adição sequencial de monossacarídeos, catalisada por glicosiltransferases, de um doador de açúcar fosforilado como o difosfato de uridina glicose (UDP-glicose) para um grupo hidroxilo aceitador no polissacarídeo nascente. Como qualquer um dos grupos hidroxilo da estrutura do substrato podem ser aceitadores, os polissacarídeos podem ter estruturas lineares ou ramificadas. Os polissacarídeos podem desempenhar funções estruturais ou metabólicas, podendo também ser transferidos para lípidos e proteínas pelas enzimas oligossacariltransferases. Ácidos gordos, isoprenoides e esteroides Esquema simplificado da via de síntese de esteroides, mostrando os intermediários metabólicos pirofosfato de isopentenilo (IPP), pirofosfato de dimetilalilo (DMAPP), pirofosfato de geranilo (GPP) e esqualeno. Outros intermediários foram omitidos para maior claridade. Os ácidos gordos são sintetizados pelas sintases de ácido gordo, que polimerizam e reduzem unidades de acetil-CoA. As cadeias acilo dos ácidos gordos são aumentadas através de um ciclo de reações que adicionam o grupo acilo, reduzemno à forma álcool, desidratam este a um grupo alceno, sendo este finalmente reduzido a um grupo alcano. As enzimas envolvidas na biossíntese de ácidos gordos encontram-se divididas em dois grupos: em animais e fungos todas estas reações são catalisadas por uma proteína multifuncional (tipo I), enquanto que em plantas e bactérias diferentes enzimas catalisam as diversas reações (tipo II). Os terpenos e os isoprenoides são uma classe de lípidos, que inclui os carotenoides, sendo a maior classe de produtos naturais vegetais. Estes compostos são sintetizados através da montagem e modificação de unidades de isopreno doadas pelas moléculas precursoras pirofosfato de isopentenilo e pirofosfato de dimetilalilo. Estes precursores podem ser obtidos de diferentes formas. Em animais e arqueas, a via do mevalonato produz estes compostos a partir do acetil-CoA, enquanto que plantas e bactérias existe uma via alternativa (do não-mevalonato) que utiliza piruvato e 3-fosfato de gliceraldeído como substratos. Uma reação importante que utiliza estes doadores de isopreno é a síntese de esteroides. Nesta, as unidades de isopreno são unidas formando esqualeno; este é então convertido a lanosterol. O lanosterol pode ser então convertido a outros esteroides, como o colesterol e o ergosterol. Proteínas Diferentes organismos possuem diferentes capacidades de sintetizar os vinte aminoácidos mais comuns. A maioria das bactérias e plantas conseguem sintetizar todos os vinte aminoácidos; os mamíferos conseguem sintetizar apenas dez, denominados não-essenciais por esta razão. Assim, os aminoácidos essenciais têm de ser obtidos através da alimentação. Todos os aminoácidos são sintetizados a partir de intermediários da glicólise, do ciclo dos ácidos tricarboxílicos ou da via das pentoses-fosfato; o azoto não existente nestes intermediários é fornecido pelo glutamato ou pela glutamina. A síntese dos aminoácidos depende da formação do alfa-cetoácido apropriado, que sofre então transaminação para formar um aminoácido. Os aminoácidos são utilizados na síntese de proteínas, ao serem ligados entre si por ligações peptídicas numa cadeia linear. Os aminoácidos podem ser ligados num número de combinações quase infinito, fazendo com que cada proteína tenha uma sequência única de aminoácidos, denominada estrutura primária. As proteínas são sintetizadas a partir de aminoácidos ativados através de uma ligação éster a uma molécula de ARN de transferência (ARNt ou tRNA). Estes aminoácidos ativados, os aminoacil-tRNA, são sintetizados pela aminoacil-tRNA sintetase, numa reação dependente da presença de ATP. Os ribossomas atuam então no aminoacil-tRNA, agregando-o à cadeia polipeptídica nascente, segundo a informação dada pelo ARN mensageiro. Síntese de nucleótidos Os nucleótidos são sintetizados a partir de aminoácidos, dióxido de carbono e ácido fórmico em vias metabólicas que necessitam de grandes quantidades de energia. As purinas são sintetizadas a partir de nucleósidos (bases ligadas à ribose). Tanto a adenina como a guanina são sintetizadas a partir do monofosfato de inosina, que por sua vez é sintetizado usando átomos provenientes dos aminoácidos glicina, glutamina e aspartato, assim como de formato transferido pela coenzima tetrahidrofolato. As pirimidinas são sintetizadas a partir da base orotato, formada a partir da glutamina e do aspartato. Metabolismo redox e de xenobióticos Todos os organismos são constantemente expostos a compostos que não podem ser utilizados no metabolismo normal e que são potencialmente tóxicos se se acumularem nas células. Tais compostos são designados xenobióticos. Os xenobióticos, incluindo substâncias como drogas sintéticas, venenos e antibióticos, são desintoxicados usando um conjunto de enzimas específicas. Em humanos, estas enzimas incluem as citocromo P450 oxidases, as UDP- glucuronosiltransferases e as glutationo-S-transferases. Este sistema de enzimas atua em três fases. Na fase I, o xenobiótico é oxidado; na fase II, existe conjugação de grupos hidrofílicos no xenobiótico oxidado, de modo a torná-lo mais hidrossolúvel; na fase III, o xenobiótico modificado é expulso das células, podendo sofrer mais algum metabolismo em organismos multicelulares antes da sua excreção. Estas reações são bastante importantes em termos ecológicos, nomeadamente na biodegradação microbiana de agentes poluentes e biorremediação de terras contaminadas e derrames de combustíveis. Muitas destas reações microbianas são idênticas às existentes em organismos multicelulares. No entanto, e graças à sua enorme diversidade, os microorganismos conseguem desintoxicar uma variedade superior de xenobióticos que os organismos multicelulares, conseguindo inclusivamente degradar agentes poluentes orgânicos persistentes, como compostos organoclorados. Um problema relacionado com o dos xenobióticos prende-se com a existência de stress oxidativo em organismos aeróbios. Os processos associados à vida em aerobiose, como a fosforilação oxidativa e a formação de ligações dissulfureto em proteínas, produzem espécies reactivas de oxigénio, como o peróxido de hidrogénio. Estas espécies danosas são removidas por antioxidantes, como a glutationa, e enzimas, como a catalase e outras peroxidases. Termodinâmica de sistemas vivos Os sistemas vivos têm de obedecer às leis da termodinâmica. A grande complexidade dos organismos aparentemente contradiz a segunda lei da termodinâmica, que enuncia que a entropia de um sistema fechado tende a aumentar; no entanto, os sistemas vivos são sistemas abertos que trocam energia e massa com o seu exterior. Assim, os organismos não se encontram em equilíbrio termodinâmico, sendo antes sistemas dissipativos, pois mantêm a sua ordem ao aumentar a entropia do seu ambiente. O metabolismo celular faz a ponte entre o processo espontâneo de catabolismo e o processo não espontâneo de anabolismo para obter este efeito. Em termos termodinâmicos, o metabolismo mantém a ordem ao criar desordem. Metabolismo e a temperatura Em fungos, bactérias, plantas ou animais de sangue quente ou frio, vários processos interagem com a temperatura interna e externa aos organismos. As plantas e leveduras parecem ter um termostato biológico simples. Na planta Arabidopsis thaliana, uma única proteína (a histona H2A) desempenha o papel em variações de temperatura inferiores a 1° C. Esta proteína altera o enrolamento do DNA, controlando assim o acesso a determinadas moléculas de DNA, ou inibindo a ativação de genes. Este efeito de "bio-termostato" parece ser comum na natureza. Entender esses mecanismos também pode ajudar a compreender melhor alguns dos efeitos da mudança do clima. Regulação e controle O ambiente da maioria dos organismos encontra-se em constante mudança, sendo necessária uma apertada regulação das reações metabólicas de modo a manter um conjunto de condições mais ou menos constante nas células, chamado homeostase. A regulação metabólica permite aos organismos dar resposta a estímulos do exterior, permitindo a interação com o seu ambiente. Existem dois conceitos relacionados que são importantes para a compreensão da forma como são reguladas vias metabólicas: em primeiro lugar, a regulação de uma enzima numa via refere-se ao aumento ou diminuição da sua actividade enzimática em resposta a estímulos; o segundo conceito é o controlo exercido por esta enzima na velocidade total da via por sofrer variações na sua actividade enzimática, ou seja, o controlo do fluxo da via metabólica. Por exemplo, uma enzima pode sofrer grandes alterações na sua actividade (ou seja, ser muito regulada) mas se estas mudanças não tiverem um efeito significativo no fluxo da via metabólica, então esta enzima não está envolvida no controlo da via. Efeito da insulina na absorção e metabolismo da glicose. A insulina liga-se ao seu receptor (1) que por sua vez inicia diversas cascatas de sinalização (2) tais como a translocação do transportador Glut-4 para a membrana plasmática e entrada de glicose (3), síntese de glicogénio (4), glicólise (5) e síntese de ácidos gordos (6). Existem diversos níveis de regulação metabólica. Na regulação intrínseca, a via metabólica regula-se a si própria em resposta a mudanças nos níveis de substratos ou produtos; por exemplo, uma diminuição na quantidade de produto pode aumentar o fluxo da via para compensar essa diminuição. Este tipo de regulação envolve frequentemente o uso de regulação alostérica das diversas enzimas que participam na via metabólica. O controlo extrínseco corresponde à mudança do metabolismo de uma célula num organismo multicelular em resposta a sinais de outras células. Estes sinais são normalmente moléculas mensageiras solúveis, como hormonas e factores de crescimento, e são detectados por receptores específicos na superfície das células. Tais sinais são então transmitidos para o interior da célula por sistemas de mensageiros secundários que envolvem frequentemente a fosforilação de proteínas. A regulação do metabolismo da glicose pela insulina é um exemplo bem conhecido de controlo extrínseco. A insulina é produzida em resposta a um aumento da glicemia. A ligação da hormona a receptores de insulina na superfície de células activa uma cascata de cinases que provoca a absorção de glicose pelas células e a sua conversão a moléculas de armazenamento, como o glicogénio e os ácidos gordos. O metabolismo do glicogénio é controlado pela actividade da glicogénio fosforilase, a enzima que hidrolisa o glicogénio, e pela glicogénio sintase, a enzima que o sintetiza. Estas enzimas são reguladas de forma recíproca, em que a fosforilação activa a fosforilase e inibe a sintase. A insulina provoca a síntese de glicogénio ao activar fosfatases, produzindo um decréscimo na fosforilação destas enzimas. Evolução A árvore filogenética, mostrando as relações entre organismos decorrentes da evolução das espécies. A azul: bactérias; a verde: arqueas; a vermelho: eucariotas. São também mostradas as posições relativas de alguns filos. As vias metabólicas descritas acima são comuns aos três domínios da vida (Eukarya, Archaea e Bacteria), considerando-se por isso que estavam também presentes no mais recente antecessor comum aos três domínios. Este antecessor era procariótico e provavelmente metanogénico, possuindo um extenso metabolismo de lípidos, aminoácidos, nucleótidos e glícidos. A preservação destas vias durante a evolução que se seguiu poderá ter resultado de serem uma solução optimizada para os seus problemas metabólicos específicos: ocorre a produção de metabolitos de forma eficiente e com um número mínimo de passos reacionais. Diversos são os modelos propostos para a descrição da evolução de novas vias metabólicas, incluindo a adição sequencial de enzimas a curtas vias ancestrais, a duplicação e posterior divergência evolutiva de vias metabólicas inteiras e a inclusão de enzimas pré-existentes numa nova via reacional. Não é clara a importância relativa destes mecanismos, mas diversos estudos genómicos sugerem que as enzimas de uma dada via metabólica possuem um antecessor comum. Esta ancestralidade comum implica que diversas vias terão evoluído passo a passo, com a criação de novas funções a partir de passos reacionais pré-existentes. Existe também a possibilidade de que partes do metabolismo existam como "módulos" que podem ser reutilizados em diferentes vias e que desempenham funções semelhantes em diferentes moléculas. A evolução de organismos pode levar também à perda de vias metabólicas. Por exemplo, em alguns parasitas, processos metabólicos que não são essenciais à sua sobrevivência são perdidos; o parasita absorve então aminoácidos, nucleótidos e glícidos do seu hospedeiro. Organismos endossimbióticos apresentam também capacidades metabólicas similarmente reduzidas. Bibliografia Nível introdutório Rose, S. and Mileusnic, R., The Chemistry of Life. (Penguin Press Science, 1999), ISBN 014-027273-9 Schneider, E. D. and Sagan, D., Into the Cool: Energy Flow, Thermodynamics, and Life. (University Of Chicago Press, 2005), ISBN 0-226-73936-8 Lane, N., Oxygen: The Molecule that Made the World. (Oxford University Press, USA, 2004), ISBN 0-19-860783-0 Nível avançado Price, N. and Stevens, L., Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. (Oxford University Press, 1999), ISBN 0-19-850229-X Berg, J. Tymoczko, J. and Stryer, L., Biochemistry. (W. H. Freeman and Company, 2002), ISBN 0-7167-4955-6 Cox, M. and Nelson, D. L., Lehninger Principles of Biochemistry. (Palgrave Macmillan, 2004), ISBN 0-7167-4339-6 Brock, T. D. Madigan, M. T. Martinko, J. and Parker J., Brock's Biology of Microorganisms. (Benjamin Cummings, 2002), ISBN 0-13-066271-2 Da Silva, J.J.R.F. and Williams, R. J. P., The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. (Clarendon Press, 1991), ISBN 0-19-855598-9 Nicholls, D. G. and Ferguson, S. J., Bioenergetics. (Academic Press Inc., 2002), ISBN 0-12518121-3 Respiração celular Respiração celular é o processo de conversão das ligações químicas de moléculas ricas em energia que poderão ser usadas nos processos vitais. Ela pode ser de dois tipos, respiração anaeróbia (sem utilização de oxigênio) e respiração aeróbia (com utilização de oxigênio). A respiração celular é o processo de obtenção de energia mais utilizado pelos seres vivos. Na respiração, ocorre a liberação de dióxido de carbono, energia e água e o consumo de oxigênio e glicose, ou outra substância orgânica, tal como lipídios. A organela responsável por essa respiração é a mitocôndria. Do ponto de vista da fisiologia, o processo pelo qual um organismo vivo troca oxigênio e dióxido de carbono com o seu meio ambiente é chamado de ventilação, respiração ocorre apenas na célula, operação executada pela mitocôndria. Do ponto de vista da bioquímica, respiração celular é o processo de conversão das ligações químicas de moléculas ricas em energia que possa ser usada nos processos vitais. A respiração celular processa-se nas seguintes etapas: Glicólise Ciclo de Krebs Cadeia respiratória Fosforilação oxidativa O processo básico da respiração celular é a quebra da glicose ou Glicólise, que se pode expressar pela seguinte equação química: C6H12O6 + 6O2 → 6CO2 + 6H2O + energia Nutrientes (energia química) + O2 → CO2 + H2O + Energia (alguma que se perde sob a forma de calor e outra parte armazena-se sob a forma de ATP) Este artigo centra-se nos fenómenos da respiração celular, que se processa segundo duas sequências básicas: Glicólise (ocorrida no citosol) e Oxidação do piruvato (ocorrida na matriz mitocondrial) através de um de dois processos: Respiração aeróbia ou Respiração anaeróbia Oxidação do piruvato De acordo com o tipo de metabolismo, existem duas sequências possíveis para a oxidação do piruvato proveniente da glicólise: 1. Neste primeiro processo, a oxidação do piruvato ocorre em uma respiração aeróbia, produzindo em seguida Acetilcoenzima A, iniciando assim o Ciclo de Krebs, como é demonstrado abaixo: Piruvato → Acetil-Coa Nesta etapa ocorre a entrada de NAD e CoA-SH. O piruvato gerado na glicólise sofre desidrogenação e descarboxilação catalisado pelo complexo piruvato-desidrogenase, durante essas reações é adicionada a coenzima A, desta forma a partir de cada piruvato produz-se um acetil-CoA, iniciando logo em seguida o Ciclo de Krebs Durante a glicólise pode ocorrer a falta de O2 gerando outras reações: 2. Nesta etapa a oxidação do piruvato ocorre em uma reação anaeróbia Oxidação Incompleta da Glicose: Glicose → Piruvato → Ácido láctico Na ausência de O2 ou em situação de hipóxia, a cadeia respiratória fica bloqueada ou parcialmente bloqueada, por isso os NADH e FADH2 gerados nas reações de oxiredução não podem ser oxidados. Assim fica faltando NAD e FAD para as reações de desidrogenação. Com isso, o ciclo de Krebs não pode ocorrer ficando totalmente bloqueado na falta de O2. Se houvesse uma forma de repor NAD e FAD sem o envolvimento da cadeia respiratória o ciclo poderia continuar ocorrendo. Na oxidação da glicose na ausência de O2, o NADH produzido não irá para a cadeia respiratória; da mesma forma, o piruvato não dará origem ao acetil-CoA. Assim fica acumulado NADH e piruvato. Para que a glicólise mantenha-se, o NADH acumulado transfere seus elétrons e P+ para o piruvato, originando ácido láctico e regenerando o NAD. Isto representa uma via alternativa de oxidação do NADH. Na oxidação incompleta o rendimento de ATP cai para apenas dois. Respiração aeróbica A respiração aeróbia requer oxigênio. Na glicólise, é formado o piruvato (também chamado de ácido pirúvico) bem como 2 ATP. Cada piruvato que entra na mitocôndria e é oxidado a um composto com dois carbonos (acetato) que depois é combinado com a Coenzima-A, com a produção de NADH e libertação de CO2. De seguida, inicia-se o Ciclo de Krebs. Neste processo, o grupo acetil é combinado com compostos com quatro carbonos formando o citrato (6C). Por cada ciclo que ocorre liberta-se 2CO2, NADH e FADH2. No ciclo de Krebs obtém-se 2 ATPs. Numa última fase - cadeia transportadora de elétrons (ou fosforilação oxidativa) os elétrons removidos da glicose são transportados ao longo de uma cadeia transportadora,criando um gradiente protónico que permite a fosforilação do ADP. O aceptor final de elétrons é o O2, que, depois de se combinar com os elétrons e o hidrogênio, forma água. Respiração anaeróbica A respiração anaeróbia envolve um receptor de elétrons diferente do oxigênio e existem vários tipos de bactérias capazes de usar uma grande variedade de compostos como receptores de elétrons na respiração: compostos nitrogenados, tais como nitratos e nitritos, compostos de enxofre, tais como sulfatos, sulfitos, dióxido de enxofre e mesmo enxofre elementar, dióxido de carbono, compostos de ferro, de manganês, de cobalto e até de urânio. No entanto, para todos estes, a respiração anaeróbia só ocorre em ambientes onde o oxigénio é escasso, como nos sedimentos marinhos e lacustres ou próximo de nascentes hidrotermais submarinas. Uma das sequências alternativas à respiração anaeróbia é a fermentação, um processo em que o piruvato é apenas parcialmente oxidado, não se segue o ciclo de Krebs e não há produção de ATP numa cadeia de transporte de eléctrons. No entanto, a fermentação é útil para a célula porque regenera o dinucleótido de nicotinamida e adenina (NAD), que é consumido durante a glicólise. Os diferentes tipos da fermentação produzem vários compostos diferentes, como o etanol (o álcool das bebidas alcoólicas, produzido por vários tipos de leveduras e bactérias) ou o ácido láctico do iogurte. Outras moléculas, como NO2, SO2 são os aceptores finais na cadeia de transporte de elétrons. Glicólise Rendimento energético da respiração celular Glicólise (do grego antigo "γλυκύς" (glykýs), adocicado e "λύσις" (lýsis), quebra, degradação) é uma sequência metabólica composta por um conjunto de dez reações catalisadas por enzimas livres no citosol, na qual a glicose é oxidada produzindo duas moléculas de piruvato, quatro moléculas de ATP (contemplando que duas moléculas de ATP foram utilizadas durante a fase de investimento, considera-se um saldo final de dois ATP, subtraindo os dois que foram utilizados da quantidade total de ATP produzido na via) e dois equivalentes reduzidos de NADH+, que serão introduzidos na cadeia respiratória ou na fermentação. A glicólise é uma das principais rotas para geração de ATP nas células e está presente em todos os tipos de tecidos. A importância da glicólise na nossa economia energética é relacionada com a disponibilidade de glicose no sangue, assim como com a habilidade da glicose gerar ATP tanto na presença quanto na ausência de oxigênio. A glicose é o principal carboidrato em nossa dieta e é o açúcar que circula no sangue para assegurar que todas as células tenham suporte energético contínuo. O cérebro utiliza quase exclusivamente glicose como combustível. A oxidação de glicose a piruvato gera ATP pela fosforilação (a transferência de fosfato de intermediários de alta energia da via do ADP) a nível de substrato e NADH. Subsequentemente, piruvato pode ser oxidado a CO2 no ciclo de Krebs e ATP gerado pela transferência de elétrons ao oxigênio na fosforilação oxidativa. Entretanto, se o piruvato e o NADH gerados na glicólise forem convertidos a lactato (glicólise anaeróbica), ATP pode ser gerado na ausência de oxigênio, através da fosforilação a nível de substrato. A glicose tem sua importância também por ser fonte de energia para todos os tipos de células de mamíferos, além de ser fonte exclusiva de energia para as hemácias. O eritrócito maduro não apresenta mitocôndrias, sendo assim obtêm sua energia a partir da glicose por duas principais vias: via glicolítica anaeróbia (EmbdenMeyerhof) que envolve 90% da degradação da glicose até lactato, e a via das pentoses fosfato ou derivação da hexose monofosfato, ou ainda via do fosfogliconato. Mais informação: Reação Global ... Reação Global Glicose + 2 NAD+ + 2 ADP + 2 Pi -----------> 2 NADH + 2 piruvato + 2 ATP + 2 H2O A glicólise é uma rota central quase universal do catabolismo da glicose, a rota com o maior fluxo de carbono na maioria das células. A quebra glicolítica de glicose é a única fonte de energia metabólica em alguns tecidos de mamíferos e tipos celulares (hemácias, medula renal, cérebro e esperma, por exemplo). Alguns tecidos de plantas que são diferenciados para armazenar amido (como os tubérculos da batata) e algumas plantas aquáticas derivam a maior parte de sua energia da glicólise; muitos micro-organismos anaeróbicos são inteiramente dependentes da glicólise. Fermentação é um termo geral para a degradação anaeróbica de glicose (glicólise anaeróbica) ou outros nutrientes orgânicos para obtenção de energia, conservada como ATP. Os organismos primitivos se originaram num mundo cuja atmosfera carecia de O2 e, por isto, a glicólise é considerada a mecanismo biológico mais primitivo para obtenção de energia a partir de moléculas orgânicas, presente em todas as formas de vida atuais. No curso da evolução, a química dessa sequência de reações foi completamente conservada; as enzimas glicolíticas dos vertebrados são intimamente similares, na sequência de aminoácidos e na estrutura tridimensional, a seus homólogos nas leveduras e no espinafre. A glicólise difere entre as espécies apenas em detalhes de sua regulação e no destino metabólico subsequente do piruvato formado. Os princípios termodinâmicos e os tipos de mecanismos regulatórios que governam a glicólise são comuns a todas as rotas de metabolismo celular. O estudo da glicólise pode, portanto, servir como modelo para muitos aspectos das rotas metabólicas. A glicólise nas células procariontes ocorre no citoplasma e nas eucariontes ocorre no citosol. A mais comum e conhecida forma de glicólise é a rota de Embden-Meyerhof, que foi inicialmente elucidada por Gustav Embden e Otto Meyerhof. O termo glicólise pode significar também outras rotas metabólicas, como a de Entner-Doudoroff. Entretanto, o resto desse artigo usará o termo glicólise para explicar a via metabólica mais comum pela qual ocorre: a rota de Embden-Meyerhof. História A glicólise foi a primeira rota metabólica a ser elucidada e é provavelmente a melhor compreendida. Os primeiros estudos formais do processo glicolítico foram feitos em 1860, quando Louis Pasteur descobriu que micro-organismos eram responsáveis pela fermentação. Em 1897, Eduard Buchner mostrou que o extrato obtido da maceração de leveduras, mesmo isento de micro-organismos vivos, fermentava açúcares, e chamou este extrato de zimase, recebendo o Prêmio Nobel da Química em 1907. Em 1905 Arthur Harden e William Young mostraram que a zimase podia ser separada em 2 extratos: um contendo moléculas grandes e sensíveis ao calor (que hoje sabemos serem as enzimas) e uma fração de moléculas menores e pouco sensíveis ao calor (que sabemos hoje serem as coenzimas), e que estes só fermentavam o açúcar quando juntos. Harden recebeu o Prêmio Nobel da Química em 1929. A via glicolítica detalhada foi determinada em 1940, com as contribuições de Otto Meyerhof (Nobel da Medicina ou Fisiologia em 1922) e alguns anos depois por Luis Leloir (Nobel da Química em 1970). A maior dificuldade na determinação da via é devido ao curto tempo de vida e baixas concentrações dos intermediários, o que faz a glicólise uma via metabólica muito rápida. Louis Pasteur verificou que a levedura crescia mais de 10 vezes mais rápido quando digeria o açúcar na fermentação do que usando o oxigênio. Sequência da Glicólise Rotas da glicólise e gliconeogênese no fígado A quebra dos seis carbonos da glicose em duas moléculas de piruvato com três carbonos ocorre em dez passos; os primeiros cinco dos quais constituem a fase preparatória (fase de investimento) e os cinco seguintes, a fase de geração de ATP (fase de rendimento). Fase 1: Preparação, regulação e gasto de energia Na fase inicial preparatória da glicólise (fase de investimento), a glicose é fosforilada duas vezes por ATP e clivada em duas trioses fosfato. Nesta fase, a célula gasta duas moléculas de ATP, o catião Mg2+ é indispensável para as reações, e processam-se cinco reações bioquímicas. Nenhuma energia é armazenada, pelo contrário, duas moléculas de ATP são investidas nas reações de fosforilação. Reação 1: hexocinase Na primeira reação, a glicose que entra nos tecidos é fosforilada no grupo hidroxila em C6, com o gasto energético de uma molécula de ATP, dando origem a glicose-6fosfato e ADP. Essa reação, catalisada pela enzima hexocinase, é irreversível sob condições fisiológicas devido a seu ΔG° altamente negativo. Trata-se de um dos três passos que regulam a glicólise. A fosforilação da glicose na primeira reação impede que esta saia da célula novamente (a glicólise realiza-se no citosol da célula). Ao adicionar um grupo fosfato à glicose, ela se torna uma molécula carregada negativamente e é impossível atravessar passivamente a membrana celular, mantendo-a aprisionada dentro da célula. Glicose-6-fosfato é um ponto de ramificação no metabolismo de carboidratos. Ela é um precursor para quase todas as rotas que utilizam a glicose, incluindo glicólise, via da pentose fosfato e síntese de glicogênio. De um ponto de vista oposto, ela também pode ser gerada a partir de outras rotas do metabolismo de carboidratos, tais como glicogenólise (quebra de glicogênio), via da pentose fosfato e gliconeogênese (síntese de glicose a partir de não-carboidratos). As hexoquinases, enzimas que catalisam a fosforilação da glicose, são uma família de isoenzimas tecido-específicas que diferem em suas propriedades cinéticas. A isoenzima encontrada no fígado e células do pâncreas tem um Km muito mais alto do que outras hexoquinases e é chamada de glicoquinase. As cinases são enzimas que catalisam a transferência de um grupo fosforil terminal do ATP para um aceptor nucleófilo. No caso da hexoquinase, o aceptor é uma hexose, normalmente Dglicose, embora a hexoquinase possa catalisar a fosforilação de outras hexoses comuns, tais como D-frutose e D-manose. A hexoquinase, como muitas outras cinases, requer Mg2+ para sua atividade, pois o verdadeiro substrato da enzima não é ATP-4, e sim MgATP-2. Em muitas células, parte da hexoquinase se encontra ligada a porinas na membrana mitocondrial externa, as quais dão a essas enzimas o acesso precoce ao ATP recém-sintetizado conforme ele sai da mitocôndria. Reação 2: fosfohexose-isomerase Na segunda reação, catalisada pela enzima glicosefosfato-isomerase (também chamada de fosfoexose isomerase), a glicose-6-fosfato, uma aldose, é convertida num processo de isomerização reversível em frutose-6-fosfato, uma cetose, assim, permitindo um sítio de entrada para a frutose da dieta na glicólise. Esta isomerização tem um papel crítico na química geral da via glicolítica, uma vez que o rearranjo dos grupos carbonil e hidroxil em C-1 e C-2 é uma preparação necessária para os próximos dois passos. A fosforilação que ocorre na reação seguinte (reação 3) requer que o grupo em C-1 seja primeiramente convertido de um carbonil para um álcool e, na reação subsequente (reação 4), a clivagem da ponte entre C-3 e C-4 pela aldolase requer um grupo carbonil em C-2. Reação 3: fosfofrutoquinase-1(PFK1) Na reação número 3, a célula investe outra molécula de ATP para fosforilar a frutose-6-fosfato e convertê-la em frutose-1,6-bisfosfato. Esta é também uma reação irreversível e de controle desta via metabólica, catalisada pela enzima fosfofrutocinase, que é a enzima marca-passo da glicólise. Esta etapa ocorre para deixar a molécula simétrica para a reação de clivagem na etapa seguinte. Reação 4: aldolase Na reação 4, a frutose-1,6-bisfosfato é clivada em duas trioses: gliceraldeído-3fosfato e dihidroxiacetona fosfato. Esta reação é catalisada pela enzima aldolase. Reação 5: triosefosfato isomerase O gliceraldeído-3-fosfato e a dihidroxiacetona fosfato são isômeros facilmente interconversíveis pela enzima triosefosfato isomerase. Ocorre então a conversão da dihidroxicetona P em gliceraldeído 3P, a única triose que pode continuar sendo oxidada. Fase 2: Produção de ATP e oxidação Na fase de geração de ATP (de rendimento), gliceraldeído-3-fosfato (uma triose fosfato) é oxidado pelo NAD e fosforilada usando fosfato inorgânico. A ponte de fosfato de alta energia gerada nesta etapa é transferida ao ADP para formar ATP. O fosfato restante é também rearranjado para formar outra ponte de fosfato de alta energia que é transferida ao ADP. Como há dois moles de triose fosfato formados, o resultado da fase de geração de ATP é de quatro ATPs e dois NADH. O resultado é uma produção global de dois moles de ATP, dois moles de NADH e dois moles de piruvato por mol de glicose. Reação 6: Gliceraldeído 3-fosfato desidrogenase Na primeira reação desta fase, a número 6 no seguimento da fase anterior, cada gliceraldeído-3-fosfato é oxidado (desidrogenado) pelo NAD+ (e o NAD+ passa a NADH) e fosforilado por um fosfato inorgânico, dando origem a 1,3-Bifosfoglicerato (1,3 BPG). Esta reação é catalisada pela enzima gliceraldeído 3-fosfato desidrogenase. Reação 7: Fosfogliceratocinase Na reação 7, catalisada pela enzima 1,3 BiP glicerato cinase, a 1,3 BPG transfere um grupo fosfato para uma molécula de ADP dando origem a uma molécula de ATP e a 3-fosfoglicerato. Esta é a primeira etapa da glicólise que sintetiza ATP diretamente na via. Reação 8: Fosfogliceratomutase Na reação 8, a enzima fosfogliceromutase reaposiciona a posição do grupo fosfato 3- Fosfoglicerato, dando origem a 2-fosfoglicerato (grupo fosfato ligado ao carbono 2), preparando o substrato para a próxima reação. Reação 9: enolase A reação 9 é uma reação de desidratação catalisada pela enzima enolase. O 2fosfoglicerato é desidratado formando uma molécula de água e fosfoenolpiruvato (PEP), um composto altamente energético. Foi devido a esta configuração energética que o grupo fosfato foi transferido da posição 3 para 2 na reação anterior. Reação 10: piruvato cinase A reação 10, última desta via metabólica, catalisada pela enzima piruvato cinase, há transferência do grupo fosfato do fosfoenolpiruvato para uma molécula de ADP, formando-se então uma molécula de ATP e piruvato. Tendo em conta que por cada molécula de gliceraldeído-3-fosfato produz-se duas moléculas de ATP, na glicólise são produzidos ao todo 4 ATPs e gastos 2. O saldo energético é de 2 moléculas de ATP e 2 NADH por molécula de glicose. Estruturas dos componentes da glicólise representadas através de projeções de Fischer e do modelo poligonal Os intermediários da glicólise apresentados utilizando projeções de Fischer mostram as mudanças químicas passo a passo. Essa imagem pode ser comparada à representação através do modelo poligonal. Outra comparação de projeções de Fischer e o modelo poligonal na glicólise é mostrado em vídeo. Estrutura dos componentes da glicólise anaeróbia mostradas utilizando projeções de Fischer, à esquerda, e modelo poligonal, à direita. Os compostos correspondem à glicose (Glu), glicose 6-fosfato (G6P), frutose 6-fosfato (F6P), frutose 1,6-bifosfato (F16BP), dihidroxicetona fosfato (DHAP), gliceraldeído 3-fosfato (GA3P), 1,3bifosfoglicerato (13BPG), 3-fosfoglicerato (3PG), 2-fosfoglicerato (2PG), fosfoenolpiruvato (PEP), piruvato (Pir) e lactato (Lac). As enzimas que participam dessa via metabólica estão indicadas pelos números sublinhados, e correspondem à hexoquinase (1), glicose 6-fosfato isomerase (2), fosfofrutoquinase-1 (3), frutosebifosfato aldolase (4), triose fosfato isomerase (5), gliceraldeído 3-fosfato desidrogenase (6), fosfoglicerato quinase (7), fosfoglicerato mutase (8), fosfopiruvato hidratase (enolase) (9), piruvato quinase (10) e lactato desidrogenase (11). As coenzimas participantes (NAD+, NADH + H+, ATP e ADP), fosfato inorgânico, H2O e CO2 foram omitidos nessas representações. As reações de fosforilação a partir de ATP, assim como as reações de fosforilação do ADP na parte mais final da glicólise são mostradas como “~P”, respectivamente entrando ou saindo na via metabólica. As reações de oxirredução usando NAD+ ou NADH são observadas como hidrogênios “2H” saindo ou entrando na via metabólica. Após a glicólise Ciclo de Krebs (ou ciclo do ácido cítrico) Para o ciclo da glicose interagir com o ciclo de Krebs, há uma reação intermediária a qual transforma-se o Piruvato em Acetil-CoA. Nesta etapa, ocorre a entrada de NAD e CoA-SH. O Piruvato gerado na glicólise sofre desidrogenação (oxidação) e descarboxilação catalisado pelo complexo Piruvato desidrogenase. Durante essas reações, é adicionada a coenzima A(CoA). Desta forma, a partir de cada piruvato, produz-se um acetil-CoA. Esta etapa é fundamental, principalmente no fígado, que regula a glicemia no sangue, pois é irreversível. O piruvato, pode ser transformado novamente em glicose, através do gasto de energia, num processo chamado gliconeogênese, processo essencial para manutenção do nível mínimo de glicose no corpo, sem o qual certos tecidos morreriam, por não realizarem o ciclo de Krebs. Uma vez transformado em acetil-CoA, não há como gerar glicose novamente, sendo este acetil-CoA usado para produzir energia (com oxigênio), corpos cetônicos, gordura, colesterol ou isoprenóides. Quando usado para produzir energia, o acetil-CoA vai para o ciclo de Krebs, onde será oxidado, produzindo CO2, água e GTP(energia). Os produtos da oxidação são oxidados pelo oxigênio na Fosforilação oxidativa, gerando ainda mais energia. Somado com a glicólise, são produzidos 38 ATP por molécula de glicose. Fermentação Anaeróbica A fermentação ocorre quando, após a glicólise, não é realizado o ciclo de Krebs, porque o organismo em questão não o possui ou porque esta via está bloqueada, como durante a hipóxia (falta de oxigênio). Em ambos os casos, a glicólise gasta NAD+ e produz NADH. Como a quantidade de NADH na célula é limitada, este deve ser regenerado a NAD+. Para isso, alguma molécula deve receber estes elétrons que o NADH carrega. Na respiração aeróbica, o oxigênio recebe estes elétrons, mas na ausência de oxigênio, o produto da glicose piruvato , ou seus derivados, recebem estes elétrons. No caso do ser humano, outros animais e algumas bactérias, a ausência de oxigênio suficiente leva a reação do NADH com o piruvato, gerando NAD+ e ácido láctico (Fermentação láctica). No caso das leveduras e bactérias do gênero Zymonas, ocorre a Fermentação alcoólica: o piruvato é descarboxilado, gerando acetaldeído, através da enzima piruvato descarboxilase (ausente em animais), e o NADH reduz o acetaldeído, produzindo NAD+ e etanol (como nos processos fermentativos do pão, dos vinhos e das cervejas). Alguns microorganismos fermentam produzindo outras variadas substâncias, como nos estudos de Chaim Weizmann, primeiro presidente de Israel (produzindo acetona), ou usando outros aceptores de elétrons que não o oxigênio, como nitrato, sulfato, íons férricos, etc.. Outras vias da oxidação da glicose Grande parte da glicose consumida nos tecidos animais é catabolizada através da glicólise até piruvato. A maior parte do piruvato por sua vez é oxidado através do ciclo do ácido cítrico. A função principal do catabolismo da glicose por esta via é gerar ATP. Porém, existem outras vias catabólicas que podem ser o destino da glicose. Estas vias constituem parte do metabolismo secundário da glicose e levam a produtos especializados necessários para a célula, sendo que duas destas vias produzem pentoses fosfato, D-glicuronato, importante na detoxificação e na excreção de compostos orgânicos estranhos, e o ácido ascórbico (vitamina C). A via das pentoses fosfato resulta em oxidação e descarboxilação na posição C-1 da glicose, produzindo NADPH, que fornece poder redutor para reações de biossíntese, e pentoses fosfato, que são componentes essenciais dos nucleotídeos e ácidos nucleicos. [01:16, 21/08/2021] Regina: Ciclo de Krebs O ciclo de Krebs, tricarboxílico ou do ácido cítrico, também referido como ciclo dos ácidos tricarboxílicos (em inglês, TCA), é uma série de reações químicas que ocorrem na vida da célula e seu metabolismo foi descrito pelo bioquímico alemão Hans Adolf Krebs. Um esquema que demonstra a via metabólica do ciclo de Krebs O ciclo é executado na matriz da mitocôndria dos eucariontes e no citoplasma dos procariontes. Trata-se de uma parte do metabolismo dos organismos aeróbicos (utilizando oxigênio da respiração celular); organismos anaeróbicos utilizam outro mecanismo, como a fermentação lática, onde o piruvato é o receptor final de elétrons na via glicolítica, gerando lactato. O ciclo de Krebs é uma rota anfibólica, ou seja, possui reações catabólicas e anabólicas, com a finalidade de oxidar a acetil-CoA (acetil coenzima A), que se obtém da degradação de carboidratos, ácidos graxos e aminoácidos a duas moléculas de dióxido de carbono (CO2). Este ciclo inicia-se quando o piruvato que é sintetizado durante a glicólise é transformado em acetil CoA (coenzima A) por acção da enzima piruvato desidrogenase. Este composto vai reagir com o oxaloacetato que é um produto do ciclo anterior formando-se citrato. O citrato vai dar origem a um composto de cinco carbonos, o alfa-cetoglutarato com libertação de NADH2, e de CO2. O alfacetoglutarato vai dar origem a outros compostos de quatro carbonos com formação de GTP, FADH2 e NADH e oxaloacetato. Após o ciclo de Krebs, ocorre outro processo denominado fosforilação oxidativa. Características O ciclo do ácido cítrico começa com a quebra de carboidratos, aminoácido e ácidosgraxos em Acetil-CoA (2 carbonos), se misturando ao ácido oxalacético(4 carbonos)e dando origem ao ácido cítrico com 6 carbonos, o ácido cítrico perde um carbono e um hidrogênio, o carbono se perde no meio e o hidrogênio e incorporado pelo NAD (nicotinamida adenina dinucleotídio) que vira NADH, o antes ácido cítrico vira ácido alfa-cetoglutário com 5 carbonos, novamente perde um carbono e um hidrogênio, o carbono se perde no meio e o hidrogênio é incorporado pelo NAD que vira NADH, o antes ácido-alfacetoglutário vira Sucinil COA com 4 carbonos, não podendo mais perder carbono o sucinil libera o COA que o conduziu até ali, nesse estágio do ciclo já essa possível transformar ADP ( adenosina difosfato) em ATP (adenosina trifosfato) que é a energia da célula. Depois da produção de energia o sucinil COA vira ácido sucinico com 4 carbonos, já não podendo perder carbonos, ele perde duas moléculas de hidrogênio, o FAD ( flavina adenina dinucleotídio) incorpora, pelo fato de o NAD só poder incorporar 1 molécula, e o então FAD vira FADH2, e o até então ácido sucinico vira ácido málico com 4 carbonos, não podendo mais perder carbono, é liberado 1 molécula de hidrogênio, o NAD incorpora e vira NADH, perdendo essa molécula de hidrogênio ele vira ácido oxalacético novamente para iniciar o ciclo outra vez. O citrato então passa por uma série de transformações químicas, perdendo dois grupos carboxila na forma de CO2. Os carbonos liberados na forma de CO2 são oriundos do oxaloacetato, e não diretamente do Acetil-CoA. Os carbonos doados pelo Acetil-CoA se tornam parte do oxaloacetato após o primeiro passo do ciclo do ácido cítrico. A transformação dos carbonos doados pelo Acetil-CoA em CO2 requer vários passos no ciclo de Krebs. No entanto, por causa do papel do ácido cítrico no anabolismo (síntese de substâncias orgânicas), ele pode não ser perdido já que muitas substâncias intermediárias do ciclo também são usadas como precursoras para a biossíntese em outras moléculas. A maior parte da energia disponível graças ao processo oxidativo do ciclo é transferida por elétrons altamente energéticos que reduzem o NAD+, transformando- o em NADH. Para cada grupo acetila que entra no ciclo de Krebs, três moléculas de NADH são produzidas (o equivalente a 2,5 ATPs). Elétrons também são transferidos ao receptor Q, formando QH2. No final de cada ciclo, o Oxoalocetato de quatro carbonos é regenerado, e o processo continua sucessivamente. São produzidas 38 moléculas de ATP. Via metabólica do ciclo de Krebs Dois carbonos são oxidados, tornando-se CO2, e a energia dessas reações é armazenada em GTP, NADH e FADH2. NADH e FADH2 são coenzimas (moléculas que ativam ou intensificam enzimas) que armazenam energia e são utilizadas na fosforilação oxidativa. Mais informação: Passo, Substrato ... Passo Substrato Enzima Tipo da reação Reagentes/ Coenzimas Produtos/ Coenzimas 1 Oxaloacetato Citrato sintase Condensação Acetil CoA + H2O CoA-SH 2 Citrato Aconitase 3 Isocitrato 4 Oxalosuccinato Desidratação/Hidratação H2O H2O Isocitrato desidrogenase Oxidação NAD+ NADH + H+ Isocitrato desidrogenase Decarboxilação H+ CO2 5 α-Cetoglutarato oxidativa NAD+ + CoA-SH NADH + H+ α-Cetoglutarato desidrogenase Decarboxilação + CO2 6 Succinil-CoA substrato GDP + Pi Succinil-CoA sintetase Fosforilação ao nível GTP + CoA-SH 7 Succinato Succinato desidrogenase Oxidação FAD FADH2 do Adição (H2O) 8 Fumarato Fumarase 9 L-Malato Malato desidrogenase H2O Oxidação NAD+ NADH + H+ As principais etapas do ciclo de Krebs Oxalacetato (4 átomos de carbono) a Citrato (6 C): O ácido acético proveniente das vias de oxidação de glícidos, lípidos e proteínas, combinam-se com a coenzima a formando o Acetil - CoA. A entrada deste composto no ciclo de Krebs ocorre pela combinação do ácido acético com o oxalacetato presente na matriz mitocondrial. Esta etapa resulta na formação do primeiro produto do ciclo de Krebs, o citrato. O coenzima A, sai da reação como CoASH. Citrato (6 C) a Isocitrato (6 C): O citrato sofre uma desidratação originando o isocitrato. Esta etapa acontece para que a molécula de citrato seja preparada para as reações de oxidação seguintes Isocitrato (6 C) a αcetoglutarato (5 C): Nesta reação há participação de NAD, onde o isocitrato sofre uma descarboxilação e uma desidrogenação transformando o NAD em NADH, liberando um CO2 e originando como produto o alfa-cetoglutarato αcetoglutarato (5 C) a Succinil - CoA (4 C): O α-cetoglutarato sofre uma descarboxilação, liberando um CO2. Também ocorre uma desidrogenação com um NAD originando um NADH, e o produto da reação acaba sendo o Succinato Succinil - CoA (4 C) a Succinato (4 C): Nesta reação houve entrada de GDP+Pi, e liberação de CoA-SH. O succinil-CoA libera grande quantidade de energia quando perde a CoA, originando succinato. A energia liberada é aproveitada para fazer a ligação do GDP com o Pi(fosfato inorgânico), formando o GTP, como o GTP não é utilizado para realizar trabalho deve ser convertido em ATP, assim esta é a única etapa do Ck que forma ATP. Succinato (4 C) a Fumarato (4 C): Nesta etapa entra FAD. O succinato sofre oxidação através de uma desidrogenação originando fumarato e FADH2. O FADH2 é formado a partir da redução do FAD. Fumarato (4 C) a Malato (4 C): O fumarato é hidratado formando malato. Malato (4 C) a Oxalacetato (4 C): Nesta etapa entra NAD. O malato sofre uma desidrogenação originando NADH, a partir do NAD, e regenerando o oxalacetato. Estruturas dos intermediários através de projeções de Fischer e do modelo poligonal Os intermediários do Ciclo de Krebs apresentados segundo projeções de Fischer mostram as mudanças químicas passo a passo. Essa imagem pode ser comparada à representação através do modelo poligonal. Outra comparação de projeções de Fischer e o modelo poligonal no Ciclo de Krebs é mostrado em vídeo. Estruturas doyjjys intermediários do ciclo do ácido cítrico mostradas utilizando projeções de Fischer, à esquerda, e modelo poligonal, à direita. Dois carbonos correspondentes ao grupo acetil na forma ativada na acetil-CoA (AcoA), parte superior da figura, condensam com a molécula de quatro carbonos oxalacetato (OxA) para formar citrato (Cit). Os próximos intermediários são, respectivamente, cis-aconitato (CisA), isocitrato (IsoC), oxalosuccinato (OxS), alfacetoglutarato (AKG), succinil-CoA (ScoA), succinato (Suc), fumarato (Fum), malato (Mal), e assim o oxalacetato é regenerado. O processo pode ser acompanhado em maior detalhe, com os dois carbonos do grupo acetil da acetil-CoA mostrados em azul sendo incorporados, de citrato a succinil-CoA, sendo que então não é mais possível distinguir esses carbonos incorporados, pois o succinato é uma molécula simétrica. As enzimas envolvidas nessa rota metabólica correspondem a citrato sintase (1), aconitase (2), isocitrato desidrogenase (3), alfacetoglutarato desidrogenase (4), succinil-CoA sintetase (5), succinato desidrogenase (6), fumarase (7), e malato desidrogenase (8). Coenzimas (CoA-SH, NAD+, NADH + H+, FAD, FADH2, ATjyP jyor GTP and ADP or Gjyjyj CO2 e H2O foram omitidas nessas representações. As produções de NADH e FADH2 das formas oxidadas dessas coenzimas são representadas, respectivamente, como “2H” e “[2H]” liberados no decorrer da via metabólica. A produção de ATP ou GTP de ADP ou GDP é mostrada pela liberação de fosfato de alta energia “~P”. O ciclo de Krebs e a respiração A influência do ciclo de Krebs no processo da respiração celular começa com a glicólise, processo ocorrido no citoplasma de uma célula, onde a glicose, obtida através dos alimentos ingeridos, passa por uma série de dez reações químicas que culminam na formação de duas moléculas de ácido pirúvico. É a partir desse ponto que começa a participação do ciclo de Krebs na respiração propriamente dita. O ciclo de Krebs ocorre dentro da mitocôndria, logo as moléculas de ácido pirúvico têm que entrar nela. Esse processo só ocorre quando há moléculas de oxigênio suficientes para cada molécula de glicose; se há, na entrada do ácido pirúvico na mitocôndria faz com que o oxigênio reaja com o ácido formando gás carbônico e libera os elétrons dos átomos de hidrogênio presentes na fórmula da glicose.Esses elétrons são transportados pelo NADH e o FADH, duas moléculas transportadoras. Os elétrons então se responsabilizam pela união de mais um átomo de fósforo, com uma molécula de adenosina difosfato (ADP) formando a adenosina trifosfato, o ATP. Esta molécula de ATP então é que fornecerá a energia para a vida da célula e o transporte ativo de substâncias pelo corpo. Função anabólica do ciclo de Krebs Os compostos intermediários do ciclo de Krebs podem ser utilizados como precursores em vias biossintéticas: oxaloacetato e α-cetoglutarato vão formar respectivamente aspartato e glutamato. A eventual retirada desses intermediários pode ser compensada por reações que permitem restabelecer o seu nível. Entre essas reações, que são chamadas de anapleróticas por serem reações de preenchimento, a mais importante é a que leva à formação de oxaloacetato a partir do piruvato e que é catalisada pela piruvato carboxilase. O oxaloacetato além de ser um intermediário do ciclo de Krebs, participa também da gliconeogênese. A degradação de vários aminoácidos também produz intermediários do ciclo de Krebs, funcionando como reações anapleróticas adicionais. Regulação do ciclo do ácido cítrico O ciclo do ácido cítrico para o fluxo de átomos de carbono do piruvato e o regula em dois níveis: a conversão de piruvato em acetil-CoA, o material inicial do ciclo (a reação do complexo do piruvato desidrogenase), e a entrada de acetil-CoA no ciclo (a reação da citrato sintase. Como o piruvato não é a única fonte de acetil-CoA (a maioria das células pode obter acetil-CoA pela oxidação dos ácidos graxos e de certos aminoácidos), a possibilidade de obtenção de intermediários dessas outras vias é muito importante na regulação da oxidação do piruvato e do ciclo do ácido cítrico. O ciclo também é regulado na altura da reação da isocitrato desidrogenase e na reação da α-cetoglutarato desidrogenase Cadeia respiratória Cadeia respiratória ou cadeia transportadora de elétrons é uma das etapas da respiração celular, que se caracteriza pelo transporte de elétrons em uma compilação de moléculas fixadas na membrana interna da mitocôndria de células eucarióticas até um aceptor final de elétrons, em várias etapas liberadoras de energia para síntese de ATP (adenosina trifosfato). Em organismos procariotos aeróbios, essas moléculas residem na membrana plasmática. A cadeia de transporte eletrônico na mitocôndria é o local onde ocorre a fosforilação oxidativa em eucariontes. O NADH e succinato produzidos no ciclo dos ácidos tricarboxílicos são oxidados, libertando-se energia utilizável pela ATP sintase. História Peter Mitchell (1920-1992) foi o responsável por uma das mudanças em termos de paradigma mais consideráveis na bioquímica. Com seu trabalho ele trouxe a hipótese da quimiosmótica, que conectou o transporte biológico de elétrons à síntese do ATP. Ele era em síntese um bioquímico teórico, apesar de ter gerado dados experimentais para apoiar sua teoria. A ideia da cadeia respiratória foi formulada por David Keilin em Cambridge, pelo qual Mitchell se interessou já que ele era atraído pela ideia da compartimentalização nas células vivas e pelo aspecto vetorial (ou de mão única) dos processos metabólicos. Ele raciocinava que deveriam existir enzimas que, como os transportadores, convertiam um substrato de um lado da membrana em produto do outro lado. Utilizando evidências de outros cientistas a respeito da formação de um gradiente de pH pela cadeia respiratória, Mitchell explicou como esse gradiente impulsionava a síntese de ATP, propondo em seu artigo original, em 1961, que a cadeia respiratória associada às cristas mitocondriais gerava uma força próton-motiva, em consequência da diferença elétrica e de pH, por meio da membrana. Essa força impulsionava uma ATPase, trabalhando no sentido contrário, catalisando a condensação do fosfato com o ADP, formando ATP. Sua hipótese obteve grande resistência por parte de outros bioquímicos, primeiramente por ser um conceito teórico sem evidências experimentais diretas e em segundo lugar, porque o estudo da cadeia respiratória e da fosforilação oxidativa era dominado por poucos e poderosos laboratórios, que não tinha inclinação ao surgimento de novas teorias. Os estudos da epóca, desde 1940, centravam-se nas atividades das enzimas solúveis e as teorias predominantes sobre a conexão entre o transporte de elétrons e a síntese de ATP, focavam-se em um composto fosforilado, como sendo um intermediário de alta energia. Fritz Lipmann propôs que um grupo fosfato de alta energia poderia se ligar a algum componente da cadeia respiratória. Essa hipótese foi aperfeiçoada, mais tarde, envolvendo um intermediário fosforilado solúvel. A busca por esse composto durou 20 anos, gerando gasto de tempo e dinheiro por parte de alguns pesquisadores relutantes a proposta de Mitchell. Uma terceira teoria envolvia o transporte de elétrons acoplado à síntese de ATP, por meio de mudanças conformacionais proteicas, com o gradiente de pH, apresentado com um subproduto do processo. Somente após 10 anos da sua publicação, Mitchell conseguiu um apoio significativo. Durante esse período de grandes debates, Mitchell adoeceu e se mudou para a Cornuália e lá reformou um casarão, do qual parte se tornou um laboratório privado conhecido como “Glnn Research”, financiado pela fortuna de sua família. Foi nesse local, onde ele e sua colaboradora de toda a vida, Jennufer Mayle, conseguiram evidências experimentais para apoiar a quimiosmótica. Por fim, sua teoria foi confirmada por outros bombeamento de pesquisadores, que prótons por demonstraram componentes a mitocondriais atividade de purificados, resconstituídos em lipossomos. Mitchell ganhou o Prêmio Nobel de Química, em 1978, mas é importante enfatizar que Mitchell se recusava em alterar qualquer uma de suas ideias, e por muitos anos ele se recusou a reconhecer o bombeamento de prótons, propondo um mecanismo denominado “alça redox”. Além disso ele nunca largou sua crença de que os prótons participavam diretamente na fosforilação do ADP no sítio ativo da ATP-sintase. Local onde ocorre As mitocôndrias possuem uma membrana externa que é permeável a maioria dos metabólitos, que conta com a presença de diversas enzimas, das quais incluí-se a acil-CoA sintetase e a glicerolfosfato aciltransferase e outra membrana interna que tem permeabilidade seletiva, que envolve uma matriz, nela estão presentes o fosfolípideo cardiolipina, as enzimas da cadeia respiratória, à ATP-sintase e vários transportadores de membrana. Componentes da cadeia respiratória Os elétrons removidos do substrato (glicose, por exemplo) são passados a um carregador de elétrons, uma coenzima chamada de NAD+ (Dinucleótideo de nicotinamina e adenina), que é um derivado da vitamina niacina, funcionando como um agente oxidante durante as etapas anteriores da respiração, que é reduzido a NADH ao receber o par de elétrons e dois prótons do substrato. Esses elétrons removidos serão transportados pelo NADH ao “topo”, extremidade de alta energia da cadeia respiratória, que seguirá até a parte “inferior” da cadeia, que é a extremidade de baixa energia, onde encontrará o aceptor final de elétrons. Dessa forma, temos que o fluxo de elétrons na cadeia respiratória é realizado por intermédio de um espectro redox do NAD+/NADH para O2/H2O, passando por três grandes complexos proteicos. São eles o NADH-Q oxidorredutase (Complexo I), nele os elétrons são transferidos do NADH para a coenzima Q (Q), conhecida como ubiquinona, o Q-citocromo e c-oxidorredutase (Complexo III), que transfere os elétrons adiante para o citocromo c e o citocromo c-oxidase (Complexo IV), completando a cadeia, onde os elétrons são transferidos para o O2, que é reduzido para H2O. Determinados substratos com potencial redox mais positivos que o NAD+/NADH, como por exemplo o succinato, passam os elétrons do Complexo I para a coenzima Q, por meio de um quarto complexo, o succinato-Q redutase (Complexo II). Todos os complexos estão localizados na membrana interna da mitocondria, porém a coenzima Q, difunde-se rapidamente dentro na membrana e o citocromo c, é uma proteína solúvel, portanto ambos são móveis. Esse fluxo de elétrons pelos Complexos I, III e IV, tem como resultado o bombeamento de prótons a partir da matriz, por intermédio da membrana mitocondrial interna para o interior do espaço intermembranas. O aumento da concentração de H+ no espaço intermembranar promoverá a difusão dos prótons de volta ao interior da mitocôndria, por canais proteicos específicos, as sintetases de ATP, promovendo a fosforilação de ADP em ATP. Energia liberada Se compararmos a reação exergônica, de etapa única, do hidrogênio com o oxigênio, formando água, temos uma grande quantidade de energia na forma de calor e luz sendo liberada numa explosão. No caso da respiração celular, essa mesma reação ocorre, contudo em etapas ou passos, onde essa cadeia transportadora de elétrons freia a “queda” dos elétrons durante várias etapas, num movimento em cascata de uma molécula carreadora para a seguinte, em uma série de reações redox, na qual pequenas quantidades de energia são liberadas por etapa, até alcançarem o oxigênio, que é o aceptor final de elétrons, que tem grande afinidade por elétrons. Isso permite que haja o armazenamento de parte dessa energia liberada, de forma que possa ser utilizada na produção de ATP e parte seja liberada na forma de calor. Nessa transferência de elétrons iniciada pelo NADH há uma mudança de energia livre na ordem de -53 kcal, equivalente a -222 kJ/mol É importante enfatizar que cada carreador do nível “mais baixo”, é mais eletronegativo, que o anterior, tendo em consequência uma maior “capacidade” oxidativa que o carreador do nível “superior” anterior. Há portanto, uma queda no gradiente de energia na cadeia transportadora de elétrons, até uma posição mais estável no átomo de oxigênio eletronegativo. Uma analogia possível é a de que o oxigênio puxa os elétrons cadeia abaixo, promovendo uma queda produtora de energia, de forma análoga à ação da gravidade. Doenças relacionadas a cadeia respiratória A maioria das doenças mitocondriais, considerando as mais comuns e estudadas são aquelas que afetam a cadeia respiratória. Essas doenças são classificadas geneticamente por três tipos: Aparecimento esporádico (por rearranjos do DNAmt - duplicações ou deleções); Herança materna (tipicamente por mutações de ponto no DNAmt); Herança mendeliana (tipicamente por defeitos do DNA nuclear). Aparecimento esporádico São as Síndrome de Kearns-Sayre (SKS), Oftalmoplegia externa crônica progressiva (OECP) e Síndrome de Pearson. A variante mais grave é a síndrome de KearnsSayre (SKS). Alguns indivíduos possuem uma forma atípica da doença, conhecida como Síndrome de Pearson. Todas essas variantes são causadas pela deleção ou duplicação do DNAmt, acarretando prejuízos a cadeia respiratória. Herança Materna Epilepsia mioclônica e miopatia com RRF (MERRF), Encefalomiopatias mitocondriais, acidose láctica e episódios similares a acidentes vasculares cerebrais (MELAS), doença de Leigh e neuropatia, ataxia, retinite pigmentosa (NARP), Neuropatia óptica hereditária de Leber (LHON). A doença de Leigh está associada a anormalidades nos nervos cranianos, disfunção respiratória, retinopatia pigmentosa e ataxia. Duas mutações do DNAmt são as mais importantes causas da NARP, a T8993G ou a T8993 no gene da ATPase 6. No caso, a mutação T8993G é a mais freqüente e causa a substituição do aminoácido leucina por arginina na cadeia polipeptídica da ATPase 6, gerando uma disfunção na síntese de ATP. A LHON é caracterizada pela perda da acuidade visual central, indolor e de instalação aguda ou subaguda, ocorrendo usualmente dos 12 aos 30 anos de idade. A mutação mais comum dessa doença é a A11778G, que modifica um gene de uma das subunidades protéicas do Complexo I da cadeia respiratória (ND4). Essa mutação causa a troca do aminoácido arginina por histidina na posição 340 da cadeia polipeptídica codificada por esse gene. Herança mendeliana As doenças mitocondriais causadas por herança mendeliana são as de maiores efeitos na cadeia respiratória, pois o DNA nuclear (DNAn) é o responsável pela síntese de 85% das proteínas da cadeia respiratória, enquanto o DNAmt é responsável por apenas 15% da síntese proteica. Sendo assim, as doenças mitocondriais de aparecimento esporádico e por herança materna, afetam apenas 15% da síntese proteica já que estão relacionadas a rearranjos, duplicações, deleções ou mutações de ponto do DNAmt. Fosforilação oxidativa A fosforilação oxidativa é uma via metabólica que utiliza energia libertada pela oxidação de nutrientes de forma a produzir trifosfato de adenosina (ATP). O processo refere-se à fosforilação do ADP em ATP, utilizando para isso a energia libertada nas reacções de oxidação-redução. A cadeia de transporte electrónico na mitocôndria é o local onde ocorre a fosforilação oxidativa em eucariontes. O NADH e succinato produzidos no ciclo dos ácidos tricarboxílicos são oxidados, libertando-se energia utilizável pela ATP sintase. Durante a fosforilação oxidativa, existe transferência de electrões de doadores electrónicos (moléculas redutoras) a aceitadores electrónicos (moléculas oxidantes), tais como o dioxigénio, numa reação de oxido-redução. As transferências de eletrões constituem estas reações de oxido-redução, que se processam com libertação de energia, biologicamente aproveitável para a biossíntese de ATP. Em eucariontes, tais reações redox são feitas por cinco complexos principais de proteínas mitocondriais, enquanto que em procariontes, diferentes proteínas localizam-se na membrana interna da célula, dependendo o tipo de enzima utilizado dos aceitadores e doadores electrónicos. Ao conjunto de complexos proteicos envolvidos nestas reações chama-se cadeia de transporte electrónico. A energia derivada do transporte de electrões é convertida numa força motriz protónica e é principalmente utilizada para bombear protões para o exterior da matriz mitocondrial. Este processo é denominado quimiosmose e origina energia potencial sob a forma de um gradiente de pH (ou seja, uma concentração diferente de protões dentro e fora da mitocôndria) e de potencial elétrico através da membrana. A energia é utilizada ao permitir-se o fluxo de protões a favor do gradiente de concentração através da enzima ATP sintase. Embora a fosforilação oxidativa seja uma parte vital do metabolismo, produz espécies reactivas de oxigénio tais como o superóxido e o peróxido de hidrogénio, que induzem a propagação de radicais livres, danificando componentes celulares (por exemplo, oxidando proteínas e lípidos de membrana) e contribuindo para processos de envelhecimento celular e patologias. Existem também diversos venenos e medicamentos que têm como alvo as enzimas desta via metabólica, inibindo a sua atividade. História O campo de estudo da fosforilação oxidativa iniciou-se em 1906, com a divulgação por Arthur Harden de um papel vital do fosfato na fermentação celular, embora fossem conhecidos apenas então fosfatos de açúcares. A ligação entre a oxidação de açúcares e a síntese de ATP foi firmemente estabelecida no início da década de 1940 do século XX por Herman Kalckar, confirmando-se o papel central do ATP na transferência de energia proposto por Fritz Albert Lipmann em 1941. Mais tarde, em 1949, Morris Friedkin e Albert L. Lehninger provaram que a coenzima NADH ligava vias metabólicas tais como o ciclo do ácido cítrico e a síntese de ATP. Durante as duas décadas seguintes permaneceu incógnito o mecanismo de produção do ATP, tendo havido a procura de um elusivo "intermediário de alta energia" que ligaria a oxidação às reacções de fosforilação. Este problema foi resolvido por Peter D. Mitchell com a publicação da teoria quimiosmótica em 1961. A proposta foi inicialmente controversa, mas foi lentamente aceite e Mitchell recebeu um prémio Nobel pelos seus estudos em 1978. A investigação que se seguiu neste campo concentrou-se na purificação e caracterização das enzimas desta via, havendo contribuições importantes por David Ezra Green nos complexos da cadeia de transporte electrónico e Efraim Racker na ATP sintase. Importantes passos em direcção à descoberta do mecanismo da ATP sintase foram dados por Paul D. Boyer com a sua proposta do mecanismo "ligação-modificação" em 1973 e de catálise envolvendo rotação em 1982. O trabalho mais recente no campo da fosforilação oxidativa inclui estudos estruturais das enzimas desta via por John E. Walker tendo Walker e Boyer recebido um prémio Nobel em 1997. A transferência de energia pela quimiosmose Embora as diversas formas de vida na Terra utilizem uma larga gama de nutrientes diferentes, quase todas usam a fosforilação oxidativa para produção de ATP, a molécula que fornece energia metabólica. Esta via é tão universal provavelmente por ser uma forma altamente eficiente de armazenar energia, comparando com processos alternativos de fermentação como a glicólise. A fosforilação oxidativa funciona utilizando reacções químicas exergónicas para dar energia a reacções endergónicas; os dois tipos de reacção dizem-se, neste caso, acoplados, ou seja, um não ocorre sem o outro. O fluxo de electrões através da cadeia de transporte electrónico, desde doadores electrónicos como o NADH a aceitadores de electrões como o oxigénio, é um processo exergónico, ou seja, liberta energia, enquanto que a síntese da ATP é endergónica e requer portanto energia. A variação de energia livre associada à transferência de electrões através de um dos três complexos corresponde a uma força motriz protónica capaz de fazer a síntese de ATP. Para cada NADH que se oxida, ou seja, para cada par de electrões transportado pelos complexos I, III e IV, há a síntese de três ATP. Tanto a cadeia de transporte electrónico como a ATP sintase se localizam numa membrana. A energia é transferida da cadeia de transporte electrónico para a ATP sintase pelo movimento de protões através da membrana, num processo denominado quimiosmose. Como a membrana interna da mitocôndria é impermeável a protões, estes só podem voltar à matriz e desfazer o gradiente através de sítios específicos da membrana interna. O transporte de protões através desta é feita pelos complexos I, III e IV. A ATP sintase utiliza a energia para sintetizar ATP a partir da fosforilação de difosfato de adenosina (ADP). Parte da enzima sofre uma rotação à medida que os protões passam por ela. Na prática, este processo é semelhante a um simples circuito eléctrico, existindo uma corrente de protões do lado negativo (N) da membrana para o lado positivo (P) provocada pela acção de enzimas da cadeia de transporte electrónico que bombeiam esses protões. Estas enzimas actuam como uma pilha, à medida que produzem trabalho circulando corrente através do circuito. O movimento de protões cria um gradiente electroquímico através da membrana, muitas vezes designada como força motriz protónica. Este gradiente tem duas componentes: uma diferença na concentração de protões (gradiente de pH) e uma diferença no potencial eléctrico, tendo o lado N uma carga negativa. A energia é armazenada principalmente sob a forma de uma diferença de potenciais eléctricos nas mitocôndrias e sob a forma de gradiente de pH nos cloroplastos. A ATP sintase liberta esta energia armazenada ao completar o circuito e permitir o fluxo de protões ao longo do potencial electroquímico, de volta ao lado N da membrana. Esta enzima actua como um motor eléctrico, ao usar a força motriz protónica para fornecer energia à rotação de parte da sua estrutura e acoplar este movimento à síntese de ATP. A quantidade de energia libertada pela fosforilação oxidativa é alta, comparando-se com a quantidade de energia produzida pela fermentação anaeróbia. A glicólise produz apenas duas moléculas de ATP, enquanto que a fosforilação oxidativa produz, a partir de dez moléculas de NADH e duas de succinato, 26 moléculas de ATP, comparando-se a conversão de uma molécula de glicose a dióxido de carbono e água. Este rendimento de ATP é o valor máximo teórico; na prática, alguns protões passam também através da membrana, baixando o rendimento de produção de ATP. Moléculas de transferência de protões e electrões Redução da coenzima Q a partir da sua forma de ubiquinona (Q, cima) à forma totalmente reduzida ubiquinol (QH2, em baixo). A cadeia de transporte eletrónico transporta protões e electrões, mediando a passagem de electrões de doadores reduzidos a aceitadores electrónicos e transportando protões através da membrana. Estes processos tanto usam moléculas solúveis como grupos ligados a proteínas. Nas mitocôndrias, os electrões são transferidos dentro do espaço intermembranar pela proteína de transporte electrónico citocromo c, que, por ser hidrossolúvel, pode circular no espaço intermembranar. O citocromo c transporta apenas electrões, através da oxirredução de um ião de ferro localizado num grupo hemo pertencente à estrutura da proteína. Também se encontra citocromo c nalgumas bactérias, localizando-se no espaço periplasmático. Na membrana mitocondrial interna, a coenzima Q10 (Q), um transportador electrónico lipossolúvel, transporta não só electrões mas também protões, usando um ciclo redox. Esta pequena molécula de benzoquinona é muito hidrofóbica, podendo por isso difundir-se facilmente pela membrana. Quando Q aceita dois electrões e dois protões, passa à forma totalmente reduzida ubiquinol (QH2); quando QH2 liberta dois protões e dois elecrões, volta ao estado ubiquinona (Q). Como resultado, se duas enzimas estão dispostas de modo que Q seja reduzido de um lado da membrana e QH2 seja oxidado no outro lado, a ubiquinona acoplará estas reacções e transportará protões através da membrana. Algumas cadeias de transporte electrónico bacterianas usam quinonas diferentes, tais como a menaquinona (ou vitamina K), além da ubiquinona. Dentro de proteínas, os electrões são transferidos entre cofactores flavínicos, centros de ferro-enxofre e citocromos. Existem diversos tipos de centros ferroenxofre. O tipo mais simples que se encontra na cadeia de transporte electrónico é formado por dois átomos de ferro ligados entre si e por dois átomos de enxofre inorgânico (ou seja, não pertencente a cadeias laterais de aminoácidos), designando-se este tipo de centros [2Fe-2S]. O segundo tipo de centro ferro-enxofre é o [4Fe-4S], sendo similar a um cubo constituído por quatro iões de ferro e quatro de enxofre. Nos centros de ferro-enxofre, cada ião de ferro encontra-se coordenado também a um aminoácido, normalmente através do átomo de enxofre de uma cisteína. Os cofactores contendo metais sofrem reacções redox sem ligar ou libertar protões, pelo que servem apenas para transportar electrões na cadeia de transporte electrónico. Os electrões conseguem viajar distâncias relativamente grandes dentro das proteínas ao efectuar "saltos" entre as cadeias dos cofactores. Tal ocorre devido ao efeito de tunneling quântico, que é rápido através de distâncias inferiores a 14 Å. Cadeias de transporte electrónico em eucariontes Diversos processos bioquímicos catabólicos, tais como a glicólise, o ciclo dos ácidos tricarboxílicos e a beta-oxidação, produzem a coenzima NADH. Esta coenzima contém electrões que possuem um alto potencial de transferência (correspondente a um potencial de eléctrodo muito negativo), ou seja, ao acontecer a oxidação do NADH, é libertada grande quantidade de energia. No entanto, a célula não liberta esta energia de uma só vez, pois tal reacção poderia ser incontrolável. Os electrões são então removidos do NADH e transferidos para o dioxigénio através de uma série de passos catalisados por diferentes enzimas, em que cada passo liberta uma pequena quantidade de energia. Este conjunto de enzimas, designados complexos I, II, III e IV, constitui a cadeia de transporte electrónico e encontra-se na membrana interna da mitocôndria. O succinato é também oxidado pela cadeia de transporte electrónico, mas entra na via metabólica num ponto diferente. Em eucariontes, as enzimas neste sistema de transporte electrónico utilizam a energia libertada na oxidação do NADH para bombear protões através da membrana interna da mitocôndria. Esta acção causa a acumulação de protões no espaço intermembranar, originando um gradiente electroquímico através da membrana. A energia armazenada sob este potencial é então utilizada pela ATP sintase para produzir ATP. A fosforilação oxidativa mitocondrial é a mais bem compreendida; existem mitocôndrias em quase todos os eucariontes, exceptuando-se alguns protozoários anaeróbios como Trichomonas vaginalis, que reduzem os protões a hidrogénio molecular num organelo denominado hidrogenossoma, uma mitocôndria residual. NADH-coenzima Q oxidoredutase (complexo I) Complexo I ou NADH-Q oxidorredutase. As abreviaturas utilizadas encontram-se discutidas no texto. Em todos os diagramas de complexos respiratórios, a matriz mitocondrial situa-se em baixo e o espaço intermembranar em cima. A NADH-coenzima Q oxidorredutase, também conhecida como NADH desidrogenase ou complexo I, é a primeira proteína na cadeia de transporte electrónico. O complexo I é uma enzima de grandes dimensões; o complexo I de mamíferos possui 46 subunidades e uma massa molecular de cerca de mil quilodaltons. É conhecida apenas a estrutura detalhada do complexo de uma bactéria; na maioria dos organismos, o complexo aparenta ter a forma de uma bota com uma esfera projectando-se da membrana em direcção à matriz mitocondrial. Os genes que codificam as proteínas que fazem parte deste complexo encontram-se tanto no DNA nuclear como no genoma mitocondrial, tal como acontece com diversas outras enzimas presentes na mitocôndria. A reacção catalisada por esta enzima é a redução da coenzima Q10 (ou ubiquinona, representado por Q na equação abaixo) por dois electrões provindos do NADH. A coenzima Q10 é uma quinona lipossolúvel da membrana mitocondrial. O início da reação, e de toda a cadeia electrónica, consiste na ligação de uma molécula de NADH ao complexo I e a doação de dois electrões. Os electrões entram no complexo I através de um grupo prostético ligado ao complexo, o mononucleótido de flavina (FMN). A adição de electrões ao FMN converte este à sua forma reduzida, FMNH2. Os electrões são então transferidos através de diversos centros de ferroenxofre, o segundo tipo de grupo prostético encontrado no complexo. Existem centros [2Fe-2S] e [4Fe-4S] no complexo I. À medida que os electrões passam através deste complexo, quatro protões são bombeados da matriz mitocondrial para o espaço intermembranar. Não é bem conhecido o mecanismo exacto de como esta passagem ocorre, mas aparenta haver mudanças conformacionais no complexo I que provocam a ligação de protões ao lado N da membrana e os movimentam para o lado P. Por fim, os electrões são transferidos da cadeia de centros ferro-enxofre para uma molécula de ubiquinona na membrana. A redução da ubiquinona contribui também para a geração de um gradiente de protões, por haver retirada de dois protões da matriz na sua redução a ubiquinol (QH2).Este processo se tornou importante, pois, seres heterotróficos necessitam deste ciclo(terceira fase do processo de transformação química da glicose). Complexo II: Succinato-Q oxidorredutase. Succinato-Q oxidorredutase (complexo II) A succinato-Q oxidorredutase, também conhecida como complexo II, é um segundo ponto de entrada na cadeia de transporte electrónico. Tem a característica de ser a única enzima que participa tanto no ciclo dos ácidos tricarboxílicos como na cadeia de transporte electrónico. O complexo II consiste de quatro subunidades proteicas e um cofactor dinucleótido de flavina-adenina (FAD), centros de ferro-enxofre e um grupo hemo que não participa na transferência de electrões para a coenzima Q mas aparenta ser necessário para diminuir a produção de espécies reactivas de oxigénio. Oxida o succinato a fumarato e reduz a ubiquinona. Como esta reacção liberta menos energia que a oxidação do NADH, o complexo II não transporta protões através da membrana e não contribui para o gradiente de protões. Nalguns eucariontes, tais como o verme parasita Ascaris suum, existe uma enzima similar ao complexo II, a fumarato redutase (menaquiol:fumarato oxidorredutase, ou QFR) que opera de forma reversa, oxidando ubiquinol e reduzindo fumarato. Este processo permite ao parasita sobreviver no ambiente anaeróbio do intestino grosso, realizando fosforilação oxidativa anaeróbia usando fumarato como aceitador final de electrões. Outra função pouco convencional do complexo II é encontrada no parasita que causa a malária Plasmodium falciparum, em que a acção reversa do complexo II é importante na regeneração de ubiquinol, utilizado pelo parasita num tipo raro de biossíntese de pirimidina. Flavoproteína de transporte de electrões-Q oxidorredutase A flavoproteína de transporte de electrões-ubiquinona oxidorredutase (ETF-Q oxidorredutase), também conhecida como flavoproteína de transporte de electrões desidrogenase, é um terceiro ponto de entrada na cadeia de transporte electrónico. É uma enzima que aceita electrões da flavoproteína transportadora de electrões na matriz mitocondrial e os utiliza para reduzir a ubiquinona. Esta enzima contém uma flavina e um centro [4Fe-4S] mas, ao contrário de outros complexos respiratórios, liga-se à superfície da membrana e não atravessa a bicamada lipídica. Em mamíferos, esta via metabólica é relevante na beta-oxidação de ácidos gordos e no catabolismo de aminoácidos e colina, ao aceitar electrões de diversas acetil-CoA desidrogenases. Em plantas, a ETF-Q oxidorredutase é também importante nas respostas metabólicas que permitem a sobevivência durante longos períodos de escuridão. Os dois passos de transferência electrónica no complexo III: Q-citocromo c oxidorredutase. Após cada passo, Q (na parte superior da figura) deixa a enzima. Q-citocromo c oxidorredutase (complexo III) A Q-citocromo c oxidorredutase é também conhecida simplesmente como citocromo c redutase, complexo citocromo bc1, ou simplesmente complexo III. Em mamíferos, esta enzima é um dímero, em que cada subunidade é ela própria um complexo de 11 proteínas, um centro [2Fe-2S] e três citocromos (um citocromo c1 e dois citocromos b. Um citocromo é um tipo de proteína de transferência electrónica que contém pelo menos um grupo hemo. Os iões de ferro dos grupos hémicos do complexo III alternam entre o estado ferroso (reduzido, Fe2+) e férrico (oxidado, Fe3+), à medida que os electrões são transferidos através da proteína. O complexo III catalisa a oxidação de uma molécula de ubiquinol e a redução de duas moléculas de citocromo c, que consegue transportar apenas um electrão (ao contrário da coenzima Q, que pode transportar dois) Como apenas um dos electrões pode ser transferido em cada passo do doador QH2 para um citocromo aceitador, o mecanismo de reacção do complexo III é mais elaborado que aqueles de outros complexos respiratórios e ocorre em dois passos colectivamente designados "ciclo Q". No primeiro passo, a enzima liga três substratos: primeiro o QH2, que sofre oxidação, passando um electrão para o segundo substrato, o citocromo c, e dois protões para o espaço intermembranar. O terceiro substrato é Q, que aceita o segundo electrão de QH2, reduzindo-se ao radical Q.- (ubisemiquinona). Os primeiros dois substratos são libertados, enquanto que o intermediário ubisemiquinona permanece ligado. No segundo passo, liga-se uma segunda molécula de QH2, passando novamente um electrão a outro citocromo c. O segundo electrão é transferido para a ubisemiquinona, reduzindo-a a QH2 ao mesmo tempo que são captados dois protões da matriz mitocondrial. QH2 é então libertado da enzima. À medida que a coenzima Q é reduzida a ubiquinol no lado interno da membrana e oxidada a ubiquinona no outro lado, existe uma transferência líquida de protões através da membrana, que contribui para o gradiente de protões. Este mecanismo é relativamente complexo mas assegura um aumento da eficiência da transferência de protões: se apenas uma molécula de QH2 fosse utilizada para reduzir directamente dois citocromos, a eficiência seria a metade, havendo apenas a transferência de um protão por citocromo reduzido. Complexo IV: citocromo c oxidase. Citocromo c oxidase (complexo IV) A citocromo c oxidase, também conhecda como complexo IV, é o último complexo proteico da cadeia de transporte de electrões. Em mamíferos, a enzima tem uma estrutura bastante complexa, contendo 13 subunidades, dois grupos hémicos e diversos outros cofactores metálicos (três iões de cobre, um de magnésio e um de zinco). Esta enzima catalisa a reacção final da cadeia de transporte electrónico, oxidando o citocromo c e transferindo electrões para o oxigénio, ao mesmo tempo que bombeia protões através da membrana. O aceitador final de electrões oxigénio é reduzido a água neste processo. Tanto a passagem de protões através da membrana como o consumo de protões na matriz mitocondrial contribuem para o gradiente protónico. Redutases e oxidases alternativas Muitos organismos eucarióticos possuem cadeias respiratórias diferentes das de mamíferos, que são as mais bem estudadas (e acima descritas). Por exemplo, em plantas, existem NADH oxidases que oxidam o NADH no citoplasma, não na matriz mitocondrial, e passam os electrões para uma reserva de ubiquinona. Estas enzimas não transportam proões, pelo que reduzem a ubiquinona sem alterar o gradiente electroquímico através da membrana interna. Outro exemplo de um sistema diferente é a "oxidase alternativa", encontrada em plantas, alguns fungos, protistas e possivelmente noutros animais. Esta enzima transfere electrões directamente do ubiquinol para o oxigénio. As vias de transporte electrónico em que participam estas oxidases alternativas rendem menos ATP que a cadeia completa. Não se encontram totalmente esclarecidas as vantagens em possuir cadeias mais curtas; no entanto, estas oxidases alternativas são produzidas em resposta a situações de stress, como frio, produção de espécies reactivas de oxigénio e infecção, assim como outros factores que inibam a cadeia de transporte completa. Vias alternativas podem melhorar a resistência dos organismos a danos causados pelo stress oxidativo. Organização de complexos O modelo original da organização dos complexos da cadeia respiratória descrevia a sua difusão livre e independente na membrana mitocondrial. No entanto, alguns dados mais recentes sugerem que os complexos possam formar estruturas de ordem superior, designadas "supercomplexos" ou "respirassomas". Neste modelo, os diversos complexos existem como conjuntos organizados de enzimas que interactuam. Tais associações poderão permitir a canalização de substratos ("channeling") entre os diferentes complexos da cadeia, optimizando a velocidade e eficiência da transferência de electrões. Em mamíferos, alguns dos componentes poderão existir em maior quantidade que outros, com razões entre complexos I/II/III/IV e ATP sintase de aproximadamente 1:1:3:7:4. No entanto, este modelo não é totalmente aceite, pois existem dados que aparentam não se ajustar ao modelo. Cadeias de transporte electrónico de procariontes Em contraste com a similaridade geral que existe na estrutura e função das cadeias respiratórias em eucariontes, as enzimas de transferência electrónica em bactérias e arqueas são muito diversificadas; utilizam também diversos outros compostos químicos como substratos, permitindo a sua adaptação a diferentes condições ambientais. Tal como acontece nos eucariontes, a cadeia de transporte electrónico em procariontes utiliza a energia libertada da oxidação de um substrato para bombear iões através de uma membrana e gerar um gradiente electroquímico. Em bactérias, a fosforilação oxidativa em Escherichia coli é a mais bem compreendida; em contraste, os sistemas em arqueas são ainda pouco compreendidos. Em E. coli, a fosforilação oxidativa utiliza uma grande variedade de agentes redutores e oxidantes, listados abaixo. O potencial de meia onda de um composto dá uma medida da quantidade de energia libertada quando esse composto é oxidado ou reduzido, tendo agentes redutores potenciais negativos e agentes oxidantes potenciais positivos. Mais informação: Enzimas e substratos da respiração em E. coli, Enzima respiratória ... Enzimas e substratos da respiração em E. coli Enzima respiratória Par redox Potencial de meia onda (Volts) Formato desidrogenase Bicarbonato / Formato Hidrogenase Protão / Hidrogénio −0,42 NADH desidrogenase NAD+ / NADH −0,32 Glicerol-3-fosfato desidrogenaseDHAP / Gly-3-P Piruvato oxidase −0,43 −0,19 Acetato + Dióxido de carbono / Piruvato ? Lactato desidrogenase Piruvato / Lactato D-aminoácido desidrogenase Glicose oxidase −0,19 2-oxoácido + amónia / D-aminoácido ? Glicose / Gluconato −0,14 Succinato desidrogenase Succinato / Fumarato Ubiquinol oxidase Oxigénio / Água +0,82 Nitrato redutase Nitrato / Nitrito +0,42 Nitrito redutase Nitrito / Amónia +0,36 Dimetilsulfóxido redutase DMSO / DMS N-óxido de trimetilamina redutase +0,03 +0,16 TMAO / TMA +0,13 Fumarato redutase Fumarato / Succinato +0,03 Como mostrado acima, a E. coli pode multiplicar-se na presença de agentes redutores como o formato, o hidrogénio ou o lactato como doadores de electrões e o nitrato, DMSO ou oxigénio como aceitadores. Quanto maior é a diferença entre o potencial de um composto oxidante e de um redutor, mais energia é libertada quando eles reagem. Dentro deste conjunto de compostos, o par succinato/fumarato é particular, pois o seu potencial de meia onda é quase zero. Tal significa que o succinato pode ser oxidado a fumarato se houver um oxidante forte presente (como o oxigénio) ou o fumarato pode ser reduzido a succinato na presença de um agente redutor forte (como o formato). Estas reacções alternativas são catalisadas pela succinato desidrogenase e pela fumarato redutase, respectivamente. Alguns procariontes utilizam pares redox que possuem diferenças muito pequenas no seu potencial de meia onda. Por exemplo, bactérias nitrificantes, como as pertencentes ao género Nitrobacter, oxidam nitrito a nitrato, doando elecrões ao oxigénio. A pequena quantidade de energia libertada nesta reacção é suficiente para bombear protões e produzir ATP, mas insuficiente para produzir NADH ou NADPH directamente em anabolismo. Este problema é contornado usando uma nitrito oxidorredutase que produz força motriz protónica suficiente para fazer funcionar a cadeia de transporte electrónico no sentido inverso, forçando o complexo I a produzir NADH. Os procariontes controlam o uso destes doadores e aceitadores de electrões variando o tipo de enzimas produzido, em resposta a condições ambientais. Esta flexibilidade deve-se à possibilidade de diferentes oxidases e redutases utilizarem a mesma reserva de ubiquinona. Tal permite diversas combinações funcionais de enzimas, enzimas essas ligadas pelo intermediário comum ubiquinol. Estas cadeias respiratórias têm portanto uma natureza modular, com sistemas de enzimas fáceis de permutar. Além da existência desta diversidade metabólica, os procariontes têm também várias isozimas (diferentes enzimas que catalisam a mesma reacção). Por exemplo, existe em E. coli dois tipos diferentes de ubiquinol oxidase usando oxigénio como aceitador electrónico. Sob condições totalmente aeróbias, a célula utiliza uma oxidase com baixa afinidade para com o oxigénio que consegue transportar dois protões por cada electrão. No entanto, se os níveis de oxigénio decrescem, o metabolismo muda para a utilização de uma oxidase que transfere apenas um protão por electrão, mas que tem alta afinidade para com o oxigénio. ATP sintase ATP sintase. O canal de protões FO e eixo encontra-se a rosa, o domínio sintase F1 a magenta e a membrana a azul translúcido. A ATP sintase, também designada complexo V, é a enzima final na via da fosforilação oxidativa. Esta enzima encontra-se presente em todas os organismos vivos e funciona de forma idêntica em procariontes e eucariontes. A enzima utiliza a energia armazenada num gradiente de protões existente através da membrana para realizar a síntese de ATP a partir de ADP e fosfato inorgânico (Pi). Existem estimativas de serem necessários entre três e quatro protões para sintetizar um ATP, havendo alguns estudos que apontam para uma variação nestes números, dependendo das condições. Esta reacção de fosforilação é um equilíbrio químico, que pode ser deslocado alterando-se a força motriz protónica. Se não existe uma força motriz, a reacção da ATP sintase prossegue da direita para a esquerda, havendo a hidrólise de ATP e o bombeamento de protões para fora da matriz, através da membrana. No entanto, quando a força motriz é alta, a reacção procede da esquerda para a direita, permitindo o fluxo de protões no sentido do gradiente de concentração (da maior concentração para a menor) e produzindo ATP a partir de ADP. A ATP sintase é um complexo proteico de grandes dimensões, em forma de cogumelo. A enzima em mamíferos contém 16 subunidades e uma massa de aproximadamente 600 quilodalton. A parte da enzima embebida na membrana é designada FO e contém um anel de subunidades "c" e o canal de protões. O eixo e a "cabeça" em forma de bola é designada F1, sendo o local onde ocorre a síntese de ATP. O complexo em forma de bola na extremidade de F1 contém seis proteínas de dois tipos distintos (três subunidades α e três subunidades β); o eixo consiste numa proteína (subunidade γ), cuja extremidade penetra na zona das subunidades α e β. Tanto a subunidade α como a β conseguem ligar nucleótidos, mas apenas a subunidade β catalisa a reacção de síntese do ATP. Uma outra subunidade actua como um braço lateral, estendendo-se ao longo de F1, penetrando a membrana e ligando as subunidades α e β à base da enzima. À medida que os protões atravessam a membrana através do canal na base da ATP sintase, FO entra em movimento de rotação. Esta rotação poderá ser causada por mudanças no estado de ionização de aminoácidos no anel de subunidades "c", o que poderá causar interacções electrostáticas que propulsionam o anel. Este anel em rotação, por sua vez, força a rotação do eixo central (subunidade γ) dentro das subunidades α e β; estas não entram em rotação por se encontrarem fixas pelo braço lateral, que actua como um estator. É o movimento da subunidade γ que providencia a energia necessária para os centros activos das subunidades β sofrerem alterações que permitam a produção e libertação de ATP. Esta reacção de síntese de ATP é designada em Inglês como binding change mechanism (algo como "mecanismo de ligação-modificação") e consiste na modificação cíclica do centro activo de cada subunidade β em três estados. No estado "aberto", o ADP e o fosfato entram no centro activo. A proteína muda de conformação capturando as moléculas e liga-as de forma fraca (estado de ligação fraca). A enzima muda então novamente de conformação e força o encontro entre estas moléculas (estado "fechado"), em que o centro activo liga a recém-produzida molécula de ATP com alta afinidade. O centro activo volta então ao estado "aberto", permitindo a libertação da molécula de ATP e podendo voltar a ligar ADP e fosfato. Nalgumas bactérias e arqueas, é o movimento de iões sódio, não de protões, através da membrana que potencia a síntese de ATP. Arqueas como as pertencentes ao género Methanococcus contêm também a A1Ao sintase, uma forma da enzima que contém proteínas com muito pouca semelhança a nível da estrutura primária (sequência de aminoácidos) com subunidades de outras ATP sintases bacterianas e eucarióticas. É possível que, nalgumas espécies, esta forma da enzima seja uma ATP sintase especializada no transporte de sódio, embora tal não seja obrigatoriamente verdadeiro em todos os casos. Espécies reactivas de oxigénio O dioxigénio (oxigénio molecular) é um aceitador terminal de electrões ideal, por ser um agente oxidante forte. A redução do dioxigénio pode originar intermediários potencialmente danosos. Embora a transferência de quatro protões e quatro electrões reduza o dioxigénio a água, uma espécie química inócua, a transferência de um ou dois electrões produz o anião radical superóxido e o peróxido de hidrogénio. Estas espécies reactivas de oxigénio e os seus produtos de reacção, tais como o radical hidroxilo, são muito danosos para as células, pois oxidam proteínas e lípidos membranares e causam mutações no DNA. Estes danos celulares podem contribuir para determinadas patologias e pensa-se que estejam envolvidos no processo de envelhecimento. O complexo da citocromo c oxidase é muito eficiente na redução de dioxigénio a água e produz muito poucos intermediários parcialmente reduzidos. No entanto, são produzidas pequenas quantidades de superóxido e peróxido na cadeia de transporte de electrões. É de particular importância a redução da coenzima Q10 no complexo III, quando existe a formação da ubisemiquinona, um radical livre muito reactivo e instável que pode por vezes "escoar" alguns electrões directamente para o oxigénio, produzindo superóxido. Para diminuir os efeitos das espécies reactivas de oxigénio, as células possuem diversos sistemas antioxidantes, como a presença das vitaminas C e E e enzimas como a superóxido dismutase, a catalase e peroxidases, que capturam e desintoxicam as espécies reactivas e limitam os danos por elas causados. Bibliografia recomendada Introdutória Nelson DL; Cox MM (2004). Lehninger Principles of Biochemistry 4th ed. [S.l.]: W. H. Freeman. ISBN 0-716-74339-6 Schneider ED; Sagan D (2006). Into the Cool: Energy Flow, Thermodynamics and Life 1st ed. [S.l.]: University of Chicago Press. ISBN 0-226-73937-6 Avançada Nicholls DG; Ferguson SJ (2002). Bioenergetics 3 1st ed. [S.l.]: Academic Press. ISBN 0-125-18121-3 Haynie D (2001). Biological Thermodynamics 1st ed. [S.l.]: Cambridge University Press. ISBN 0-521-79549-4 Rajan SS (2003). Introduction to Bioenergetics 1st ed. [S.l.]: Anmol. ISBN 8-12611364-2 Wikstrom M (Ed) (2005). Biophysical and Structural Aspects of Bioenergetics 1st ed. [S.l.]: Royal Society of Chemistry. ISBN 0-854-04346-2 Fotossíntese processo físico-químico celular para obtenção de glicose através de energia solar Fotossíntese é um processo físico-químico, a nível celular, realizado pelos seres vivos clorofilados, que utilizam dióxido de carbono e água, para obter glicose através da energia da luz solar, de acordo com a seguinte equação: Luz solar + 12H2O Água + 6CO2 Dióxido de carbono → Oxigênio + Água + C6H12O6 6O2 6H2O Glicose Representação da fotossíntese. A fotossíntese inicia a maior parte das cadeias alimentares na Terra. Sem ela, os animais e muitos outros seres heterotróficos seriam incapazes de sobreviver porque a base da sua alimentação estará sempre nas substâncias orgânicas proporcionadas pelas plantas verdes. A maior parte da vida na Terra usa a luz vermelha visível na fotossíntese, mas algumas usam luz infravermelha. A relação da cor verde das plantas com a luz Cronologia da vida view • Discussão • -4500 —–-4000 —–-3500 —–-3000 —–-2500 —–-2000 —–-1500 —–-1000 —–-500 —–0 — Água Vida unicelular Fotossíntese Eukaryota Vida multicelular Vida terrestre Dinossauros Mamíferos Flores ← Início da Terra (−4540) ← Início da água ← Origem da vida (−4000) ← Meteoritos de LHB ← Início do oxigênio ← Oxigênio atmosférico ← Crise de oxigênio ← Início da reprodução sexual ← Explosão Cambriana ← Era dos humanos Pongolano Huroniano Criogeniano Andino Karoo Quaternário Escala do eixo em milhões de anos. Aristóteles tinha observado e descrito que as plantas necessitavam de luz solar para adquirir a sua cor verde. No entanto, só em 1771, a fotossíntese começou a ser estudada por Joseph Priestley. Este químico inglês, confinando uma planta numa redoma de cristal comprovou a produção de uma substância que permitia a combustão e que, em certos casos, avivava a chama de um carvão em brasa. Posteriormente, concluiu-se que a substância observada era o gás oxigênio. As plantas possuem folhagem de coloração verde pois essa frequência de onda eletromagnética é refletida por não ser aproveitada de forma eficiente no processo da fotossíntese em que se converte a energia luminosa em química. Dessa forma, se um vegetal for iluminado somente com luz monocromática verde a taxa de fotossíntese será insuficiente para garantir a sua sobrevivência e ocorrerá a atrofia dos tecidos da planta, podendo resultar na morte do organismo. Enquanto a luz verde é a que gera o menor rendimento fotossintético, as frequências de luz azul, violeta e vermelho são as que apresentam o maior índice de absorção pela clorofila. A descoberta da fotossíntese Em 1778, Jan Ingenhousz, físico-químico neerlandês, verificou que uma vela colocada dentro de um frasco fechado não se apagava, desde que houvesse também no frasco partes verdes de plantas e o frasco estivesse exposto à luz, ou seja, que na presença de luz, as plantas libertam oxigénio. A incorporação da água pelas plantas Nicolas-Théodore de Saussure, já no início do século XIX descobriu que os vegetais incorporavam água em seus tecidos. Com o passar do tempo, os avanços no campo óptico e as tecnologias de estudo aprimoradas, possibilitaram os conhecimentos em relação a nutrição vegetal. A descoberta da retirada de nutrientes do solo Células vegetais com cloroplastos visíveis. Uma observação importante foi que o azoto, assim como diversos sais e minerais, era retirado do solo pelas plantas e que a energia proveniente do Sol se transformava em energia química, ficando armazenada numa série de produtos em virtude de um processo que então acabou por ser chamado de fotossíntese. A substância chamada de clorofila foi isolada na segunda década do século XIX. Ainda naquele século, descobriu-se que a clorofila era a responsável pela cor verde das plantas, além de desempenhar um papel importante na síntese da matéria orgânica. Julius von Sachs demonstrou que a clorofila se localizava nos chamados organelos celulares, que, por meio de estudos mais apurados, foram chamados de cloroplastos. A reprodução do ciclo da clorofila em laboratório Ao avançarem as técnicas bioquímicas, em 1954 foi possível o isolamento e extracção destes organelos. Foi Daniel Israel Arnon quem obteve cloroplastos a partir das células do espinafre, conseguindo reproduzir em laboratório as reações completas da fotossíntese. As etapas da fotossíntese Com estas técnicas, descobriu-se, por exemplo, que a fotossíntese ocorre ao longo de duas etapas: A fase fotoquímica, fase luminosa ou fase clara (fase dependente da luz solar) é a primeira fase do processo fotossintético. Essa fase ocorre nos tilacoides. Seu evento principal é a fotofosforilação, que é a adição de fosfato inorgânico (Pi) ao difosfato de adenosina (ADP). A energia luminosa é captada por meio de pigmentos fotossintetizantes, capazes de conduzi-la até o centro de reação. Tal centro é composto por um par de clorofilas α, também denominado P700. Os elétrons excitados da P700 saem da molécula e são transferidos para uma primeira substância aceptora de elétrons, a ferredoxina. Esta logo os transfere para outra substância, e assim por diante, formando uma cadeia de transporte de elétrons. Tais substâncias aceptoras estão presente na membrana do tilacoide. Nessa transferência entre os aceptores, os elétrons vão liberando energia gradativamente e esta é aproveitada para transportar hidrogênio iônico de fora para dentro do tilacoide, reduzindo o pH do interior deste. A redução do pH ativa o complexo proteico "ATP sintetase". O fluxo de hidrogênios iônicos através do complexo gira, em seu interior, uma espécie de "turbina proteica", que promove a fosforilação de moléculas de adenosina difosfato dando origem à adenosina trifosfato (ATP). Ao chegarem ao último aceptor, os elétrons têm nível energético suficientemente baixo e retornam ao par de clorofilas 'a', fala-se em fotofosforilação cíclica. Porém, existe outra forma de fosforilação, a fotofosforilação acíclica onde os elétrons das moléculas de clorofila 'a' (P700), excitados pela luz, são captados pela ferredoxina, mas ao em vez de passarem pela cadeia transportadora são captados pelo NADP (nicotinamida adenina dinucleotídeo Fosfato) e não retornam para o P700. Este fica temporariamente deficiente de elétrons. Esses elétrons são repostos por outros provenientes de outro Em seguida passa aos citocromos e plastocianina até serem captados pelo P700, que se recompõe. Este processo de transporte também promove a síntese do (ATP). Já o P680 fica deficiente de elétrons. Esses elétrons serão repostos pela fotólise da água. A quebra da molécula da água por radiação (fotólise da água) produz íons de hidrogênios e hidróxidos. Os elétrons dos íons hidróxidos são utilizados para recompor o P680 e os íons hidrogênio são aceptados pelo NADP, com isso ocorre a formação de água oxigenada (H2O2) oriunda da reação de síntese entre as hidroxilas. A água oxigenada é decomposta pela célula em água e O2 sendo este último liberado do processo como resíduo. Com a repetição do processo forma-se o aporte energético e de NADPHs necessários para a fase escura. Equação: 12H2O + 6NADP + 9ADP + 9P -(luz)→ 9ATP + 6NADPH2 + 3O2+ 6H2O Ciclo de Calvin e fixação do carbono. A fase química ou "fase escura" é um ciclo descoberto pelos cientistas Melvin Calvin, Andrew Benson e James Bassham. Nessa fase chamada de ciclo de Calvin ou ciclo das pentoses, que ocorre no estroma do cloroplasto, o tilacoide fornece ATP e NADPH2 ao estroma do cloroplasto, onde se encontra a pentose (ribulose fosfato), essa pentose ativada por um fosfato, fixa o carbono que provém do dióxido de carbono do ar sob a ação catalisadora da "RuBisCO" (ribulose bifosfato carboxilaseoxidase) e em seguida é hidrogenada pelo NAPH2 formando o aldeído que dará origem à glicose. Para a síntese de uma molécula de glicose são fixadas seis de dióxido de carbono, permitindo que o processo recicle a ribulose fosfato. devolvendo-a ao estroma. Desta fase resulta a formação de compostos orgânicos como a glicose, necessária à atividade da planta. Esta fase é denominada fase escura, no entanto é um termo utilizado de forma inadequada pois para a "RuBisCO" entrar em atividade determinando a fixação do CO2 atmosférico para a formação de moléculas de glicose, ela precisa estar num estado reduzido, e para isso acontecer é necessário que a luz esteja presente. Equação: 6CO2 + 12NADPH2 + 18ATP -(enzimas)→ 12NADP + 18ADP + 18P + 6H2O + C6H12O6 Plantas jovens consomem mais dióxido de carbono e libertam mais oxigénio, pois o carbono é incorporado a sua estrutura física durante o crescimento. É importante realçar que a fase escura não ocorre apenas à noite ou na ausência de luz, o nome refere-se ao facto desta fase não necessitar da luz para funcionar. Ela acontece logo após a fase clara numa reação em cadeia até que o substrato se esgote. A equação geral da formação de glicose é resultado da soma das duas equações: Equação simplificada da fase fotoquímica: 12H2O + 12NADP + 18ADP + 18P (luz)→ 18ATP + 12NADPH2 + 6O2 Equação simplificada da fase química: 6CO2 + 12NADPH2 + 18ATP -(enzimas)→ 12NADP + 18ADP + 18P + 6H2O + C6H12O6 Somando-as e simplificando, obtém-se a equação geral da fotossíntese: 12H2O + 6CO2 → 6O2 +C6H12O6 + 6H2O Organismos fotossintetizadores Além das plantas verdes, incluem-se entre os organismos fotossintéticos, as algas (como as diatomáceas, as euglenófitas), as cianofíceas (algas verde-azuladas) e diversas bactérias. Quimeras Os cientistas desenvolveram um sistema de proteína fotossintética usando clorofila e bacterioclorofila para aprimorar uma abordagem mais sustentável dos dispositivos tecnológicos movidos a energia solar. Ao fazer isso, os cientistas demonstraram que os dois sistemas de pigmentos poderiam trabalhar juntos para obter a conversão de energia solar. Fatores que afetam Concentração de dióxido de carbono: É geralmente o fator limitante da fotossíntese para as plantas terrestres em geral, devido a sua baixa concentração na atmosfera, que é em torno de 0,04%. Temperatura: Para a maioria das plantas, a temperatura ótima para os processos fotossintéticos está entre 30 e 38 °C . Acima dos 45 °C a velocidade da reação decresce, pois cessa a atividade enzimática. Água: A água é fundamental como fonte de hidrogênio para a produção da matéria orgânica. Em regiões secas as plantas têm a água como um grande fator limitante. Morfologia foliar Ponto de compensação fótico É chamado "ponto de compensação fótico" o instante em que as velocidades de fotossíntese e respiração são exatamente ou simplesmente as mesmas. Neste instante toda a glicose produzida na fotossíntese é "quebrada" na respiração, e todo dióxido de carbono(CO2) gasto na fotossíntese é produzido na respiração. A importância da fotossíntese A fotossíntese é o principal processo de transformação de energia na biosfera. Ao alimentarmo-nos, parte das substâncias orgânicas, produzidas graças à fotossíntese, entram na nossa constituição celular, enquanto outras (os nutrientes energéticos) fornecem a energia necessária às nossas funções vitais, como o crescimento e a reprodução. Além do mais, ela fornece oxigênio para a respiração dos organismos heterotróficos. É essencial para a manutenção da vida na Terra. Subprodutos remotos da fotossíntese De acordo com a teoria da geração orgânica do petróleo, indiretamente energia química presente no petróleo e no carvão, que são utilizados pelo ser humano como combustíveis, têm origem na fotossíntese, pois, são produtos orgânicos provenientes de seres vivos (plantas ou seres que se alimentavam de plantas) de outras eras geológicas. Quimiossíntese A quimiossíntese é a produção de matéria orgânica através da oxidação de substâncias minerais, sem recorrer à luz solar. A quimiossíntese divide-se em duas etapas: A formação do NADPH e de ATP, usando a energia fornecida por determinadas reações químicas de oxirredução que ocorrem no meio; A segunda fase é igual à fase química da fotossíntese, redução de dióxido de carbono, o que conduz à síntese de substâncias orgânicas. A quimiossíntese é realizada principalmente por bactérias, entre as quais as ferrobactérias, as sulfobactérias e as nitrobactérias. Cada uma dessas bactérias utiliza a energia de um mineral que oxida, compostos respectivamente de ferro, enxofre e nitrogénio. Comparada à fotossíntese, a taxa da quimiossíntese apresenta uma fração minúscula de produção, mas é muito importante para o ciclo do nitrogênio, onde este elemento é fixado no solo ou nas plantas. Em 1890, Winogradsky verificou que a oxidação do composto amoníaco existente no solo liberta energia. Partindo deste conhecimento verificou que bactérias do solo pudessem oxidar compostos azotados, utilizando a energia para reduzir o dióxido de carbono (CO2) e formar substâncias orgânicas. Essas bactérias foram designadas por bactérias nitrificantes ou ainda bactérias quimioautotróficos, As bactérias nitricantes são seres quimiossintéticos porque utilizam a energia resultante da oxidação de compostos químicos, e autotróficos porque a fonte de carbono é um mineral. As bactérias nitrificantes são geralmente encontradas livremente no solo ou associadas a plantas, formando nódulos radiculares. A biofixação se inicia com a assimilação no nitrogênio atmosférico, transformando-o em amônia, reagente oxidado pela nitrossomonas, resultando em nitrito e energia para a produção de substâncias orgânicas sustentáveis a esse gênero de bactérias. O nitrito liberado no solo e absorvido pela nitrobactéria também passa por oxidação, gerando energia química (destinada à produção de substâncias orgânicas) e nitrato (NO3-) (aproveitado pelas plantas na elaboração dos aminoácidos). Existem bactérias ricas em H2S. Essas bactérias são capazes de incorporar o dióxido de carbono para a síntese de moléculas orgânicas, utilizando a energia química resultante da oxidação do sulfureto de hidrogénio. Essas bactérias são designadas por Sulfo-bactéria e quimioautotrófico. Apesar do processo quimiossintético representar uma pequena formação do processo de produção de compostos orgânicos , as bactérias quimiossintéticas desempenham actidades importantes na biosfera , nomeadamente na manutenção da fertilidade dos solos, através da sua intervenção na reciclagem de compostos azotados. Grupos de Bactérias quimiossintetizantes sulfobacterias: que oxidam compostos do enxofre; ferrobacterias: que oxidam compostos do ferro; nitrobacterias: que oxidam compostos do nitrogênio;