Enviado por
common.user3641
Ácidos ORGÂNICOS

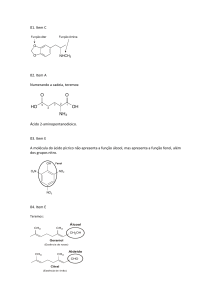
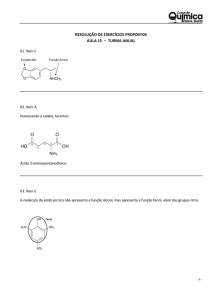
Ácidos Ácido acético, ácido tartárico e ácido cítrico são exemplos de ácidos orgânicos. Ácido nítrico e ácido fluorídrico são exemplos de ácidos inorgânicos. Svante Arrehenius foi um químico sueco que, em 1887, realizou inúmeras experiências com substâncias diluídas em água e observou que: - Quando em solução aquosa, os ácidos se ionizam, isto é, dão origem a íons, produzindo como cátion H+. - Em solução aquosa, os ácidos conduzem eletricidade. Isso ocorre porque os ácidos se desdobram em íons. - Os ácidos têm sabor azedo. O limão, o vinagre, o tamarindo contêm ácidos; é por isso que eles são azedos. - Os ácidos alteram a cor de certas substâncias chamadas indicadores. Os indicadores têm a propriedade de mudar a cor conforme o caráter ácido ou básico das soluções. O tornassol e a fenolftaleína são indicadores de ácidos e bases. A solução de fenolftaleína vermelha fica incolor em presença de um ácido. Já o papel de tornassol azul fica vermelho. - Os ácidos reagem com as bases, formando sais e água. Essa reação se chama reação de neutralização. Resumindo, a definição de Arrehenius ficaria assim: ácido é toda substância que se ioniza em presença de água e origina, como um dos íons, o cátion H+. Veja os exemplos de ácidos orgânicos (que fazem parte de nossa alimentação), e onde podem ser encontrados: Ácido acético = vinagre. Ácido tartárico = uva. Ácido málico = maçã. Ácido cítrico = laranja, acerola, limão. Ácido fosfórico = usado na fabricação de refrigerantes à base de cola. Ácido carbônico = sob a forma de gás carbônico, é um dos constituintes das águas minerais gaseificadas e dos refrigerantes. Existe uma classe de ácidos muito perigosos, que se forem ingeridos podem levar o indivíduo à morte, são os chamados ácidos inorgânicos. Exemplos: Ácido Clorídrico (HCl)--> O HCl impuro é comercializado com o nome de ácido muriático e é utilizado principalmente na limpeza de pisos ou de superfícies metálicas antes da soldagem. O HCl é um componente do suco gástrico, conferindo a ele um pH adequado para a ação das enzimas digestivas gástricas. Ácido Fluorídrico (HF) --> O HF tem a propriedade de corroer o vidro; por isso, é usado para fazer gravações em vidros e cristais. Ácido Sulfúrico (H2SO4) --> É utilizado nas baterias de automóvel, na fabricação de corantes, tintas, explosivos e papel; é também usado na indústria de fertilizantes agrícolas, permitindo a fabricação de produtos como o sulfato de amônio. Ácido Nítrico (HNO3) --> É usado na fabricação de explosivos como o trinitrotolueno (TNT) e a nitroglicerina (dinamite); é muito útil para a indústria de fertilizantes agrícolas, permitindo a obtenção do salitre. É usado também na identificação de amostras de ouro. Ácido Cianídrico (HCN) --> Ácido utilizado em indústrias diversas, como nas de plásticos, acrílicos e corantes, entre outras. Mas ele tem também um destino sinistro: nos Estados Unidos, é usado nas "câmaras de gás" para executar pessoas condenadas à morte, este ácido libera um gás extremamente tóxico. ÁCIDOS E BASES ORGÂNICAS SÃO ÁCIDOS DE BRONSTED-LOWRY Ordem decrescente de acidez: Ácido carboxílico > fenol > álcool ATENÇÃO Efeitos que alteram a acidez: Efeito indutivo negativo (Is–) São efeitos causados por elementos capazes de atrair elétrons, por consequência, enfraquecem a ligação entre o H e o O que estão ligados nessas funções e por isso aumentam a acidez desses compostos. Principais elementos causadores do efeito indutivo negativo: F, O, Cl, Br, I, etc. Exemplo: Observe que no composto (I) tem-se o elemento Cl, que por ser um elemento bastante eletronegativo, causa um Is– que enfraquece a ligação entre o O e o H da hidroxila desse composto, fazendo com que sua acidez aumente. Já no composto (II) isso não acontece, pois o H não causará Is–. Por isso, o composto (I) é mais ácido que o composto (II). Efeito Indutivo Positivo (Is+) São efeitos causados por elementos capazes de repelirem elétrons, por esse motivo diminuem a acidez. Os principais causadores desse efeito são os radicais alquilas (metil, etil, propil, etc). Quanto maior for o número de carbonos nesses radicas, maior será o efeito. Exemplo: Observe que o composto (II), por apresentar um grupo metila, causa um Is+, fortalecendo a ligação entre o H e o O, dificultando a sua saída, e por esse motivo o composto (II) é mais básico que o composto (I). CUIDADO! Observe que no composto (I) a metila está mais afastada da hidroxila quando comparado ao composto (II), como a força elétrica é inversamente proporcional a distância, temos um efeito indutivo positivo mais acentuado no composto (II). Partindo do princípio que o efeito indutivo positivo diminui a acidez, têm-se que (II) é mais básico que (I). Conclusão: quanto maior for a distância, menor será o efeito indutivo. PRINCIPAIS BASES ORGÂNICAS São bases de Lewis Aminas Ordem decrescente de basicidade das aminas Em solução aquosa: Amina 2a > amina 1a > amina 3a > amina aromática. Como observamos anteriormente, os Is+ diminuem a acidez, logo quanto maior for o número de Is+ maior será a acidez do composto. Quando comparamos uma amina 2a com uma amina 1a fica fácil de entender porque que a amina 2a é mais básica, tendo em vista que ela possui dois grupos que fazem Is+ equnato que a primária só possui um. Veja: Amina 1a Amina 2a Tem-se que tomar cuidado quando se compara a amina 2a com a amina 3a. Embora a amina 3a possuía um Is+ mais eficaz que a amina 2a, ela é menos básica devido ao impedimento espacial ou impedimento estérico, ou seja o par de elétrons da amina 3a está menos disponível e por isso essa amina é menos básica. Veja: Amina 2a Amina 3a, impedimento espacial. Já a amina aromática é menos básica devido ao comprometimento do par eletrônico do Nitrogênio com a ressonância do anel aromático. Veja: