CURSINHO ETWB 2012
Componente Curricular: Química
Professor: Ricardo Honda
Data: Terça-feira, 26/06/2012
Tema da aula: Eletrólise ígnea e Eletrólise aquosa
“A eletrólise é um processo não espontâneo, em que a passagem de uma corrente elétrica através de um sistema
líquido, no qual existam íons, produz reações químicas”.
Eletrólise
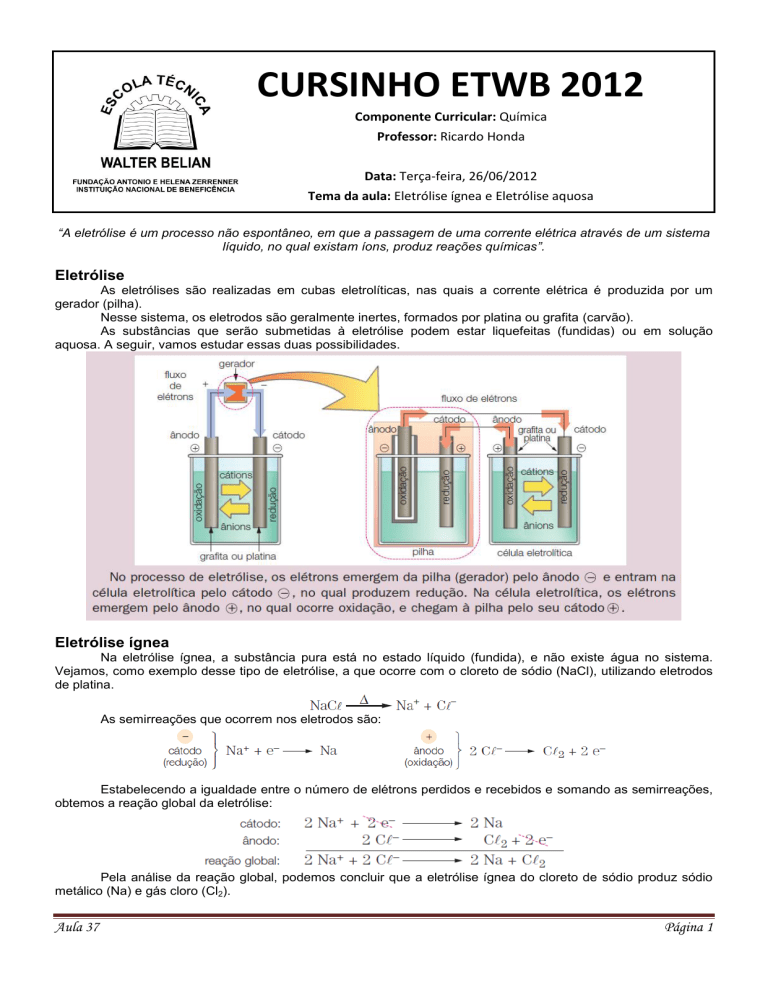
As eletrólises são realizadas em cubas eletrolíticas, nas quais a corrente elétrica é produzida por um
gerador (pilha).
Nesse sistema, os eletrodos são geralmente inertes, formados por platina ou grafita (carvão).
As substâncias que serão submetidas à eletrólise podem estar liquefeitas (fundidas) ou em solução
aquosa. A seguir, vamos estudar essas duas possibilidades.
Eletrólise ígnea
Na eletrólise ígnea, a substância pura está no estado líquido (fundida), e não existe água no sistema.
Vejamos, como exemplo desse tipo de eletrólise, a que ocorre com o cloreto de sódio (NaCl), utilizando eletrodos
de platina.
As semirreações que ocorrem nos eletrodos são:
Estabelecendo a igualdade entre o número de elétrons perdidos e recebidos e somando as semirreações,
obtemos a reação global da eletrólise:
Pela análise da reação global, podemos concluir que a eletrólise ígnea do cloreto de sódio produz sódio
metálico (Na) e gás cloro (Cl2).
Aula 37
Página 1
Eletrólise aquosa
Nesse tipo de eletrólise devemos considerar não só os íons provenientes do soluto, mas também os da
água, provenientes de sua ionização.
Genericamente, temos:
Experimentalmente, verificou-se que somente um dos cátions e somente um dos ânions sofrem descarga
nos eletrodos e que essa descarga segue a seguinte ordem de prioridade:
Vamos estudar, agora, duas eletrólises em meio aquoso.
1. Eletrólise aquosa do cloreto de sódio
Na solução, temos:
Somando as quatro equações, temos a reação global do processo:
A eletrólise do NaCl(aq) é um processo que permite obter soda cáustica (NaOH), gás hidrogênio (H2) e
–
gás cloro (Cl2). Note que a presença de OH na solução final da eletrólise caracteriza soluções básicas.
2. Eletrólise aquosa do sulfato de cobre
Na solução, temos:
Aula 37
Página 2
Somando as quatro equações, temos a reação global do processo:
Note que, pela eletrólise do CuSO4, obtivemos cobre metálico (Cu) e gás oxigênio (O 2), e que a solução
+
final apresenta caráter ácido devido aos íons H (aq).
EXERCÍCIOS DE CLASSE
1. (UERJ 2012) – Em um experimento pioneiro, a cientista Marie Curie isolou a forma metálica do elemento
químico rádio, por meio da eletrólise ígnea com eletrodos inertes do cloreto de rádio.
Nomeie o tipo de ligação interatômica presente no cloreto de rádio e escreva a equação química que representa a
eletrólise desse elemento.
2. (FUVEST 2009) – Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura
representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
a) Nesse experimento, para que ocorra a eletrólise da água, o que deve ser adicionado, inicialmente, à água
contida no recipiente IV? Justifique.
b) Dê as fórmulas moleculares das substâncias recolhidas, respectivamente, nos tubos II e III.
c) Qual a relação estequiométrica entre as quantidades de matéria (mols) recolhidas em II e III?
d) Escreva a equação balanceada que representa a semirreação que ocorre no eletrodo (anodo) inserido no tubo
III.
EXERCÍCIOS COMPLEMENTARES
1. (UNIFESP 2008) – A figura representa uma célula de eletrólise de soluções aquosas com eletrodo inerte.
Também são fornecidos os potenciais-padrão de redução (Eº) de algumas espécies.
+
–
Na (aq) + e → Na (s)
+
–
2 H (aq) + 2 e → H2 (g)
–
–
H2O (l) + ½ O2 + 2 e → 2 OH (aq)
–
–
Cl2 (g) + 2 e → 2 Cl (aq)
Aula 37
o
E = –2,71 V
o
E = 0,00 V
o
E = +0,40 V
o
E = +1,36V
Página 3
Para essa célula, foram feitas as seguintes afirmações:
I. O polo positivo é o eletrodo do compartimento Y.
II. O ânodo é o eletrodo do compartimento X.
III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.
IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.
V. Na eletrólise da solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.
São corretas somente as afirmações
a) I, II, III e IV.
b) I, III e V.
c) I, IV e V.
d) II, III e IV.
e) II, IV e V.
2. (UFRGS 2010) – A eletrólise de uma solução aquosa concentrada de cloreto de sódio é uma reação de grande
importância. A partir de reagentes simples e baratos, essa reação permite a obtenção de cloro e hidrogênio
gasosos, entre outros produtos.
Observe os potenciais-padrão de redução abaixo.
–
–
Cl2 (g) + 2 e → 2 Cl (aq)
+
–
O2 (g) + 4 H (aq) + 4 e → 2 H2O (l)
+
–→
2 H (aq) + 2 e H2 (g)
–
–
2 H2O (l) + 2 e → H2 (g) + 2 OH (aq)
+
–→
Na (aq) + e Na (s)
E° = 1,36 V
E° = 1,23 V
E° = 0,00 V
E° = - 0,83 V
E° = 2,71 V
Assinale a afirmação correta sobre a célula eletrolítica envolvida nesse processo de eletrólise.
a) O pH da solução aumenta à medida que a reação prossegue.
b) O potencial que ela fornece é de 1,36 V.
–
–
c) A reação anódica é: 2 H2O (l) + 2 e → H2 (g) + 2 OH (aq).
d) Ocorre deposição de sódio metálico no cátodo.
e) Hidrogênio e cloro são liberados no mesmo eletrodo.
Aula 37
Página 4