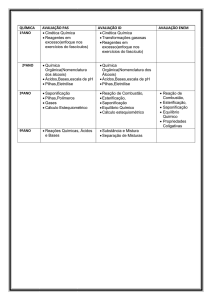
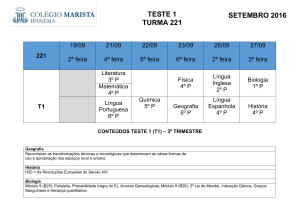
Aplicação da Eletrólise
Eletrólise é todo processo químico não espontâneo provocado por corrente elétrica.
Substâncias iônicas possuem a capacidade de conduzir corrente elétrica quando estão em soluções
aquosas. A eletrólise provém dessa propriedade iônica, ou seja, é um processo que se baseia na descarga
de íons, onde ocorre uma perda de carga por parte de cátions e ânions.
A eletrólise é uma transformação artificial, pois é provocada por um gerador, mas tem uma enorme
importância prática. Ela tem grande utilização em indústrias, na produção de muitas substâncias, dentre
elas metais alcalinos, alcalino-terrosos, gás hidrogênio e gás cloro.
A eletrólise é um processo útil na obtenção de vários elementos químicos. Por exemplo:
Sódio: eletrólise ígnea de NaCl (cloreto de sódio) fundido em um processo que ocorre a cerca de 800°C.
Alumínio: eletrólise ígnea de Al2O3(bauxita).
Soda cáustica (NaOH): eletrólise aquosa do NaCl (cloreto de sódio).
Gás hidrogênio: eletrólise aquosa do NaCl (cloreto de sódio).
Cloro: eletrólise ígnea do gás cloro (Cl2). O cloro é muito utilizado na produção de compostos orgânicos
clorados e alvejantes, e também para o tratamento de água para consumo e de piscinas.
Observação: Eletrólise ígnea é a passagem da corrente elétrica em uma substância iônica no estado de
fusão, diferente da eletrólise aquosa em que a passagem elétrica ocorre através de um líquido condutor.
A eletrólise é muito utilizada na galvanoplastia, isto é, no recobrimento de objetos com uma fina camada
de metal. Vários cátions metálicos, após a redução, ficam grudados no cátodo, o que provoca a formação
de uma camada de metal. Por exemplo:
Niquelação: recobrimento de um objeto com níquel;
Cromação: recobrimento de um objeto com cromo.
Pilhas alcalinas
As pilhas se tornaram tão importantes em nosso cotidiano que merecem um estudo especial. São elas as
responsáveis pelo funcionamento de computadores portáteis, relógios, telefones, calculadoras, rádios, e
até na medicina, em marca-passos cardíacos.
Vamos falar então da mais popular, a pilha alcalina. As pilhas alcalinas recebem este nome por que são
feitas a partir de bases, possuem d.d.p de 1,5 V e não são recarregáveis.
Quais as diferenças entre pilhas ácidas e alcalinas?
1. Composição: A pilha alcalina é composta por uma mistura eletrolítica: pasta básica de NaOH (hidróxido
de sódio - bom condutor eletrolítico). Já a pilha seca comum contém cloreto de amônio NH4Cl (sal ácido) e
recebe a classificação de ácida.
2. Aplicação: A pilha seca é usada para produzir correntes pequenas em serviços contínuos, sendo por isso
indicada para rádios portáteis, telefones, campainhas, lanternas, serviços de sinalização, etc. A pilha
alcalina, por sua vez, é apropriada para equipamentos que requerem descargas de energia rápidas e
fortes, como brinquedos, câmeras fotográficas digitais, MP3 players, etc.
3. Durabilidade: as pilhas alcalinas duram cerca de cinco vezes mais que as ácidas. O Hidróxido de sódio
possui maior condutividade elétrica e consequentemente vai transportar energia mais rapidamente que o
Cloreto de amônio. Esta reação rápida em pilhas básicas proporciona maior vida útil aos seus
constituintes.
Aluna: Camila
2º Ano