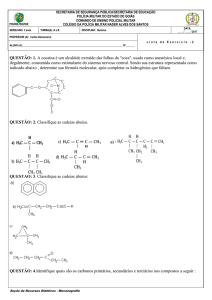
Universidade Federal Rural do Semi­Árido Lista de Exercícios 02 – Classificação das Cadeias Carbônicas 1‐ Defina: a) Carbono primário; b) Carbono secundário; c) Carbono terciário; d) Carbono quaternário; e) Cadeia homogênea; f) Cadeia heterogênea; g) Cadeia normal; h) Cadeia ramificada; i) Cadeia saturada; j) Cadeia insaturada. 2‐ Por que o carbono é a base para a Química Orgânica? 3‐ O átomo de carbono, no estado fundamental, apresenta dois elétrons p desemparelhados. Sendo assim, ele só poderia formar duas ligações sigma. Explique detalhadamente, fazendo distribuições eletrônicas, diagramas e desenhos representando os átomos e orbitais. a) Como é possível ele formar quatro ligações sigma? b) Como é possível ele formar três ligações sigma e uma pi? c) Como é possível ele formar duas ligações sigma e duas pi? 4‐ Como se dá a formação de ligações sigma? Exemplifique desenhando as sobreposições dos orbitais para a formação do etano. Qual o ângulo de ligação? Qual a estrutura do composto? 5‐ Como se dá a formação de ligações sigma e pi? Exemplifique desenhando as sobreposições dos orbitais para a formação do eteno. Qual o ângulo de ligação? Qual a estrutura do composto? 6‐ Como se dá a formação de ligações sigma e pi? Exemplifique desenhando as sobreposições dos orbitais para a formação do etino. Qual o ângulo de ligação? Qual a estrutura do composto? 7‐ O esqualeno é um dos últimos precursores para a biossíntese do colesterol. Tomando como base a molécula do esqualeno, responda: 1 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido b
a
c
e
d
f
Esqualeno
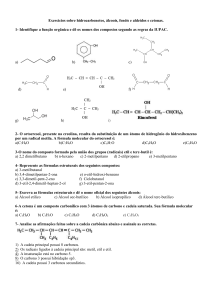
a) Classifique esta molécula quanto a sua organização estrutural. b) Identifique os carbonos primários, secundários, terciários e quaternários. c) Identifique o estado de hibridização de cada átomo de carbono. d) Para os átomos de carbono marcados com letras diga quantas ligações sigma e pi eles apresentam. e) Para os átomos carbono marcados com letras diga qual o ângulo que se forma entre as ligações. 8‐ O colesterol, uma molécula de grande importância, pois é necessária para a biossíntese de hormônios, da vitamina D e do ácido biliar. Tomando como base a molécula do colesterol, responda: CH3
e
CH3
H
H
HO
f
b
a
H
d
c
Colesterol
a) Classifique esta molécula quanto a sua organização estrutural; b) Identifique os carbonos primários, secundários, terciários e quaternários; c) Identifique o estado de hibridização de cada átomo de carbono; d) Para os carbonos marcados com letras diga quantas ligações sigma e pi eles apresentam; 2 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido e) Para os carbonos marcados com letras diga qual o ângulo que se forma entre as ligações. 9‐ Dentre os inseticidas de origem vegetal, um dos mais importantes é a nicotina cuja toxidez é conhecida há pelo menos 300 anos. É extraída da elaboração do fumo, submetidos a uma lixiviação com água acidulada. Tomando como base a molécula do colesterol, responda: N
R
N
Nicotina: R = CH3
Nornicotina: R = H
a) Classifique esta molécula quanto a sua organização estrutural; b) Identifique os carbonos primários, secundários, terciários e quaternários; c) Identifique o estado de hibridização de cada átomo de carbono; d) Para os carbonos marcados com letras diga quantas ligações sigma e pi eles apresentam; e) Para os carbonos marcados com letras diga qual o ângulo que se forma entre as ligações. 10‐ Sobre as estruturas abaixo: 3 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido Onde as bolas cinzas são carbonos, as bolas brancas são hidrogênios, as bolas verdes são cloros, as bolas vermelhas são oxigênios e as bolas azuis são nitrogênios. Passe as estruturas de bolas e varetas para: a) Fórmulas de traço; b) Fórmulas de linhas; c) Fórmulas condensadas. 11‐ Qual a diferença entre massa atômica, massa molar? 12‐ Qual a diferença entre fórmula empírica e fórmula molecular? 13‐ Calcule a fórmula empírica dos compostos orgânicos abaixo. Em seguida, usando os dados de uma tabela periódica, calcule a massa molar de cada uma das fórmulas empíricas encontradas. a) 85,6% C; 14,4%H; b) 40,0% C; 6,7% H; c) 40,7% C; 8,5% H; 23,8% N; d) 12,6% C; 3,2% H; 84,1% Br. 14‐ Um indivíduo morreu e seu corpo foi levado a autópsia. Após a análise de seu sangue constatou‐se que o indivíduo morreu devido uma intoxicação por ingerir em grande excesso uma substância desconhecida. A análise desta substância mostrou que ela continha somente carbono, hidrogênio e oxigênio. Em outra análise descobriu‐se que a massa molecular da substância desconhecida é 46 g/mol. Determine qual foi a substância causadora da morte deste indivíduo. Dados: C=52,24% e H=13,05%. 4 Prof. Ms. Zilvam Melo – Química Orgânica