UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS
CÂMPUS DE JABOTICABAL
ADAPTAÇÕES DO MÚSCULO GLÚTEO MÉDIO EM
EQÜINOS SUBMETIDOS A TREINAMENTO DE
RESISTÊNCIA E SUPLEMENTADOS COM DIFERENTES
CONCENTRAÇÕES DE ÓLEO DE SOJA
Carla Braga Martins
Orientador: Prof. Dr. José Corrêa de Lacerda Neto
Tese apresentada à Faculdade de Ciências Agrárias e
Veterinárias UNESP, Câmpus de Jaboticabal - como parte
das exigências para obtenção do título de Doutor em Medicina
Veterinária - área de concentração em Medicina Veterinária
(Clínica Médica Veterinária).
JABOTICABAL - SÃO PAULO - BRASIL
Janeiro de 2007
SUMÁRIO
Página
LISTA DE ABREVIATURAS ..................................................................................iii
LISTA DE FIGURAS ............................................................................................. IV
LISTA DE TABELAS.............................................................................................. V
RESUMO .............................................................................................................. VII
SUMMARY ......................................................................................................... VIII
I. INTRODUÇÃO......................................................................................................1
II. REVISÃO DE LITERATURA ...............................................................................3
2.1. CARACTERÍSTICAS DOS CAVALOS PURO SANGUE ÁRABE (PSA).........................3
2.2. ESTRUTURA DO MÚSCULO ESTRIADO ESQUELÉTICO ............................................4
2.3. GENERALIDADES DAS FIBRAS MUSCULARES.......................................................5
2.4. CARACTERÍSTICAS DAS PROTEÍNAS CONTRÁTEIS ................................................6
2.5. CONTRAÇÃO MUSCULAR...................................................................................8
2.6. CLASSIFICAÇÃO DOS TIPOS DE FIBRAS MUSCULARES ..........................................9
2.7. ADAPTAÇÕES DA MUSCULATURA ESQUELÉTICA ................................................14
2.8. CARACTERÍSTICAS DO MÚSCULO GLÚTEO MÉDIO ..............................................22
2.9. FONTES DE ENERGIA PARA A CONTRAÇÃO MUSCULAR ......................................22
2.10. PRODUÇÃO DE LACTATO ..............................................................................24
2.11. CAUSAS DE LIMITAÇÃO NO DESEMPENHO .......................................................26
2.12. IMPORTÂNCIA DA TÉCNICA DE BIÓPSIA PERCUTÂNEA.......................................26
III. MATERIAL E MÉTODOS .................................................................................29
3.1. ANIMAIS ........................................................................................................29
3.2. TESTE PARA DETERMINAÇÃO DA CURVA VELOCIDADE-LACTATO.........................31
3.3. PROGRAMA DE TREINAMENTO .........................................................................32
3.4. DETERMINAÇÃO DO PESO E ESCORE CORPORAL ...............................................33
3.5. COLHEITA DE AMOSTRAS MUSCULARES ...........................................................33
ii
3.6. PROCESSAMENTO DAS AMOSTRAS MUSCULARES .............................................38
3.7. ANÁLISES HISTOQUÍMICAS..............................................................................39
3.8. ANÁLISES MORFOMÉTRICAS............................................................................41
3.9. DETERMINAÇÃO DO GLICOGÊNIO TOTAL ...........................................................42
3.10. ANÁLISE ESTATÍSTICA...........................................................................43
IV. RESULTADOS.................................................................................................44
4.1. PESO E ESCORE CORPORAL ............................................................................44
4.2. TÉCNICA DE BIÓPSIA MUSCULAR .....................................................................45
4.3. IDENTIFICAÇÃO DOS TIPOS DE FIBRAS MUSCULARES .........................................46
4.4. MORFOMETRIA DAS FIBRAS MUSCULARES ........................................................50
4.5. QUANTIFICAÇÃO DO GLICOGÊNIO TOTAL ..........................................................53
4.6. RELAÇÃO TREINAMENTO X TIPO DE FIBRA X METABOLISMO ENERGÉTICO ............54
V. DISCUSSÃO .....................................................................................................56
VI. CONCLUSÕES ................................................................................................67
VII. REFERÊNCIAS...............................................................................................68
VIII. APÊNDICE.........................................................................................................I
iii
LISTA DE ABREVIATURAS
ADP - adenosina difosfato
ATP - adenosina trifosfato
CPM - cadeia pesada de miosina
EE - extrato etéreo
EPM - erro padrão da média
mATPase - adenosina trifosfatase miofibrilar ou miosina adenosina trifofatase
MS - matéria seca
NADH - nicotinamida adenina dinucleotídeo reduzida
PSA - Puro Sangue Árabe
Pi - ortofosfato inorgânico
iv
LISTA DE FIGURAS
Figura 1. Agulha de biópsia muscular tipo Bergström 6,0mm (Kruise). (a) agulha
guia contendo uma abertura; (b) cilindro cortante; (c) mandril...............34
Figura 2. Procedimentos para colheita da amostra muscular. (a) Local da
tricotomia (área de 25 cm2 aproximadamente), (b) infiltração do
anestésico local, (c) botão anestésico, (d) incisão de pele, (e) local
incisado, (f) inserção da agulha de biópsia muscular na incisão de
pele. A agulha possui marcações externas para auxiliar na colheita da
amostra na profundidade adequada....................................................36
Figura 3. Ilustração da ferida cirúrgica. (a) lesão imediatamente após a colheita
das amostras; (b) curativo realizado subseqüentemente.......................37
Figura 4. Amostra muscular no interior da abertura da agulha..............................38
Figura 5. Ilustração da evolução da cicatrização da ferida cirúrgica. (a) 0, (b) 1, (c)
2 e (d) 7 dias após a colheita da amostra...............................................46
Figura 6. Fotomicrografia de cortes transversais do músculo glúteo médio corados
mediante técnicas histoquímicas. a. mATPase após pré incubação ácida
(pH 4,5) e incubação alcalina (pH 10,5). b. NADH-TR. Observar o
padrão de organização em mosaico dos diferentes tipos de fibras. Obj.
20x..........................................................................................................48
Figura 7. Cortes histológicos transversais seriados do músculo glúteo médio
corados com as técnicas: a. mATPase, b. NADH-TR. Observam-se
fibras tipo I, IIA e IIAX (células grandes com reação na periferia) e IIX
................................................................................................................49
Figura 8. Curva velocidade-lactato de eqüinos cruza Árabe e PSA, submetidos a
treinamento de resistência durante sete semanas..................................55
v
LISTA DE TABELAS
Tabela 1. Distribuição dos animais em grupos experimentais com base na dieta
alimentar fornecida (0, 6, 12, 18 e 24% de adição de óleo....................30
Tabela 2. Protocolo de treinamento dos eqüinos na esteira rolante......................32
Tabela 3. Médias ± erro padrão da média (EPM) do peso e escore corporal de
eqüinos cruza Árabe e Puro Sangue Árabe (PSA) submetidos à
suplementação com diferentes concentrações com óleo de soja..........44
Tabela 4. Médias ± EPM do peso e escore corporal de eqüinos cruza Árabe e
PSA,
submetidos
a
treinamento
de
resistência
durante
sete
semanas...............................................................................................44
Tabela
5.
Colorações
histoquímicas
observadas
nas
fibras
musculares
avaliadas.................................................................................................47
Tabela 6. Efeito da suplementação com óleo de soja sobre a freqüência (%) ±
EPM dos tipos de fibras do músculo glúteo médio de eqüinos cruza
Árabe e PSA .......................................................................................50
Tabela 7. Freqüência (%) ± EPM dos tipos de fibras do músculo glúteo médio de
eqüinos cruza Árabe e PSA, submetidos a treinamento de resistência
durante sete semanas............................................................................51
Tabela 8. Efeito da suplementação com óleo de soja ± EPM sobre a área média
de secção transversal dos tipos de fibras do músculo glúteo médio de
eqüinos cruza Árabe e PSA ...................................................................51
Tabela 9. Área média de secção transversal (µm2) ± EPM dos tipos de fibras do
músculo glúteo médio de eqüinos PSA, submetidos a treinamento de
resistência durante sete semanas..........................................................52
vi
Tabela 10. Efeito da suplementação com óleo de soja ± EPM sobre a área relativa
dos tipos de fibras do músculo glúteo médio de eqüinos cruza Árabe e
PSA .....................................................................................................52
Tabela 11. Área relativa (%) ± EPM dos tipos de fibras do músculo glúteo médio
de eqüinos cruza Árabe
e PSA, submetidos a treinamento de
resistência durante sete semanas.......................................................53
Tabela 12. Médias ± EPM do glicogênio total presente nas fibras do músculo
glúteo médio de eqüinos cruza Árabe e PSA, submetidos a diferentes
concentrações de óleo de soja............................................................53
Tabela 13. Médias ± EPM do glicogênio total presente nas fibras do músculo
glúteo médio de eqüinos cruza Árabe e PSA, submetidos a treinamento
de resistência durante sete semanas...................................................54
Tabela 14. Freqüência e área relativa das fibras oxidativas e glicolíticas antes e
após o período de treinamento............................................................55
Tabela 15. Composição percentual e química dos concentrados experimentais....II
Tabela 16. Escala de avaliação do escore corporal...............................................III
vii
ADAPTAÇÕES DO MÚSCULO GLÚTEO MÉDIO EM EQÜINOS SUBMETIDOS A
TREINAMENTO DE RESISTÊNCIA E SUPLEMENTADOS COM ÓLEO DE SOJA
RESUMO - Objetivou-se avaliar o efeito da suplementação com diferentes
concentrações de óleo de soja e do treinamento de resistência nas adaptações do
músculo glúteo médio de 20 eqüinos da raça Puro Sangue Árabe. Os animais
foram distribuídos em cinco grupos, cada grupo foi composto por quatro cavalos.
O grupo controle não recebeu óleo e os demais foram suplementados com 6, 12,
18 e 24% de óleo. Os animais foram submetidos a sete semanas consecutivas de
exercício em esteira rolante e trilha. Analisou-se a influência do treinamento e da
suplementação com óleo sobre o peso e escore corporal, concentração de
glicogênio muscular e características das fibras do músculo glúteo médio. Os
resultados demonstraram que as diferentes concentrações de óleo na dieta não
influenciaram as variáveis estudadas. Houve redução significativa do peso
corpóreo após o treinamento, no entanto o escore corporal permaneceu constante.
O músculo glúteo médio expressou três tipos de fibras puras: I, IIA, IIX. O
treinamento não induziu hipertrofia das fibras do músculo glúteo médio. O
treinamento ocasionou aumento na proporção e na área relativa das fibras tipo IIA
em detrimento das fibras IIX, melhorando a capacidade oxidativa muscular. Tanto
as dietas com óleo como o treinamento não aumentaram as concentrações de
glicogênio muscular.
Palavras-chave: Eqüinos, músculo glúteo médio, biópsia muscular, glicogênio
muscular.
viii
GLUTEUS MEDIUS MUSCLE ADAPTATIONS OF ARABIAN HORSES
SUBMITTED TO ENDURANCE TRAINING AND SUPPLEMENTED WITH TO
SOY OIL
SUMMARY – The aim of this study was evaluate the effects of
supplementation with different concentrations of soy oil and endurance training on
gluteus medius muscle adaptations in twenty Arabian horses. The horses were
randomized in five groups (four horses each group). The control group did not
receive the oil and the other groups were supplemented with 6%, 12%, 18% and
24% of soy oil. The animals were submitted to seven weeks of exercise on
treadmill and track. The influence of training and oil supplementation on body
weight, corporal score, muscular glycogen stores and characteristics of the gluteus
medius
muscular
fibers
were
analyzed.
The
results
showed
that
the
supplementation of soy oil in diet was not significantly effective on the studied
parameters. There was a significant reduction of the body weight after the end of
training; however the corporal score showed no changes. The gluteus medius
muscle expressed three types of pure fibers: I, IIA and IIX. The training induced a
increase in the proportion and relative area of the type IIA fibers in detriment of
type IIX fibers, improving the oxidative capacity muscular. No hypertrophy of the
muscular fibers was observed. There were no significant changes in the values of
the total glycogen after the training period.
Keywords: Equine, gluteus medius muscle, muscular biopsy, muscular glycogen.
I. INTRODUÇÃO
A utilização do cavalo para a prática de esportes vem aumentando no Brasil
e no mundo. Nos últimos anos muitas pesquisas sobre fisiologia do exercício têm
sido realizadas em eqüinos, estudando a resposta desta espécie a diferentes
estímulos, como o treinamento e a dieta alimentar.
Cada vez mais os cavalos são vistos como atletas e submetidos a
protocolos de treinamento que visam a melhoria de seu desempenho. Dentre os
esportes eqüestres mais praticados se destaca o enduro, caracterizado por ser
uma prova de resistência. Esta modalidade de esporte hípico surgiu nos Estados
Unidos em 1955, se expandiu pela Europa e chegou ao Brasil em 1989, onde
desde então, apresenta crescimento relevante.
Os animais que participam desta atividade estão sujeitos a inúmeros tipos
de estresse, quer pelo treinamento excessivo quer pela natureza exaustiva da
modalidade. Para isso, a adequada preparação física é fundamental e diminui os
riscos de exaustão. É do interesse de cavaleiros e técnicos que os cavalos
possam desempenhar da melhor forma possível o seu papel durante a
competição, sem comprometimento de sua saúde. Com
isso, torna-se
imprescindível condicionar os animais, destacando as qualidades de resistência,
sem causar-lhes transtornos físicos.
O sistema muscular possui participação primordial no exercício, pois todo
movimento é o resultado da contração de músculos esqueléticos por meio de uma
articulação móvel. As fibras musculares exibem alta capacidade de adaptar-se
estruturalmente frente ao trabalho muscular aos quais os animais são submetidos.
Tais adaptações envolvem trocas estruturais e metabólicas, que determinam a
capacidade de locomoção e trabalho de um cavalo e, portanto, seu desempenho
em programas de treinamento. Algumas dessas respostas adaptativas envolvem,
entre outras coisas, características relacionadas à demanda energética em função
do trabalho muscular desempenhado.
2
Com a evolução dos estudos foram desenvolvidas técnicas para se
pesquisar o efeito do exercício sobre as fibras musculares. O uso combinado
dessas diferentes técnicas de análise muscular fornece informação suficiente para
identificar corretamente o fenótipo miofibrilar; determinar o tipo de metabolismo
que o músculo utiliza para obter a energia química e transformá-la em mecânica e
proporciona informação à cerca do tamanho dos diferentes tipos de fibras dos
músculos. Desta forma, este estudo teve como objetivo avaliar os efeitos do
treinamento orientado pela curva velocidade-lactato e da suplementação alimentar
com diferentes concentrações de óleo de soja sobre as características
morfológicas e bioquímicas do músculo glúteo médio de eqüinos cruza Árabe e
PSA submetidos a treinamento de resistência em esteira rolante e trilha.
3
II. REVISÃO DE LITERATURA
2.1. Características dos cavalos Puro Sangue Árabe (PSA)
A mais antiga raça de cavalos no mundo foi registrada nos hieróglifos
egípcios 1800 anos antes de Cristo. O cavalo Árabe foi apreciado durante 3500
anos devido a sua extraordinária capacidade como animal de montaria, pela
velocidade, resistência, agilidade e inteligência. Foram necessários mais de três
milênios de seleção para se obter o cavalo de guerra do deserto, capaz de resistir
a prolongados períodos de trabalho intenso com o mínimo de cuidado e
alimentação. Essas qualidades persistem em seu fenótipo e são reconhecidas até
hoje, por meio de competições de longo percurso nos Estados Unidos da América
e na Europa. No Brasil, onde essas provas também são realizadas, o PSA se
destaca sempre nas primeiras colocações. No trabalho da fazenda, os criadores
se surpreendem com a produtividade diária, capaz de pronta recuperação após
um dia inteiro de atividade (PERROY, 2006).
Os três mil anos de seleção e aprimoramento do cavalo Árabe
proporcionaram-lhe qualidades genéticas incomparáveis. A partir da Idade Média,
garanhões árabes foram exportados para quase todas as partes do mundo, dando
origem a outras raças e regenerando plantéis inteiros de cavalos. Dentre suas
aptidões, o PSA participa de esportes hípicos como salto, adestramento em
categorias intermediárias, hipismo rural, enduro e trabalho agropecuário, se
destacando em provas de longa distância devido a sua resistência (PERROY,
2006).
4
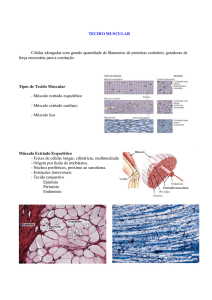
2.2. Estrutura do músculo estriado esquelético
O músculo esquelético, assim denominado porque se insere no esqueleto,
é o tecido mais abundante do corpo, compreendendo cerca de 40% do peso
corporal dos mamíferos. No cavalo da raça Puro Sangue Inglês, a musculatura
esquelética constitui 52% do peso corpóreo, comparada com 42% em outras raças
(GOLL, 1996).
O músculo esquelético eqüino é um tecido heterogêneo, composto por
diferentes tipos de fibras musculares, capaz de realizar ampla variedade de
atividades físicas devido a grande diversidade celular, molecular, especialização
funcional e capacidade plástica. Essa característica proporciona ao tecido
muscular a capacidade de gerar um amplo tipo de atividades de contração, a qual
se traduz em maior eficiência mecânica e termodinâmica do organismo
(GOLDSPINK,1998). As variedades de funções desempenhadas pelos músculos
requerem diferentes proporções de tipo de fibra, acarretando assim diferenças na
composição de fibras entre os músculos, as quais exibem propriedades mecânicas
e metabólicas distintas (LUTZ et al., 1998).
Os músculos esqueléticos dos mamíferos são compostos por fascículos de
fibras musculares unidos por meio de tecido conectivo. A camada mais externa
que envolve o músculo é denominada epimísio. O perimísio é o tecido conectivo
que envolve feixes individuais de fibras musculares denominados fascículos. Cada
fibra muscular é revestida por tecido conectivo denominado endomísio. A unidade
morfofuncional do músculo esquelético é a fibra muscular. Essas fibras
representam o resultado coordenado da expressão de distintas proteínas
estruturais e enzimas metabólicas (POWERS & HOWLEY, 2000).
O padrão de inervação estabelecido determina as propriedades fisiológicas
das fibras musculares, culminando com a formação das unidades motoras,
elemento funcional constituído pelo neurônio motor e fibras musculares
associadas (GONZALES & SARTORI, 2002).
5
Um dos aspectos microscópicos mais distintos nos músculos esqueléticos é
sua aparência estriada. Tais estriações são produzidas pela alternância entre
bandas claras e escuras que aparecem ao longo do comprimento da fibra devido a
distribuição ordenada dos filamentos longitudinais de diferentes espessuras, os
quais correspondem às proteínas contrateis, actina e miosina (POWERS &
HOWLEY, 2000; BLANCO & PÉREZ, 2004).
2.3. Generalidades das fibras musculares
As fibras musculares são células altamente especializadas, apresentam
inúmeras organelas, são multinucleadas, cujos núcleos estão localizados ao redor
da periferia da célula e abaixo do sarcolema (POWERS & HOWLEY, 2000). De
acordo com SNOW & VALBERG (1994), as fibras do músculo esquelético dos
eqüinos contêm de 100 a 200 núcleos. Entre o sarcolema e a membrana basal
encontram-se as células satélites, importantes na reparação de injúrias
musculares. Uma quantidade variável de retículo endoplasmático liso e rugoso,
aparelho de Golgi e lisossomos estão normalmente localizados próximo dos
núcleos das células musculares. Numerosas proteínas, incluindo a mioglobina e
enzimas envolvidas na glicólise estão distribuídas no sarcoplasma. Grânulos de
glicogênio e variável quantidade de gotículas de lipídeos também estão
distribuídos pelo sarcoplasma entre os miofilamentos e sob o sarcolema. Enzimas
envolvidas no metabolismo oxidativo estão localizadas dentro das membranas
mitocondriais. As mitocôndrias dos músculos dos eqüinos estão concentradas
abaixo do sarcolema, particularmente associadas aos capilares, embora também
sejam encontradas entre as miofibrilas.
No sarcoplasma do músculo, existe uma extensa rede de canais
membranosos que envolvem cada miofibrila e correm paralelamente a elas. Esses
canais são denominados de retículo sarcoplasmático e armazenam cálcio, o qual
6
possui grande importância para a contração muscular (POWERS & HOWLEY,
2000).
As fibras musculares estão organizadas em numerosas estruturas
fusiformes presentes no sarcoplasma, denominadas miofibrilas, caracterizadas por
apresentar composição molecular diversa e constituir as estruturas intracelulares
que durante a contração muscular convertem a energia química em mecânica. As
miofibrilas são compostas por dois filamentos protéicos, os filamentos espessos
de miosina e finos de actina (POWERS & HOWLEY, 2000; BLANCO & PÉREZ,
2004).
Cada espécie possui uma distribuição fibrilar característica na musculatura
esquelética. Nos eqüinos, assim como na maioria dos mamíferos, as fibras
musculares seguem o padrão de distribuição denominado mosaico, devido as
fibras tipo I, IIA e IIX pertencentes a diferentes unidades motoras se entremearem
umas com as outras (RIVERO & PIERCY, 2004).
2.4. Características das proteínas contráteis
2.4.1 Miosina
A miosina é uma proteína constituída por seis cadeias polipeptídicas, sendo
quatro cadeias leves e duas cadeias pesadas (POWERS & HOWLEY, 2000). É
considerada a proteína contrátil mais abundante do músculo esquelético e
representa um terço do total das proteínas musculares (PICARD et al., 2002),
constitui a molécula motora da contração muscular. É o componente principal dos
filamentos grossos das miofibrilas (SELLERS, 2000).
As isoformas de cadeia pesada de miosina (CPM) constituem proteínas
com pequenas diferenças entre si. A molécula da miosina apresenta dois
extremos terminais, um corresponde à porção amino e o outro a porção carboxil. A
porção amino forma a cabeça da miosina, componente essencial que atua como
7
motor durante o sistema de geração de forças do músculo, devido aos sítios ativos
que possui para a união com a actina e com a enzima mATPase, responsável pela
hidrólise do ATP em difosfato de adenosina e fosfato inorgânico (GALLER et al.,
1997; KARLSSON et al., 1999). O terminal carboxil das cadeias pesadas de
miosina se enrola sobre si mesmo, para formar a cauda da miosina (LENNINGER,
1981).
As proteínas que caracterizam a célula muscular esquelética são
codificadas por uma família multigênica, denominada isoformas (SCHIAFFINO &
REGGIANI, 1996; EDDINGER, 1998, BOTTINELLI & REGGIANI, 2000). Essas
apresentam características bioquímicas, estruturais e fisiológicas comuns, mas
demonstram distinções na seqüência de aminoácidos, manifestando ligeiras
diferenças nas atividades biológicas, como a atividade da mATPase e a afinidade
ao cálcio. E, ademais, constituem parte essencial do sistema contrátil do músculo
(PERRY, 1985).
As isoformas de miosina de cadeia pesada e leve dos músculos
esqueléticos possuem como função a regulação das propriedades contráteis das
fibras musculares, determinando a velocidade máxima de contração muscular. A
velocidade e a força de contração muscular dependem da quantidade de fibras
musculares ativas, de suas propriedades contráteis e metabólicas. A velocidade
máxima de encurtamento de uma única fibra muscular está correlacionada com as
isoformas de CPM que predominam nas fibras musculares (SCHIAFFINO &
REGGIANI, 1996; McKOY et al., 1998; RIVERO & PIERCY, 2004).
A expressão e o desenvolvimento das diferentes isoformas de miosina no
músculo esquelético são regulados pela interação de múltiplos mecanismos de
controles, dentro dos quais se destacam os fatores neuronais, hormonais e
mecânicos (SCHIAFFINO & REGGIANI, 1996; TALMADGE, 2000; LEFAUCHEUR,
2001).
Nos mamíferos, incluindo o homem, se conhecem nove isoformas de
cadeia pesada de miosina, e cada uma delas é codificada por um gene diferente,
8
apresentando atividade mATPase particular (BOTTINELLI & REGGIANI, 2000;
ALLEN & LEINWAND, 2001; DA COSTA et al., 2002).
2.4.2 Actina
Os filamentos delgados são formados principalmente pela actina, a nebulina
e proteínas reguladoras (tropomiosina e troponina) que possuem importante papel
na regulação do processo contrátil. A actina constitui a principal proteína desse
grupo (EDDINGER, 1998). As fibras musculares dos mamíferos expressam duas
isoformas de actina, a esquelética e a cardíaca. A parte terminal amino (NH2) da
actina interage com a cabeça da miosina (SCHIAFFINO & REGGIANI, 1996) e
conjuntamente formam a unidade contrátil do músculo (BOTTINELLI & REGGIANI,
2000).
2.5. Contração muscular
A energia para a contração muscular é oriunda da degradação do ATP pela
enzima mATPase presente na cabeça da miosina, originando difosfato de
adenosina e fosfato inorgânico e liberando energia que irá energizar as pontes
cruzadas de miosina, ocorrendo a união da cabeça da miosina ao filamento de
actina. Como resultado, ocorre alteração conformacional da molécula da miosina e
parte da energia liberada é utilizada para produção de movimento entre os
filamentos, onde os filamentos de actina deslizam sobre os filamentos de miosina.
Ao final dessa seqüência, os produtos da hidrólise do ATP são liberados e se
unem novamente reconstituindo a molécula de ATP (POWERS & HOWLEY,
2000).
O fator desencadeante da contração muscular é a chegada de um impulso
nervoso à junção neuromuscular. A geração de um potencial de ação num
9
motoneurônio provoca a liberação de acetilcolina na junção neuromuscular, essa
se liga aos receptores da placa motora, causando despolarização na membrana
celular, a qual é conduzida através dos túbulos transversos profundamente na
fibra muscular, resultando na liberação do cálcio do retículo sarcoplasmático. O
cálcio se liga à troponina, alterando a posição da tropomiosina e descobrindo os
sítios ativos da actina. A ponte cruzada da miosina energizada forma uma ligação
forte no sítio ativo da actina. Esse ciclo da contração é repetido enquanto houver
cálcio e ATP presentes e se rompe quando cessam os potenciais de ação e o
retículo sarcoplasmático remove ativamente o cálcio do sarcoplasma (POWERS &
HOWLEY, 2000).
2.6. Classificação dos tipos de fibras musculares
Ao longo do tempo, para o estudo das características fibrilares, tanto em
músculos de animais como em humanos, vem se aplicando diversas
classificações, fundamentadas em técnicas que avaliam parâmetros bioquímicos,
estruturais, funcionais e histoquímicos da fibra muscular. A diferenciação clássica
dos tipos de fibras se baseava na coloração que conferiam ao músculo, vermelho
ou branco, segundo o seu conteúdo de mioglobina. Dessa forma, os músculos
com mais de 40% de fibras vermelhas foram denominados vermelhos. Ao
contrário, os que possuíam mais de 40% de fibras pálidas, recebiam o nome de
músculos brancos (BEECHER et al., 1965).
Atualmente, o sistema de classificação das fibras musculares mais
comumente empregado é o histoquímico, que consiste no tratamento do tecido
muscular com técnicas histoquímicas ou histoenzimáticas que permitem identificar
de forma simples e rápida os diferentes tipos de fibras. A análise histoquímica
mais utilizada se baseia nas propriedades contráteis das fibras, a partir da
determinação do grau de reatividade da atividade da enzima adenosina
trifosfatase miofibrilar (mATPase) presente na fibra muscular em meio ácido ou
10
alcalino, proposto por PADYKULA & HERMAN (1955) citado por BOTTINELLI &
REGGIANI (2000).
ENGEL (1962) aplicou as análises mencionadas em músculo humano
definindo as fibras tipos I e II. BROOKE & KAISER (1970), melhorando a técnica
da atividade mATPase mediante pré-incubação ácida, demonstraram na
musculatura humana a subdivisão do tipo II em subtipos IIA, IIB e IIC.
Outra técnica histoquímica amplamente utilizada para a identificação fibrilar
se fundamenta na determinação das propriedades metabólicas e proporciona
informações sobre o substrato utilizado pela fibra muscular para obter energia. Por
meio desta técnica é possível diferenciar as fibras com baixa capacidade
oxidativa, as quais contêm elevadas concentrações de enzimas sarcoplasmáticas
das fibras com alta capacidade oxidativa, que contêm por sua vez, elevadas
concentrações
de
enzimas
mitocondriais
dentre
as
quais
a
succinato
desidrogenase (RIVERO et al., 1993b).
GAUTHEIR (1969) citado por KLONT et al. (1998), determinou a
capacidade oxidativa da fibra muscular utilizando como marcador do padrão
oxidativo a enzima succinato desidrogenase (SDH), e identificou três tipos de
fibras, as quais denominou segundo a tonalidade predominante como fibras
vermelhas, intermediárias e brancas. ASHMORE & DOERR (1971), associaram
técnicas histoquímicas de atividade da mATPase e da enzima succinato
desidrogenase (SDH) e descreveram três tipos de fibras: mATPase resistente e
metabolismo oxidativo, mATPase ácido lábil e metabolismo oxidativo-glicolítico e
mATPase ácido lábil e metabolismo glicolítico.
A caracterização morfológica, bioquímica e fisiológica das fibras musculares
esqueléticas de mamíferos foram aperfeiçoadas com a utilização de técnicas
histoquímicas e imunohistoquímicas por PETER et al. (1972); SNOW et al. (1982);
RIVERO (1993b).
PETER et al. (1972), estudaram as propriedades motoras e metabólicas
das fibras musculares, objetivando identificar as características fibrilares segundo
as propriedades contráteis e o grau de resistência à fadiga. Para tanto, tais
11
pesquisadores utilizaram como marcador do padrão oxidativo da fibra muscular a
enzima nicotinamida adenina dinucleotideo desidrogenase (NADH). Esta enzima
se encontra na face interna da membrana mitocondrial e sua função é catalizar a
transferência de elétrons do NADH2 a compostos citocromos, e por último ao
oxigênio, na cadeia de transporte de elétrons (DUBOTWITZ & BROOKE, 1973).
Essas técnicas possibilitaram a identificação de unidades motoras com proteínas
contráteis e metabólicas peculiares, dentre as quais destacaram-se as fibras
oxidativas de contração lenta, que possuem unidades motoras resistentes à fadiga
e metabolismo oxidativo; fibras rápidas glicolíticas-oxidativas, com atividade
metabólica tanto glicolítica como oxidativa, média resistência à fadiga; e as fibras
rápidas glicolíticas, as quais se caracterizam por apresentarem unidades motoras
facilmente fatigáveis e metabolismo glicolítico.
Apesar do uso extensivo e simplicidade de execução, as técnicas
histoquímicas apresentam certas limitações para a identificação correta do
fenótipo fibrilar, devido a grande variabilidade da atividade mATPase entre os
diversos tipos de fibras presentes no músculo esquelético (GORZA, 1990). Dessa
forma, para reduzir a porcentagem de erro na identificação deve-se associar
técnicas mais sensíveis que permitam determinar a heterogeneidade das fibras
musculares. Entre essas técnicas se destacam a eletroforese, imunohistoquímica,
hibridação in situ e reação da cadeia de polimerase (PCR). O princípio básico
dessas provas consiste em definir as isoformas específicas das cadeias pesadas e
leves de miosina, já que cada tipo de fibra muscular expressa uma isoforma
diferente que demonstra divergências em atividades contráteis, atividade
mATPase, velocidade de contração e produção de força. A atividade da mATPase
está intimamente relacionada ao
predomínio do tipo de isoformas, que
determinará as propriedades contráteis das fibras musculares (CHIKUNI et al.,
2001).
RIVERO et al. (1996, 1999), através da técnica de ELISA e eletroforese
identificaram três tipos de isoformas MHC presentes em diferentes músculos de
cavalos, uma lenta (MHC-I) e duas rápidas (MHC-IIA e MHC-IIX). Através da
12
imunohistoquímica definiram três tipos de fibras puras I, IIA e IIX e duas híbridas
IIC e IIAX. Estes métodos integrados demonstraram que o músculo esquelético
eqüino não expressa isoforma tipo IIB e fibras assim denominadas deveriam
receber a denominação de fibras IIX (RIVERO et al., 1999; SERRANO & RIVERO,
2000; ETO et al., 2003).
As fibras híbridas também são denominadas intermediárias, pois são
consideradas resultados do estado de transição fenotípica entre dois tipos de
fibras puras que pode ser estimulado pelo treinamento ou destreinamento, ou pelo
envelhecimento (PEUKER & PETTE, 1997; LEFAUCHEUR et al., 1998; PICARD
et al., 2002). Essas fibras possuem alto potencial de adaptação, já que são
capazes de alterar o fenótipo das isoformas de cadeia pesada de miosina quando
a demanda funcional do músculo necessita (BALDWIN & HADDAD, 2001).
As fibras híbridas podem ser identificadas com a utilização de anticorpos
específicos, os quais reagem com as isoformas de cadeia pesada de miosina das
fibras musculares esqueléticas (PICARD et al., 2003). Essas fibras são
caracterizadas por expressar mais de uma isoforma de cadeia pesada de miosina
(STARON et al., 1999; PICARD et al., 2002; STRBENC et al., 2004).
As fibras tipo IIC são encontradas em quantidades relativamente grandes
em animais muito jovens, porém são raras no eqüino adulto, no qual geralmente
são citadas como fibras de transição (SANTOS, 2002).
2.6.1 Fibras tipo I
A isoforma de cadeia pesada de miosina expressada por essas fibras é a
tipo I. Foram primeiramente denominadas células vermelhas devido a coloração
avermelhada que conferiam ao músculo dada a grande concentração de
mioglobina presente no seu citoplasma. Posteriormente, considerando suas
características funcionais e metabólicas foram classificadas como fibras de
contração lenta e metabolismo oxidativo. Apresentam baixas concentrações da
13
enzima mATPase (BOTTINELLI et al., 1994), a qual lhes confere baixa
capacidade para hidrolisar o ATP (ROSE, 1986). Possuem metabolismo oxidativo,
consumindo glicose e ácidos graxos através do metabolismo aeróbio. Utilizam a
oxidação dos ácidos graxos que estão distribuídos amplamente nos espaços
miofibrilares do interior da fibra muscular como fonte preferencial de energia. Para
que ocorra o processo de oxidação é necessário amplo fornecimento sangüíneo
para o transporte de oxigênio e ácidos graxos. Por isso, essas células são
altamente vascularizadas e possuem elevado conteúdo mitocondrial. Nas
mitocôndrias ocorrem as reações do ciclo de Krebs com a utilização do oxigênio
para a produção de energia, indispensável para a contração muscular.
Apresentam número expressivo de núcleos, os quais lhes conferem grande
atividade metabólica, capacitando-as para a síntese e o desdobramento rápido de
suas próprias proteínas (POWERS & HOWLEY, 2000). Possuem pequeno
tamanho, o que facilita a difusão rápida do oxigênio e de substratos à mitocôndria.
Apresentam elevada resistência à fadiga muscular, pois são dotadas estrutural e
bioquimicamente para gerar força muscular durante um período prolongado de
tempo, realizar movimentos repetitivos lentos e manter uma força isométrica a
custa da produção de elevada taxa de energia a partir das rotas aeróbias (SIECK
et al., 1995; PICARD et al., 2002).
2.6.2 Fibras tipo IIA
Essas fibras expressam a isoforma de cadeia pesada de miosina tipo IIA e
apresentam características entre as fibras do tipo I e IIX. São designadas como
células de contração rápida, possuem muitas mitocôndrias e são irrigadas por
grande número de vasos sangüíneos, apresentam elevado conteúdo de
mioglobina, o que lhes confere tonalidade avermelhada. Armazenam mais
oxigênio e lipídeos, e menos glicogênio do que as fibras IIX, podendo, portanto,
apresentar metabolismo glicolítico e oxidativo. Estão adaptadas ao metabolismo
14
aeróbio devido ao conteúdo intermediário de mitocôndrias, que lhes proporciona
resistência à fadiga e capacidade glicolítica moderada a baixa. Sua contração é
rápida e sustentável por razoável período de tempo (PICARD et al., 1995;
QUIROZ-ROTHE & RIVERO, 2001).
2.6.3 Fibras tipo IIX
As fibras IIX possuem metabolismo energético glicolítico e expressam a
isoforma de cadeia pesada de miosina tipo IIX. Consomem glicose por meio do
metabolismo anaeróbio com desenvolvimento de força maior do que aquela
descrita para as fibras tipo I. A velocidade de contração das fibras tipo IIX é rápida,
similar às fibras tipo IIA, porém não conseguem sustentar esta contração por muito
tempo (BOTTINELLI et al., 1991). Segundo SWASH & SCHWARTZ (1981) e
HILDEBRAND (1995), as fibras glicolíticas tipo IIX são pouco vascularizadas,
apresentam baixa concentração de mioglobina e poucas mitocôndrias, pois o
metabolismo aeróbio é menos importante.
Com relação ao tamanho, são geralmente maiores que as fibras tipo I e IIA
(PICARD et al., 1995). Apresentam extenso retículo sarcoplasmático que lhes
permite rápida liberação de íons cálcio. Estão bem adaptadas para saltos, corridas
e outros movimentos vigorosos e breves (PICARD et al., 1995; QUIROZ-ROTHE &
RIVERO, 2001).
2.7. Adaptações da musculatura esquelética
O músculo pode ser considerado, dentre todos os tecidos, como um dos
sistemas de maior capacidade adaptativa. Devido a sua plasticidade o tecido
muscular é capaz de modificar suas características morfológicas e funcionais
como resposta a diversos estímulos. Dentre os fatores que exercem influência
15
sobre as características do tecido muscular destacam-se a idade, sexo,
alimentação, função do músculo, hormônios, inervação, exercício, raça e genética
(KARLSSON et al., 1999; BROCKS et al., 2000; LEFAUCHEUR et al., 2003).
A capacidade máxima de interconversão entre os diferentes tipos de fibras
é limitada, e depende de um estímulo adequado. Desta forma, o estímulo pode
fazer uma fibra muscular, inicialmente adaptada para a contração rápida passar a
expressar isoformas de contração lenta, tornando-se de contração lenta, e viceversa (GONDIM, 2005).
2.7.1 Alimentação
Segundo HAMBLETON et al. (1980) a adição de óleo como fonte de
energia e a adaptação dos animais ao metabolismo lipídico produz efeito
poupador de glicogênio, importante para o animal persistir no exercício. JONES et
al. (1992) relataram que a suplementação com óleo promove aumento do
armazenamento e redução da mobilização do glicogênio. Segundo estes
pesquisadores, isto pode ser conseqüência da maior utilização dos ácidos graxos
como substrato para a produção de energia, favorecendo a melhora da
performance aeróbia e anaeróbia.
2.7.2 Genética e Raça
Durante o desenvolvimento embrionário dos mamíferos, as células
musculares iniciais começam a expressar proteínas contráteis específicas antes
do músculo ser inervado. Dessa forma, o fenótipo da fibra muscular aparenta ser
uma
propriedade
geneticamente
ARMBRUSTMACHER, 1999).
determinada
da
célula
(HAYS
&
16
Nos eqüinos, as diferenças individuais existentes em uma mesma raça,
referentes à composição das fibras musculares, estão relacionadas com as
características genéticas e fenotípicas (HODGSON et al., 1986; RIVERO et al.,
1993a; SNOW & VALBERG, 1994; ESSÉN-GUSTAVSSON et al., 1980).
As variedades na composição fibrilar de músculos podem ser observadas
entre as raças. Essas diferenças estão relacionadas às características de
desempenho, para as quais a raça foi selecionada. No cavalo, a distinção é mais
evidente no músculo glúteo médio, um dos maiores e mais importantes músculos
para a produção de força propulsora. Existem também variações na área das
fibras e na capacidade oxidativa entre as raças e dentro delas (PETTE &
STARON, 1997). Cada cavalo possui propensão genética para determinado tipo
de atividade, que pode ser mais bem aproveitada se houver treinamento
apropriado (LEWIS, 1995).
As proporções das fibras do tipo I e do tipo II são estáveis dentro de uma
raça (RIVERO et al., 1989). Segundo esses mesmos autores, a proporção média
das fibras do tipo II é menor nos cavalos das raças American Trotter, Árabe e
Andaluz em relação a animais da raça Puro Sangue Inglês.
2.7.2 Inervação
As propriedades de uma fibra em particular, são determinadas pela sua
inervação, sendo que todas as fibras relacionadas com o mesmo neurônio motor
possuem propriedades similares, mas não idênticas (SNOW & VALBERG, 1994).
A inervação do músculo pode alterar os tipos de miofibrilas, como exemplo,
após lesão de desnervação, a reinervação de fibras de contração lenta por
neurônio motor de fibras de contração rápida faz com que as fibras lentas recéminervadas assumam as características de contração rápida. Acredita-se que o
padrão ou o índice de descarga do neurônio motor inferior desempenhe papel
importante nesse processo (HAYS & ARMBRUSTMACHER, 1999).
17
2.7.3 Função do músculo
Os músculos esqueléticos de eqüinos são compostos por diferentes tipos
de fibras. As fibras musculares que realizam atividades em condições aeróbias se
mesclam com as fibras de caráter metabólico anaeróbio ou intermediário. Em
conseqüência, a distribuição e a proporção dessas fibras determinam o grau de
especialização do músculo. Devido a este fato, as diferenças entre os músculos
esqueléticos e função são determinadas pela presença e distribuição dos
diferentes tipos de isoformas de proteínas contráteis e regulatórias das miofibrilas
(PERRY, 1985).
As fibras tipo I, de contração lenta, são ativadas em atividades que
requerem a manutenção de atividade durante períodos prolongados, como as
funções posturais ou exercício de resistência. Em contrapartida, as fibras tipo IIA
estão associadas com atividades que requerem o desenvolvimento de forças
rápidas e prolongadas. Enquanto que as fibras tipo IIX são ativadas quando se
requer o desenvolvimento de forças rápidas e breves, portanto são recrutadas em
exercícios de alta intensidade e curta duração (ALECKOVIC et al., 1989).
Os músculos propulsores estão situados proximalmente à coxa e atuam em
curtos períodos de tempo, possuem poucas fibras tipo I e maior porcentagem de
fibras tipo II com grande velocidade de contração (ESSÉN-GUSTAVSSON et al.,
1994; MAYORAL et al., 1999).
2.7.4 Exercício ou treinamento
As adaptações da musculatura esquelética durante o exercício e após um
período de treinamento físico podem ser observadas de forma macroscópica,
microscópica e bioquímica (ERIKSON, 1996).
O exercício físico, espontâneo ou induzido, dependendo da duração,
freqüência e intensidade, e pode gerar modificações na estrutura do tecido
18
muscular (ESSÉN-GUSTAVSSON & LINDHOLM, 1985; RIVERO et al., 1993a,
SUCRE et al., 1999).
O exercício espontâneo é aquele que o animal realiza no desenvolvimento
normal de suas atividades sem estar submetido a nenhum treinamento. Esse tipo
de atividade física parece exercer efeito positivo sobre todos os músculos
implicados no exercício, já que tende a incrementar ligeiramente o metabolismo
oxidativo, aumentando a proporção das fibras oxidativas e conferindo maior
tolerância ao estresse físico (ESSÉN-GUSTAVSSON & JENSEN WAERN, 1993).
Outros pesquisadores afirmam que o exercício espontâneo não é suficiente para
modificar as proporções dos diferentes tipos de fibras musculares (GENTRY et al.,
2002).
O efeito do exercício induzido, aquele produzido pela aplicação de
treinamentos durante um período de tempo determinado, sobre a composição
fibrilar é variável. Alguns pesquisadores relatam que o exercício de resistência,
moderado e aeróbio produz aumento da capacidade aeróbia do músculo para
gerar ATP (ESSÉN-GUSTAVSSON et al., 1983; DEMIREL et al., 1999). Esta
modificação ocorre mediante adaptações metabólicas fibrilares associadas ao
aumento da atividade de enzimas implicadas no metabolismo oxidativo como,
citrato sintetase (CS) e 3-OH-Acil-Coa desidrogenase (HAD), além do incremento
na proporção de fibras oxidativas (ESSÉN-GUSTAVSSON et al., 1983; RIVERO et
al., 1999). Quando o exercício é anaeróbio ou de força, ocorre hipertrofia fibrilar
(SALTIN & GOLLNICK, 1983), embora alguns autores não tenham encontrado
evidencias de tal efeito (UHRIN & LIPTAJ, 1992).
Os efeitos do exercício sobre a composição fibrilar são complexos e
variáveis, dependem de vários fatores, incluindo o tipo de exercício (força e
resistência), a intensidade e duração, o condicionamento físico prévio do
indivíduo, o músculo estudado e a constituição genética.
As alterações bioquímicas e fisiológicas produzidas resultam da adaptação
dos componentes miofibrilares aos novos requerimentos de energia como
resposta ao estresse metabólico que se origina nos músculos que participam
19
ativamente no exercício. Entre essas adaptações se destaca o incremento da
capacidade oxidativa das fibras musculares, através do aumento da atividade das
enzimas que intervêem na β oxidação dos ácidos graxos, aumento da densidade
mitocondrial e da capilarização (ESSÉN-GUSTAVSSON, 1996; SUCRE et al.,
1999). GUYTON (2002) ressalta ainda, a hipertrofia e hiperplasia; aumento das
enzimas mitocôndriais; aumento nos componentes do sistema metabólico do
fosfanogênio (ATP e fosfocreatina); aumento das reservas de glicogênio e
triglicerídeos. Como conseqüência ocorre melhoria na capacidade dos sistemas
metabólicos, tanto anaeróbio como aeróbio, aprimorando especialmente a
velocidade máxima de oxidação e a eficiência do sistema metabólico oxidativo.
Segundo LINDNER et al. (2003), dentre os principais efeitos fisiológicos que
o treinamento induz no músculo esquelético eqüino, se destacam a hipertrofia das
fibras musculares, aumento da proporção de determinado tipo de fibras,
conversão dos tipos de fibras, aumento da atividade das enzimas oxidativas,
aumento da densidade mitocondrial, aumento da densidade capilar, aumento da
atividade da enzima AMP desaminase, nulo ou pequeno efeito na atividade das
enzimas anaeróbias, aumento moderado do conteúdo de glicogênio intramuscular,
aumento do número de transportadores de glicose na membrana, aumento do
número de transportadores de ácidos graxos livres na membrana, melhoria no
transporte
iônico
através
de
membrana,
aumento
da
capacidade
de
tamponamento do músculo.
HENCKEL
(1983)
relata
que
o
treinamento
pode
aumentar
significativamente a área e o número médio de fibras. Admite-se que um número
pequeno de fibras musculares que apresentam aumento da sua área possa
fender-se ao meio, por todo comprimento, formando fibras inteiramente novas,
aumentando assim, também o número de fibras (GUYTON, 2002).
A realização de exercícios de alta velocidade, assim como o salto, requer
potência, a qual está associada a presença de grandes massas musculares.
Exercícios prolongados necessitam de oxigênio para o metabolismo energético,
uma característica de músculos contendo elevada proporção de fibras pequenas
20
(tipo I). O aumento da musculatura para obter maior potência é conseqüência do
aumento no número e tamanho de fibras, estas alterações são controladas por
fatores genéticos e pela intensidade de treinamento (LEWIS, 1995).
LINDNER et al. (2003) observaram que as adaptações celulares
corresponderam às alterações ultra-estruturais. Tais alterações têm sido
interpretadas no cavalo como indicativos de aumento na capacidade aeróbia e de
melhoria da resistência. Numerosos estudos têm demonstrado aumento da
densidade mitocondrial no cavalo associado com diferentes tipos de treinamento e
uma correlação positiva entre o número de fibras musculares com elevada
capacidade oxidativa e o êxito competitivo em atividades de resistência (RIVERO,
1997).
As mensurações sangüíneas de lactato imediatamente após o exercício
durante o treinamento mostraram que as concentrações deste metabólito são
reduzidas com o desenvolver do treinamento. LINDNER et al. (2001),
demonstraram que além do deslocamento para a direita da curva de lactato, à
medida que ocorre melhoria do condicionamento físico em animais treinados em
esteira rolante, também ocorrem modificações nas fibras musculares.
A capacidade para realizar exercícios de baixa intensidade e longa duração
está correlacionada com elevadas percentagens de fibras musculares de tipo I e
IIA (RIVERO et al., 1993a), enquanto que exercícios de curta duração e alta
velocidade estão relacionados a elevadas porcentagens de fibras tipo II (BARREY
et al., 1999). Cavalos de resistência de elite apresentaram porcentagens mais
altas de fibras do tipo I e IIA e porcentagens mais baixas de fibras do tipo IIX no
músculo glúteo médio quando comparado a competidores comuns. Em eventos de
resistência humana, diversos relatos equacionam uma alta proporção de fibras de
contração lenta em músculos ativos em atletas competidores com desempenho
superior. Ao contrário, os atletas corredores de curtas distâncias geralmente
apresentam porcentagem maior de fibras musculares tipo IIB em seus músculos
locomotores (BLANCO & PÉREZ, 2004).
21
Animais submetidos a treinamento de resistência utilizam em maior
proporção o metabolismo aeróbio para produção de energia (RONÉUS et al.,
1994), o que mostra o papel preponderante das fibras oxidativas musculares na
performance desses animais. Entretanto, as fibras glicolíticas também participam
desta atividade, uma vez que, a medida que o trabalho se torna mais intenso,
cada vez mais energia é fornecida por meio anaeróbio (WHITE & SNOW, 1987;
SCHUBACK & ESSÉN-GUSTAVSSON, 1998).
SERRANO et al. (2000) estudaram os efeitos de um programa de
treinamento sobre os tipos de fibras musculares do músculo glúteo médio por
meio de técnicas de eletroforese, histoquímica, imunohistoquímica e bioquímica.
Após três meses de treinamento observaram diminuição significativa de fibras tipo
IIX e aumento das fibras tipo IIA, enquanto a freqüência de fibras tipo I não foi
alterada. A diminuição das fibras tipo IIX foi ainda maior após oito meses de
treinamento.
Exercícios de resistência em cavalos evocam significante transição dos
tipos de fibras de contração rápidas para lenta (SERRANO et al., 2000). Segundo
GONDIM (2005), quanto maior a porcentagem de isoformas dos tipos I e IIA,
melhor poderá ser o desempenho em longas distâncias.
Segundo ROSE (1986), uma das maiores e mais importantes adaptações
ao treinamento de resistência é o aumento, no músculo esquelético, das
concentrações de enzimas das vias associadas a β oxidação. Como resultado
ocorre o aumento da capacidade de trabalho devido à grande oxidação das
gorduras e a pequena utilização de glicogênio. Entretanto a duração do período de
treinamento e a intensidade do exercício podem influenciar no perfil de atividade
destas enzimas.
22
2.8. Características do músculo glúteo médio
O músculo glúteo médio, objeto de estudo no presente trabalho, está
localizado na região da garupa do cavalo. Sua função é estender a articulação
coxofemoral e abduzir a coxa (SISSON, 1986).
No cavalo, o músculo glúteo médio possui grande importância na
locomoção e tem sido utilizado em estudos da performance atlética para avaliar o
grau de adaptação muscular ao treinamento, por ser o mais ativo em todos os
andamentos. Sua localização facilita o acesso e o volume de sua massa é
representativo (LINDHOLM & PIEHL, 1974; LINDHOLM & SALTIN, 1974; ESSÉNGUSTAVSSON et al., 1989; BAYLY & HODGSON, 1991; RIVERO et al., 1993b).
Apresenta grande atividade propulsora nos andamentos durante o exercício e
ausência de grandes artérias, veias e nervos (HENCKEL, 1983; RIVERO et al.,
1989).
2.9. Fontes de energia para a contração muscular
A energia para a contração muscular é oriunda da degradação do ATP pela
mAPTase localizada na cabeça da miosina. A degradação do ATP em ADP + Pi e
a liberação de energia servem para energizar as pontes cruzadas de miosina, que
por sua vez deslocam as moléculas de actina sobre a miosina, encurtando o
músculo (POWERS & HOWLEY, 2000).
A manutenção da contração muscular requer o fornecimento de uma
quantidade de energia química cerca de quatro vezes maior durante o exercício do
que no repouso. Esta demanda energética é suprida pela síntese de ATP
realizada principalmente a partir da fosfocreatina, glicólise anaeróbia, β oxidação e
fosforilação oxidativa (BALDISSERA, 1997; POWERS & HOWLEY, 2000).
Todos os exercícios utilizam em primeiro momento a energia armazenada
nos estoques intramusculares de ATP e creatina fosfato, fase esta chamada de
23
alática da produção anaeróbia de energia. Inicialmente estes estoques de ATP
são restabelecidos pela via glicolítica e posteriormente pela via aeróbia, sendo que
esta última utiliza primeiramente o glicogênio e em seguida os lipídeos como
substratos (SPURWAY, 1992).
A via predominante em determinado momento depende em parte da
intensidade do exercício e em parte da duração do mesmo. MUÑOZ et al. (1999)
ressaltam que a via glicolítica é um mecanismo importante para geração de
energia muscular durante o exercício em eqüinos, principalmente em esforços de
alta intensidade e curta duração.
Nos exercícios de longa duração e baixa intensidade o fornecimento de
energia é realizado preferencialmente pelas vias do ácido tricarboxílico e β
oxidação pelas vias metabólicas aeróbias e, alternativamente, pela via glicolítica,
anaeróbia (HODGSON et al., 1985, ESSÉN-GUSTAVSSON et al., 1989).
Animais submetidos a treinamento de resistência utilizam em maior
extensão o metabolismo aeróbio para produção de energia (RONÉUS et al.,
1994), o que mostra serem as fibras oxidativas musculares de papel
preponderante na performance desses animais. Entretanto, as fibras glicolíticas
também o são, já que em trabalhos mais intensos também utilizam o metabolismo
anaeróbio como fonte de energia (WHITE & SNOW, 1987; SCHUBACK & ESSÉNGUSTAVSSON, 1998).
As fibras tipo I tendem a depender amplamente do metabolismo aeróbio da
glicose e de ácidos graxos para obtenção de energia. As fibras do tipo II derivam
energia principalmente da glicose anaeróbia tendo o glicogênio como substrato
principal. Tais fibras se tornam fatigadas mais rapidamente, porém são capazes
de realizar contrações rápidas e, portanto, são encontradas em elevadas
proporções nos grupos musculares que movem rapidamente os membros
(SANTOS, 2002).
SNOW et al. (1981) estudando o glicogênio em um grupo de cavalos
participantes de uma competição de enduro, relacionaram o desempenho dos
animais e a composição das fibras musculares do músculo glúteo médio.
24
Observaram que, os animais com alta proporção de fibras tipo I e adequado
estoque de glicogênio muscular apresentaram melhor desempenho na competição
de enduro de 80km.
2.10. Produção de Lactato
Com o aumento da intensidade do exercício há primeiramente elevação
discreta das concentrações sangüíneas ou plasmáticas de lactato, mas ao se
atingir determinada intensidade de esforço ocorre repentina elevação do lactato,
formando um ponto de inflexão na curva lactato-velocidade. Este ponto é referido
como limiar anaeróbio ou início do acúmulo de lactato no sangue, e geralmente
ocorre quando a concentração de lactato alcança entre 2 e 4mmol/L (NIMMO &
SNOW, 1982).
O lactato produzido pela via glicolítica e não aproveitado pela fosforilação
oxidativa mitocondrial possui dois destinos no organismo, acumula-se no próprio
músculo ou se difunde para o sangue. Difundido para o sangue, o lactato é
carreado para o fígado, coração e outras fibras musculares, onde é metabolizado
aerobiamente ou ressintetizado a novas unidades de carboidratos (SPURWAY,
1992). O lactato que não é dissipado das fibras acumula-se continuamente,
excedendo a capacidade de tamponamento físico-químico e de transporte de íons
H+ das células. Sendo assim, o pH intracelular diminui, afetando tanto o processo
de contração como mecanismos que regulam a remoção de ADP nos sítios das
pontes cruzadas, localizadas entre a actina e a miosina. A falência da homeostase
ATP/ADP é o maior desafio para a continuidade da excitação, e a conseqüente
contração muscular. O mesmo autor ressalta que, não se sabe ao certo se a
queda de pH dentro da fibra muscular é o único mecanismo da fadiga muscular,
entretanto, sabe-se que esta queda contribui decisivamente para a parada do
exercício.
25
O limiar anaeróbio vem sendo utilizado para a determinação da intensidade
do exercício em programas de treinamento de cavalos atletas (EVANS et al.,
1993; TRILK et al., 2002). O limiar anaeróbio individual se baseia na cinética do
lactato plasmático durante exercício com cargas progressivas (STEGMANN et al.,
1981).
O Ponto de Lactato Mínimo (Lacmin) consiste do momento em que a
concentração de lactato plasmática é mínima antes de um exercício com cargas
progressivas e após indução de acidose lática. Inicialmente, estimula-se acidose
láctica colocando o animal para percorrer 4km em velocidade intensa. Quando a
concentração de lactato estiver alta, a intensidade do exercício é diminuída. O
lactato vai sendo metabolizado e sua concentração começa a diminuir. O animal é
submetido a teste de velocidades progressivas, a velocidade na qual a
concentração de lactato (que está caindo após a acidose provocada) apresentar
uma inflexão e voltar a subir é considerado o limiar anaeróbio (TEGTBUR et al.,
1993).
A metabolização acentuada de glicose, durante a glicólise; assim como a
mobilização acentuada de fibras do tipo IIX acaba produzindo quantidade
excessiva de lactato superando a capacidade de remoção. Cavalos de enduro
apresentam elevações de apenas duas a três vezes no lactato após uma
competição de intensidade submáxima (ESSÉN-GUSTAVSSON et al., 1984);
enquanto aumentos de até 40 vezes foram registrados após exercício de máxima
intensidade (LINDHOLM & SALTIN, 1974).
Há alguns anos pensava-se que o aumento da intensidade do exercício
levaria ao ponto no qual uma quantidade insuficiente de oxigênio estaria
disponível para a fosforilação oxidativa e moléculas de NADH2 seriam reoxidadas
através da transformação do piruvato em lactato, gerando acúmulo deste último no
músculo e posteriormente no sangue. Este modelo apontava o déficit de oxigênio
como principal fator para o acúmulo de lactato muscular e sanguíneo (MYERS &
ASHLEY, 1997). Apesar de alguns pesquisadores sustentarem tal modelo
(WASSERMAN et al., 1999), trabalhos recentes apontam não somente a falta de
26
oxigênio, mas o aumento do fluxo da glicose e o recrutamento de fibras
musculares que produzem energia pela via anaeróbia como mecanismos
responsáveis pelo acúmulo de lactato (ANTONUTTO & DI PRANPERO, 1995;
BILLAT, 1996).
2.11. Causas de limitação no desempenho
São inúmeras as causas de exaustão que se desenvolvem em cavalos que
realizam provas de resistência. As diminuições nas reservas de energia
constituem fatores importantes de exaustão que se manifestam no transcorrer dos
eventos eqüestres. A fadiga pode ocorrer devido à diminuição das reservas de
glicogênio das fibras musculares e não ao declínio de glicose circulante (ESSÉNGUSTAVSSON et al., 1984, VALBERG, 1986).
A acidose muscular decorrente do acúmulo de lactato pode impedir a
glicólise e a capacidade respiratória da mitocrôndria e, ambas podem estar
associadas ao declínio do ATP muscular (NIMMO & SNOW, 1982).
A fadiga muscular está diretamente relacionada ao desajuste entre a
produção e a metabolização do ATP (POWERS & HOWLEY, 2000).
Os problemas musculares são causas comuns de déficit no rendimento
atlético do cavalo. Os músculos mais freqüentemente afetados em cavalos de
esporte são os glúteos e a musculatura lombar (RIVERO et al., 1999).
2.12. Importância da técnica de biópsia percutânea
A técnica de biópsia por agulha percutânea foi introduzida por Bergström
em 1962 e desde 1974 tem sido aplicada para o músculo esquelético de cavalos
(LINDHOLM & PIEHL, 1974). As informações adquiridas em análises do músculo
esquelético têm auxiliado no diagnóstico e prognóstico de afecções musculares,
27
na avaliação do treinamento atlético e na compreensão das adaptações que
ocorrem em decorrência do treinamento (WHITE & SNOW, 1987; SNOW &
VALBERG, 1994).
A técnica de biópsia muscular utilizando a agulha percutânea é simples e
pode ser realizada durante o período de treinamento sem causar complicação ou
efeito negativo no rendimento do cavalo, sendo bem aceita pelo proprietário do
animal (LINDHOLM & PIEHL, 1974; SNOW & GUY, 1976; SNOW & VALBERG,
1994; RIVERO et al., 1999). Essa técnica constitui excelente ferramenta na
avaliação do potencial atlético do cavalo, sendo bastante utilizada na medicina
esportiva eqüina (ESSÉN-GUSTAVSSON et al., 1984; HODGSON & ROSE, 1987;
RIVERO et al.,1995a,b).
Investigações realizadas em diferentes raças têm demonstrado que regiões
mais profundas do músculo glúteo médio possuem maior porcentagem de fibras
tipo I, enquanto as regiões mais superficiais têm maior porcentagem de fibras do
tipo II (KLINE et al., 1987; RIVERO et al., 1993b, ISLAS et al., 1996). Segundo
SERRANO & RIVERO (2000) regiões profundas (proximais) do músculo possuem
grande porcentagem de fibras tipo I que são recrutadas para postura e
manutenção e, altas proporções são encontradas em atividades de longa duração.
Em contrapartida, maiores proporções de fibras tipo IIX, de partes superficiais
(distais) do músculo, indicam que esta região é mais envolvida com exercícios de
curta duração e alta intensidade.
LEXELL et al. (1983) relataram que para se ter representação adequada do
músculo e minimizar os erros, é necessário realizar biópsia em diferentes
profundidades e analisar no mínimo 150 fibras por amostra.
RIVERO
et
al.
(1993b)
não
encontraram
diferenças
quanto
às
características musculares contra laterais em cavalos.
Para superar o problema da grande variação na percentagem dos tipos de
miofibrilas, o ideal é que a coleta do músculo glúteo médio seja feita sempre na
mesma profundidade (SNOW & GUY, 1980; RIVERO et al., 1993a,b; RIVERO et
al., 1995b). De acordo com SERRANO & RIVERO (2000), as variações que
28
existentes nesta profundidade podem ser provocadas pelo efeito do treinamento
de baixa intensidade e longa duração.
Para examinar o efeito de coletas repetidas no mesmo local do músculo,
LINDNER et al. (2002) coletaram fragmentos do músculo glúteo médio direito e
esquerdo nas profundidades de 20 e 60 mm, utilizando a técnica descrita por
LINDHOLM & PIEHL (1974). Cada lado do músculo foi biopsado três vezes em um
intervalo de sete semanas. Esses autores comprovaram que, quando se coleta
várias amostras nesse intervalo permite-se à constituição completa do músculo.
Dessa forma, não há prejuízo para avaliação das variáveis musculares. Após a
ocorrência de injúria, observa-se que o tecido muscular apresenta excelente
capacidade de reparação. Esta habilidade de regeneração está relacionada à
extensão da necrose, a preservação da inervação e do suprimento sanguíneo na
área e o grau de integridade do sarcolema da fibra muscular. Quando o trauma
não danifica a lâmina basal e o plasmalema das miofibrilas, é possível a reparação
completa (RIVERO et al., 1999; LINDNER et al., 2002).
29
III. MATERIAL E MÉTODOS
3.1. Animais
Foram utilizados 20 eqüinos PSA e cruza Árabe, 13 éguas e sete machos
castrados, com peso entre 314 e 418kg e idades variando entre quatro e 11 anos,
pertencentes a propriedades particulares e ao Departamento de Clínica e Cirurgia
Veterinária da Faculdade de Ciências Agrárias e Veterinárias (FCAV) - UNESP,
campus de Jaboticabal.
Os animais permaneceram confinados em baias individuais no Setor de
Eqüideocultura desta faculdade, dispondo de sal mineral e água à vontade, e feno
de Cynodon dactylon de acordo com a proporção 60:40 (volumoso:concentrado)
para um consumo de matéria seca de 2% do peso vivo. Adicionalmente,
receberam concentrados em cochos individuais duas vezes ao dia, formulados
com 0, 6, 12, 18 e 24% de óleo de soja refinado, fubá de milho, farelo de soja,
fosfato bicálcico, calcário e premix mineral e vitamínico (Apêndice -Tabela 15). O
consumo de energia e nutrientes foi proporcional ao peso metabólico (P0,75kg) de
cada animal, seguindo a exigência para cavalo de 370kg submetidos a exercício
moderado de acordo com o NRC (1989). Os animais foram soltos em piquetes de
Cynodon dactylon uma vez por semana.
Antes do período experimental os animais foram submetidos a exame
físico para avaliação da higidez, dando-se destaque à integridade do sistema
locomotor (TAYLOR & HILLYER, 1997). Utilizou-se eqüinos sadios, em boas
condições nutricionais e após passarem por programas de desverminação,
combate a ectoparasitas e vacinação.
Os animais foram submetidos a treinamento de equitação e adaptação ao
manejo e a esteira, durante período de 15 dias consecutivos. Neste período foi
fornecido o concentrado experimental com 0% de óleo. Posteriormente, os 20
eqüinos foram distribuídos em cinco grupos de acordo com a dieta alimentar,
30
sendo cada grupo composto de quatro cavalos. O critério de distribuição foi feito
em função do sexo e idade, na tentativa de formar grupos homogêneos. O grupo
controle não recebeu óleo e os demais grupos foram suplementados com 6, 12, 18
e 24% de óleo de soja (Tabela 1). O óleo foi adicionado aos concentrados no
momento do fornecimento, evitando-se assim a possível rancificação na
armazenagem devido ao alto teor de extrato etéreo (EE). A composição dos
concentrados experimentais utilizados está relacionada na Tabela 15 (Apêndice).
Tabela 1. Distribuição dos animais em grupos experimentais com base na dieta
alimentar fornecida (0, 6 12, 18 e 24 % de adição de óleo).
Grupos
Animal
1
2
3
4
Óleo (%)
0
0
0
0
Sexo
F
F
M
F
Idade (anos)
6
7
11
4
6
5
6
7
8
6
6
6
6
F
F
M
M
6
7
9
8
12
9
10
11
12
12
12
12
12
F
F
M
M
6
6
7
11
18
13
14
15
16
18
18
18
18
F
F
M
F
6
6
12
8
24
17
18
19
20
24
24
24
24
F
F
M
F
5
5
7
11
0
F; fêmea, M: macho.
31
3.2. Teste para determinação da curva velocidade-lactato
Com o propósito de avaliar o condicionamento físico dos animais e
determinar a intensidade do treinamento em esteira1 foram realizados dois tipos
de exercícios testes, denominados velocidade-lactato e Lacmim.
O teste velocidade-lactato consistiu em um período de aquecimento de dois
minutos a 1,7 m/s e cinco minutos a 4,0 m/s com 0% inclinação. Em seguida a
esteira foi inclinada a 10%, com velocidade inicial de 4,0 m/s e, a cada 2 minutos a
velocidade foi acrescida em 1,0 m/s. A velocidade final foi determinada pelo
momento no qual o animal demonstrava sinais de fadiga, como desconcentração,
sudorese intensa, abaixamento da cabeça e cansaço tendendo a não acompanhar
a esteira rolante, se deslocando para trás. Após este período, o animal foi
submetido ao desaquecimento durante 15 minutos a 1,7 m/s, objetivando sua
recuperação.
Foi realizado também o teste para a determinação do limiar anaeróbio pelo
Ponto de lactato mínimo - Lacmim (TEGTBUR et al., 1993). Este teste consistia de
5 minutos de aquecimento a 4m/s com a esteira sem inclinação, depois, galope a
9m/s com inclinação de 10% até que a concentração sangüínea de lactato
atingisse 8mmol/L. Para esta determinação foi realizada a coleta de sangue a
cada minuto. Após esta etapa, foi realizado o desaquecimento a velocidade de
3,5m/s até que concentração sangüínea de lactato reduzisse em 50% do pico
máximo. Na fase seguinte, inclinava-se a esteira a 5% na velocidade de 4m/s. A
cada dois minutos a velocidade foi aumentada em 1m/s e mensurado o lactato
sangüíneo até ocorrer dois aumentos consecutivos na lactacidemia. Teste
finalizado, realizou-se novo desaquecimento de 3 minutos a 3,5m/s, seguido de
5min a 1,7m/s. O limiar anaeróbio foi calculado no ponto mínimo da curva da
concentração sangüínea de lactato. O valor obtido no teste de Lcmim determinou
a velocidade no estágio 5 do protocolo de treinamento em esteira (Tabela 2).
________________________________
1
Esteira Galloper 5500 - Sahinco LTDA, Palmital, SP, Brasil.
32
3.3. Programa de treinamento
Os cavalos trabalharam seis dias por semana, intercalando exercício na
esteira rolante e na trilha em dias alternados. Metade dos animais foi treinado pela
manhã na esteira rolante e a outra metade, montados no período da tarde, em
trilha.
O protocolo de treinamento na esteira rolante está descrito na tabela 2. No
estágio 5 do trabalho na esteira utilizou-se 80% da velocidade correspondente ao
limiar anaeróbio, observado para cada cavalo no teste de Lacmim.
O exercício em trilha foi realizado a velocidade média de 9km/h durante
duas horas consecutivas, em que os animais realizavam sempre o mesmo
percurso. O programa de treinamento foi o mesmo para todos os animais. No dia
de descanso permaneciam soltos em piquete.
Tabela 2. Protocolo de treinamento dos eqüinos na esteira rolante.
Estágio
Tempo (min)
V (m/s)
1
2
3*
4
5*
6
7
8
Total
2
4
10
2
10
2
7
3
35
1,7
5
4
4
(6-7) #
3
5
1,7
* inclinação de 5%
#
80% da velocidade encontrada para o limiar anaeróbio no Teste de Lacmim
Espaço (m)
204
1200
2400
480
3600-4200
360
2100
306
10650-11250
33
3.4. Determinação do peso e escore corporal
O peso corporal foi mensurado em balança específica para grandes
animais1. A avaliação do escore corporal foi realizada segundo HENNEKE et al.
(1983), a partir da visualização e palpação das regiões zootécnicas tais como:
pescoço, costela, cernelha, paleta, escápula, processos espinhosos lombares,
glúteos e base da cauda; atribuindo valores através de uma escala pontuada de 1
a 9, onde 1 é considerado extremamente magro e 9, extremamente gordo (Tabela
15), independente do tamanho e conformação do animal. Ambos os parâmetros
foram determinados antes e após o término do treinamento de sete semanas.
3.5. Colheita de amostras musculares
Para a análise muscular foi selecionado o músculo esquelético glúteo
médio, por participar ativamente da locomoção e ser um dos mais importantes
músculos para a produção de força propulsora.
Amostras do músculo glúteo médio foram colhidas dos animais em tronco
de contenção específico para eqüinos, em posição quadrupedal. As colheitas
foram efetuadas de acordo com a metodologia preconizada por LINDHOLM &
PIEHL (1974) e VALETTE et al. (1999), utilizando a agulha de biópsia percutânea
do tipo Bergström nº 6.0 (Figura 1). As amostragens foram realizadas no lado
esquerdo da garupa dois dias antes do início do treinamento e ao término deste
(sete semanas após).
_____________________
1
Perfecta, São Paulo.
34
a
b
c
Figura 1. Agulha de biópsia muscular tipo Bergström 6,0mm ( Kruise).
(a) agulha guia contendo uma abertura;
(b) cilindro cortante;
(c) mandril.
O local de inserção da agulha adotado foi o sugerido por LINDHOLM &
PIEHL (1974), o qual se localiza no terço médio cranial de uma linha imaginária
que se estende da tuberosidade coxal à base da cauda. Para tanto, realizou-se
tricotomia de uma área de aproximadamente 5cm2, correspondente à região do
músculo glúteo médio. Foi realizada a limpeza da região, utilizando gaze estéril
embebida em solução de iodopovidine1 e posteriormente embebida em solução de
álcool iodado. Em seguida, foi realizado o bloqueio anestésico local, mediante a
infiltração de 1mL de Cloridrato de lidocaína 2% sem vasoconstrictor2 por via
subcutânea. Dois minutos após a realização da anestesia local, realizou-se a antisepsia com solução de álcool-iodado e procedeu-se uma incisão na pele, tecido
subcutâneo e fáscia glútea, utilizando lâmina de bisturi descartável nº 22, em
seguida promoveu-se hemostasia compressiva utilizando gaze estéril.
_____________
1
2
Asteriodine, ASTER, São Paulo, SP.
Lidostesim® SV, DENSPLY, Catanduva, SP.
35
Introduziu-se a agulha acoplada ao cilindro cortante com a janela fechada,
b
ambos previamente esterilizados, em um ângulo de 90º, na incisão promovida
pela lâmina de bisturi, até aproximadamente 6,0 cm de profundidade, para atingir
o músculo glúteo médio. Em seguida, o cilindro cortante foi suspenso, permitindo a
abertura da janela de corte e procedeu-se o deslocamento lateral na agulha,
pressionando lateralmente contra a massa muscular descrevendo um ângulo de
45º, então, introduziu-se o cilindro cortante para a realização do corte do
fragmento muscular (Figura 2).
36
a
b
c
d
a
e
f
Figura 2. Procedimentos para colheita da amostra muscular.
(a) Local da tricotomia (área de 25cm2 aproximadamente),
(b) infiltração do anestésico local,
(c) botão anestésico,
(d) incisão de pele,
(e) local incisado,
(f)* inserção da agulha de biópsia muscular na incisão de pele. A
agulha possui marcações externas para auxiliar na colheita da
amostra na profundidade adequada.
__________
*Foto cedida por D’ANGELIS, 2004.
37
Foram coletadas duas amostras consecutivas do músculo glúteo médio
através da mesma incisão no lado esquerdo da garupa de cada animal. As
amostras destinadas às análises histoquímicas foram colhidas com a abertura da
agulha direcionada medialmente e amostras destinadas à análise bioquímica
foram colhidas com a abertura direcionada lateralmente. Após a colheita da
amostra, a agulha foi retirada cuidadosamente e realizou-se a hemostasia
comprimindo-se manualmente a ferida cirúrgica com gaze estéril. A lesão foi
tratada com pomada cicatrizante e repelente1 uma vez ao dia, até a cicatrização
(Figura 3).
a
b
Figura 3. Ilustração da ferida cirúrgica.
a. lesão imediatamente após a colheita das amostras;
b. curativo realizado subseqüentemente.
_________________
1
Ungüento Person®, Saúde Animal Ltda, Rio de Janeiro, RJ.
38
3.6. Processamento das amostras musculares
As amostras musculares obtidas do músculo glúteo médio (Figura 4)
destinadas à análise histoquímica foram resfriadas dois minutos após a colheita,
mediante a imersão em hexano2 por 30 segundos, em seguida imersas em
nitrogênio líquido a -196ºC. As amostras destinadas à quantificação de glicogênio
na fibra muscular, foram imediatamente imersas em nitrogênio líquido. Ambas
foram armazenadas em freezer a -70°C até o momento da análise laboratorial.
Figura 4. Amostra muscular no interior da abertura da agulha.
_____________
2
Hexano P.A. Synth, Diadema, SP.
39
3.7. Análises Histoquímicas
Foram realizadas quatro secções transversais seriadas com 12µm de
espessura das amostras musculares, em criostato1 à -20°C. Os cortes foram
dispostos em lâminas histológicas, as quais permaneceram armazenadas em
freezer a temperatura de -20°C até o momento da realização das análises
musculares no laboratório de Farmacologia do Departamento de Morfologia e
Fisiologia Animal da FCAV - UNESP, campus de Jaboticabal, São Paulo.
3.7.1. Adenosina Trifosfatase Miofibrilar (mATPase)
A atividade enzimática da mATPase foi utilizada para identificar e distinguir
os tipos de fibras musculares puras por meio da velocidade de contração destas.
A técnica utilizada para essa análise foi uma adaptação do método de coloração
metacromática da atividade ATPase em miofibras, descrito por OLGIVIE &
FEEBACK (1990), utilizando alguns passos recomendados por GUTH & SAMAHA
(1970) e ENNION et al. (1995) e, empregada com sucesso por D’ANGELIS et al.
(2005).
As lâminas contendo os cortes musculares foram mantidas à temperatura
ambiente durante 35 minutos, para secagem e aderência dos mesmos à lâmina
histológica. Os cortes foram fixados por 6 minutos à temperatura de 22 a 24°C em
solução de formalina tamponada a 5% e pH 7,3 contendo 0,17M de cloreto de
sódio, 336 mm de sacarose e 0,13M de cacodilato de sódio. Posteriormente,
foram lavados três vezes em solução tampão Tris base 21 mM pH 7,8 contendo
3,4 mM de cloreto de cálcio (GUTH & SAMAHA, 1970). Em seguida, foram préincubados em meio ácido (pH 4,50 a 4,55) contendo 52 mM de acetato de
potássio e 17,7 mM de cloreto de cálcio durante 5 minutos à temperatura de 22 a
24°C (OLGIVIE & FEEBACK, 1990). Os cortes foram lavados, utilizando o mesmo
____________
1
Mícron GmbH – H1599 OM, 69190, Walldorf, Alemanha.
40
tampão conforme descrito anteriormente, e incubados segundo o procedimento
descrito por ENNION et al. (1995), em meio alcalino (pH 10,50 a 10,55) contendo
40 mM de glicina, 20 mM de cloreto de cálcio e 2,5 mM de ATP1 em estufa a 37°C
durante 25 minutos. Após esses procedimentos, foram lavados rapidamente em
água destilada e incubados em solução aquosa de cloreto de cálcio 1% por três
minutos. Em seguida, foram novamente lavados em água destilada, corados com
azul de toluidina 1% durante 10 segundos, desidratados em séries crescentes de
etanol (70, 80, 90, 100 e 100%), diafanizados em três séries de xilol 100% e
montados em lamínulas com entelan (OLGIVIE & FEEBACK, 1990).
3.7.2 Nicotinamida adenina dinucleotídeo tetrazólio redutase
A NADH-TR foi realizada para determinar o metabolismo oxidativoglicolítico dos diferentes tipos de fibras musculares de eqüinos.
Utilizou-se como marcador do padrão oxidativo, a enzima nicotinamida
adenina dinucleotideo desidrigenase (NADH). A técnica consiste em incubar a
amostra muscular em solução que contêm a enzima NADH e NBT (Nitro blue
tetrazolium) para formar o complexo NADH-TR (RYAN, 1992).
As lâminas contendo os cortes musculares foram mantidas à temperatura
ambiente durante 20 minutos, para secagem e aderência dos mesmos a lâmina
histológica. Os cortes foram incubados durante 40 minutos em estufa a 37°C em
solução contendo 8 mg de NADH-TR, 10 mg NBT e 10 mL de tampão Tris 0,2M
pH 7,4 (1,2114g Tris em 50 mL de água destilada). Em seguida, foram lavados em
água destilada três vezes. Posteriormente, foram fixados em formol 5%
tamponado pH 7,0, durante cinco minutos. Seguido de lavagem em água
destilada, desidratação em etanol, diafanização em xilol e montagem com
entelam, conforme descrito anteriormente para mATPase.
____________
1
Sigma Aldrich, Química do Brasil Ltda, São Paulo, SP.
41
3.8. Análises morfométricas
As análises morfométricas foram realizadas no laboratório de análises de
imagens
do
Departamento
de
Anatomia
da
Faculdade
de
Veterinária,
Universidade de Córdoba, Córdoba, Espanha.
Dois cortes histológicos corados mediante as técnicas histoquímicas, foram
digitalizados em campos idênticos a partir da realização de fotomicrografias de
cada secção utilizando o sistema de processamento de imagens computadorizado
equipado com microscópio Leica DMLS1 acoplado a câmara Leica ICC A de alta
resolução1.
A freqüência e área média de secção transversal de cada tipo de fibra
foram obtidas utilizando o programa de análises de imagens2.
A freqüência média foi considerada como a porcentagem do número total
de fibras. A área média de secção transversal das fibras foi medida em µm2, a
partir da mensuração de cada tipo de fibra muscular. Foram mensuradas entre
100 e 200 fibras por amostra (total de dois campos analisados).
A área relativa (%) que cada tipo de fibra ocupa em uma amostra de
músculo foi calculada multiplicando por 100, o resultado da divisão entre a
porcentagem do tipo de fibra multiplicada pela área média de secção transversal
deste tipo de fibra e a somatória resultante ao aplicar a fórmula para todos os tipos
de fibras (SULLIVAN & ARMSTRONG, 1978; RIVERO et al., 1993a).
____________
1
2
Leica Microsistemas, Barcelona, Espanha
Visiolog 5, Noemi, Microptic, Barcelona, Espanha.
42
3.9. Determinação do glicogênio total
A quantificação do glicogênio total presente nas fibras musculares foi
realizada segundo a metodologia preconizada por MOON et al. (1989) com
algumas adaptações.
Adicionou-se 1ml de solução de ácido perclórico 6% à 50-100mg da
amostra muscular. Homogeneizou-se imediatamente utilizando-se o sonicador,
assegurando-se que todo tecido estivesse macerado. Em seguida, foi realizada a
neutralização pela adição de X µL* de K2CO3 3M. As amostras neutralizadas foram
centrifugadas a 3000g por 15 minutos a 10-12oC em centrífuga refrigerada1. O
sobrenadante foi desprezado, agitou-se e retirou-se 100µL do homogeneizado
neutralizado. Realizou-se o mesmo procedimento com o branco (tampão citrato) e
com os padrões (P50, P150, P300 e P600). Acrescentou-se 200µL de
amiloglicosidase e incubou-se à temperatura ambiente por 1 hora. Em seguida,
adicionou 300µL de ácido perclórico 6%. Agitou e neutralizou pela adição de YµL*
de K2CO3 2,25M, agitando-se novamente. Centrifugou em centrífuga refrigerada a
2250xg por 10 minutos a 10-12oC. Adicionou-se 1ml do meio de análise de glicose
(Kit Labtest) à 20µL do sobrenadante neutralizado (amostras e padrões) e
incubou-se por 18 minutos. A leitura foi realizada em espectofotômetro a 505 nm.
O cálculo do glicogênio presente nas amostras musculares foi efetuado a
partir da fórrmula abaixo:
%=
∑ [ P]
∑
Leit. Amostra
x Leitura
, XXXx0x ,001
∑ [ padrões]
Leiturax1amostra
1, XXX x 0,001
amostra
Peso xmúsculo
Leit
.
P
PesoFígado
∑ Leitura padrões
Peso músculo
O valor de XXX = volume de K2CO3 3M utilizado para neutralização.
1
Centrífuga ALC, PK121K , Itália.
O volume de K2CO3 3M ou 2,25M a ser adicionado depende do momento do preparo do reagente. Ao se
preparar uma nova solução de ácido peclórico e/ou K2CO3, o volume para a neutralização deve ser checado e
o cálculo refeito, se necessário.
43
Para as formulações dos reagentes utilizou-se: tampão citrato (21,0g de
ácido cítrico em 1000mL de água deionizada; 5,5 a 6,0g de NaOH em pastilhas pH
para 4,0-4,4); ácido perclórico 6% (10mL de ácido perclórico a 70%, diluído em
107mL de água deionizada); carbonato de potássio (K2CO3) 3M (41,4g de K2CO3
em 100mL de água destilada) e K2CO32,25M (31,1g K2CO3 em 100mL de água
destilada).
3.10. ANÁLISE ESTATÍSTICA
As variáveis estudadas foram analisadas mediante o programa estatístico
SAS – Statistical Analysis System (SAS, 2002).
Realizou-se a Análise de
Variância (ANOVA) para avaliar o efeito da dieta e do treinamento sobre as
variáveis estudadas. Utilizou-se o teste de Tukey para a comparação das médias
entre os diferentes grupos de dieta alimentar. Aplicou-se o t de “student” quando
as comparações foram realizadas entre os grupos de treinamento, e o teste de
Wilcoxon para comparações referentes ao escore corporal. Para todas as análises
realizadas estabeleceu-se o nível de significância igual a p≤0,05 (SAMPAIO,
1998). Os resultados foram apresentados como valores médios ± erro padrão da
média (EPM), na forma de tabelas e figuras.
44
IV. RESULTADOS
4.1. Peso e escore corporal
Mediante análise dos dados é possível observar que não houve efeito
significativo da suplementação com óleo de soja sobre o peso e escore corporal
dos animais (Tabela 3). Desta forma, os animais foram comparados em função do
treinamento realizado (Tabela 4).
Tabela 3. Médias ± erro padrão da média (EPM) do peso e escore corporal de
eqüinos cruza Árabe e Puro Sangue Árabe (PSA) submetidos à
suplementação com diferentes concentrações com óleo de soja.
Grupos
I (n=4)
Variáveis Fisiológicas
Peso corpóreo (kg)
Escore corporal
388,5 ± 20,6
5
II (n=4)
389,5 ± 15,2
5
III (n=4)
399,7 ± 11,3
6
IV (n=4)
380,2 ± 15,1
5
V (n=4)
392,6 ± 19,0
6
Médias na mesma coluna não diferiram significativamente pelos testes de Tukey e Wilcoxon (p≤0,05).
Tabela 4. Médias ± EPM do peso e escore corporal de eqüinos cruza Árabe e
PSA, submetidos a treinamento de resistência durante sete semanas.
Grupos
Pré (n=20)
Pós (n=20)
Variáveis Fisiológicas
Peso corpóreo (kg)
Escore corporal
5
398,4ª ± 8,91
381,9b ± 5,74
6
Pré: antes do treinamento, Pós: após o treinamento.
Médias na mesma coluna seguidas de letras iguais não diferem significativamente pelo teste t de student e
Wilcoxon (p≤0,05).
O valor médio do peso corpóreo diminuiu significativamente (p≤0,05) após o
período de sete semanas de treinamento. O treinamento não exerceu efeito
significativo (p>0,05) sobre o escore corporal.
45
4.2. Técnica de biópsia muscular
A técnica de biópsia preconizada por Bergström permitiu a colheita de
amostras musculares de tamanho adequado e em condições apropriadas para as
análises histoquímicas. Neste caso a profundidade escolhida, 6,0 cm, permitiu a
colheita de amostras homogêneas.
O local determinado para a colheita apresentou fácil acesso. A
administração de 1,0 ml de cloridrato de lidocaína suprimiu a sensibilidade
cutânea e permitiu a realização da incisão sem qualquer reação por parte dos
animais. A introdução da agulha de biópsia no músculo glúteo médio se deu de
forma tranqüila, sem necessidade adicional de anestésico. Os animais não
apresentaram sensibilidade muscular e não mostraram reflexo nociceptivos
durante a retirada de espécimes do músculo.
As feridas cirúrgicas cicatrizaram por segunda intenção. Observou-se que
as bordas das feridas cirúrgicas dos animais apresentaram-se coaptadas no dia
seguinte da realização da biópsia muscular e a cicatrização evoluiu naturalmente,
estando a ferida cicatrizada e apresentando crescimento de pêlos após sete dias
(Figura 5).
46
a
b
c
d
Figura 5. Ilustração da evolução da cicatrização da ferida cirúrgica.
d a colheita da amostra.
(a) 0, (b) 1, (c) 2 e (d) 7 dias após
a
4.3. Identificação dos tipos de fibras musculares
4.3.1 mATPase
O músculo glúteo médio dos eqüinos estudados apresentou três tipos de
fibras puras: I, IIA e IIX, segundo o grau de reatividade da enzima mATPase após
a pré-incubação ácida (pH 4,5) e incubação alcalina (pH 10,5).
Os diferentes tipos de fibras demonstraram o padrão de organização em
mosaico. As fibras tipo I foram ácido estáveis e alcalino lábeis, demonstrando
coloração azul claro. As fibras tipo IIA foram ácido lábeis a pré-incubação ácida e
47
alcalino resistentes à incubação alcalina, assumindo coloração intermediária entre
as fibras tipo I e IIX (azul intermediário). As fibras tipo IIX mostraram-se ácido
lábeis e alcalino resistentes, corando-se fortemente quando submetidas à
incubação alcalina, assumindo coloração azul escuro (Tabela 5 e Figura 6a).
4.3.2. Atividade metabólica das fibras musculares
As fibras musculares foram classificadas em oxidativas e/ou glicolíticas
segundo a intensidade da reação utilizando a técnica NADH-TR que determina
seu metabolismo energético.
As fibras tipo I demonstraram reação fortemente positiva, assumindo
coloração roxo intenso, indicando metabolismo energético oxidativo. As fibras tipo
IIA reagiram moderadamente, mostrando coloração moderada a intensa,
intermediária entre as fibras tipo I e IIX, com intensa reação na periferia da célula.
As fibras tipo IIX reagiram fracamente à técnica NADH-TR, assumindo coloração
clara, mostrando-se glicolíticas (Tabela 5 e Figura 6b).
Mediante a comparação das técnicas mATPase e NADH-TR foi possível
distinguir ainda, as fibras híbridas tipo IIAX (intermediária entre IIA e IIX), as quais
demonstraram coloração intermediária entre as fibras IIA e IIX, e reação na
periferia da célula após a coloração com a técnica de NADH-TR (Figura 7).
A tabela 5 caracteriza o resultado da reação dos diferentes tipos de fibras
às técnicas histoquímicas mATPase e NADH-TR para o músculo glúteo médio de
eqüinos.
Tabela 5. Colorações histoquímicas observadas nas fibras musculares avaliadas.
Tipos de fibra
I
IIA
IIAX
IIX
Reação
+
++
+++
+++
mATPase alcalina
Coloração
azul claro
azul intermediário
azul escuro
azul escuro
+++: reação positiva forte; ++: reação moderada; +: reação fraca.
Reação
+++
++
++
+
NADH- TR
Coloração
roxo escuro
roxo intermediário
lilás
lilás
48
IIX
IIA
IIA
IIX
IIX
I
IIX
IIA
I
IIX
I
a
IIX
IIA
IIA
IIX
IIX
IIX
I
IIA
I
IIX
I
b
Figura 6. Fotomicrografia de cortes transversais do músculo glúteo médio
corados mediante técnicas histoquímicas. a. mATPase após
pré incubação ácida (pH 4,5) e incubação alcalina (pH 10,5). b.
NADH-TR. Observar o padrão de organização em mosaico dos
diferentes tipos de fibras. Obj. 20x.
49
As fibras foram identificadas a partir da análise comparativa dos campos
corados mediante as técnicas de mATPase e NADH-TR impressos em preto e
branco (Figura 7).
I
IIX
I
IIA
IIX
IIX
IIAX
IIA
I
IIX
I
IIX
IIA
a
I
IIX
IIX
IIA
IIX
IIAX
I
IIA
I
IIX
I
IIX
IIA
b
Figura 7. Cortes histológicos transversais seriados do músculo
glúteo médio corados com as técnicas: a. mATPAse, b.
NADH-TR. Observam-se fibras tipo I, IIA, IIAX (células
grandes com reação na periferia) e IIX.
50
4.4. Morfometria das fibras musculares
Para os estudos quantitativos não foram incluídas as fibras híbridas (IIAX),
uma vez que sua proporção foi muito pequena (3,4 e 0,6% pré e pós-treinamento,
respectivamente). Portanto, estas fibras foram consideradas como IIX.
4.4.1. Freqüência dos tipos de fibras (%)
Determinou-se a freqüência ou percentual de cada tipo de fibra muscular
em relação à dieta alimentar baseada nas diferentes concentrações de óleo de
soja (Tabela 6).
Tabela 6. Efeito da suplementação com de óleo de soja sobre a freqüência (%) ±
EPM dos tipos de fibras no músculo glúteo médio de eqüinos cruza
Árabe e PSA.
Grupos de
dietas
Freqüência dos tipos de fibras (%)
IIA
I
IIX
Pré
Pós
Pré
Pós
Pré
Pós
I (n=4)
21,5 ± 0,71
22,7 ± 1,31
49,7 ± 1,38
58,5 ± 4,87
28,8 ± 1,56
18,8 ± 3,62
II (n=4)
21,7 ± 1,60
21,7 ± 1,93
48,7 ± 1,65
50,2 ± 5,19
29,6 ± 4,21
28,1 ± 3,42
III (n=4)
19,7 ± 2,32
21,2 ± 1,18
41,0 ± 2,20
53,5 ± 0,87
39,3 ± 0,85
25,3 ± 2,17
IV (n=4)
25,5 ± 2,72
26,5 ± 1,31
40,5 ± 4,05
55,5 ± 2,96
34,0 ± 6,01
18,0 ± 3,88
V (n=4)
18,5 ± 3,93
19,7 ± 1,38
45,7 ± 1,54
58,2 ± 1,80
35,8 ± 5,78
22,1 ± 1,85
Médias na mesma coluna não diferiram significativamente pelo teste de Tukey (p≤0,05).
Como não houve diferenças em decorrência dos tratamentos com óleo,
podemos desconsiderar a hipótese desta variável influenciar na freqüência dos
diferentes tipos de fibras no músculo glúteo médio dos eqüinos. Assim sendo, os
animais foram distribuídos em dois grupos em função do treinamento (Tabela 7).
51
Tabela 7. Freqüência (%) ± EPM dos tipos de fibras do músculo glúteo médio de
eqüinos cruza Árabe e PSA, submetidos a treinamento de resistência
durante sete semanas.
Grupos de
treinamentos
I
Pré (n=20)
20,7Ac ± 1,19
Pós (n=20)
22,4Ab ± 0,76
Freqüência dos tipos de fibras (%)
IIA
IIX
35,1Ab ± 2,09
44,2Ba ± 1,47
55,2Aa ± 1,58
22,4Bb ± 1,56
Pré: antes do treinamento, Pós: após o treinamento.
Letras maiúsculas representam comparações na mesma coluna (entre treinamentos) e letras minúsculas
representam comparações na mesma linha (entre tipos de fibras). Letras diferentes diferem significativamente
pelo teste t de student (p≤0,05).
Observou-se aumento significativo nas fibras tipo IIA (p≤0,05) e diminuição
significativa (p≤0,05) nas fibras tipo IIAX e IIX após o período de treinamento de
sete semanas. Houve predomínio das fibras IIA pré e pós treinamento em relação
às demais.
4.4.2. Área total de secção transversal (µm2)
A dieta (Tabela 8) e o treinamento (Tabela 9) não ocasionaram alteração
significativa (p>0,05) na área de secção transversal em nenhum dos tipos de
fibras musculares.
Tabela 8. Efeito da suplementação com de óleo de soja ± EPM sobre a área
média de secção transversal (µm2) dos tipos de fibras no músculo glúteo
médio de eqüinos cruza Árabe e PSA.
Grupos de
dietas
Área de secção transversal (µm2)
IIA
I
IIX
Pré
Pós
Pré
Pós
Pré
Pós
I (n=4)
3851 ± 139
3921 ± 356
4863 ± 199
5154 ± 678
7861 ± 348
8894 ± 1762
II (n=4)
3601 ± 129
4139 ± 442
4392 ± 412
4965 ± 534
7020 ± 466
8711 ± 865
III (n=4)
2608 ± 312
4491 ± 227
3437 ± 364
5276 ± 207
6308 ± 646
8869 ± 426
IV (n=4)
4634 ± 351
3751 ± 563
6724 ± 693
4754 ± 652
10524 ± 957 7688 ± 1029
V (n=4)
3914 ± 453
3380 ± 407
4806 ± 555
4362 ± 463
7267 ± 989
7200 ± 983
Médias na mesma coluna não diferiram significativamente pelo teste de Tukey (p≤0,05).
Letras minúsculas representam comparações na mesma linha (entre tipos de fibras). Letras diferentes diferem
significativamente pelo teste de Tukey (p≤0,05).
52
Tabela 9. Área média de secção transversal (µm2) ± EPM dos tipos de fibras do
músculo glúteo médio de eqüinos cruza Árabe e PSA, submetidos a
treinamento de resistência durante sete semanas.
Grupos de
treinamentos
I
Pré (n=20)
Pós (n=20)
3766
Ac
± 212,3
3936
Ac
± 185,4
Área de secção transversal (µm2)
IIA
IIX
Aa
Ab
± 512,7
7451
4824 ± 335,8
4902Ab ± 225,0
8273Aa ± 465,9
Pré: antes do treinamento, Pós: após o treinamento.
Letras maiúsculas representam comparações na mesma coluna (entre treinamentos) e letras minúsculas
representam comparações na mesma linha (entre tipos de fibras). Letras diferentes diferem significativamente
pelo teste t de student (p≤0,05).
Em relação ao tamanho dos diferentes tipos de fibras, conforme observado
na Tabela 9, a área de secção transversal das fibras tipo IIX foi significativamente
maior (P≤0,05) que a área correspondente às fibras tipo I e IIA, obedecendo a
seguinte ordem da maior para a menor: IIX >IIA > I.
4.4.3. Área Relativa (%)
Como não houve efeito dos tratamentos com óleo sobre a área relativa dos
tipos de fibras musculares (Tabela 10), os animais foram distribuídos em dois
grupos em função do treinamento (Tabela 11).
Tabela 10. Efeito da suplementação com de óleo de soja sobre a área relativa (%)
± EPM dos tipos de fibras no músculo glúteo médio de eqüinos cruza
Árabe e PSA.
Grupos de
dietas
Área relativa (%)
IIA
I
IIX
Pré
Pós
Pré
Pós
Pré
Pós
I (n=4)
15,4 ± 1,15
16,5 ± 0,5
44,7 ± 1,55
54,7 ± 5,74
39,9 ± 1,83
28,8 ± 5,69
II (n=4)
15,7 ± 0,85
15,5 ± 0,5
43,2 ± 3,97
43,2 ± 4,33
41,1 ± 5,36
41,3 ± 3,88
III (n=4)
11,8 ± 1,70
16,0 ± 0,81
32,5 ± 2,25
47,1 ± 1,41
55,7 ± 2,39
36,9 ± 1,89
IV (n=4)
16,7 ± 3,45
20,0 ± 1,22
36,2 ± 4,27
53,0 ± 3,67
47,1 ± 7,84
27,0 ± 4,49
V (n=4)
13,5 ± 2,33
14,2 ± 1,31
41,2 ± 1,93
53,5 ± 2,63
45,3 ± 5,43
32,3 ± 3,29
Médias na mesma coluna não diferiram significativamente pelo teste de Tukey (p≤0,05).
53
Tabela 11. Área relativa (%) ± EPM dos tipos de fibras do músculo glúteo médio
de eqüinos cruza Árabe e PSA, submetidos a treinamento de resistência
durante sete semanas.
Grupos de
treinamentos
I
14,4Ac ± 0,94
Pré (n=20)
Pós (n=20)
16,4
Ac
± 0,58
Área relativa (%)
IIA
39,1
Bb
± 1,78
IIX
46,5Aa ± 2,57
51,1
Aa
± 1,84
32,5Bb ± 2,09
Pré: antes do treinamento, Pós: após o treinamento.
Letras maiúsculas representam comparações na mesma coluna (entre treinamentos) e letras minúsculas
representam comparações na mesma linha (entre tipos de fibras). Letras diferentes diferem significativamente
pelo teste t de student (p≤0,05).
Conforme observado na Tabela 11, houve aumento significativo (p<0,05) na
área relativa das fibras tipo IIA decorrente do treinamento. Em contrapartida,
ocorreu diminuição significativa (p<0,05) na área ocupada pelas fibras IIX. A área
ocupada pelas fibras IIA foi significativamente maior (p<0,05) que a área ocupada
pelas fibras tipos I e IIX, tanto nos animais treinados como nos inativos.
4.5. Quantificação do glicogênio total
A dieta alimentar não influenciou na concentração de glicogênio total nas
fibras musculares (Tabela 12).
Tabela 12. Médias ± EPM do glicogênio total presente nas fibras do músculo
glúteo médio de eqüinos cruza Árabe e PSA, submetidos a diferentes
concentrações de óleo de soja.
Grupos de dietas
Glicogênio total (g/100g)
I (n=4)
1,46 ± 0,17
II (n=4)
1,51 ± 0,16
III (n=4)
1,54 ± 0,25
IV (n=4)
1,15 ± 0,14
V (n=4)
1,27 ± 0,32
Médias na mesma coluna não diferiram significativamente pelo teste de Tukey (p≤0,05).
54
Não houve alteração significativa (p>0,05) no glicogênio total presente no
músculo glúteo médio dos animais estudados após o período de treinamento de
sete semanas (Tabela 13).
Tabela 13. Médias ± EPM do glicogênio total presente nas fibras do músculo
glúteo médio de eqüinos cruza Árabe e PSA, submetidos a treinamento
de resistência durante sete semanas.
Grupos de treinamentos
Pré (n=20)
Glicogênio total (g/100g)
1,41 ± 0,11
Pós (n=20)
1,37 ± 0,07
Pré: antes do treinamento, Pós: após o treinamento.
Médias na mesma coluna não diferiram significativamente pelo teste t de student (p<0,05).
4.6. Relação treinamento x tipo de fibra x metabolismo energético
As curvas velocidade-lactato médias dos animais, assim como, as
proporções das fibras oxidativas e glicolíticas do músculo glúteo médio antes e
após o período de treinamento estão apresentadas na Figura 8 e Tabela 14,
respectivamente. Observa-se que houve deslocamento da curva velocidadelactato para a direita, aumentando a velocidade necessária para atingir o limiar
anaeróbio considerado como 4mmol de lactato sanguíneo (VLac4). Os animais
apresentaram aumento significativo no percentual de fibras oxidativas (I+IIA) e
diminuição das fibras glicolíticas (IIX) após o treinamento.
55
10
9
Concentração de lactato (mmol/L)
Pré-treinamento
Pós-treinamento
VLac4 PRÉ: 7,71b
VLac4 PÓS: 8,80a
8
7
a
6
5
IIX
IIX
4
IIX
IIA
3
2
1
0
0
1
2
3
4
5
6
7
8
9
10
11
Velocidade (m/s)
Figura 8. Curva velocidade-lactato de eqüinos cruza Árabe e PSA,
submetidos a treinamento de resistência durante sete semanas.
Tabela 14. Freqüência e área relativa das fibras oxidativas e glicolíticas
antes e após o período de treinamento.
Variáveis
Fibras
oxidativas
glicolíticas
PRÉ
64,9Ab
35,1Ba
PÓS
77,6Aa
22,4Bb
oxidativas
53,5Ab
67,5Aa
glicolíticas
Oxidativas (I + IIA), glicolíticas (IIX).
46,5Ba
32,5Bb
Freqüência (%)
Area relativa (%)
Letras maiúsculas representam comparações na mesma coluna (entre fibras) e letras minúsculas
representam comparações na mesma linha (entre treinamentos). Letras diferentes diferem
significativamente pelo teste t de student (p≤0,05).
56
V. DISCUSSÃO
A alimentação, assim como, o tipo de exercício desenvolvido são fatores
que influenciam a adaptação das fibras musculares (RIVERO & PIERCY, 2004).
Neste estudo a suplementação alimentar com base nas diferentes concentrações
de óleo de soja durante sete semanas não influiu significativamente sobre
nenhuma das variáveis estudadas, sendo o treinamento responsável pelas
adaptações ocorridas no músculo glúteo médio dos animais em questão. Esses
resultados deferiram dos encontrados por Dunnett et al. (2002), que observaram
aumento da capacidade oxidativa muscular em animais submetidos a exercício de
baixa e moderada intensidade, suplementados com óleo durante 10 semanas.
Embora o peso dos animais tenha diminuído significativamente ao final do
treinamento; o escore corporal aumentou, entretanto esse aumento não foi
considerado significativo. Esse fato pode ser explicado porque o grupo de animais
utilizado não apresentava homogeneidade quanto ao estado corporal no início do
treinamento. Dessa forma, os animais magros adquiriram peso enquanto os
obesos perderam, formando um grupo aparentemente mais homogêneo que
demonstrou uma condição corporal adequada no decorrer do treinamento. Notouse ainda, que ambos adquiriram massa muscular e melhoria na capacidade física
para realização dos exercícios, adquirindo maior resistência à fadiga. De acordo
com SERRANO et al. (2000) a resistência à fadiga está relacionada ao aumento
do número de mitocôndrias e capilares, da atividade oxidativa das enzimas
musculares, e a menor mobilização de glicogênio endógeno devido a utilização da
oxidação dos lipídeos como fonte de energia.
Conforme relatado por inúmeros pesquisadores (ESSÉN-GUSTAVSSON et
al., 1984; RIVERO et al., 1995a; 1995b; LINDNER et al., 2002; D’ANGELIS, 2004),
o método de biópsia muscular por agulha percutânea tipo Bergström adotado
nesta pesquisa demonstrou ser uma técnica de fácil aplicação, causando lesões
de pequena proporção, cuja cicatrização evoluiu de forma rápida sem a ocorrência
57
de complicações, podendo ser aplicada em animais que estejam participando de
programas de treinamento.
A profundidade de 6,0 cm adotada para a colheita propiciou amostras
homogêneas.
Considera-se
que
amostras
coletadas
em
eqüinos
nesta
profundidade apresentam maior homogeneidade dos tipos de fibras. Enquanto, na
profundidade de 8,0 cm, observa-se maior proporção de fibras do tipo I e em
regiões superficiais do músculo (4,0 cm) encontra-se maior predomínio de fibras
tipo IIX (RIVERO et al., 1995a; SERRANO & RIVERO, 2000).
Conforme descrito em estudos prévios na espécie eqüina, os resultados
obtidos a partir da técnica de mATPase permitiu confirmar a existência de três
tipos de fibras puras no músculo glúteo médio de eqüinos, as fibras tipo I, IIA e IIX.
Mediante a utilização da técnica metabólica do NADH-TR observou-se que as
fibras tipo I e IIA reagiram intensamente, demonstrando, portanto, serem
oxidativas, enquanto as fibras IIX reagiram fracamente por apresentarem
metabolismo glicolítico. A associação das técnicas mATPase e NADH-TR,
possibilitou ainda, identificar as fibras híbridas IIAX (IIA + IIX) que representaram
3,4% e 0,6% antes e após o treinamento respectivamente. Para a identificação
adequada das fibras híbridas é indicada a utilização de técnicas mais precisas
como a eletroforese e a imunohistoquímica (RIVERO & PIERCY, 2004), entretanto
tais técnicas não foram realizadas neste estudo e dessa forma pode-se inferir que
a freqüência de fibras tipo IIAX foram subestimadas. Não foram identificadas fibras
híbridas tipo C, tal fato pode ser justificado porque estas são geralmente
encontradas em animais jovens, sendo raras em adultos.
GONDIM et al. (2005) identificaram fibras puras I, IIA e IIX, e fibras híbridas
IIAX em amostras do músculo glúteo médio de cavalos árabes com idades entre
sete e 11 anos submetidos a treinamento para enduro. Observaram ainda que as
fibras híbridas IIAX representavam uma porcentagem inferior a 10% do total de
fibras quantificadas, e apresentavam área de secção transversal muito variada.
Estes autores também não identificaram fibras tipo C nas suas amostras.
58
As fibras musculares apresentaram o padrão de distribuição em mosaico no
músculo glúteo médio, corroborando com estudos precedentes realizados em
eqüinos (RIVERO & PIERCY, 2004).
As
fibras
tipo
IIX
apresentaram
área
de
secção
transversal
significativamente maior que as fibras tipo IIA. Por sua vez, nestas últimas a área
de secção transversal foi maior que a das fibras tipo I nos períodos pré e pós
treinamento, esses achados corroboram os encontrados por GONDIM et al.
(2005). Segundo RIVERO et al. (1999) e SERRANO & RIVERO (2000) as fibras
IIX são maiores em tamanho que as fibras tipo I e IIA, especialmente em eqüinos
sem treinamento prévio.
O treinamento de resistência realizado no período de sete semanas
resultou em modificações nas propriedades contráteis e metabólicas do músculo
glúteo médio, aumentando a capacidade oxidativa das fibras musculares a partir
do aumento na proporção das fibras tipo IIA em detrimento das fibras tipo IIX; do
aumento da área relativa ocupada pelas fibras oxidativas (I + IIA) e da diminuição
da área ocupada pelas fibras glicolíticas (IIX). Os diferentes tipos de fibras
apresentaram diferenças quanto a porcentagem da área ocupada por cada uma
dela, obedecendo a seguinte proporção da maior para a menor: IIX>IIA>I e
IIA>IIX>I antes e após o treinamento, respectivamente. O somatório da área
ocupada pelas fibras I e IIA atingiu 64,9 e 77,6% nos períodos pré e pós
treinamento, respectivamente, confirmando a melhoria na capacidade oxidativa do
músculo. Entretanto, não se observou hipertrofia das fibras musculares,
possivelmente devido ao tempo de duração e intensidade do treinamento utilizado.
Inúmeros estudos utilizando treinamento de resistência em eqüinos têm
demonstrado aumento na freqüência das fibras IIA e concomitante diminuição das
fibras IIX (ESSÉN-GUSTAVSSON & LINDHOLM, 1985; ESSÉN-GUSTAVSSON et
al., 1989; RIVERO et al., 1989; 1991; 1995b; RIVERO, 1996). As pesquisas têm
reportado ainda, o aumento de fibras híbridas IIAX e fibras tipo I (RIVERO et al.,
1995b; RONÉUS et al., 1987; SERRANO et al., 2000). Em contrapartida, os
treinamentos de alta intensidade e curta duração têm ocasionado diminuição das
59
fibras tipo I e aumento das fibras tipo IIX (LOVELL & ROSE, 1991; RIVERO et al.,
2002).
SERRANO et al. (2000) relataram que dependendo da natureza do estímulo
induzido, a resposta adaptativa pode ocasionar hipertrofia nas fibras musculares
e/ou alteração das propriedades metabólicas e estruturais. A correlação entre a
duração do programa de treinamento e a magnitude das alterações induzidas no
âmbito molecular tem demonstrado a ocorrência da transição de fibras IIX para IIA
durante a fase precoce do treinamento e conversão de fibras IIA em I mais
tardiamente (SERRANO & RIVERO, 2000; SERRANO et al., 2000). Dessa forma a
fibra é capaz de alterar completamente suas propriedades contráteis e
metabólicas como resposta ao estímulo recebido (RIVERO & PIERCY, 2004).
O efeito do treinamento sobre a área das fibras musculares de eqüinos é
controverso (RIVERO & PIERCY, 2004). As pesquisas vêm apresentando
resultados diversificados, tal fato pode ser explicado pelos diferentes tipos de
exercício que os cavalos são submetidos, pela diferença na proporção de fibras
em cada raça e pelas diferentes respostas que esta diferença pode apresentar
após um período de treinamento. Cavalos adultos sob um programa de
treinamento aeróbio apresentam normalmente pequeno aumento da área das
fibras musculares. Esta resposta está relacionada à conversão de fibras de baixa
capacidade oxidativa em fibras de alta capacidade oxidativa, que possuem área
menor. A redução na área da fibra quando esta está se tornando mais adaptada
ao metabolismo aeróbio é uma alteração favorável, pois permite rápida difusão de
oxigênio para o interior da fibra e remoção de produtos do metabolismo, como o
CO2. Estudos realizados em cavalos de corrida de idades similares verificaram
maior área de fibra para os animais inativos do que nos cavalos em atividade,
apesar de uma aparentemente maior massa muscular nos cavalos de alta
performance (SNOW & VALBERG,1994). Segundo RIVERO (1996) as respostas
musculares adaptivas ao treinamento são mais pronunciadas em cavalos jovens e
inativos que em cavalos maduros e treinados regularmente. Tais respostas
60
geralmente são mantidas por um período de cinco a seis semanas de inatividade
(FOREMAN et al., 1990; TYLER et al., 1998).
RIVERO et al. (1995b) encontraram hipertrofia das fibras tipo I e IIA em
amostras colhidas na profundidade de 6,0 cm do glúteo médio em PSA
submetidos a programa de treinamento de resistência por três meses. Notaram
ainda, que os animais que possuíam maiores porcentagens e áreas das fibras tipo
I e IIA apresentaram melhor resposta ao teste ergométrico. RIVERO et al. (1993c)
observaram que cavalos competidores em enduro que apresentavam performance
atlética excelente possuíam alta porcentagem de fibras de contração lenta e
metabolismo oxidativo, com maior área que cavalos considerados de performance
moderada. Enquanto TYLER et al. (1998) observaram hipertrofia dos três tipos de
fibras em resposta ao treinamento de alta intensidade.
SERRANO & RIVERO (2000) verificaram hipertrofia de fibras tipo I após
três meses de treinamento aeróbio de éguas da raça Andaluz, utilizando 50% da
vlac2 (velocidade correspondente a 2mmol/L de lactato sangüíneo). Argumentaram
que esse período de treinamento não foi suficiente para converter fibras IIX em IIA
e estas em I. SERRANO et al. (2000) aplicando metodologia semelhante a
SERRANO & RIVERO (2000) em garanhões Andaluzes observaram hipertrofia
das fibras IIA após três meses de treinamento. Segundo os mesmos autores, esse
tipo específico de hipertrofia é explicado pela conversão de fibras IIX em IIA, já
que as fibras IIX possuem área maior que as fibras tipo IIA.
D’ANGELIS et al. (2005) observaram que o treinamento aeróbio em PSA
realizado por 90 dias utilizando 80% do Vlac4 (velocidade em que a concentração
de lactato sangüínea atingiu 4mmol/L) não alterou significativamente a freqüência
das fibras tipo I e IIA, entretanto reduziu significativamente a porcentagem das
fibras tipo IIX. Verificaram ainda hipertrofia das fibras tipo I, IIA e IIX, e aumento da
área relativa das fibras tipo I.
Existe possível relação entre o tamanho dos diferentes tipos de fibras
musculares com os padrões que regem a ativação das mesmas durante o
exercício muscular, já que são recrutadas de acordo com a intensidade e duração
61
do trabalho muscular. Dessa forma, as respostas musculares ao treinamento
dependerão das características do estímulo (tipo, intensidade e duração) e do
estado do músculo antes do início do treinamento (RIVERO, 1996).
Para a
manutenção da postura e exercícios de baixa intensidade, geralmente, são
ativadas as fibras tipo I. Quando a atividade requer o desenvolvimento de forças
rápidas e prolongadas são recrutadas as fibras IIA (ARMSTRONG & PHELPS,
1984; ALECKOVIC et al., 1989) e quando o trabalho muscular gera movimentos
rápidos e breves, são ativadas as fibras IIX (RIVERO & CLAYTON, 1996).
De acordo com SERRANO et al. (2000), exercícios de resistência
ocasionam transição de fibras de contração rápida para contração lenta. O
organismo, no seu mecanismo de adaptação ao estresse metabólico, modifica a
expressão das isoformas de cadeia pesada de miosina (SERRANO & RIVERO,
2000; BALDWIN & HADDAD, 2001). Isso pode explicar o incremento das fibras
musculares com tendência ao metabolismo aeróbio, devido a transformação das
fibras tipo IIX em IIA e destas em I (ESSÉN-GUSTAVSSON e LINDHOLM, 1985;
RIVERO et al., 1993a; BALDWIN & HADDAD, 2001; LEFAUCHER, 2001).
Como ressalta MUÑOZ et al. (1999), o desempenho atlético do eqüino está
intimamente ligado à relação entre a capacidade oxidativa e glicolítica do
indivíduo. D’ANGELIS et al. (2005) observaram que os animais apresentando
maiores freqüências e área ocupada pelas fibras tipo I e IIA, após três meses de
treinamento aeróbio, também, foram os melhores em desempenho atlético nos
testes ergométricos. Contrariamente, os cavalos que mostraram menores
freqüências e área ocupada pelas fibras tipo I e IIA apresentaram baixo
desempenho no exercício teste. Esses dados confirmam que cavalos com
excelente desempenho atlético em programas de treinamento aeróbio apresentam
maiores freqüências de fibras oxidativas. No entanto, no presente estudo tal fato
não foi observado, pois não houve diferença significativa na freqüência e área
ocupada pelas fibras oxidativas entre os animais que obtiveram melhor e pior
desempenho nos testes ergométricos.
62
As adaptações celulares e ultra-estruturais musculares observadas têm
sido interpretadas no homem (HOPPELER et al., 1973; ANDERSEN &
HENRIKSSON, 1977; INGJER, 1979) e no cavalo (RIVERO, 1997) como
indicativos de incremento da capacidade aeróbia e melhoria da capacidade de
resistência. Numerosos estudos têm demonstrado no cavalo um incremento da
densidade mitocondrial associado com diferentes tipos de treinamento e uma
correlação positiva entre o número de fibras musculares com elevada capacidade
oxidativa e o êxito competitivo em atividades de resistência (RIVERO, 1997).
Segundo LINDNER et al. (1997), o treinamento realizado em dias
alternados durante seis semanas em intensidades equivalentes a vlac1,5 ou vlac2,5
durante 45 minutos possuíram maior efeito sobre os parâmetros celulares e ultraestruturais do músculo glúteo médio que o treinamento em maior intensidade
(vlac4) durante apenas 25 minutos. Dessa forma, concluíram que o treinamento
delineado com sessões de intensidade relativamente baixa e duração prolongada
é mais efetivo para melhorar a capacidade de resistência individual que o
treinamento com exercícios de intensidade mais alta e de menor duração. Esses
resultados corroboram com nossos achados e confirmam as observações que
vêm sendo realizadas na fisiologia do exercício eqüino por D’ANGELIS et al.
(2005) e MARTINS et al. (2006).
SERRANO et al. (2000) concluíram que a magnitude das alterações
ocorridas em função do treinamento, como a conversão de fibras de contração
rápida em lenta, depende da duração do mesmo. A maioria das adaptações
induzidas com o treinamento é reversível quando o estímulo cessa e que as
alterações em resposta ao treinamento não ocorrem de forma homogênea no
tecido muscular, sendo mais marcantes em determinadas regiões do músculo.
A produção e a utilização apropriada de energia são essenciais para o
eqüino atleta, representando o ponto crítico para o desempenho máximo (EATON,
1994; LINDNER et al., 1997; HARRIS & HARRIS, 1998). Em cavalos de enduro, a
principal via energética utilizada é a aeróbia (SLOET et al., 1991; HOFFMAN et al.,
2002), sendo os lipídeos a principal fonte energética (BERGERO et al., 2005).
63
PRINCE et al. (2002) demonstraram que eqüinos da raça PSA possuem
predisposição racial para a utilização de ácidos graxos livres durante exercícios de
baixa intensidade.
Em exercícios de baixa intensidade e longa duração ocorre ativação do
metabolismo oxidativo que utiliza principalmente da oxidação de lipídeos como
fonte
de
energia.
O
condicionamento
aeróbio
ocasiona
aumento
das
concentrações de enzimas das vias associadas a β-oxidação no músculo
esquelético resultando no aumento da capacidade de trabalho devido à grande
oxidação das gorduras e a pequena utilização de glicogênio (ROSE, 1986) e
aumento da capacidade oxidativa, aumento da vascularização, redução da
glicogenólise muscular e do metabolismo anaeróbio (GEOR et al., 1999; TYLER et
al., 1998). Como conseqüência ocorre melhoria do mecanismo de produção e
metabolização do lactato, retardando o seu acúmulo (BAYLY, 1985; VALBERG,
1986). De acordo com RIVERO & PIERCY (2004) essas adaptações são
acompanhadas pela melhoria da capacidade de tamponamento muscular e maior
eficiência do complexo excitação contração.
Alguns pesquisadores consideram que o organismo como mecanismo de
compensação ao aumento dos ácidos graxos no sangue, modifica as vias
metabólicas responsáveis pela produção de ATP no músculo esquelético em
direção as vias oxidativas, especialmente, as implicadas na degradação dos
ácidos graxos. Essa adaptação metabólica direcionada ao metabolismo aeróbio
parece gerar alterações na estrutura do fenótipo fibrilar, como diminuição do
tamanho da fibra muscular e possui a vantagem de facilitar a difusão do oxigênio e
substratos necessários para o metabolismo oxidativo (SIECK et al., 1995; PICARD
et al., 2002).
Embora os lipídeos sejam os substratos energéticos predominantes para a
realização de exercícios submáximos, a fadiga nesses casos tem sido associada
ao esgotamento de glicogênio intramuscular (VALBERG, 1986). BERGSTRÖM et
al. (1967) relataram que atletas com maior concentração de glicogênio muscular
apresentaram maior desempenho físico e dessa forma, o aumento das reservas
64
de glicogênio muscular adquiridas com o treinamento tem sido interpretado como
benéfico.
De acordo com DUNNETTT et al. (2002) a vantagem de utilizar dietas
hiperlipídicas concomitante ao treinamento físico é favorecer a utilização de ácidos
graxos como substrato para o metabolismo energético. Como conseqüência desta
alteração metabólica ocorre a economia de outros substratos como a glicose
plasmática, aminoácidos e o glicogênio muscular. Entretanto, nesse trabalho, as
reservas de glicogênio muscular dos animais se mantiveram constantes após o
período de treinamento. Tal fato pode ser justificado pela duração do período
experimental ter sido insuficiente para ocasionar tais adaptações. A grande
divergência dos resultados dos estudos nos quais é avaliado o efeito de gordura
animal ou óleos vegetais sobre a resposta metabólica e o desempenho de cavalos
atletas parece depender da disparidade dos protocolos experimentais utilizados,
podendo ser atribuída a vários fatores, como, idade, condição corporal, raça,
intensidade e duração do condicionamento físico, composição e período de
administração da dieta e a técnica de determinação do glicogênio.
D’ANGELIS (2004) também não observou alterações nas reservas de
glicogênio muscular após o período de treinamento de 90 dias. Em contrapartida,
SERRANO et al. (2000) encontraram aumento significativo no conteúdo de
glicogênio muscular após três e oito meses de treinamento para enduro. Esses
mesmos autores constataram também que o treinamento aeróbio induziu menor
mobilização de glicogênio endógeno, utilizando a oxidação de lipídeos como fonte
de energia.
GANSEN et al. (1999) avaliaram o efeito de três programas de treinamentos
diferentes sobre as reservas de glicogênio muscular e verificaram que durante
todo período de condicionamento as concentrações de glicogênio permaneceram
constantes para as amostras colhidas na profundidade de 2,0 e 6,0 cm. Nove dias
após o término do treinamento observaram aumento de 47 e 48% respectivamente
nas concentrações de glicogênio dos animais submetidos aos treinamentos
delineados na vlac1,5 ou vlac2,5 durante 45 minutos e essas concentrações
65
permaneceram elevadas até cinco semanas após o fim do condicionamento. Já o
treinamento de maior intensidade e menor duração utilizando a vlac4 por 25 minutos
não exerceu efeito significativo sobre a variável estudada. Os mesmos autores
relataram ainda que as amostras colhidas na profundidade de 6,0 cm
apresentaram maiores concentrações de glicogênio quando comparada às
colheitas efetuadas na profundidade de 2,0 cm.
SERRANO et al. (2000) detectaram aumento do conteúdo de glicogênio
intramuscular após três meses de treinamento aeróbio e observaram que esse
substrato diminuiu significativamente após três meses de destreinamento. No
entanto, ainda foi considerado significativamente mais elevado que antes do início
do treinamento.
Considerando que as fibras tipo I e IIA possuem metabolismo oxidativo, os
resultados obtidos indicaram que o programa de treinamento utilizado promoveu o
aumento do potencial aeróbio no músculo glúteo médio em detrimento do
potencial glicolítico do mesmo.
De acordo com RIVERO (1996) a análise de biópsias musculares extraídas
antes e após o programa de treinamento pode comprovar a efetividade do mesmo.
Embora sejam numerosos os estudos que investigam a resposta muscular ao
exercício e como o treinamento modifica esta resposta (SNOW & VALBERG 1994;
RIVERO & PIERCY, 2004), são poucos os pesquisadores que empregam esses
conhecimentos básicos em aplicações práticas para avaliar a capacidade
competitiva e controlar o treinamento aplicado ao cavalo.
A importância da musculatura esquelética no sistema locomotor, sua
grande capacidade adaptativa e sua íntima relação com a performance nas
diversas atividades eqüestres, devem servir de estímulo para busca de
conhecimentos estruturais e metabólicos deste tecido para que possamos
manipular o desenvolvimento muscular de forma adequada, obtendo o máximo
desempenho e evitando afecções musculares, entre outras. É importante enfatizar
que embora a literatura disponha de inúmeras pesquisas relacionadas ao estudo
das características musculares em eqüinos, novos estudos se fazem necessários
66
para determinar as características metabólicas, bioquímicas e estruturais das
fibras nas diversas raças submetidas a diferentes programas de treinamento,
especialmente os realizados à campo. Faz-se também necessário a difusão e a
aplicação prática dos conhecimentos adquiridos com as pesquisas visando auxiliar
os programas de treinamentos realizados nas diversas modalidades de esportes
eqüestres.
67
VI. CONCLUSÕES
Os resultados obtidos no presente trabalho permitiram concluir que:
As diferentes concentrações de óleo na dieta não influenciaram as variáveis
estudadas.
O treinamento não induziu hipertrofia das fibras do músculo glúteo médio.
O treinamento ocasionou aumento na proporção e na área relativa das
fibras tipo IIA em detrimento das fibras IIX, melhorando a capacidade oxidativa
muscular.
Tanto as dietas com óleo como o treinamento não aumentaram as
concentrações de glicogênio muscular.
O treinamento melhorou a capacidade aeróbia dos animais.
68
VII. REFERÊNCIAS
ALECKOVIC, Z.; ZOBUNDZIJA, M.; BRICK, A.; MIHOLJCIC, B. Histochemical and
morphological characteristics of muscles in relation to their functional activity. Acta
Veterinaria, Brno, v. 39, n. 5-6, p. 287-298, 1989.
ALLEN, D. L.; LEINWAND, L. A. Postnatal myosin heavy chain isoform expression
in normal mice and mice null for IIB or IID myosin heavy chains. Developmental
Biology, San Diego, v. 229, p. 383-395, 2001.
ANDERSEN P.; HENRIKSSON, J. Capillary supply of the quadriceps muscle of
man: adaptive response to exercise. The Journal of Physiology, Cambridge, v.
270, p. 677-690, 1977.
ANTONUTTO, G.; DI PRANPERO, P. E. The concept of lactate threshold: A short
review. Journal of Sports Medicine and Physical Fitness, Torino, v. 35, n. 1, p.
6-12, 1995.
ARMSTRONG R. B.; PHELPS, R. O. Muscle fiber type composition of the rat
hindlimb. American Journal of Anatomy, Philadelphia, v. 171, p. 259-272, 1984.
ASHMORE, C. R.; DOERR, L. Comparative aspects of muscle fiber types in
different species. Experimental Neurology, San Diego, v. 31, p. 408-418, 1971.
BALDISSERA, V. Fisiologia do exercício para eqüinos. Cadernos Técnicos da
Escola de Medicina Veterinária da UFMG, Belo Horizonte, n.19, p. 39-47, 1997.
BALDWIN, K. M.; HADDAD, F. Plasticity in skeletal, cardiac, and smooth muscle
invited review: Effects of different activity and inactivity paradigms on myosin heavy
chain gene expression in striated muscle. Journal Applied Physiology,
Bethesda, v. 90, p. 345-357, 2001.
BARREY, E.; VALETTE, J. P.; JOUGLIN, M.; BLOUIN, C.; LANGLOIS, B.
Heritability of percentage of fast myosin heavy chains in skeletal muscles and
relationship with performance. Equine Veterinary Journal, London, Suppl. 30, p.
289-292, 1999.
69
BAYLY, W. M. Training programs. Veterinary Clin North Am Equine Pratice, v.
1, n. 3, p. 567-610, 1985.
BAYLY, W. M.; HODGSON, D. Muscle biopsy: What have we learnt in the last 20
years? Equine Veterinary Journal, London , v. 23, p. 105-151, 1991.
BEECHER, G. R; CASSENS, R. G.; HOEKSTRA, W. G.; BRISKEY, E. J. Red and
white fiber content and associated post mortem properties of seven porcine
muscles. Journal of Food Science, Chicago, v. 30, p. 969-976, 1965.
BERGERO, D.; ASSENZA, A.; CAOLA, G. Contribution to our knwledge of the
physiology and metabolism of the endurance horses. Livestock Production
Science, Amsterdam, v. 92, n.2, p.167-176, 2005.
BERGSTRÖM, J.; HERMANSEN, L.; HULTMAN, E.; SALTIN, B. Diet, muscle
glycogen
and
physical
performance.
Acta
Physiologica
Scandinavica,
Stockholm, v.71, p. 140-150, 1967.
BILLAT, L. V. Use of blood lactate measurements for prediction of exercise
performance for control of training. Recommendations for long distance running.
Sports Medicine, Auckland, v. 22, n. 3, p. 157-175, 1996.
BLANCO, A. R.; PÉREZ, A. J. Tejido muscular. In: GASQUEZ, A. O.; BLANCO, A.
R. Tratado de histología veterinaria. Barcelona: Masson, 2004. p. 145-152.
BOTTINELLI, R.; REGGIANI, C. Human skeletal muscle fibres: molecular and
functional diversity. Progress in Biophysics & Molecular Biology, New York, v.
73, p. 195-262, 2000.
BOTTINELLI, R.; SCHIAFFINO, S.; REGGIANI, C. Force velocity relations and
myosin heavy chain isoform compositions of skinned fibres from rat skeletal
muscle. The Journal of Physiology, Cambridge, v. 437, p. 655-672, 1991.
BOTTINELLI, R.; CANEPARI, M.; REGGIANI, C.; STIENEN, G.J. Myofibrilar
ATPase activity during isometric contraction and isomyosin composition in rat
70
single skinned muscle fibers. The Journal of Physiology, Cambridge, v. 481, p.
663-675, 1994.
BROCKS, L.; KLONT, R. E.; GREEF, K. De; TIEMAN, M.; ENGEL, B. The effects
of selection of pigs on growth rate vs. leanness on histochemical characteristics of
different muscle. Journal of Animal Science, Champaign, v. 78, p. 1247-1254,
2000.
BROOKE, M. H.; KAISER, K. Muscle fiber types: How many and what kind.
Archives of Neurology, Chicago, v. 23, p. 369, 1970.
CHIKUNI, K.; TANABE, R.; MUROYA, S.; NAKAJIMA, I. Differences in molecular
structure among the porcine myosin heavy chain 2a, 2x, and 2b isoforms. Meat
Science, Barking, v. 57, p. 311-317, 2001.
DA COSTA, N.; BLACKLEY, R.; ALZUHERRI, H.; CHANG, KIN CHOW.
Quantifying the temporospatial expression of postnatal and skeletal myosin heavy
chain genes. The Journal of Histochemistry and Cytochemistry, Baltimore, v.
50, n. 3, p. 353-364, 2002.
D’ANGELIS, F.H.F. Avaliação do efeito da suplementação prolongada com
creatina sobre músculos estriados esqueléticos de eqüinos em treinamento
aeróbico. 2004. 83f. Tese (Doutorado em Medicina Veterinária) - Faculdade de
Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal,
2004.
D’ANGELIS, F. H. F.; FERRAZ, G. C.; BOLELI, J. C.; LACERDA-NETO, J. C.;
QUEIROZ-NETO, A. Aerobic training, but not creatine supplementation, alters the
gluteus medius muscle. Journal of Animal Science, Champaing, v. 83, p. 579585, 2005.
DEMIREL, H. A.; POWERS, S. K.; NAITO, H.; HUGHES, M.; COOMBES, J. S.
Exercise induced alterations in skeletal muscle myosin heavy chain phenotype:
dose response relationship. Journal Applied Physiology, Bethesda, v. 86, n. 3, p.
1002-1008, 1999.
71
DUBOWITZ, V.; BROOKE, M. H. Muscle biopsy: a modern approach. London:
W.B. Saunders, 1973.
DUNNETT, C. E.; MARLIN, D. J.; HARRIS, H. C.
Effect of dietary lipid on
response to exercise: relationship to metalolic adaptation. Equine Veterinary
Journal Suppl., v. 34, p. 75-80, 2002.
EATON, M.D. Energetics and performance. In: HODGSON, D.R.; ROSE ,R.J.; The
athletic horse: principles and practice of equine sports medicine. Philadelphia: W.
B. Saunders, 1994, p. 49-62.
EDDINGER, T. J. Review. Myosin heavy chain isoforms and dynamic contractile
properties: skeletal versus smooth muscle. Comparative Biochemistry and
Physiology. Part B, New York, v. 119, p. 425-434, 1998.
ENNION, S.; SANT’ANA, P. J.; SARGEANT, A. J.; YOUNG, A.; GOLDSPINK, G.
Characterization of human skeletal muscle fibres according to the myosin heavy
chains they express. Journal of Muscle Research Cell Motility, Dordrecht, v.16,
p.35-43, 1995.
ENGEL, A. G. The essentiality of histo and cytochemical studies of skeletal muscle
in investigation of neuromuscular disease. Neurology, Minneapolis, v. 12, p. 778,
1962.
ERIKSON, H. H. Fisiologia do exercício. In: DUKES, M. J. S. Fisiologia dos
animais domésticos. 11. ed. Rio de Janeiro: Guanabara Koogan, 1996. p. 277296.
ESSÉN-GUSTAVSSON, B. Skeletal muscle adaptation with use and disuse.
Comparative aspects between species. In: INTERNATIONAL CONGRESS OF
MEAT SCIENCE AND TECHNOLOGY, 42. 1996, Lillehammer. Proceedings…,
1996. p. 1-16.
ESSÉN-GUSTAVSSON, B.; KARLSTROM, K.; LINDHOLM, A.
Fibre types,
enzyme activities and substrate utilization in skeletal muscle of horses competing
in endurance rides. Equine Veterinary Journal, London, v. 16, p. 197-202, 1984.
72
ESSEN-GUSTAVSSON, B.; KARLSSON, A.; LUNDSTROM, K.; ENFALT, A. C.
Intramuscular fat and muscle fibre lipid contents in halothane gene free pigs fed
high or low protein diets and its relation to meat quality. Meat Science, Barking, v.
38, p. 269-277, 1994.
ESSEN-GUSTAVSSON, B.; LINDHOLM, A.; McMIKEN, D. Skeletal muscle
characteristics in young Standardbreds in relation to growth and early training. In:
SNOW D. H.; PERSSON, S. G. B; ROSE; R. J. Equine exercise physiology.
Cambridge: Burligton Press, 1983. p. 200-210.
ESSEN-GUSTAVSSON, B.; LINDHOLM, A.; THORTHON, J. Histochemical
propries of muscle fibres types and enzime actives in skeletal muscles of
Standerbred trotters of different ages. Equine Veterinary Journal, London, v. 12,
n. 4, p. 175-180, 1980.
ESSÉN-GUSTAVSSON, B.; McMIKEN, D.; KARLSTRÖM, K.; LINDHOLM, A.;
PERSSON, S.; THORNTON, J. Muscular adaptations to intensive training and
detraining. Equine Veterinary Journal, London , v. 21, p. 27-33, 1989.
ESSEN-GUSTAVSSON, B.; JENSEN WAERN, M. Muscle characteristics and
metabolic response at slaughter in domestic pigs reared either outdoors or indoors,
In: INTERNATIONAL CONGRESS OF MEAT SCIENCE AND TECHNOLOGY.
Calgary, v. 39, 1993.
ESSEN-GUSTAVSSON, B.; LINDHOLM, A. Muscle fibre characteristics of actives
and inactives Standarbred horse. Equine Veterinary Journal, London, v. 17, p.
434-438, 1985.
ETO, D.; YAMANO, S.; KASASHIMA, Y.; SUGIURA, T.; NASU, T.; TOKURIKI, M.;
MIYATA, H. Effect of controlled exercise on midle gluteal muscle fibre composition
in thoroughbred foals. Equine Veterinary Journal, London, v. 35, n. 7, p. 676-680,
2003.
73
EVANS, D. L.; HARRIS, R. C.; SNOW, D. H. Correlation of racing performance
with blood lactate and heart rate after exercise in thoroughbred horses. Equine
Veterinary Journal, London , v. 25, n. 5, p. 441-445, 1993.
FOREMAN, J. H.; BAYLY, W. M.; ALLEN, J. R.; MATOBA, H.; GRANT, B. D.;
GOLLNICK, P. D. Muscle responses of Throughbreds to conventional race training
and detraining . American Journal Veterinary Research, v. 51, p. 909-913, 1990.
GALLER, S.; HILBER, K.; GOHLSCH, B.; PETTE, D. Two functionally distinct
myosin heavy chain isoforms in slow skeletal muscle fibres. FEBS Letters,
Amsterdam, v. 410, n. 2-3, p.150-152, 1997.
GANSEN, S., LINDNER, A., MARX, S., MOSEN, H., SALLMANN, H. –P. Effects of
conditioning horses with lactate-guided exercise on muscle glycogen content.
Equine Veterinary Journal, London, Supl. 30, p. 329-331, 1999.
GENTRY, J. G.; McGLONE, J. J.; BLANTON, J. R; MILLER, M. F. Impact of
spontaneous
exercise
on
performance,
meat
quality
and
muscle
fiber
characteristics of growing finishing pigs. Journal of Animal Science, Champaign,
v. 80, n. 11, p. 2833-2839, 2002.
GEOR, R. J.; McCUTCHEON, J. L.; SHEN, H. Muscular and metabolic responses
to moderate intensity short term training. Equine Veterinary Journal, London,
Suppl. 30, p. 311-317, 1999.
GOLDSPINK, G. Selective gene expression during adaptation of muscle in
response to different physiological demands. Review. Comparative Biochemistry
and Phisiology Part B, New York, v. 120, p. 5-15, 1998.
GOLL, D. E. Músculo esquelético. In: SWENSON, M. J.; RIECE, W.O. DUKES:
Fisiologia dos animais domésticos. 11ed., Rio de Janeiro: Guanabara Koogan,
1996, 856p.
GONDIM, F. Fibras musculares: aptidão atlética diagnosticável por tipagem.
Disponível em: <www. endurancebrasil.com.br>. Acesso em: 12 de abril de 2005.
74
GONZALES, E.; SARTORI, J. R. Crescimento e metabolismo muscular. In:
Fisiologia aviária aplicada a frangos de corte. Jaboticabal: FUNEP/UNESP,
2002, p. 279-297.
GORZA, L. Identification of a novel type 2 fiber population in mammalian skeletal
muscle by combined use of histochemical myosin ATPase and anti myosin
monoclonal antibodies. The Journal of Histochemistry and Cytochemistry,
Baltimore, v. 38, n. 2, p. 257-265, 1990.
GUTH, L.: SAMAHA, F. J. Procedure for the histochemical demonstration of
actomyosin ATPase. Experimental Neurology, San Diego, v. 26, p. 120-125,
1970.
GUYTON, A. C. Fisiologia humana, 10ed., Rio de Janeiro: Guanabara Koogan,
2002.
HAMBLETON, P.L., SLADE, L.M., HAMAR, D.W. et al. Dietary fat and exercise
conditioning effect on metabolic parameters in the horse. Journal of Animal
Science, Champaing, v.51, p.1330-1339, 1980.
HARRIS, P.A.; HARRIS, R.C. Nutritional ergogenic aids in the horse – uses and
abuses. In: CONFERENCE ON EQUINE SPORTS MEDICINE AND SCIENCE,
Córdoba, Espanha. Proceedings…, p.203-218, 1998.
HAYS, A. P.; ARMBRUSTMACHER, V. W. Skeletal muscle. In: RUBIN, E.;
FABER, J. L. Pathology. Philadelphia: Lippincott-Raven, 1999, p. 1414-1440.
HENNEKE, D. R.; POTTER, G. D.; KREIDER, J. L.; YEATES, B. F. Relationship
between condition score, physical measurements and body fat percentage in
mares. Equine Veterinary Journal, London, v. 15, n. 4, p. 371-372, 1983.
HENCKEL, P. Training an growth induced changes in the middle gluteal muscle of
young Standerbred trotters. Equine Veterinary Journal, London, v. 15, n. 2, p.
134-140, 1983.
75
HILDEBRAND, M. Análise da estrutura dos vertebrados. São Paulo: Atheneu,
1995. 700p.
HODGSON, D. R.; ROSE, R. J.
Effects of a nine-month endurance training
programme on muscle composition in the horse. Veterinary Record, London, v.
121, p. 271-274, 1987.
HODGSON, D. R.; ROSE, R. J.; DIMAURO, J.; ALLEN, J. R. Effects of a
submaximal treadmill training programme on histochemical properties, enzyme
activities, and glycogen utilization of skeletal muscle in the horse. Equine
Veterinary Journal, London , v. 17, p. 300-305, 1985.
HODGSON, D. R.; ROSE, R. J.; DIMAURO, J. Effects of a training on muscle
composition in horse. American Journal of Veterinary Research, Chicago, v.
47, p. 12-15, 1986.
HOFFMAN, R.M.; HESS, T.M.; WILLIAMS, C.A.; KRONFELD, D.S.; GRIEWECRANDELL, K.M.; WALDRON, J.E.; GRAHAM-THIERS, P.M.; GAY, .S.; SPLAN,
R.K.; SAKER, K.E.; HARRRIS, P.A. Speed associated with plasma pH, oxygen
content, total protein and urea in an 80 km race. Equine Veterinary Journal,
London, suppl.34, p.39-43, 2002.
HOPPELER, H.; LÜTHI, P.; CLAASEN, H.; WEIBEL, E. R.; HOWALD, H. The
ultrastructure of the normal human skeletal muscle: a morphometric analysis on
untrained men, women, well trained orienteers. European Applied Journal of
Physiology, Heidelberg, v. 344, p. 217-232, 1973.
INGJER, F. Capillary supply and mitochondrial content of different skeletal muscle
fibre types in untrained and endurance-trained men. European Journal of
Applied Physiology, Heidelberg, v. 40, 197-209, 1979.
ISLAS, A.; RIVERO, J. L. L.; QUEZADA, M.; MORA, G.; AEDO, V.; BRIONES, V.;
MARIN, L. Características histoquímicas de las fibras del músculo gluteus medius
en equinos de tiro. Archivos de Medicina Veterinaria, Valdivia, v. 28, n. 1, p. 8391, 1996.
76
JONES, D. L.; POTTTER, G. D.; GREENE, L. W. et al. Muscle glycogen in
exercised miniature horses at various body conditions and fed a control or fat
supplemented diet. Journal Equine Veterinary Science, v. 12, n. 5, p. 287-291,
1992.
KARLSSON, A. H.; KLONT, R. E.; FERNANDEZ, X. Skeletal muscle fibres as
factors for pork quality. Livestock Production Science, Amsterdam, v. 60, p. 255269, 1999.
KLINE, K.H.; LAWRENCE, L.M.; NOVAKOFSKY, J.; BECHTEL, P.J. Changes in
muscle fiber variation within the middle gluteal of young and mature horses as a
function of sampling depth. Equine Exercise Physiology, Davis, v. 2, p. 271-277,
1987.
KLONT, R.E.; BROCKS, L.; EIKELENBOOM, G. Muscle fibre type and meat
quality. Meat Science, Barking, v. 49, n. 1, p. 219 -229, 1998.
LEFAUCHER, L. Myofiber typing and pig meat production. Slovenian Veterinary
Research, Ljubljana, v. 38, n. 1, p. 5-33, 2001.
LEFAUCHEUR, L.; HOFFMAN, R. K.; GERRARD, D. E.; OKAMURA, C. S.;
RUBINSTEIN, N.; KELLY, A. Evidence for three adult fast myosin heavy chain
isoforms in type II skeletal muscle fibers in pigs. Journal of Animal Science,
Champaign, v. 76, n. 6, p. 1584-1593, 1998.
LEFAUCHER, L.; ECOLAN, P.; BARZIC, Y.M.; MARION, J.; LE DIVIDICH, J. Early
postnatal food intake alters myofiber maturation in pig skeletal muscle. The
Journal of Nutrition, Philadelphia, v. 133, n. 1, p. 140-147, 2003.
LENNINGER, A. L. Bioquímica. 2. ed. Barcelona: Omega, 1981.
LEWIS, L. D. Equine clinical nutrition: feeding and care. São Paulo: Roca, 1995.
248p.
LEXELL, J.; HENRIKSSON-LARSEN, K.; WINBLAD, B.; SJOSTROM, M.
Distribution of different fibre types in human skeletal muscles: effects of aging
77
studied in whole muscle cross sections. Journal of the Neurological Sciences,
Amsterdam, v. 6, n. 8, p. 588-595, 1983.
LINDHOLM, A.; PIEHL, K. Fibre composition, enzyme activity and concentrations
of metabolites and electrolytes in muscle of Standardbred horses. Acta Veterinary
Scandinavica, Copenhagen, v.15, p. 287-309, 1974.
LINDHOLM, A., SALTIN, B. The physiological and biochemical response of
Standardbred horses to exercise of varing speed and duration. Acta Veterinary
Scandinavica, Copenhagen, v. 15, p. 310-324, 1974.
LINDNER, A.; RIVERO, J. L. L.; LIGHTOWLER, C.; ISLAS LETELIER, A.
Evaluación de la capacidad competitiva y del efecto del entrenamiento en el
caballo de deporte. In: CONFERENCIA INTERNACIONAL DE CABALLOS DE
DEPORTE-CICADE, 2003, Curitiba. 1CD-ROM.
LINDNER, A.; DAG, S.; MARTI-KORFF, S.; QUIROZ-ROTHE, E.; RIVERO, J.L.L.;
DROMMER, W. Effects of repeated biopsying on muscle tissue in horses. Equine
Veterinary Journal, London, v. 34, n. 6, p. 619-624, 2002.
LINDNER, A.; DAG, S.; KISSENBECK, S.; MOSEN, H.; RIVERO, J. L. L.;
DROMMER, W. Efecto de entrenamiento, conducido mediante la concentración de
láctato
sanguíneo,
sobre
ultraestrutura
del
músculo
glúteo
médio.
In:
CONFERENCIA INTERNACIONAL DE CABALLOS DE DEPORTE-CICADE,
2001, Argentina. Abstracts…
LINDNER, A.; MOSEN, H.; GANSEN, S. Effect of conditioning horses with
exercise at v1,5 and v2,5 for 45 minutes and at v4 for 25 minutes on v4. In: EQUINE
NUTRITION AND PHYSIOLOGY SOCIETY SYMPOSIM, 15. Proceedings…1997,
p. 243.
LOVELL, D. K.; ROSE, R. J. Changes in skeletal muscle composition on response
to interval high intensity training. In: PERSSON, S. G. B.; LINDHOLM, A.;
JEFFCOTT, L. B. Equine exercise physiology 3. Davis: ICEEP Publications,
1991, p. 215-222.
78
LUTZ, G. J.; BREMNER, S.; LAVEVARDI, N. B.; LIEBER, R. L.; ROME, L. C.
Quantitative analysis of muscle fibre type and myosin heavy chain distribution in
the frog hindlimb: implications for locomotory design. Journal of Muscle
Research and Cell Motility, Dordrecht, v.19, p. 717-731, 1998.
MARTINS, C. B.; SILVA, M. A. G.; D’ANGELIS, F. H. F.; GOMIDE, L. M. W.;
OROZCO, C. A. G.; CHRISTOVÃO, F. G.; QUEIROZ NETO, A.; LACERDA NETO,
J. C. Efeito do condicionamento no músculo glúteo médio de eqüinos Puro Sangue
Árabes. In: CONFERÊNCIA ANUAL DA ABRAVEQ 7., 2006, São Paulo. 1 CDROM.
MAYORAL, A.; DORADO, M.; GUILLÉN, M. T.; ROBINA, A. Development of meta
and carcass quality characterisitics in Iberian pigs reared outdoors. Meat Science,
Barking, v. 52, 1999.
McKOY, G.; LEGER, M. E.; BACOU, F.; GOLDSPINK, G. Differential expression of
myosin heavy chain mRNA and protein isoforms in four functionally diverse rabbit
skeletal muscles during pre and posnatal development. Developmental
Dynamics, New York, v. 211, n. 3, p. 193-203, 1998.
MOON, T. W.; FOSTER, G. D.; PLISETSKAYA, E. M. Changes in peptide
hormones and liver enzymes in the rainbow trout deprived of food 6 weeks.
Canadian Journal of Zoology, Ottawa, v. 67, p. 2189-2193, 1989.
MUÑOZ, A.; SANTISTEBAN, R.; RUBIO, M. D.; AGÜERA, E. I.; ESCRIBANO, B.
M.; CASTEJÓN, F. M. Locomotor, cardiocirculatory and metabolic adaptations to
training in Andalusian and Anglo-Arabian horses. Research in Veterinary
Science, London, v. 66, n. 1,p.25-31, 1999.
MYERS, J.; ASHLEY, E. Dangerous curves: a perspective on exercise, lactate,
and the anaerobic threshold. Chest, Chicago, v.111, n.3, p.787-95, 1997.
NATIONAL
RESEARCH
Washington, 1989. 10p.
COUNCIL.
Nutrients
requirements
of
horses.
79
NIMMO, M. A.; SNOW, D. H. Time course of ultrastrutural changes in skeletal
muscle after two types of exercise. Journal Applied Physiology, Bethesda, v. 52,
p. 910-915, 1982.
OLGIVIE, R. W.; FEEBACK, D. L. A metachromatic dye-ATPase method for the
simultaneous identification of skeletal muscle fiber types I, IIA, IIB, IIC. Stain
Technology, Baltimore, v.65, p.231-241, 1990.
PERROY,
L.
História
do
cavalo
Árabe
no
mundo.
Disponível
em:
<www.abcca.com.br >. Acesso em: 25 ago. 2006.
PERRY, S. V. Properties of muscle proteins - a comparative approach. Journal
Experimental Biology, v. 115, p. 31-42, 1985.
PETER, J. B.; BARNAD, R. J.; EDGERTON, V. R.; GILLESPIE, C. A.; STEMPEL,
K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and
rabbits. Biochemistry, New York, v. 11, p. 2627-2633, 1972.
PETTE, D.; STARON, R. S. Mammalian skeletal muscle fiber type transitions.
International Review of Cytology, New York, v. 170, p. 143-223, 1997.
PEUKER, H.; PETTE, D. Mammalian skeletal muscle fiber type transitions.
International Review of Cytology, New York, v. 170, p. 143-223, 1997.
PICARD, B.; JURIE, C.; CASSAR MALEK, I.; HOCQUETTE, J. F.; LEFAUCHER,
L.; BERRI, C.; DUCLOS, M. J.; ALAMI-DURANTE, H.; RESCAN, P. Y. Typologie
et ontogenèse des fibres musculaires chez le différentes espéces d’intérêt
agronomique. Institute National de la Recherche Agronomique: Productions
Animales, Paris, v. 16, n. 2, p. 117-123, 2003.
PICARD, B.; LEFAUCHER, L.; BERRI, C.; DUCLOS, M. Muscle fibre ontogenesis
in farm animal species. Reproduction and Nutrition Developpmental, Paris, v.
42, p. 415-431, 2002.
80
PICARD, B.; GAGNIERE, H.; ROBELIN, J.; PONS, F.; GEAY, Y. Presence of an
Unidentified Myosin Isoform in certain Bovine Foetal Muscles. Meat Science,
Barking, v. 41, n. 3, p. 315-324, 1995.
POWERS, S. K., HOWLEY, E. T. Fisiologia do exercício: teoria e aplicação ao
condicionamento e ao desempenho. 3. ed. São Paulo: Manole, 2000. 527 p.
PRINCE, A.; GEOR, R.; HARRIS, P.; HOEKSTRA, S.; GARDNER, S.; HUDSON,
C.; PAGAN, J. Comparison of the metabolic responses of trained Arabians and
Thoroughbreds during high and low intensity exercise. Equine Veterinary
Journal, London, Suppl. 34, p. 95-99, 2002.
QUIROZ-ROTHE, E.; RIVERO, J. L. Co-ordinated expression of contractile and
non-contractile features of control equine muscle fibre types characterized by
immunostaining of myosin heavy chains. Histochemistry and Cell Biology,
Heildelberg, v. 116, p. 299-312, 2001.
RIVERO, J. L. L.; PIERCY, R. J. Muscle physiology: responses to exercise and
training. In: HINCHCLIFF, K. W.; KANEPS, A. J.; GEOR, J. Equine sports
medicine and surgery: basic and clinical sciences of the equine athlete.
Edinburgh: Saunders Elsevier, 2004, p. 45-76.
RIVERO, J. L. L.; SPORLEDER, H. P.; QUIROZ-ROTHE, E.; VERVUERT, I.;
COENEN, M.; HARMEYER, J. Oral L-carnitine combined with training promotes
changes in skeletal muscle. Equine Veterinary Journal, London, Suppl. 34, p.
269-274, 2002.
RIVERO, J. L. L.; SERRANO, A. L.; BARREY, E.; VALETTE, J. P.; JOUGLIN, M.
Analysis of myosin heavy chains at the protein level in horse skeletal muscle.
Journal of Muscle Research Cell Motility, Dordrecht, v.20, p. 2121-2122, 1999.
RIVERO, J. L. L. Muscle variables. In: LINDNER, A. Performance diagnosis of
horse. Wageningen: Wageningen Pers, 1997, p. 44-71.
81
RIVERO, J. L. L. Muscle biopsy index for discriminating between endurance
horses with different performance records. Research in Veterinary Science,
London, v. 61, p. 49-54, 1996.
RIVERO, J. L. L.; CLAYTON, H. The potential role of the muscle in kinematic
characteristics. Pferdeheilkunde, v. 12, p. 635-640, 1996.
RIVERO, J. L. L.; TALMADGE, R. J.; EDGERTON, V. R. Myosin heavy chaim
isoforms
in
adult
equine
skeletal
muscle:
An
imunohistochimical
and
electrophoretic study. The Anatomical Record, New York, v. 246, p. 185-194,
1996.
RIVERO, J. L. L.; SERRANO, A. L.; HENCKEL, P. Activities of selected aerobic
and anaerobic enzymes in the gluteus medius of endurance horses with different
performance records. Veterinary Research, Les Ulis, v. 137, p. 187-192, 1995a.
RIVERO, J. L. L.; RUZ, M.C.; SERRANO, A. L.; DIZ, A. M. Effects of the 3 month
endurance training programme on skeletal muscle histochemistry in andalusian,
Arabian and Anglo-Arabian horses. Equine Veterinary Journal, London, v.27, p.
51-59, 1995b.
RIVERO, J. L. L.; SERRANO, A. L.; DIZ, A. M.; MORALES, J. L. Changes in crosssectional area and capillary supply of the muscle fiber population in equine gluteus
medius muscle as a function of sampling depth. American Journal of Veterinary
Research, Chicago, v. 54, p. 32-37, 1993a.
RIVERO, J. L. L.; DIZ, A. M.; MONTEVERDE, J. G.; AGÜERA, E. Intramuscular
distribuition of fibre types in the gluteus medius of the horse: A histochemical
analyses. Anatomy Histology and Embriology, v. 22, p. 223-240, 1993b.
RIVERO, J. L. L.; SERRANO, A. L.; HENCKEL, P. AGÜERA, E. Muscle fiber type
composition and fiber size in successfully and unsuccessfully endurance-raced
horses. Journal Applied Physiology, Bethesda, v. 162, p. 1758-1766, 1993c.
82
RIVERO, J. L. L.; LOPEZ, M. J. L.; GALISTEO, A. M.; AGUERA, E. M. Muscle
fibre type composition in untrained and endurance-trained Andalusian and Arabian
horses. Equine Veterinary Journal, London, v. 23, p. 91-93, 1991.
RIVERO, J. L. L.; AGÜERA, E.; MONTEVERDE, J. G.; BARBUDO, M. R.; MIRO,
F. Comparative study of muscle fiber type composition in the middle gluteal muscle
of Andalusian, Thoroughbred and Arabian horses. Journal of Equine Veterinary
Science, Wildomar, v. 9, p.377-340, 1989.
RYAN, J.M.; COBB, M.A.; HERMANSON, J.W. Elbow extensor muscles of the
horse: postural and dynamic implications. Acta Anat., v. 144, p.71-79, 1992.
RONÉUS, N.; ESSÉN-GUSTAVSSON, B.; LINDHOLM, A. Plasma lactate
response to submaximal and maximal exercise tests with training, and its
relationship to performance and muscle characteristics in standardbred trotters.
Equine Veterinary Journal, London, v. 26, p. 117-121, 1994.
RONEUS, M.; ESSEN-GUSTAVSSON, B.; LINDHOLM, A.; PERSSON, S. A field
study circulatory response and muscle characteristics in young Thoroughbreds. In:
GILLESPIE, J. R.; ROBINSON, N. E. Equine exercise physiology 2. Davis:
ICEEP Pubications, Davis, 1987, p. 376-383.
ROSE, R. J. Endurance exercise in the horse- a review. Part I. British Veterinary
Journal, London, v. 142, n. 6, p. 532-541, 1986.
SALTIN, B.; GOLLNICK, P. D. Skeletal muscle adaptability: significance for
metabolism and performance. Handbook of Physiology, Skeletal Muscle.
American Physiological Society, Bethesda, p. 555- 631, 1983.
SAMPAIO, I. B. M. Estatística aplicada à experimentação animal. Belo
Horizonte: Fundação de Ensino e Pesquisa em Medicina Veterinária e Zoootecnia,
1998. 221 p.
SANTOS, V. P. Avaliação metabólica do eqüino atleta. 2002. Disponível em:
<http://www.ufrgs.br/bioquímica/posgrad>. Acesso em: 22 maio 2005.
83
SAS INSTITUTE. SAS User’s guide: Statistics. Cary, 2002.
SCHIAFFINO, S.; REGGIANI, C. Molecular diversity of myofibrilar proteins: gene
regulation and functional significance. Physiological Reviews, Baltimore, v. 76, n.
2, p. 371-423, 1996.
SCHUBACK, K.; ESSÉN-GUSTAVSSON, B. Muscle anaerobic response to a
maximal treadmill exercise test in Standardbred trotters. Equine Veterinary
Journal, London, v. 30, p.504-510, 1998.
SELLERS, J. R. Myosins: a diverse superfamily. Review. Biochimica et
Biophysica Acta. v. 1496: p. 3-22, 2000.
SERRANO, A. L.; RIVERO, J. L. L. Myosin Heavy Chain profile of equine Gluteus
medius following prolonged draught exercise training and detraining. Journal of
Muscle Research and Cell Motility, Dordrecht, v. 21, p. 235-245, 2000.
SERRANO, A. L.; QUIROZ-ROTHE, E.; RIVERO, J. L. L. Early long-term changes
of equine skeletal muscle in response to endurance training and detraining.
European Journal Physiology, v. 441, p. 263-274, 2000.
SIECK, G. G.; ZHAN, W. Z.; PRAKASH, Y. S.; DAOOD, M. J.; WATCHKO, J. F.
SDH and actomyosin ATPase activities of different fiber types in rat diaphragm
muscle. Journal of Applied Physiology, Bethesda, v. 79, n. 5, p. 1629-1639,
1995.
SISSON, S. Músculos dos eqüinos. In: GETTY, R. Sisson/Grossman anatomia
dos animais domésticos. 5. ed. Rio de Janeiro: Guanabara Koogan, v. 1, 1986,
p. 402-407.
SLOET
VAN
OLDRUITENBORGH-OOSTERBAAN,
M.M.;
WENSING,
T.;
BARNEVELD, A.; BREUKINK, H.J. Heart rate, blood biochemistry and
performance of horses compeing in a 100 km endurance ride. Veterinary Record,
London, v.23, p.175-179, 1991.
84
SNOW, D. H.; VALBERG, S. J. Muscle anatomy, physiology, and adaptations to
exercise. In: ROSE, R. J.; HODGSON, D. R. The athletic horse: principles and
practice of equine sports medicine. Philadelphia: W. B. Saunders Company, 1994,
p. 49-62.
SNOW, D. H.; KERR, M. G.; NIMNO, M. A.; ABOTT, E. A. Alterations in blood,
sweat, urine and muscle composition during prolonged exercise in the horse.
Veterinary Record, London, v. 110, p. 377-384, 1982.
SNOW, D. H.; BILLETER, R.; JENNY, E. Myosin types in equine skeletal muscle.
Research in Veterinary Science, London, v. 30, p. 381-382, 1981.
SNOW, D. H.; GUY, P. S. Muscle fibre type composition of a number of limb
muscle in different types of horse. Research in Veterinary Science, London, v.
28, p. 173-144, 1980.
SNOW, D. H.; GUY, P.S. Percutaneous needle muscle biopsy in the horse.
Equine Veterinary Journal, London, v. 8, p. 150-155, 1976.
SPURWAY, N. C. Aerobic exercise, anaerobic exercise and the lactate threshold.
British Medical Bulletin, Edinburgh, v. 48, p. 569-591, 1992.
STARON, R. S.; KRAEMER, W. J.; HIKIDA, R. S.; FRY, A. C.; MURRIA, J. D.;
CAMPOS, G. E. Fiber type composition of four hindlimb muscles of adult fisher 344
rats. Histochemistry and Cell biology, Berlin, v. 111, n. 2, p. 117-123, 1999.
STEGMANN, H.; KINDERMANN, W.; SCHNABEL, A. Lactate kinetics and
individual anaerobic threshold. International Journal of Sports Medicine,
Stuttgart, v. 2, n. 3, p.160-165, 1981.
STRBENC, M.; SMERDU, V.; ZUPANC, M.; TOZON, N.; FAZARINC, G. Pattern of
myosin heavy chain isoforms in different fibre types of canine trunk and limb
skeletal muscles. Cells Tissues Organs, Basel, v. 176, p. 4, 2004.
SUCRE, L. E.; HERNÁNDEZ, N.; HECKER TORRES, S. Efecto del entrenamento
sobres las actividades enzimáticas y composición fibrilar en el músculo gluteus
85
medius de Caballos Pura Sangre Venezolanos. Revista Científica, Trujillo, v. 9, n.
6, p. 489-501, 1999.
SULLIVAN, T.E.; ARMSTRONG, R.B. Rat locomotory muscle fibre activity during
trotting and galloping. Journal of Applied Physiology, Bethesda, v. 75, p. 358363, 1978.
SWASH, M.; SCHWARTZ, M. Neuromuscular a practical approach to diagnosis
and management. In: SWASH, M. Neuromuscular diseases. Berlin: Springer
Verlag, 1981.
TALMADGE, R. J. Myosin heavy chain isoform expression following reduced
neuromuscular activity: Potencial regulatory mechanisms. Muscle Nerve, v. 23, p.
661-679, 2000.
TAYLOR, F. G. R.; HILLYER, M. H. Diagnostic techniques in equine medicine.
London: WB Saunders, 1997. 348p.
TEGTBUR, U.; BUSSE, M. W.; BRAUMANN, E. Estimation of an individual
equilibrium between lactate production and Catabolism during exercise. Medicine
and Science in Sports Exercise, Hagerstown, v. 25, p. 620-627, 1993.
TRILK, J. L.; LINDNER, A. J.; GREENE, H. M.; ALBERGHINA, D.; WICKLER, S. J.
A lactate-guided conditioning programme to improve endurance performance.
Equine Veterinary Journal, London, v. 34, p. 122-125, 2002.
TYLER, C. M.; GOLLAND, L. C.; EVANS, D. L.; HODGSON, D. R.; ROSE, R. J.
Skeletal muscle adaptations to prolonged training, overtraining and detraining in
horse. European Applied Journal of Physiology, Heidelberg, v. 436, p. 391-397,
1998.
UHRIN, P.; LIPTAJ, T. Effect of training on fiber composition and phosphate
metabolites in rest measured in vitro in muscles of young pigs. Comparative
Biochemistry Physiology B, New York, v. 102, n. 2, p. 397-401, 1992.
86
VALBERG, S. Glycogen depletion patterns in the muscle of Standardbred trotters
after exercise of varing intensities and duration. Equine Veterinary Journal,
London, v. 18, p. 479-484, 1986.
VALETTE, J. P.; BARREY, E.; JOUGLIN, M.; COUROUCE, A.; AUVINET, B.;
FLAUX, B. Standardisation of muscular biopsy of gluteus medius in French trotters.
Equine Veterinary Journal, London, v. 30, p. 342-344, 1999.
WASSERMAN, K.; HANSEN, J. E.; SUE, S. Y.; WHIPP, B. J. Principles of
exercise testing & interpretation: including pathophysiology and clinical
applications. 3. ed. Philadelphia: Lippincott Williams & Wilkins, 1999.
WHITE, M. G.; SNOW, D. H. Quantitative histochimical study of glycogen depletion
in the maximally exercised Thoroughbred. Equine Veterinary Journal, London, v.
19, p. 67, 1987.
*Referências citadas segundo as normas da Associação Brasileira de Normas
Técnicas - ABNT - NBR 6023, agosto de 2002.
IX. APÊNDICE
II
Tabela 15. Composição percentual e química e energética dos concentrados
experimentais.
Ingredientes (%)
0%
6%
12%
18%
24%
Fubá de milho
84,45
73,50
59,85
47,70
38,25
Farelo de soja
13,20
17,75
25,00
30,75
34,00
0,00
6,00
12,00
18,00
24,00
Calcário
0,95
1,00
1,05
1,00
1,00
Fosfato
0,20
0,30
0,40
0,65
0,65
Sal comum
0,80
1,00
1,20
1,30
1,40
0,40
0,50
0,60
0,70
0,80
100,00
100,05
100,10
100,10
100,10
3,141
3,380
4,022
4,390
4,500
PB* (%)
12,00
12,90
15,35
16,76
17,20
EE* (%)
2,89
8,57
14,18
19,83
25,55
FB* (%)
2,35
2,46
2,68
2,84
2,89
MM* (%)
4,52
4,84
5,26
5,68
5,70
Ca (%)
0,46
0,52
0,59
0,65
0,66
P (%)
0,34
0,35
0,37
0,42
0,45
Óleo de soja
1
2
Premix
Total
Valores Calculados
ED*
Mcal/kg
1
Óleo de soja refinado ; 2Premix: P-72g, Ca-191g, Na-68,25, Cl-105,00, Mg-27,5, S-14,963g, Zn-1500,00mg,
Cu-250,00mg, Mn-1000,00mg, Fe-1000,00, Co-12,24mg, I-20,00mg, Se-2,25mg, Fl(max)-0,72, Vit A
1600000UI,Vit D3 200000UI, Vit E 3000UI, Vit K3 636mg, Vit B1 1200mg, Vit B2 1600mg, Vit B12 3300mg,
Ác. Pantotênico 3300mg, Biotina 20mg, Ác. Nicotínico-6000mg, Ác. Fólico-200mg, Colina 40g, L-lisina 25g,
Antioxidante 200mg.
*Energia digestível (ED), proteína bruta (PB) e extrato etéreo (EE), fibra bruta (FB), matéria mineral (MM).
Como não foi possível a formulação de concentrados isoenergéticos e
isoproteicos, devido a grande adição de óleo nos grupos 18 e 24%, o ajuste foi
realizado através da quantidade de concentrado fornecido para que o consumo de
nutrientes e energia fosse o mesmo.
III
Tabela 16. Escala de avaliação do escore corporal.
Condição
Pontuação
Descrição
Pobre
1
Animal extremamente emaciado; saliências ósseas
aparecendo, especialmente vértebras cervicais e
lombares.
Muito magro
2
Animal emaciado; saliências ósseas ainda visíveis
na paleta e pelve; vértebras cervicais discretamente
visíveis.
Magro
3
Pescoço magro; junção acentuada do pescoço,
cernelha e paleta; estrutura pélvica ainda
acentuada.
Moderadamente magro
4
A espinha ainda aparece, mas as vértebras não são
individualizadas; linha da costela ainda visível.
Moderado
5
Lombo relativamente achatado; costelas
visíveis, porém facilmente palpáveis.
6
Pescoço, paleta e cernelha com formas
arredondadas; área do lombo pode ter leve
depressão ao longo da espinha; base da cauda e
costelas com consistência macia.
Moderadamente gordo
7
Gordura depositada ao longo da cernelha e
pescoço; base da cauda macia; costelas cobertas
por gordura; dobras sobre a espinha podem ser
visíveis.
Gordo
8
Pescoço engrossado; acúmulo de gordura nas
nádegas; dobras evidentes ao longo da espinha;
difícil palpação das costelas.
Extremamente gordo
9
Pescoço, cernelha e paleta inchadas de gordura;
dobras proeminentes nas costas; bolsas de gordura
sobre as costelas.
Levemente gordo
Fonte: HENNEKE et al. (1983).
não