Formulário de Agendamento: FlowSight (Amnis)
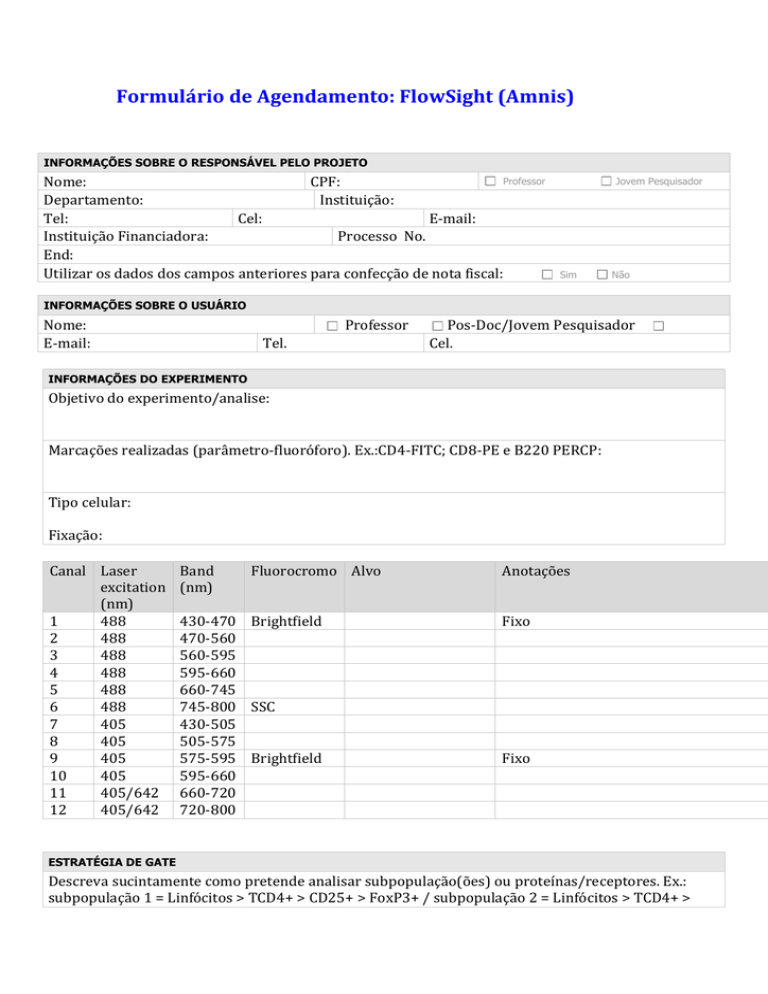
INFORMAÇÕES SOBRE O RESPONSÁVEL PELO PROJETO
Professor
Nome:
CPF:
Departamento:
Instituição:
Tel:
Cel:
E-mail:
Instituição Financiadora:
Processo No.
End:
Utilizar os dados dos campos anteriores para confecção de nota fiscal:
Jovem Pesquisador
Sim
Não
INFORMAÇÕES SOBRE O USUÁRIO
Nome:
E-mail:
Professor
Tel.
Doutorando/Mestrando
Pos-Doc/Jovem Pesquisador
Cel.
INFORMAÇÕES DO EXPERIMENTO
Objetivo do experimento/analise:
Marcações realizadas (parâmetro-fluoróforo). Ex.:CD4-FITC; CD8-PE e B220 PERCP:
Tipo celular:
Fixação:
Canal Laser
excitation
(nm)
1
488
2
488
3
488
4
488
5
488
6
488
7
405
8
405
9
405
10
405
11
405/642
12
405/642
Band
(nm)
Fluorocromo Alvo
430-470 Brightfield
470-560
560-595
595-660
660-745
745-800 SSC
430-505
505-575
575-595 Brightfield
595-660
660-720
720-800
Anotações
Fixo
Fixo
ESTRATÉGIA DE GATE
Descreva sucintamente como pretende analisar subpopulação(ões) ou proteínas/receptores. Ex.:
subpopulação 1 = Linfócitos > TCD4+ > CD25+ > FoxP3+ / subpopulação 2 = Linfócitos > TCD4+ >
CD25- / subpopulação 3 = Linfócitos > TCD8+ e subpopulação 4 = Linfócitos > B220
Descrição:
Estou ciente da necessidade de citar o uso do
equipamento nos trabalhos apresentados em congressos e
publicações cientificas e da responsabilidade de comunicar
a responsável pelo equipamento, para que seja
encaminhado o relatório de uso do equipamento a FAPESP.
Data
/
/
____________________________________________
Assinatura do Docente Responsável
INFORMAÇÕES IMPORTANTES
Preparação das amostras a serem submetidas a citometria de fluxo:
1. Escolha do tipo celular: As células ou partícula deve possuir diâmetro menor
que 60 microns;
2. Concentração da amostra e volume final: As amostras devem conter 1 x 106
células em 50 μL (2 x 107 celulas/mL) em PBS/ 2% FBS em microtubos de 1,5 mL
siliconizado (Axygen)
3. Preparo da amostra: As amostras podem ser preparadas conforme protocolos
pré-estabelecidos para citometria de fluxo. Testar a diluição dos anticorpos para
a marcação desejada previamente. Realizar a marcação das células no gelo em
tampão contendo azida (PBS/ 2% FBS/0,01% azida sódica) para reduzir o
“capping” não-especifico dos anticorpos. Usar tubos de polipropileno,
siliconizado, para processar as amostras.
4. Escolha dos Fluorocromos: apenas os excitáveis por laser de 488 nm.
5. Marcação: para teste preparar tubos com células marcadas individualmente com
cada uma fluoróforos e pelo menos dois tubos com células marcadas com todos
os fluoróforos.
6. Agregação celular: Para minimizar os problemas com agregação das células
passar as amostras em filtro de nylon 70 μM ou usar tampão anti-aglomeração
como PBS/1 mM EDTA ou Accumax antes da fixação das amostras.
7. Fixação das células: Se a fixação for necessária, fixar as células com 1%
formaldeído
(ou
1%
paraformaldeido,
concentração
final
em
células
ressuspensas em PBS) no gelo por 20 min, agitação leve.
8. Número de amostras: Podem ser analisados um 30 amostras por período de 3
horas. Não esquecer de incluir os controles experimentais positivo e negativo.
9. Perda da marcação/luminosidade: é importante ter um teste prévio da
sobrevida da marcação.
DIAS DE ANÁLISE: QUINTAS-FEIRAS (agendamentos excepcionais podem ser feitos às quartas feiras através de solicitação (via e-mail) com antecedência.
PARA AGENDAMENTO: ENVIAR FORMULÁRIO PREENCHIDO E ASSINADO PELO RESPONSÁVEL
PARA: [email protected]
Deve ser trazido o material necessário para o manuseio da amostra.
Atenção:
Aguarde o recebimento da confirmação do agendamento.
Assinatura do Docente Responsável
Data












