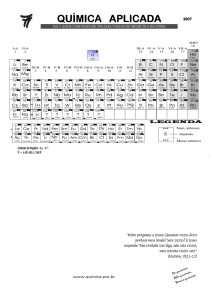
QUÍMICA
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
(com massas atômicas referidas ao isótopo 12 do carbono)
127,8
84
Po
Tm
Md
(209)
HÉLIO
Yb
Lu
No
102
Lr
35,5
Br
79,9
53
52
Te
NEÔNIO
ARGÔNIO
CRIPTÔNIO
FLÚOR
Rn
CLORO
At
BROMO
ENXOFRE
SELÊNIO
XENÔNIO
209,0
Xe
RADÔNIO
Bi
78,9
Kr
LUTÉCIO
Es
FÓSFORO
SILÍCIO
Ho
207,2
83
Se
35
18
LAURÊNCIO
Cf
Pb
121,8
34
Cl
20,2
Ar
IODO
97
82
32,1
17
ASTATO
Bk
204,4
118,7
Sb
S
19,0
10
ITÉRBIO
Dy
Ti
Sn
51
74,9
16
Ne
4,00
NOBÉLIO
Tb
200,6
81
50
As
TELÚRIO
Hg
114,8
72,6
33
ARSÊNIO
80
112,4
Ge
31,0
ANTIMÔNIO
In
Cd
GERMÂNIO
GÁLIO
ALUMÍNIO
49
32
P
16,0
POLÔNIO
197,0
69,7
28,1
15
F
2
He
I
126,9
85
(210)
39,9
36
83,8
54
131,3
86
(222)
111º
110º
Une
Mt
Mt
Au
Ga
Si
14,0
O
TÚLIO
195,1
79
31
14
N
MENDELÉVIO
Pt
107,9
48
27,0
12,0
BISMUTO
78
Ag
65,4
Al
ESTANHO
106,4
47
13
CHUMBO
Pd
63,5
Zn
10,8
C
HÓLMIO
BORO
B
OXIGÊNIO
9
NITROGÊNIO
8
CARBONO
7
ÍNDIO
46
Cu
ZINCO
58,7
COBRE
NÍQUEL
COBALTO
109º
Uno
Hn
Hs
6
TÁLIO
192,2
5
DISPRÓSIO
Ir
17
7A
CALIFÓRNIO
77
Ni
PRATA
102,9
PALÁDIO
Rh
16
6A
CÁDMIO
Uns
Bh
Ns
45
15
5A
MERCÚRIO
190,2
108º
58,9
14
4A
TÉRBIO
Unh
Rf
Sg
Os
RÓDIO
FERRO
107º
76
Co
OURO
186,2
RUTÊNIO
MANGANÊS
TECNÉCIO
CROMO
TITÂNIO
VANÁDIO
Unp
Jl
Ha
Re
101,1
30
PLATINA
183,6
106º
75
Ru
IRÍDIO
W
98,9
44
29
18
0
13
3A
BERQUÉLIO
Uun
-
Uuu
-
Série dos Lantanídios
139
58
Ce
140
59
Pr
141
60
Nd
U
144
61
Pm
Np
(145)
62
Sm
Pu
150
63
Eu
Am
152
64
Gd
Cm
157
65
159
66
163
67
165
68
ÉRBIO
57
La
Er
FÉRMIO
( ) = Nº de massa
isótopo mais estável
74
Tc
55,8
28
GADOLÍNIO
Massa Atômica
180,9
95,9
43
27
CÚRIO
Símbolo
Ta
105º
Unq
Db
Rf
Série dos
Actinídios
73
Mo
54,9
12
2B
EURÓPIO
Nome do Elemento
Número atômico
179
104º
92,9
42
11
1B
AMERÍCIO
(226)
Hf
Nb
52,0
10
SAMÁRIO
Ra
91
72
41
Fe
9
8B
PLUTÔNIO
89-103
Zr
50,9
Mn
ÓSMIO
88
40
Cr
26
PROMÉCIO
137,3
Série dos
Lantanídios
47,9
V
8
NEPTÚNIO
Ba
88,9
57-71
Ti
RÊNIO
56
25
TUNGSTÊNIO MOLIBDÊNIO
87,6
Y
24
NIÓBIO
Sr
45
39
23
NEODÍMIO
(223)
38
22
URÂNIO
Fr
40,1
Sc
7
7B
PRASEODÍMIO
87
Ca
21
6
6B
Fm
167
69
169
70
173
71
175
Série dos Actinídios
89
Ac
(227)
90
Th
232
PROTACTÍNIO
132,9
20
5
5B
TANTÁLIO
Cs
24,3
4
4B
CÉRIO
55
3
3B
TÓRIO
85,5
Mg
ZIRCÔNIO
Rb
12
HÁFNIO
37
9,01
LANTÂNIO
39,1
Be
ACTÍNIO
K
Elementos de transição
ESCÂNDIO
19
4
ÍTRIO
23,0
MAGNÉSIO
Na
CÁLCIO
SÓDIO
POTÁSSIO
RUBÍDIO
CÉSIO
11
ESTRÔNCIO
Li
BÁRIO
3
BERÍLIO
1,008
6,94
FRÂNCIO
2
2A
EINSTÊNIO
1
H
RÁDIO
LÍTIO
HIDROGÊNIO
1
1A
91
Pa
231
92
238
93
(237)
94
(244)
95
(243)
96
(247)
(247)
98
(251)
99
(252)
100
(257)
101
(258)
(259)
103
(260)
Abreviaturas: (s) = sólido; (l) = líquido; (g) = gás; (aq) = aquoso; [A] = concentração de A em mol/L.
37. Considere que representa H, representa C e O representa O. O sistema final, após a reação de
combustão completa de 4,0 g de metano (CH4 ) em uma câmara de combustão hermeticamente fechada
contendo 32,0 g de gás oxigênio (O2 ), é corretamente representado pelo modelo esquematizado em
A)
B)
D)
VESTIBULAR UNIFICADO PUC-SP 2004
C)
E)
17
38. Três balões de borracha idênticos, designados
por A, B e C, foram inflados com gases diferentes,
obtendo-se balões de mesmo volume, com a
mesma pressão interna e sob a mesma
temperatura.
O gás utilizado para encher o balão A foi o hélio
(He), para o balão B foi o argônio (Ar), e para o C
foi o dióxido de carbono (CO2 ).
Com relação aos balões é incorreto afirmar que
A) apenas o balão A ascenderá no ar, enquanto
que os balões B e C ficarão no chão.
B) logo após encher os balões, a quantidade de
moléculas no estado gasoso no balão A será
maior do que a encontrada nos balões B e C.
C) logo após encher os balões, a massa do balão
A será menor do que a de B que será menor do
que a de C.
D) primeiramente ficará murcho o balão A, depois
o B e por último o C.
E) os gases utilizados para encher os balões A e B
são classificados como gases nobres devido à sua
inércia química.
39. Dado:
o
-5
K a do ácido acético (H3CCOOH) a 25 C = 2 x 10 .
o
A 25 C, uma solução aquosa de ácido acético de
pH 4 apresenta, no equilíbrio,
-
-10
-
-4
-
-4
-
-4
-
-2
A) [H3CCOO ] = 1 x 10 mol/L .
-4
[H3CCOOH] = 1 x 10 mol/L .
B) [H3CCOO ] = 1 x 10 mol/L .
[H3CCOOH] = 5 mol/L .
C) [H3CCOO ] = 1 x 10 mol/L .
-4
[H3CCOOH] = 5 x 10 mol/L .
D) [H3CCOO ] = 1 x 10 mol/L .
-4
[H3CCOOH] = 1 x 10 mol/L .
40. Dados:
2+
[Ba ] considerada letal para o ser humano =
-3
= 2 x 10 mol/L de sangue
-5
o
solubilidade do BaSO4 a 25 C = 1,0 x 10 mol/L
-5
o
solubilidade do BaCO3 a 25 C = 9,0 x 10 mol/L
o
solubilidade do BaCl2 a 25 C = elevada
Em um procedimento bastante comum, utiliza-se
uma suspensão aquosa de sulfato de bário
(BaSO4 ) como contraste para exames de raios X
do sistema digestório. Essa suspensão é ingerida
e após algumas horas são feitas chapas de raios
X da região do aparelho digestório a ser
analisada.
No primeiro semestre de 2003 pacientes que
foram submetidos a esse procedimento e
utilizaram um lote de determinado contraste
apresentaram graves sintomas de intoxicação e
cerca de 20 pessoas morreram provavelmente em
conseqüência de envenenamento por íons bário
2+
(Ba ). As investigações indicaram que o lote
encontrava-se contaminado por carbonato de
bário (BaCO3 ).
Considerando as informações pode-se afirmar que
2+
a intoxicação por íons bário (Ba ) ocorreu
devido à
A) dissociação do BaSO4 em água,
2+
disponibilizando alta concentração de Ba livre
em solução.
B) solubilidade do BaCO3 em água ser muito
maior do que a do BaSO4 , disponibilizando alta
2+
concentração de Ba livre em solução.
C) reação entre o ácido clorídrico (HCl) presente
no estômago e o BaSO4 , liberando grande
2+
quantidade de Ba livre em solução.
D) presença do BaCO3 que torna o BaSO4 muito
mais solúvel em água.
E) reação entre o ácido clorídrico (HCl) presente
no estômago e o BaCO3 , disponibilizando grande
2+
quantidade de Ba livre em solução.
E) [H3CCOO ] = 1 x 10 mol/L .
-3
[H3CCOOH] = 2 x 10 mol/L .
18
VESTIBULAR UNIFICADO PUC-SP 2004
41. Considere a reação:
NO2(g) + CO(g)
NO(g) + CO2(g)
H = -226 kJ/mol
o
Ao realizar essa reação a 700 C e com pressões
parciais de NO2 (pNO2 ) e CO (pCO) iguais a
1 atm, determinou-se uma taxa de formação para
o CO2 (v) igual a x.
Sabendo-se que a lei de velocidade para essa
reação é v = k[NO2 ]², foram feitas as seguintes
previsões sobre a taxa de formação de CO2 (v).
experimento
I
II
III
pNO2 (atm)
2
1
1
pCO (atm)
1
2
1
t ( C)
o
C) na etapa I o N2 é reduzido, na etapa II o NH3 é
neutralizado e na etapa III ocorre uma reação de
oxidação.
D) na etapa I o N2 é reduzido, na etapa II o NH3 é
oxidado e na etapa III ocorre uma reação de
neutralização.
E) na etapa I o N2 é oxidado, na etapa II o NH3
sofre combustão e na etapa III ocorre uma reação
de neutralização.
v
700 2x
700 x
900 >x
Estão corretas as previsões feitas para
43. Considere as seguintes reações químicas
envolvendo o etanol:
o
II. H2SO4, 180 C
H3C CH2
H2C CH2 + H2O
OH
A) I, apenas.
B) I e II, apenas.
C) II e III, apenas.
D) I e III, apenas.
E) I, II e III.
II. II
O
O
+ H3C CH2 OH
H3C C
III.III
Pode-se afirmar a respeito dessas etapas que
A) na etapa I o N2 é oxidado, na etapa II o NH3 é
neutralizado e na etapa III ocorre uma reação de
amonização.
+ H2O
CH3
O CH2
OH
O
+
H3C
CH2
OH
K2Cr2O7, H
H3C
C
H
IV. IV
H3C CH2
42. O processo de produção do nitrato de amônio
(NH4NO3), um importante componente de
fertilizantes e de explosivos, pode ser resumido
em três etapas, representadas pelas equações
globais abaixo:
Etapa I: Síntese da amônia
N2 + 3 H2
2 NH3
Etapa II: Obtenção do ácido nítrico
NH3 + 2 O2
HNO3 + H2O
Etapa III: Síntese do nitrato de amônio
NH3 + HNO3
NH4NO3
H3C C
OH + HBr
H3C CH2Br + H2O
É correto classificar as reações I, II, III e IV,
respectivamente, em
A) eliminação, esterificação, oxidação e
substituição.
B) neutralização, esterificação, oxidação e
acidificação.
C) condensação, adição, redução e halogenação.
D) eliminação, neutralização, hidrogenação e
substituição.
E) neutralização, condensação, redução e
halogenação.
B) na etapa I o N2 é reduzido, na etapa II o NH3
sofre combustão e na etapa III o HNO3 é reduzido.
VESTIBULAR UNIFICADO PUC-SP 2004
19
44. Em condições reacionais apropriadas, o
benzeno sofre reação de substituição.
Br
Br
+ Br
Br22
AlCl
AlC3l3
+ HBr
Grupos ligados ao anel benzênico interferem na
sua reatividade. Alguns grupos tornam as
posições orto e para mais reativas para reações
de substituição e são chamados orto e para
dirigentes, enquanto outros grupos tornam a
posição meta mais reativa, sendo chamados de
meta dirigentes.
Grupos orto e para dirigentes: -Cl, -Br, -NH2 , -OH
Grupos meta dirigentes: -NO2 , -COOH, -SO3H
Considerando as informações acima, o principal
produto da reação do 4-nitrofenol com bromo
(Br2) na presença do catalisador AlCl3 é
A)
(A)
(B)
B)
OH
(C)
C)
OH
OH
Br
• Polietileno - Polímero formado por reação de
adição. Principal componente de sacos e sacolas
plásticas. Pode ser reciclado ou usado como
combustível.
• PET - É um poliéster. Material das garrafas
plásticas de refrigerante, está presente em muitas
outras aplicações, como filmes fotográficos.
As fórmulas estruturais desses quatro polímeros
estão, não respectivamente, representadas
abaixo.
I-
I.
II - II.
III - III.
( CH2
O
O
(C
(D)
D)
Br
Br
NO2
Br
(E)
E)
NO2
O
(C
O
(CH2)4
C N
(CH2)6
H
IV - IV.
F
(C
N )n
H
F
C )n
F
A alternativa que relaciona corretamente os
polímeros descritos com as fórmulas estruturais
representadas é
OH
Br
NO2
CH2)n
C O CH2
F
NO2
CH2 )
n
NO2
A)
polietileno
C)
PET
B)
D)
45. Os polímeros fazem, cada vez mais, parte do
nosso cotidiano, estando presentes nos mais
diversos materiais. Dentre os polímeros mais
comuns podem-se citar
I
E)
II
PET
náilon
náilon
polietileno
PET
teflon
teflon
polietileno
PET
teflon
polietileno
III
IV
teflon
PET
náilon
náilon
polietileno
teflon
náilon
• Teflon - Polímero de adição, extremamente
inerte, praticamente insolúvel em todos os
solventes. Usado em revestimento de panelas e
roupas de astronautas.
• Náilon - Forma uma fibra muito resistente à
tração, devido às ligações de hidrogênio que
ocorrem entre suas moléculas. É usado como
fibra têxtil.
20
VESTIBULAR UNIFICADO PUC-SP 2004