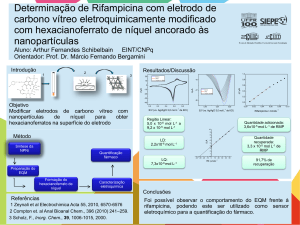
UNIVERSIDADE FEDERAL DO PARANÁ
PROCESSO DE OCUPAÇÃO DE VAGAS REMANESCENTES
NÚCLEO DE CONCURSOS
Edital n° 09/2016 – UOVR/COPAP/NC/PROGRAD / UFPR
Prova Objetiva – 16/10/2016
INSCRIÇÃO
TURMA
NOME DO CANDIDATO
ASSINO DECLARANDO QUE LI E COMPREENDI AS INSTRUÇÕES ABAIXO:
ORDEM
240 – Química – Licenciatura/Licenciatura e Bacharelado
INSTRUÇÕES
1. Confira, acima, o seu número de inscrição, turma e nome. Assine no local indicado.
2. Aguarde autorização para abrir o caderno de prova. Antes de iniciar a resolução das
questões, confira a numeração de todas as páginas.
3. A prova é composta de 20 questões objetivas.
4. Nesta prova, as questões objetivas são de múltipla escolha, com 5 alternativas cada
uma, sempre na sequência a, b, c, d, e, das quais somente uma deve ser assinalada.
5. A interpretação das questões é parte do processo de avaliação, não sendo permitidas
perguntas aos aplicadores de prova.
6. Ao receber o cartão-resposta, examine-o e verifique se o nome impresso nele
corresponde ao seu. Caso haja qualquer irregularidade, comunique-a imediatamente
ao aplicador de prova.
7. O cartão-resposta deverá ser preenchido com caneta esferográfica preta, tendo-se o
cuidado de não ultrapassar o limite do espaço para cada marcação.
8. Não serão permitidos empréstimos, consultas e comunicação entre os candidatos,
tampouco o uso de livros, apontamentos e equipamentos eletrônicos ou não, inclusive
relógio. O não cumprimento dessas exigências implicará a eliminação do candidato.
9. A duração da prova é de 4 horas. Esse tempo inclui a resolução das questões e a
transcrição das respostas para o cartão-resposta.
Conhecimentos
Específicos
10. São vedados o porte e/ou o uso de aparelhos sonoros, fonográficos, de comunicação ou de
registro, eletrônicos ou não, tais como: agendas, relógios com calculadoras, relógios digitais,
telefones celulares, tablets, microcomputadores portáteis ou similares, devendo ser
desligados e colocados OBRIGATORIAMENTE no saco plástico. São vedados também o
porte e /ou uso de armas, óculos ou de quaisquer acessórios de chapelaria, tais como boné,
chapéu, gorro ou protetores auriculares. Caso alguma dessas exigências seja descumprida,
o candidato será excluído do concurso.
11. Ao concluir a prova, permaneça em seu lugar e comunique ao aplicador de prova.
Aguarde autorização para entregar o caderno de prova e o cartão-resposta.
12. Se desejar, anote as respostas no quadro abaixo, recorte na linha indicada e leve-o
consigo.
DURAÇÃO DESTA PROVA: 4 horas
...............................................................................................................................................................................................................................
01 02 03 04 05 -
06 07 08 09 10 -
RESPOSTAS
11 12 13 14 15 -
16 17 18 19 20 -
2
3
01
A celulose é um polímero de cadeia longa composto de um só monômero (glicose), classificado como polissacarídeo
ou carboidrato. É um dos principais constituintes das paredes celulares das plantas (cerca de 33% do peso da planta),
em combinação com a lignina, com hemicelulose e pectina e não é digerível pelo homem. A celulose é um polímero de
cadeia longa de peso molecular variável, com fórmula empírica (C6H10O5)n, com um valor mínimo de n=200 (tipicamente
300 a 700, podendo passar de 7000), constituindo uma fibra dietética. A análise elementar de uma amostra de celulose
forneceu o seguinte resultado:
Carbono
28.871,2 g
Hidrogênio
4.017,6 g
Oxigênio
31.946,4
A partir do exposto é correto afirmar que as percentagens de carbono, de hidrogênio, de oxigênio e o valor de n na
celulose são, respectivamente, iguais a:
Dados: (Massas Molares do O = 16 g; C = 12,0 g e H = 1,0 g)
a)
b)
c)
►d)
e)
36,5 – 5,2 – 40,5 – 500.
40,5 – 5,2 – 39,3 – 450.
42,6 – 5,0 – 36,3 – 425.
44,5 – 6,2 – 49,3 – 400.
39,3 – 6,2 – 44,5 – 450.
**02 - O metanol, CH3OH, usado como combustível pode ser produzido pela reação de monóxido de carbono com
hidrogênio. Suponha que 356 g de CO sejam misturados com 65,0 g e H2, após a reação é correto afirmar que a
quantidade de metanol formada é de:
Dados: (Massas Molares do O = 16 g; C = 12,0 g e H = 1,0 g).
►a)
b)
c)
d)
e)
407,1 g.
507,1 g.
421,1 g.
520,1 g.
417,1 g.
03 - Sobre reações em solução aquosa, considere as seguintes afirmativas:
1.
2.
3.
4.
A mistura de soluções de NaCl e de AgNO3 formará um sal pouco solúvel.
A mistura de soluções de Na2CO3 e de HCl formará um gás.
A mistura de soluções de Ba(NO3)2 e de (NH4)2SO4 formará um gás e um sal pouco solúvel.
A mistura de soluções de CH3COOK e de H2SO4 formará um precipitado com odor de vinagre.
Assinale a alternativa correta.
a)
►b)
c)
d)
e)
Somente a afirmativa 1 é verdadeira.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 3 e 4 são verdadeiras.
As afirmativas 1, 2, 3 e 4 são verdadeiras.
04 - Sobre equilíbrio em solução aquosa, considere as seguintes afirmativas:
Uma solução, cujo pH é igual a 5,0, a concentração de [OH-] equivale a 1,0.10-11 mol L-1.
Uma solução com concentração de H3O+ igual a 10-8 mol L-1 apresenta pOH = 5,0.
Uma solução de pH = 5,0 que for diluída cem vezes a concentração de [OH-] equivale a 1,0.10-7 mol L-1.
Uma solução com pH = 3,0 e outra com [OH-] igual a 1,0.10-11 mol L-1 têm a mesma concentração de íons [H3O +].
1.
2.
3.
4.
Assinale a alternativa correta.
a)
b)
c)
►d)
e)
Somente a afirmativa 3 é verdadeira.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 2, 3 e 4 são verdadeiras.
Somente as afirmativas 3 e 4 são verdadeiras.
As afirmativas 1, 2, 3 e 4 são verdadeiras.
05 - Sobre determinação de fórmula dos compostos químicos, identifique como verdadeiras (V) ou falsas (F) as seguintes
afirmativas:
(
(
(
(
)
)
)
)
A massa de nitrogênio em 454 g de NH3 equivale a 373,9 g.
A percentagem de hidrogênio em uma molécula de amônia equivale a 27,6%.
A percentagem de nitrogênio em uma molécula de amônia equivale a 82,3%.
A massa de hidrogênio em duas moléculas de NH3 equivale a 3 g.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
a) V – V – V – V.
b) V – F – F – V.
►c) V – F – V – F.
d) F – V – F – V.
e) F – V – V – F.
** Questão com resposta alterada.
4
**06 - Observando o diagrama ao lado que representa a reação direta (1)
e reação inversa (2), X ↔ Y, identifique como verdadeiras (V) ou falsas
(F) as seguintes afirmativas:
( ) A energia de ativação da reação inversa é o dobro da energia de
ativação da reação direta.
( ) A reação direta é endotérmica.
( ) A reação direta é mais rápida que a inversa, por ter menor
energia de ativação.
( ) A variação da entalpia da reação inversa é igual a zero.
Assinale a alternativa que apresenta a sequência correta, de cima para
baixo.
a)
b)
►c)
d)
e)
V – V – V – F.
V – V – F – V.
V – F – V – F.
F – V – V – V.
V – F – V – V.
Caminho da reação
07 - A partir dos conceitos sobre energia, numere a coluna da direita de acordo com sua correspondência com a coluna da
esquerda.
1.
Energia dos átomos, das moléculas ou dos íons em movimento no nível
submicroscópico.
Energia que resulta das atrações entre os núcleos atômicos nas moléculas.
Energia entre íons positivos e negativos afastados por uma pequena distância.
Energia associada ao movimento dos átomos, íons e moléculas.
2.
3.
4.
(
(
(
(
)
)
)
)
Eletrostática.
Térmica.
Cinética.
Potencial química.
Assinale a alternativa que apresenta a numeração correta na coluna da direita, de cima para baixo.
a)
►b)
c)
d)
e)
1 – 4 – 3 – 2.
3 – 1 – 4 – 2.
3 – 4 – 2 – 1.
2 – 4 – 1 – 3.
2 – 1 – 4 – 3.
08 - Sobre energia envolvida nas reações químicas, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
(
(
(
(
)
)
)
)
A energia interna de um sistema químico é a soma das energias potencial e cinética dos átomos.
Valores negativos de ΔE e ΔH significam que a energia é transferida da vizinhança para o sistema.
O valor da energia interna é extremamente difícil de ser determinado.
A variação da entalpia não depende das quantidades molares dos reagentes e de produtos.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
a)
►b)
c)
d)
e)
V – V – V – V.
V – F – V – F.
V – F – F – F.
F – V – F – V.
F – V – V – F.
09 - Suponha que a água e o café tenham a mesma densidade (1,00 g mL -1) e a mesma capacidade calorífica específica
(4,184 J g-1 K-1). A quantidade de calor que deve ser adicionada para elevar a temperatura de um copo de café (250 mL)
de 20,5º a 95,6º C equivale a:
►a)
b)
c)
d)
e)
79 KJ.
89 KJ.
99 KJ.
109 KJ.
119 KJ.
10 - A diferença de solubilidade de sais é largamente empregada na separação de amostras contendo diferentes cátions
ou ânions. Considere a seguinte situação: em uma amostra contendo os íons cloreto, brometo e iodeto, cada um em
concentração igual a 0,005 mol L-1, é adicionada lentamente solução de AgNO3. Sabendo-se que os valores das
constantes dos produtos de solubilidade do cloreto de prata, do brometo de prata e do iodeto de prata são:
Kps AgCl = 1,0.10-10; Kps AgBr = 5,2.10-13; Kps AgI = 8,3.10-17, é correto afirmar:
(Dados: Massa molar do AgCl = 143,3 g mol-1, massa molar do AgBr = 187,8 g mol-1 e Massa molar do AgI = 234,8 g mol-1).
a)
b)
c)
►d)
e)
O sal que precipita primeiro independente da concentração de íons prata é o brometo de prata.
A concentração de íons Ag+ necessária para iniciar a precipitação do AgCl tem que ser maior que 5,0.10 -11 mol L-1.
A solubilidade em mol L-1 do AgI é maior que a solubilidade em mol L-1 do AgCl.
A solubilidade em g L-1 do AgCl é igual a 0,00143.
A concentração de íons Ag+ necessária para iniciar a precipitação do AgI é igual a 4,55.10-13 mol L-1.
** Questão com resposta alterada.
5
11 - Em solução aquosa, íons cromato (CrO42-), de cor amarela, coexistem em equilíbrio com íons dicromato (Cr2O72-), de
cor alaranjada, segundo a reação:
2 CrO42- (aq) +2 H+ (aq) ↔ Cr2O7 2- (aq) + H2O
É correto afirmar que a coloração alaranjada torna-se mais intensa quando:
a)
►b)
c)
d)
e)
adiciona-se OH-.
diminui-se o pH.
aumenta-se a pressão.
adiciona-se mais água.
adiciona-se um catalisador.
12 - Com o passar do tempo, objetos de prata geralmente adquirem manchas escuras que são películas de sulfeto de prata
(Ag2S) formadas na reação da prata com compostos que contém enxofre encontrados em vários alimentos. Um dos
processos para limpar o objeto escurecido consiste em colocá-lo em um recipiente de alumínio contendo água e
detergente e aquecer até a fervura. O detergente retira a gordura do objeto facilitando a reação do alumínio da panela
com o sulfeto de prata, regenerando a prata com seu brilho característico, de acordo com a reação:
2 Al + 3 Ag2S → Al2S3+ 6 Ag
Em função do exposto, é correto afirmar:
►a)
b)
c)
d)
e)
A prata ao adquirir manchas escuras sofre oxidação.
Na reação entre alumínio e o sulfeto de prata, o alumínio é o agente oxidante.
O alumínio é menos reativo do que a prata.
A prata possui maior potencial de oxidação do que o alumínio.
A presença do detergente na água diminui o potencial de oxidação do alumínio.
13 - Considere a seguinte tabela:
Substância
CH4 (g)
Cl2 (g)
CCl4 (g)
HCl (g)
Entalpia de Formação
- 17,9 kcal mol-1
zero
- 33,3 kcal mol-1
- 22,2 kcal mol-1
A cloração total do metano produz tetracloreto de carbono. Conhecendo as entalpias de formação dos reagentes e
produtos na tabela acima, o valor do H para essa reação é.
a)
b)
c)
d)
►e)
- 103,4 kcal mol-1.
+ 103,4 kcal mol-1.
- 100,5 kcal mol-1.
+ 104,2 kcal mol-1.
- 104,2 kcal mol-1.
14 - Uma reação química genérica é representada pela equação: 2A(g) + 2B(g) → C(g), onde "A" "B" e "C" significam as
espécies químicas que são colocadas para reagir. Verificou-se experimentalmente numa certa temperatura, que a
velocidade dessa reação quadruplica com a duplicação da concentração da espécie "A", mas não depende das
concentrações das espécies "B" e "C". É correto afirmar que a expressão da velocidade e o valor da ordem da reação
são, respectivamente, iguais a:
a)
b)
c)
d)
►e)
**15 -
v = k [A]2 [B] 2 e 4.
v = k [A] 2 [B] 2 e 3.
v = k [A] 2 [B] 2 e 2.
v = k [A] 2 e 4.
v = k [A] 2 e 2.
Ao lado segue um rótulo de uma lata de leite em pó:
A porcentagem em massa indica a quantidade de gramas de
cada componente em 100 g de leite em pó. A partir das
informações contidas no rótulo, é correto afirmar que a
concentração em g L-1 de proteínas em um copo de 200 mL de
leite preparado equivale a:
a)
b)
c)
d)
►e)
25 g L-1.
30 g L-1.
35 g L-1.
40 g L-1.
45 g L-1.
** Questão com resposta alterada.
Modo de Preparar:
Coloque o leite integral instantâneo sobre água
quente ou fria, previamente fervida. Mexa
ligeiramente e complete com água até a medida
desejada
Para um copo (200 mL) – 2 colheres de sopa bem
cheias (30 g)
Composição média do produto em pó (% m/m)
Gordura - 26%
Sais minerais - 6%
Proteína - 30%
Água - 3%
Lactose - 35%
Lecitina - 0,2% no pó
6
16 - Uma solução de um monoácido fraco, cuja constante de ionização Ka = 2×10-5, deve ser misturada a uma outra solução
de um sal desse monoácido para preparar uma solução tampão de pH = 6. É correto afirmar que a razão entre as
concentrações do ácido e do sal é igual a:
a)
►b)
c)
d)
e)
1/10.
1/20.
1/6.
1/5.
1/3.
17 - Numa solução aquosa 0,100 mol L-1 de um ácido monocarboxílico, a 25 °C, o ácido está 3,7% dissociado após o
equilíbrio ter sido atingido. É correto afirmar que o valor da constante de dissociação desse ácido nessa temperatura
é igual a:
a)
b)
►c)
d)
e)
1,4. 10-2.
1,4.10-3.
1,4.10-4.
3,7.10-2.
3,7.10-4.
18 - As ligações químicas nos compostos orgânicos podem ser do tipo ou . A ligação é
formada pela interação de dois orbitais atômicos, segundo o eixo que une os dois átomos,
ao passo que na ligação , a interação dos orbitais atômicos se faz segundo o plano que
contém o eixo da ligação. Em relação à estrutura representada ao lado, é correto afirmar
que a ela contém:
a)
b)
c)
d)
►e)
2 ligações e 6 ligações .
2 ligações e 8 ligações .
4 ligações e 4 ligações .
6 ligações e 2 ligações .
8 ligações e 2 ligações .
19 - Considere o sistema eletrolítico composto por uma solução aquosa de Cu(NO3)2 (0,10 mol L–1) e por dois eletrodos que
não sofrem modificações ao longo da eletrólise. Suponha que uma corrente i passa por esse sistema em um intervalo
de tempo igual a Δt, provocando a eletrodeposição de x mols de cobre metálico em um dos eletrodos. Considere ainda
que esse sistema obedece à lei de Faraday (Q = n . Z . F) e que Q = i . Δt, onde:
Q = carga elétrica total utilizada na eletrólise;
n = quantidade de matéria do produto (expressa em mol) que é gerado na eletrólise;
Z = número de elétrons transferidos por mol de produto obtido na eletrólise;
F = constante de Faraday.
Com base nas informações acima e supondo-se que a lei de Faraday seja obedecida em sistemas análogos, é correto
afirmar:
Se o intervalo de tempo Δt fosse dobrado e a corrente i fosse diminuída pela metade, a quantidade de cobre depositada
cairia pela metade.
►b) Se a solução aquosa de Cu(NO3)2 fosse substituída por uma solução aquosa de AgNO3, de igual concentração, mantendose a corrente i e o intervalo de tempo Δt inalterados, haveria a deposição de 2x mol de prata metálica.
c) Se a corrente i e o intervalo de tempo Δt fossem dobrados, a massa de cobre eletrodepositado também seria aumentada
em duas vezes.
d) O processo de eletrólise ocorre espontaneamente.
e) O cobre metálico seria depositado sobre o cátodo, onde ocorre um processo de oxidação.
a)
20 - Em relação ao composto 2,4-dimetil-3-hexanol, considere as seguintes afirmativas:
1.
2.
3.
4.
Apresenta 4 carbonos primários.
Sua fórmula molecular é C8H18O.
Apresenta 2 carbonos terciários.
Apresenta um carbono assimétrico.
Assinale a alternativa correta.
a)
b)
►c)
d)
e)
Somente a afirmativa 2 é verdadeira.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 3 e 4 são verdadeiras.
As afirmativas 1, 2, 3 e 4 são verdadeiras.