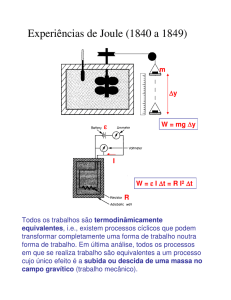
2.5 Primeiro Princípio da Termodinâmica
Vamos considerar o caso especial do princípio da conservação de energia, no qual a
única variação na energia de um sistema é a variação na sua energia interna U, e os
únicos mecanismos de transferência de energia são o calor Q e o trabalho W. Isso leva a
uma equação chamada de primeiro princípio da termodinâmica, que pode se utilizada
para analisar muitos problemas termodinâmicos. Essa equação da conservação de
energia pode ser escrita como
∆U = Q − W
(2.8)
Q é a energia transferida para o sistema (para o gás) e W é o trabalho realizado pelo
sistema (pelo gás). Significa que a variação da energia interna de um sistema é igual à
soma da energia transferida através da fronteira do sistema pelo calor e a energia
transferida pelo trabalho.
Figura 2.11. O primeiro princípio da termodinâmica iguala a variação da energia
interna num sistema à transferência de energia resultante para o sistema pelo calor Q e
trabalho W.
A Figura 2.11 mostra a transferência de energia e a variação da energia interna para um
gás num cilindro, consistente com o primeiro princípio. Alguns problemas podem não
se adequar às condições do primeiro princípio. Por exemplo, a energia interna das
resistências numa torradeira não aumenta devido ao calor ou ao trabalho, mas sim,
devido à transmissão de energia eléctrica. Lembre-se que o primeiro princípio é um caso
especial da equação da conservação de energia geral, que abrange maior espectro de
situações possíveis.
Quando um sistema é submetido a uma mudança infinitesimal em seu estado, tal
que uma pequena quantidade de energia dQ transferida pelo calor e uma pequena
quantidade de trabalho dW realizado pelo sistema, a energia interna também varia de
uma quantidade pequena dU. Logo, para processos infinitesimais, podemos expressar o
primeiro princípio como:
∆U = dQ − dW
(2.9)
27
Nota. Convenção de sinais. Alguns textos apresentam o primeiro princípio (ou primeira lei) da
termodinâmica como U = Q + W . A razão disso é que o trabalho é definido como o trabalho
Vf
realizado sobre o gás (e não pelo gás) e W = − ∫ PdV .
Vi
É importante observar que dQ e dW não são diferenciais exactas porque ambos
dependem da trajectória (Q e W não são varáveis de estado), embora dU seja uma
diferencial exacta (é uma variável de estado). Podemos expressar essas diferenças
escrevendo o primeiro princípio na forma dU = δQ − δW .
Não existe uma distinção prática entre os resultados obtidos pelo calor e trabalho
numa escala microscópica. Cada uma pode produzir a variação de energia interna num
sistema. Embora as quantidades macroscópicas Q e W não sejam propriedades do
sistema, elas estão relacionadas com a mudança da energia interna dum sistema
estacionário por meio do primeiro princípio da termodinâmica. Uma vez que um
processo ou trajectória é definido, Q e W podem ser calculados ou medidos e a variação
na energia interna pode ser determinada a partir do primeiro princípio.
2.6 Algumas Aplicações do Primeiro Princípio da Termodinâmica
Para aplicar o primeiro princípio da termodinâmica a sistemas específicos, é útil definir
alguns processos termodinâmicos comuns. Identificamos quatro processos especiais que
são utilizados como modelos simplificados próximos dos processos reais; são eles os
processos: adiabático, isométrico (ou isocórico), isotérmico e o cíclico. Imaginamos
para cada um desses processos o gás da Figura 2.11.
•
Processo adiabático
Durante um processo adiabático nenhuma energia sai ou entra no sistema por meio do
calor; isto é, Q=0. Para o pistão da Figura 2.11, imagine que todas as superfícies do
pistão são isolantes perfeitos, de maneira que a transferência de energia pelo calor não
existe. Uma outra maneira de obter um processo adiabático é realizá-lo muito
rapidamente, uma vez que a transferência de energia pelo calor tende a ser relativamente
lenta. Aplicando o primeiro princípio para este caso:
∆U = Q − W = 0 − W
ou
∆U = −W
(2.10)
Com base nesse resultado, podemos concluir que quando o gás é comprimido
adiabaticamente, tanto W quanto U são positivos – o trabalho realizado pelo gás é
negativo, representando a transferência de energia para dentro do sistema, de maneira
que a energia interna aumenta. E quando o gás se expande adiabaticamente, U é
negativo.
Os processos adiabáticos são muito importantes na prática de engenharia, como
na expansão dos gases quentes num motor de combustão interna, a condensação de
gases num sistema de refrigeração e a compressão num motor diesel.
A expansão livre representada na Figura 2.10b é um processo adiabático único,
em que nenhum trabalho é realizado sobre o gás. Como Q=0 e W=0, quando
substituímos na equação 2.8, obtemos U. Isto significa que as energias internas inicial e
28
final de um gás são iguais numa expansão livre. Como a energia interna de um gás ideal
depende somente da sua temperatura, não esperamos nenhuma variação na temperatura
durante uma expansão livre adiabática. Isto concorda com os experimentos realizados a
pressões baixas. Para gases reais a pressões altas, experimentos mostram um pequeno
aumento (ou diminuição) da temperatura após a expansão por causa da interacção entre
as moléculas.
•
Processo isobárico
Um processo que ocorre a uma pressão constante é chamado de processo isobárico. Na
Figura 2.11 quando o pistão está perfeitamente livre para se mover, a pressão do gás é
devido à pressão atmosférica e ao peso do pistão. Num processo desse tipo, o trabalho
realizado pelo gás corresponde a pressão constante, multiplicada pela variação de
volume, ou W = P (V f − Vi ) . Num diagrama PV, um processo isobárico aparece como
uma linha horizontal, como a segunda parte do processo na Figura 2.9a, ou a primeira
parte do processo na Figura 2.9b. Teremos para esse processo ∆U = Q − W .
•
Processo isométrico (ou isocórico)
Para a Figura 2.11, o processo isométrico é criado segurando-se o pistão de maneira que
ele não se mova. Num processo desse tipo, o trabalho realizado é nulo porque o volume
não se altera. Substituindo W=0 na equação 2.8, obtém-se
∆U = Q − W = Q + 0
ou
∆U = Q
(2.11)
Esta equação nos diz que, se a energia for adicionada ao sistema por meio do calor, toda
a energia vai para o aumento da energia interna do sistema – nenhuma energia entra ou
sai do sistema por meio do trabalho. Por exemplo, quando uma lata de aerossol é jogada
no fogo, a energia entra no sistema (o gás dentro da lata) pelo calor através das paredes
de metal da lata. Consequentemente, a temperatura e a pressão do gás sobem até que a
lata possivelmente estoure. Num diagrama PV, um processo isocórico aparece como
uma linha vertical, como a primeira parte do processo na Figura 2.9a ou a segunda parte
do processo da Figura 2.9b.
•
Processo isotérmico
Um processo que ocorre a uma temperatura constante é chamado de processo
isotérmico. Uma vez que a energia interna de um gás ideal é uma função apenas da
temperatura, num processo isotérmico para um gás ideal, ∆U = 0 . Substituindo na
equação 2.8
∆U = Q − W ⇒ 0 = Q − W ⇒ W = Q
O que significa que num processo isotérmico qualquer energia que entre no gás por
meio do trabalho sai do gás por meio do calor, de modo que a energia interna
permanece fixa.
29
Num diagrama PV, um processo isotérmico aparece como uma linha curva,
como na Figura 2.12. Podemos calcular o trabalho realizado sobre um gás ideal num
processo isotérmico.
Vf
O trabalho realizado pelo gás é: W = ∫ PdV . Sabemos que para um gás ideal
Vi
PV = nRT . Então P =
Vf
nRT
, substituímos na integral. Assim:
V
Vf
Vf
nRT
1
V
W = ∫ PdV = ∫
dV = nRT ∫ dV = nRT ln V V f = nRT (ln V f − ln Vi )
i
V
V
Vi
Vi
Vi
ou
V
W = nRT ln f
Vi
(2.12)
Isoterma
Figura 2.12. Diagrama PV para uma expansão isotérmica de um gás ideal de um estado
inicial até um estado final. A curva é uma hipérbole.
•
Processo cíclico
Agora vamos considerar o processo cíclico, no qual um sistema não isolado começa e
termina no mesmo estado. Neste caso a variação da energia interna deve ser nula,
porque a energia interna é uma variável de estado, e os estados inicial e final são
idênticos. A energia adicionada ao sistema na forma de calor, deve ser igual e negativo
do trabalho realizado sobre o sistema durante o ciclo. Assim num processo cíclico,
∆U = 0
⇒
Q =W
O trabalho resultante realizado por ciclo é igual à área circunscrita pela trajectória
representando o processo num diagrama PV (Figura 2.13). Os processos cíclicos são
muito importantes na descrição das máquinas térmicas.
30
Figura 2.13. Processo cíclico.
2.6. Mecanismos de Transferência de Energia
Neste capítulo discutimos o trabalho e o calor, que na realidade corresponde a uma parte
responsável pela variação da energia total de um sistema. Nesta secção estudaremos
com mais detalhe o calor e mais outros dois métodos de transferência de energia que
frequentemente estão relacionados às variações de temperatura: convecção (uma forma
de transferência de matéria) e radiação electromagnética.
•
Condução
O processo de transferência de energia pelo calor também pode ser chamado de
condução ou condução térmica. Nesse processo, o mecanismo de transferência pode
ser visto em escala atómica como uma troca de energia cinética entre moléculas, na qual
as moléculas menos energéticas ganham energia colidindo. Por exemplo se segurarmos
numa das extremidades de uma longa barra de metal e inserirmos a outra extremidade
numa chama, a temperatura do metal na nossa mão eleva-se rapidamente. A energia
alcança a nossa mão por condução. Pode-se entender como isso ocorre examinando-se o
que está acontecendo com os átomos do metal. Inicialmente, antes de se inserir a barras
na chama, os átomos estão vibrando em torno de suas posições de equilíbrio. À medida
que a chama fornece energia à barra, os átomos próximos à chama começam a vibrar
com amplitudes cada vez maiores, e, por sua vez, colidem com seus vizinhos e
transferem um pouco de sua energia nas colisões. Lentamente, os átomos do metal cada
vez mais distantes da chama aumentam a sua própria amplitude de vibração, até que
eventualmente aqueles próximos a nossa mão sejam afectados. A vibração aumentada
representa uma elevação de temperatura do metal (e possivelmente a mão queimada).
Figura 2.14. Condução térmica
Embora a transferência de energia através do material possa ser parcialmente
explicada pelas vibrações atómicas, a taxa de condução também depende das
propriedades da substância. Por exemplo, é possível segurar um pedaço de amianto
31
numa chama indefinidamente. O que significa que muito pouca energia está sendo
conduzida por meio do amianto. Geralmente os metais são bons condutores térmicos
porque eles contêm um grande número de electrões que são relativamente livres para se
mover através do metal e podem transportar energia de uma região para outra. Logo um
bom condutor térmico, como o cobre, a condução ocorre pela vibração dos átomos e
pelo movimento dos electrões livres. Materiais como o amianto, rolha, papel e fibra de
vidro são maus condutores. Os gases também são maus condutores térmicos por causa
das grandes distâncias entre as moléculas.
A condução ocorre apenas se as temperaturas forem diferentes nas duas partes
do meio condutor. A diferença de temperatura impulsiona o fluxo de energia.
Considere um bloco cujo material tem espessura ∆x e uma secção de área A,
cujas faces opostas têm temperaturas T1 e T2, onde T1> T2 (Figura 2.15). O bloco
permite que a energia seja transferida da região de alta temperatura para a região de
baixa temperatura por meio da condução térmica. A taxa de transferência de energia
pelo calor, H = Q / ∆t , é proporcional à área da secção A e à diferença de temperatura e
inversamente proporcional à espessura do bloco:
H=
Q
∆T
αA
∆t
∆x
Quando Q está em Joules e ∆t em segundos, temos H em Watts. Isso não é
surpreendente, uma vez que H é potência – a taxa de transferência de energia pelo calor.
T1
T2
T1
T2
Figura 2.15. Condução térmica
através de um bloco.
Figura 2.16. Condução térmica
através de uma barra.
Para um bloco de espessura infinitesimal dx e diferença de temperatura dT, podemos
escrever a lei da condução como
dT
(2.13)
H = kA
dx
onde a constante de proporcionalidade k é chamada de condutividade térmica do
material e dT / dx é o gradiente de temperatura (variação da temperatura com a
posição). É o facto da condutividade térmica do metal ser maior do que a condutividade
térmica do papel cartão, que faz com que o recipiente de gelo pareça mais frio do que o
pacote de papel cartão, da discussão anterior no Capítulo1.
32
Suponha que uma substância esteja na forma de uma barra longa e uniforme e de
comprimento L, como indica a Figura 2.16, e seja isolada de modo que a energia não
possa escapar pelo calor a partir da sua superfície excepto nas extremidades, que estão
em contacto térmico com reservatórios que têm temperaturas T1 e T2. Quando o estado
estacionário é alcançado, a temperatura em cada ponto ao longo da barra é constante no
tempo. Neste caso, o gradiente de temperatura é o mesmo em qualquer ponto da barra e
é dado por
dT T2 − T1
=
dx
L
Logo, a taxa de transferência de energia pelo calor
H = kA
T2 − T1
L
(2.14)
As substâncias que são boas condutoras térmicas têm valores grandes de
condutividade térmica, enquanto os bons isolantes térmicos têm valores pequenos de
condutividade térmica. A Tabela 2.3 relaciona as condutividades térmicas para várias
substâncias.
•
Convecção
Podemos aquecer nossas mãos colocando-as sobre uma chama. Em tal situação, o ar
directamente acima da chama é aquecido e se expande – resultando numa diminuição da
densidade do ar, e ele sobe. A massa de ar aquecida transfere energia pelo calor para as
mãos, à medida que flúi através delas. A transferência de energia da chama para as
mãos é realizada por meio de transferência de matéria – a energia se propaga com o ar.
A energia transferida pelo movimento de um fluido é um processo chamado de
convecção. Quando o movimento resulta de diferença de densidade, como no exemplo
do ar em torno de uma fogueira, o processo é chamado de convecção natural. Quando
o fluido é forçado a se mover por um fole ou uma bomba, como em alguns sistemas de
aquecimento de ar e água, o processo é chamado de convecção forçada.
O padrão de circulação do fluxo de ar numa praia é um exemplo de convecção
na natureza. A mistura que ocorre à medida que a água é arrefecida e eventualmente
congelada na superfície do lago é outro exemplo.
Se não fosse pelas correntes de convecção, seria muito difícil ferver a água. À
medida que a água é aquecida numa panela, as camadas inferiores são aquecidas
primeiras (Figura 2.17a). Essas regiões se expandem e sobem porque tem uma
densidade menor que a da água fria. Ao mesmo tempo, a água mais fria e mais densa
vai para o fundo da panela e aí pode ser aquecida.
O mesmo processo ocorre numa sala aquecida por um aquecedor (Figura 2.17b).
O aquecedor aquece o ar nas regiões inferiores da sala pelo calor da interface entre a
superfície do aquecedor e o ar. O ar quente se expande e flúi até o teto devido a sua
baixa densidade, estabelecendo um padrão de corrente de ar.
33
(a)
(b)
Figura 2.17. a) Correntes de convecção na água; b) As correntes de convecção no ar.
•
Radiação
Outro método de transferência de energia que pode ser relacionado com a variação de
temperatura é a radiação electromagnética. Todos os corpos irradiam energia
continuamente na forma de ondas electromagnéticas. A origem da radiação
electromagnética é a aceleração de cargas eléctricas. Da discussão sobre a temperatura,
sabemos que a temperatura corresponde ao movimento aleatório das moléculas que
estão mudando de direcção constantemente, e portanto acelerando. Uma vez que as
moléculas contêm cargas eléctricas, as cargas também aceleram. Logo, qualquer corpo
emite radiação electromagnética devido ao movimento térmico de suas moléculas. Esta
radiação é chamada de radiação térmica.
Aproximadamente 1340 J da energia do Sol atingem, por meio da radiação
electromagnética, cada metro quadrado da parte superior da atmosfera da Terra a cada
segundo (ver Figura 2.18). Uma parte dessa radiação é reflectida de volta para o espaço
e uma parte é absorvida pela atmosfera, mas o suficiente chega à superfície da Terra a
cada dia para suprir acima de centenas de vezes nossa necessidade de energia – se ela
pudesse ser capturada e usada com eficiência. O crescimento do número de casa com
energia solar é um exemplo da tentativa de se fazer uso dessa energia abundante.
A taxa de emissão de energia de um corpo por meio da radiação térmica a partir
da superfície é proporcional à quarta potência de sua temperatura superficial absoluta.
Esse princípio, conhecido como a lei de Stefan, é expresso na forma de equação como
H = σAeT 4
(2.15)
onde H é a potência irradiada pelo corpo em watts, σ é a constante de StefanBoltzmann, e σ = 5.6696 × 10−8 W/m2⋅K4, A é a área da superfície do corpo em metros
quadrados, e é uma constante chamada emissividade e T é a temperatura da superfície
do corpo em kelvins.
34
Figura 2.18. Radiação térmica.
O valor de e varia entre 0 e 1, dependendo das propriedades do corpo. A emissividade é
igual a fracção da radiação incidente que é absorvida pela superfície. Ao mesmo tempo
que irradia, um corpo também absorve radiação electromagnética do ambiente. Se o
segundo processo não ocorresse, um corpo irradiaria constantemente sua energia e sua
temperatura diminuiria espontaneamente até o zero absoluto. Se um corpo estiver na
temperatura T e o exterior estiver na temperatura T0, a taxa resultante de variação da
energia para o corpo em consequência da radiação é
(
H resultante = σAe T 4 − T04
)
(2.36)
Quando um corpo está em equilíbrio com o exterior, irradia e absorve energia à mesma
taxa, de maneira que sua temperatura permanece constante – este é o modelo de sistema
não isolado em estado estacionário. Quando um corpo está mais quente que o exterior,
irradia mais energia do que absorve e arrefece – este é o modelo do sistema não isolado.
Enigma 2.2. Se você observar, uma geada numa manhã fria, verá que ela tende a se
formar mais nas superfícies superiores dos corpos, como a caixa do correio de metal ou
no carro, do que nas superfícies laterais. Porque?
35