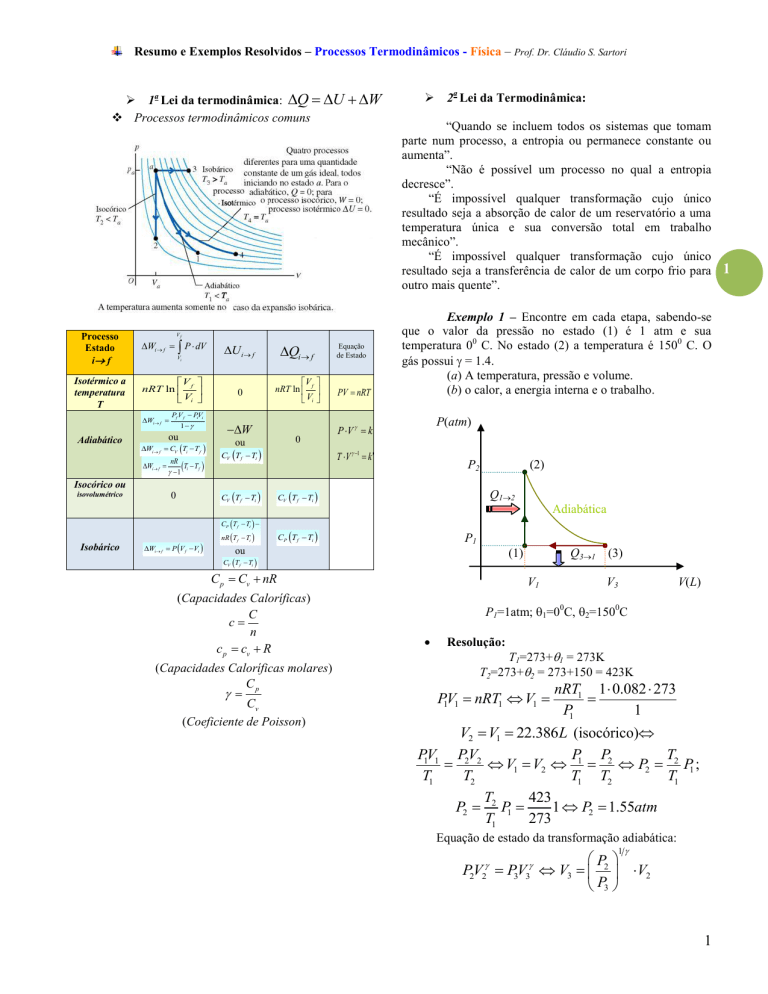
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
1a Lei da termodinâmica: Q U
Processos termodinâmicos comuns
Processo
Estado
i f
Isotérmico a
temperatura
T
Vf
Wi f
P dV
Vi
V
nRT ln f
Vi
Wi f
Adiabático
U i f
Qi f
0
V
nRT ln f
Vi
Equação
de Estado
PV nRT
1
Wi f CV Ti T f
W
nR
Ti Tf
1
Isocórico ou
0
ou
0
CV T f Ti
CV T f Ti
2a Lei da Termodinâmica:
“Quando se incluem todos os sistemas que tomam
parte num processo, a entropia ou permanece constante ou
aumenta”.
“Não é possível um processo no qual a entropia
decresce”.
“É impossível qualquer transformação cujo único
resultado seja a absorção de calor de um reservatório a uma
temperatura única e sua conversão total em trabalho
mecânico”.
“É impossível qualquer transformação cujo único
resultado seja a transferência de calor de um corpo frio para
outro mais quente”.
Exemplo 1 – Encontre em cada etapa, sabendo-se
que o valor da pressão no estado (1) é 1 atm e sua
temperatura 00 C. No estado (2) a temperatura é 1500 C. O
gás possui = 1.4.
(a) A temperatura, pressão e volume.
(b) o calor, a energia interna e o trabalho.
Pf V f PV
i i
ou
Wi f
isovolumétrico
W
P(atm)
P V k
T V 1 k
P2
(2)
CV T f Ti
Q12
Adiabática
CP T f Ti
Isobárico
Wi f P V f Vi
nR T f Ti
CP T f Ti
P1
ou
(1)
CV T f Ti
C p Cv nR
(Capacidades Caloríficas)
C
c
n
c p cv R
(Capacidades Caloríficas molares)
C
p
Cv
(Coeficiente de Poisson)
Q31
V1
(3)
V3
V(L)
P1=1atm; 1=00C, 2=1500C
Resolução:
T1=273+1 = 273K
T2=273+2 = 273+150 = 423K
nRT1 1 0.082 273
P1
1
V2 V1 22.386L (isocórico)
PV
PV
P P
T
1 1
2 2 V1 V2 1 2 P2 2 P1 ;
T1
T2
T1 T2
T1
T
423
P2 2 P1
1 P2 1.55atm
T1
273
PV
1 1 nRT1 V1
Equação de estado da transformação adiabática:
1
P2
PV
V2
2 2 PV
3 3 V3
P3
1
1
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
W23 1032.72 J
1
1.55 1.4
V3
22.386 V3 30.61L
1
PV
1 30.61
3 3
PV
373.29 K
3 3 nRT3 T3
nR 1 0.082
Etapa 1 2 (isocórica – Não há variação de volume)
U 23 W23
U 23 1032.72 J
Etapa 3 1 (Isobárica)
V1
W31 PdV P V1 V3
V2
W12 PdV 0 ; Q12 CV T12
V3
W31 1 22.386 30.61
V1
Cp
; C p Cv nR
Cv
C nR
C 1 8.31
v
1.4 v
Cv
Cv
1.4Cv Cv 8.31 1.4Cv Cv 8.31
8.31
0.4Cv 8.31 Cv
Cv 20.775 KJ ;
0.4
C p Cv nR C p 20.775 1 8.31
Q31 29.085 273 372.29
C p 29.085 KJ
Q31 2916.93J
W31 8.224atm L
W31 8.224 101.3
W31 833.09 J
Q31 CP T31
Q31 CP T1 T3
Q31 W31 U31 (1a Lei da Termodinâmica)
Q12 CV T2 T1
U31 Q31 W31
Q12 20.775 423 273
U31 2916.93 833.09
Q12 3116.25J
U31 2083.84 J
Q12 W12 U12
Q12 U12 0 U12 Q12 3116.25J
Etapa 2 3 (Adiabática: Calor nulo)
Q23 0
Q23 W23 U 23 (1a Lei da Termodinâmica)
0 W23 U 23 U 23 W23
Vf
Wi f
Vf
PdV
Vi
Wi f
kV
dV
Pf V f PV
i i
1
Vi
nR
Pf V f PV
i i ou
Wi f
T T
1 i f
1
Wi f nR
T f Ti
T f Ti
Wi f nRCV C C
C
V
P
1 P
CV
T Ti
Wi f nRCV f
nR
Wi f CV Ti T f
2
Como 1 atm.L=101.3 J
W23 CV T2 T3
W23 20.775 423 373.29
Etapa 1 231 (Ciclo)
Q11 Q12 Q23 Q31
Q11 3116.25 0 2916.3
Q11 199 J
W11 W12 W23 W31
W11 0 1032.72 833.09
W11 199 J
U11 U12 U 23 U31
U11 311625 1032.72 2083.84
U11 0
Resumo do Ciclo:
Etapa
W ( J )
U ( J )
Q( J )
12
23
31
1
…1
0
1032.72
-833.09
199
3116.25
-1032.72
-2083.84
0
3116.25
0
-2916.93
199
2
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Exemplo 2 – Um cilindro com um pistão contém
0.150 mol de nitrogênio a uma pressão de l,80.10 5 Pa e à
temperatura de 300 K. Suponha que o nitrogênio possa ser
tratado como um gás ideal. O gás inicialmente é comprimido
isobaricamente até ocupar a metade do seu volume inicial. A
seguir ele se expande adiabaticamente de volta para seu
volume inicial e finalmente ele é aquecido isocoricamente até
atingir sua pressão inicial.
(a) Desenhe um diagrama pV para esta sequência de
processos.
(b) Ache a temperatura no início e no fim da
expansão adiabática.
(c) Calcule a pressão mínima.
Exemplo 3 – Use as condições e os processos
mencionados no Exemplo 2 para calcular:
(a) o trabalho realizado pelo gás, o calor fornecido
ao gás e a variação da energia interna durante a compressão
inicial;
(b) o trabalho realizado pelo gás, o calor fornecido
ao gás e a variação da energia interna durante a expansão
adiabática;
(c) o trabalho realizado pelo gás, o calor fornecido
ao gás e a variação da energia interna durante o aquecimento
final.
Vb
PV
Pb
b b PV
c c Pc
Vc
1
Pc 1.8 105
2
C
p ; C p Cv nR
Cv
C nR
20.76 0.15 8.31
v
1.06
Cv
20.76
C p Cv 20.76 1.06 C p 22.0065 KJ
1.06
1
Pc
2
1.8 105 Pc 86333.77 Pa
1.8 105 0.00103875
150K
0.15 8.31
86333.77 0.0020775
PV
143.89 K
c c nRTc Tc
0.15 8.31
PV
b b nRTb Tb
Etapa a b (isobárica – Não há variação de pressão)
Vb
Wa b PdV
Resolução:
Va
Wab Pa Vb Va
P(Pa)
Wab 1.8 105 0.00103875 0.0020775
isobárica
Pi =1,8.105
(b)
(a)
Adiabática
Wab 186.525J
isocórica
Pi
Vi
Cv ( N2 ) 20.76
V(m3)
J
K
n = 0.15; R=8.31J/(molK)
Pi=1,8.105Pa; Ti = Ta = 300K
PV
i i nRTi Vi
Qab CP Tb Ta
Qab 22.0065 150 300
(c)
Vf = Vi/2
Qab CP Tab
nRTi 0.15 8.31 300
Pi
1.8 105
Vi 0.0020775m3
V
V 1
V f i b Vc Va 0.00103875m3
2
Vc 2
Qab 3300.975J
Qab Wab U ab
U ab Qab Wab
U ab 3300.975 186.525
U ab 3114.45J
Etapa b c (Adiabática: Calor nulo)
Qbc
Qbc 0
Wbc Ubc
(1a Lei da Termodinâmica)
0 Wbc Ubc Ubc Wbc
3
3
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Vf
Wi f
Vi
Vf
PdV
kV
dV
Pf V f PV
i i
Vi
1
nR
Pf V f PV
i i ou
Wi f
T T
1 i f
1
nR
W
T T
ou i f CP 1 i f
CV
Wi f
Wi f nRCV
Wi f nRCV
Ti T f
Onde:
CP CV
Ti T f
nR
Wi f CV Ti T f
Exemplo 3 – Dado o Ciclo Diesel, com:
Taxa de expansão:
V
rE a
Vc
Taxa de compressão:
V
rC a
Vb
Va 8Vc ; Va 10Vb ; 1.4 ; Tb 350K ;
Vb 2.5 103 m3 ; n 2.5
4
e seu rendimento dado por:
1 1 rE 1 rC
1
1 rE 1 rC
Wbc CV Tb Tc
Wbc 20.76 150 143.89
Wbc 126.8436 J
Ubc Wbc
Ubc 126.8436 J
Etapa c a (Isocórica Vca = 0)
Determine:
(a) As temperaturas, volume e pressão nas etapas a, b e
c.
(b) O trabalho, o calor e a energia interna em cada etapa.
O rendimento do ciclo.
Dados:
CP
; CP CV nR ; PV nRT ;
CV
PV
b b nRTb
Wca 0 J
Qca CV Ta Tc
Qca 20.76 300 146.39
Qca 3240.84 J
Qca Wca U ca
(1a Lei da Termodinâmica)
3240.84 0 U ca
U ca 3240.84 J
Etapa 1 …1
Somas
Etapa
W ( J )
U ( J )
Q( J )
ab
b c
ca
-186.525
126.844
0
-60
-3114.45
-126.844
3240.84
0
-3300.975
0
3240.84
-60
a … a
Vb
Resolução:
(a) Va 8Vc ;
Vc
Va
Va 10Vb ; 1.4 ; Tb 350K ;
Vb 2.5 10 m ; n 2.5
3
3
Va 10Vb 10 2.5 103 Va 2.5 102 m3
Va 8Vc Vc
Va 2.5 102
8
8
Vc 3.125 103 m3
4
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
U ab Wab
Vb Vc
V
Tc c Tb
Tb Tc
Vb
Tc
U ab 10939.57 J
3
3.125 10
350 Tc 437.5K
2.5 103
1
PV
a a PV
b b TaVa
Etapa b c: Expansão isobárica.
1
TbVb
Vc
Wbc PdV
1
V
Ta b
Va
Vb
Tb
Wbc Pb Vc Vb nR Tc Tb
Wbc 2.5 8.31 437.5 350
1.4 1
1
Ta 350
10
Ta 139.34K
1
PV
c c PdVd TcVc
Qbc CP Tbc
Qbc CP Tc Tb
1
TdVd
Qbc 72.71 350 139.34
1
V
Td c
Vd
Tc
Qbc 6362.125J
Qbc Wbc Ubc
Ubc Qbc Wbc
1.4 1
1
Td 437.5
8
Td 190.43K
(b)
C
P ; CP CV nR
CV
C
1.4 P CP 1.4CV
CV
1.4CV CV 2.5 8.31 1.4CV CV 20.775
20.775
CV 51.93 KJ
0.4CV 20.775 CV
0.4
CP 1.4CV CP 1.4 51.93 CP 72.71 KJ
Etapa a b: Compressão adiabática.
Qab 0
Qab Wab U ab (1a Lei da Termodinâmica)
0 Wab U ab U ab Wab
Wi f
Wi f
Vf
Vf
Vi
Vi
PdV kV
P V PV
i i ou
f f
1
dV
Wi f nR
5
Wbc 1817.81J
Pf V f PV
i i
C
U bc CP Tc Tb - nR Tc Tb =
nR Tc C p nR Tb Cv Tc Tb
p
Ubc Cv Tc Tb
Ubc 6362.125 1817.81
Ubc 4544.315J
Etapa c d: Expansão adiabática.
Qcd
0 Wcd U cd U cd Wcd
Vf
Wi f
Vf
PdV
Vi
dV
Pf V f PV
i i
1
Pf V f PV
i i ou W
i f
1
nR
Wi f CV Ti T f
T f Ti
T f Ti
1 ou
Wcd CV Tc Td
1
Wcd 51.93 437.5 190.43
Wi f CV Ti T f Wab CV Ta Tb
Wab 10939.57 J
kV
Vi
Wi f
1
Wab 51.93 139.34 350
Qcd 0
Wcd U cd (1a Lei da Termodinâmica)
Wcd
U cd
12830.34 J
Wcd U cd 12830.34 J
5
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Etapa d a: isocórico.
Wd a
1 T T
1 d a
Tc Tb
Va
PdV 0
Na expansão adiabática:
Vd
Qd a CV Tda Qd a CV Ta Td
Qd a 51.93 139.34 190.43
bc
expansão
isobárica
U ( J )
CV Tb Ta
Q( J )
-10939.57
10939.57
Pb Vc Vb
CP Tc Tb
0
CP Tc Tb
6362.125
QH
nR Tc Tb =
1817.81
C nR T
C nR T
p
c
p
CV Tc Td
cd
expansão
adiabática
12830.34
da
isocórica
0
a … a
b
Cv Tc Tb
4543.875
CV Td Tc
0
12830.34
CV Ta Td
CV Ta Td
-2653.103
-2653.103
0
3709.022
QC
3708.583709
Observe que:
Wciclo
QH
C T T nR Tc Tb CV Tc Td
V a b
CP Tc Tb
nR CV Ta Tb Tc Td
CP CP
Tc Tb
C C
C T T Tc Td
P V V a b
CP
CP
Tc Tb
1 1 T T Tc Td
1 a b
Tc Tb
1 T T Tc Td
1 1 a b
Tc Tb
1 Tc Tb Ta Tb Tc Td
1
Tc Tb
rE 1 Td rE1 Tc Na
T V
TaVa TbVb a b rC 1 Ta rC1 Tb
Tb Va
Vc
1
Vb Vc
T V V
r
T r
r
c c a E C c C
1 rE
Tb Tc
Tb Vb Vb
Tb rE
rc
Va
1
W ( J )
CV Ta Tb
nR Tc Tb
TcVc
T V
c d
Td Vc
1
U d a 2653.103J
ab
Compressão
adiabática
TdVd
1
compressão adiabática:
Qd a 2653.103J
Etapa
1
1
1
6
1 rE1 Tc rC1 Tb
1
Tc Tb
1 Tc
rE
rC1
Tb
1
1
Tc 1
Tb
rE rC rC
1 rC
rE
rC1
rE
1 rE rE rC
1
1
1
rC 1
rC rE
rE
rE
1 1
rC
1 rE rC
1
rC rE
rE
1 1
1 rE rC
1
rC rE
rC rE
1 1
1 rE rC
1
11
rE rC
Chega-se, portanto, a:
1 1 r 1 rC
1 E
1 rE 1 rC
6
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Resolução:
(a)
Etapa a b: Compressão adiabática
Wciclo 3709
58%
QH
6362
Podemos calcular também, sabendo que:
rE
Va
V
8 ; rC a 10 ; 1.4
Vc
Vb
1 1 rE 1 rC
1
1 rE 1 rC
1.4
1.4
1 1 8 1 10
1
1.4 1 8 1 10
1 1 8 1 10
1
1.4 1 8 1 10
58%
1.4
1.4
(a) O trabalho, a energia interna e o calor em cada
etapa.
(b) O rendimento do ciclo.
Vb
Va
é chamada de razão de compressão.
Assim:
1
1
r
1
TbVb
V
Ta b
Va
1
1
Tb Ta
r
Tb
1.4 1
1
Ta
9
350 Ta 145.33K
Vf
n = 2.5 e r = 9
Vb 2.5 103 m3 . Determine:
TaVa
1
Qab 0
Qab Wab U ab (1a Lei da Termodinâmica)
0 Wab U ab U ab Wab
Exemplo 4 – Dado o Ciclo Otto do motor a
gasolina, com: Tb 350 K e Tc 600 K
Dados: A razão: r
1
1
Wi f
Vf
PdV
Vi
Wi f
kV
dV
Pf V f PV
i i
1
Vi
Pf V f PV
i i ou
1
Wi f nR
7
T f Ti
1
Wi f CV Ti T f
ou
Wa b CV Ta Tb
CP
CV
CP CV nR
C
1.4 P CP 1.4CV ;
CV
1.4CV CV 2.5 8.31 1.4CV CV 20.775
20.775
0.4CV 20.775 CV
0.4
CV 51.93 KJ
CP 1.4CV
CP 1.4 51.93
CP 72.71 KJ
Wab 51.93 145.33 350
Wab 10628.5J
U ab Wab U ab 10628.5J
Etapa b c: Aumento isocórico de volume
Vc
Wbc PdV 0
Vb
Qbc CV Tbc Qbc CV Tb Tc
nRTb
PV
b b nRTb Pb
Vb
7
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
2.5 8.31 350
Pb 2908kPa
2.5 103
Va rVb Va 2.5 102 m3
nRTa
PV
a a nRTa Pa
Va
2.5 8.31145.33
Pa
Pa 120769.23Pa
2.5 102
Pb
1
1
TcVc
1
Td Vd
V
Td c
Vd
1
1
Tc Td
r
Tc
1.4 1
1
Td
9
600 Td 249 K
Qbc 51.93 600 350
Qbc 12982.5J
Ubc 12982.5J
Etapa c d: Expansão adiabática
Qcd 0
Qcd Wcd U cd (1a Lei da Termodinâmica)
0 Wcd U cd U cd Wcd
Wi f
Wi f
Vf
Vf
Vi
Vi
PdV kV
Pf V f PV
i i ou W
i f
1
dV
nR
Pf V f PV
i i
1
T f Ti
1
Wi f CV Ti T f
ou
Wcd 51.93 600 249
Wcd 18227.43J
U cd Wcd
U cd 18227.43J
Etapa d a: Queda isocórica
Va
PdV 0
Vd
Qd a CV Tda Qd a CV Ta Td
Qd a 51.93 145.33 249
Qd a 5383.58J
U d a 5383.58J
cd
expansão
queda de
temperatura de
Tc a Td
da
queda
isocórica da
temperatura
abc
da
W(J)
U(J)
Q(J)
CV (Ta Tb )
CV (Tb Ta )
-10628.5
0
10628.5
0
QH CV Tc Tb
12982.5
QH CV Tc Tb
CV (Tc Td )
CV (Td Tc )
18227.43
-18227.43
0
12982.5 8
QC CV Ta Td
QC CV Ta Td
0
-5383.58
-5383.58
CV (Ta Tb ) +
0
CV (Tc Td )
CV Tc Tb +
CV Ta Td
7598.9
7598.93
(b) Cálculo do rendimento:
1
QC
QH
QH Cv Tc Tb e QC Cv Ta Td
Wcd CV Tc Td
Wd a
Processo
Estado
(PiViTi)
ab
Compressão
Adiabática
Tb>Ta
bc
absorção de
calor QH
1
Td Ta
Tc Tb
Como: TaVa 1 TbVb 1 ; TcVb 1 TdVa 1
Por subtração: Td Ta Va 1 Tc Tb Vb 1
1
Td Ta
Tc Tb
1
V
b
Va
1
r
1
1
1
1.4 1
9
0.5847
58.47%
QC
QH
5383.58
1
12982.5
58%
1
8
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Wciclo
QH
7598.93
58%
12982.5
Exemplo 5 – No ciclo de Stirling, os calores
transferidos no processos b → c, e d → a não envolvem
fontes de calor externas, porém usam a regeneração: a
mesma substância que transfere calor ao gás dentro do
cilindro no processo b → c também absorve calor de
volta do gás no processo d → a. Portanto, os calores
transferidos Qb→c, e Qd→a não desempenham pape! na
determinação da eficiência da máquina. Explique esta
última afirmação comparando as expressões de Qb→c, e
Qd→a, obtidas na parte (a),
Calcule a eficiência de um ciclo Stirling em termos das
temperaturas T1 E T2. Como ele se compara com a
eficiência de um ciclo de Camot operando entre estas
mesmas temperaturas? (Historicamente o ciclo Stirling
foi deduzido antes do ciclo de Carnot.) Este resultado
viola a segunda lei da termodinâmica? Explique.
Infelizmente a máquina que funciona com o ciclo
Stirling não pode atingir esta eficiência, devido a
problemas oriundos de transferência de calor e perdas de
pressão na máquina.
QH
Processo / Estado
(PiViTi)
ab
Compressão
Isotémica T1
bc
aumento isocórico
da temperatura e
pressão produzido
pela absorção de
calor QH
cd
expansão
isotérmica
da
queda
isocórica
quase estática da
temperatura
e
pressão de T2 a T1
abcd
a
W(J)
nRT1 ln
1
r
U(J)
Q(J)
QC nRT1 ln
0
1
r
0
Cv T2 T1
Cv T2 T1
nRT2 ln r
0
QH nRT2 ln r
0
1
+
r
nRT2 ln r
nRT1 ln
Cv T1 T2
Cv T1 T2
0
QC+QH
1
Q
r
1 C 1
nRT2 ln r
QH
nRT1 ln
T1 ln r 1
T2 ln r
T ln r
1 1
T2 ln r
T
1 1
T2
1
QC
9
9
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Exemplo 6 – Processos termodinâmicos para um
refrigerador. Um refrigerador opera mediante o ciclo
indicado na Figura. Os processos de compressão (d→a)
e expansão (b→c) são adiabáticos. A pressão, a
temperatura e o volume do refrigerante em cada um dos
quatro estados a, b, c e d são dados na tabela abaixo.
Estado
T(°C)
P(kPa)
V (m3)
U(kJ)
a
80
2305
0,0682
1969
Per
cen
de
tag
liqu
em
0
ido
b
c
d
80
5
5
2305
363
363
0,00946
0,2202
0,4513
1171
1005
1657
100
54
5
(a) Em cada ciclo, qual é o calor retirado do interior
do refrigerador para o líquido refrigerante enquanto ele se
encontra no evaporador?
(b) Em cada ciclo, qual é o calor rejeitado do
refrigerante para fora do refrigerador enquanto o refrigerante
está no condensador?
(c) Em cada ciclo, qual é o trabalho realizado pelo
motor que aciona o compressor?
(d) Calcule o coeficiente de performance do
refrigerador.
Etapa a b: Condensador:
Compressão Isobárica
Vf
Wi f
Vb
PdV PdV P Vb Va nR Tb Ta
Vi
Va
Wab nR Tb Ta
Qab CP Tb Ta
Qab Wab U ab U ab Qab Wab
U ab CP Tb Ta nR Tb Ta
U ab Tb CP nR Ta CP nR
U ab CV Tb Ta
10
Etapa b c: Válvula de expansão:
Adiabática
Qbc 0
Qbc Wbc Ubc (1a Lei da Termodinâmica)
0 Wbc Ubc Ubc Wbc
Wi f CV Ti T f
Wbc CV Tb Tc
Ubc CV Tc Tb
Etapa c d: Evaporador:
Expansão Isobárica
Wi f
QC
Vf
Vd
Vi
Vc
PdV
PdV P V
d
Vc nR Td Tc
Wcd nR Td Tc
Qcd CP Td Tc
Qcd Wcd U cd U cd Qcd Wcd
U cd CP Td Tc nR Td Tc
Ucd Td CP nR Tc CP nR
U cd CV Td Tc
Etapa d a: Compressor:
Compressão Adiabática
Qd a 0
Qd a Wd a U d a (1a Lei da Termodinâmica)
0 Wd a U d a U d a Wd a
QH
Wi f CV Ti T f
Wd a CV Td Ta
U d a CV Ta Td
a b c d a: Ciclo
Wciclo nR Tb Ta CV Tb Tc
nR Td Tc CV Td Ta
10
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Wciclo nR CV Tb nR CV Ta
Td nR CV Tc nR CV
(a)
Wciclo C pTb C pTa C pTd C pTc
Wciclo C p Tb Ta Td Tc
Processo / Estado
(PiViTi)
ab
Compressão
Isobárica
bc
Expansão
adiabática
cd
Expansão isobárica
da
Compressão
adiabática
Ciclo
abcd
a
W(J)
U(J)
Resolução:
PV nRT Va
n R TH
Pa
0.2 8.31 400
Va 6.648 104 m3
106
Vb 2 Va 1.3296 103 m3
n R TQ
PV nRT Pb
Vb
0.2 8.31 400
Pb
Pb 5.00 105 Pa
1.3296 103
Va
Q(J)
nR Tb Ta
CV Tb Ta QH CP Tb Ta
CV Tb Tc
CV Tc Tb
0
nR Td Tc
CV Td Tc
QC CP Td Tc
CV Td Ta
CV Ta Td
0
C p Tb Ta Td Tc
0
QH QC
Exemplo 7 – Ciclo de Carnot. Uma quantidade de 0.2
mol de gás com = 1.4 efetua o ciclo de Carnot
representado. A temperatura da fonte quente é TQ = 400K e a
temperatura da fonte fria TF = 300K. Sabendo que a pressão
inicial é de Pa = 106 Pa e que o volume dobra na expansão
isotérmica, encontre:
(a) A temperatura, o volume e a pressão nos estados a, b,
c e d.
(b) O trabalho, o calor e a energia interna em cada etapa.
(c) o seu rendimento .
11
Tb Vb 1 Tc Vc 1
1
T 1
Vc b Vb
Tc
1
TQ 1
Vc Vb
TF
1
400 1.41
Vc
1.3296 103
300
Vc 2.7294 103 m3
PV nRT Pc
Pc
n R TF
Vc
0.2 8.31 300
Pc 1.8267 105 Pa
3
2.7294 10
Td Vd 1 Ta Va 1
1
T 1
Vd a Va
Td
1
T 1
Vd Q Va
TF
1
400 1.41
Vd
6.648 104
300
Vd 1.3647 103 m3
PV nRT Pd
Pd
n R TF
Vd
0.2 8.31 300
Pd 3.65355 105 Pa
3
1.3647 10
11
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
U d a Wd a
nR
Wi f
T T
1 i f
nR
Wd a
T T
1 d a
0.2 8.31
Wbc
300 400
1.4 1
(b)
Etapa a b: Expansão isotérmica
U ab 0
Qab Wab U ab (1a Lei da Termodinâmica)
Qab Wab 0 Qab Wab
Vf
Wi f
Vi
n R TQ
V
dV n R TQ ln f
V
Vi
Vi
Wi f 0.2 8.31 400 ln 2
Vf
PdV
Wbc 415.5J
Wi f 460.80 J
Qab 460.80 J
Ubc 415.5J
Etapa b c: Expansão adiabática
Qbc 0 J
0 Wbc Ubc (1a Lei da Termodinâmica)
Ubc Wbc
nR
Wi f
T T
1 i f
nR
Wbc
T T
1 b c
0.2 8.31
Wbc
400 300
1.4 1
Adiabáticas: P V K T V 1 cte ;Q = 0
Isotérmicas PV nRT : (Gás ideal) U = 0
C (Coeficiente de Poisson)
P
CV
W
U
Q
nRTH ln VVba
0
nRTH ln VVba
Processo
/ Estado
(PiViTi)
ab
460.8
bc
Wbc 415.5J
Ubc 415.5J
PcVc PbVb
=
1
CV (TH TC )
460.8=QH
CV (TC TH )
U cd 0
Qcd Wcd U cd (1a Lei da Termodinâmica)
Qcd Wcd 0 Qcd Wcd
Vf
Wi f
Vi
Vf
PdV
Vi
n R TQ
V
V
dV n R TF ln f
Vi
V
Wcd n R TF ln d
Vc
1.3647
Wcd 0.2 8.31 300 ln
2.7294
Wcd 345.6 J
0
-415.5
415.5
cd
nRTC ln VVdc
0
-345.6
Etapa c d: Compressão isotérmica
12
da
a
b...
a
nRTC ln VVdc
-345.6
CV (TC TH )
CV (TH TC )
-415.5
415.5
0
Área do ciclo A
115.2
0
A
115.2
1
QF Wciclo 115.8
25%
QQ
QQ
460.8
1
TF
300 1
1
25%
TQ
400 4
Qcd 345.6 J
Etapa d a: Compressão adiabática
Qd a 0 J
0 Wd a U d a (1a Lei da Termodinâmica)
12
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Exemplo 8 - n = 0.04 moles de ar ( = 1.4)
executam o ciclo diesel com taxas: rE = 8 e rC = 10; (taxas de
expansão e compressão, respectivamente).
Sabe-se que no estado a a temperatura é a = 27°C e
a pressão Pa = 1atm;
1.4
0.04 8.31
1.4 1
J
CP 1.1634
mol
CP
Processo
Estado (PiViTi)
ab
compressão
adiabática
Vf
PdV
Wi f
Ui f CV Tf Ti
Qi f Wi f Ui f
(J)
(J)
(J)
CV Ta Tb
CV Tb Ta
0
Vi
0.831 300753.57 376.91
bc
isobárica
376.91
QH
62.62
Pc Vc Vb
13
CP Ta Tb
156.55
CV Tc Tb
1.1634 941.96753.57
219,17
n R (Tc Tb )
(a) Determine o volume Va, Vb e Vc.
(b) Encontre as pressões e as temperaturas nos
estados a, b, c e d.
(c) Encontre o trabalho, o calor e a energia interna
em cada etapa.
(d) Determine o rendimento do ciclo.
cd
expansão
adiabática
da
isocórica
CV Tc Td
CV Td Tc
0
C
Ta Td)
V (
C
Ta Td)
V (
442.06
442.06
0
a ...a
QC
91.41
A Wciclo
91.41
QH QC
0
127.7
127.77
Solução:
Va
1 1 r 1 rC
1 E
1 rE 1 rC
n R Ta
0.04 0.082 300
Va
Pa
1
Va 0.98L
Va
0.984
Vb
Vb 0.0984L
rC
10
V
0.984
Vc a Vc
Vc 0.123L
rE
8
Vb
1
r
10
Tc c Tb Tc 753.57 Tc 941.96K
re
8
Tc
941.95
Td 1.41 Td 410K
rE 1
8
Pc
25.12
Pd Pd 1.4 Pd 1.366atm
rE
8
Td
a
b
c
d
CV
CV
P
(atm)
1
25.12
1.366
1.4
1.4
1 1 8 1 10
1.4 1 8 1 10
1 0.054409 0.0398107
1.4
0.025
1 0.41709 58%
Tb rC 1 Ta Tb 101.41 300 Tb 753.57K
V
(L)
0.98
0.0984
0.123
0.98
1
Pb rC Pa Pb 101.4 1 Pb 25.12atm
Processo / Estado
(PiViTi)
T
(K)
300
753.57
941.96
410
Wciclo
127.77
58.3%
QH
219.17
Exemplo 9 n = 0.04 moles de ar ( = 1.4) executam
o ciclo Otto com taxas: r = 10; (taxa de compressão).
Sabe-se que no estado a a temperatura é a = 27°C e
a pressão Pa = 1atm e após a explosão a pressão aumenta 2
atm.
nR
1
0.04 8.31
J
CV 0.831
1.4 1
mol
CP
n R
1
13
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
(a) Determine o volume Va eVb.
(b) Encontre as pressões e as temperaturas nos
estados a, b, c e d.
(c) Encontre o trabalho, o calor e a energia interna
em cada etapa.
(d) Determine o rendimento do ciclo.
Processo
Estado (PiViTi)
ab
compressão
adiabática
bc
isocórica
Solução:
Va
Vb
n R Ta
0.04 0.082 300
Va
Pa
1
Va 0.98L
Va
0.984
Vb
Vb 0.0984 L
r
10
a b : Pb r Pa Pb 101.4 1 Pb 25.12atm
Pc Pb 2 Pc 25.12 2 Pc 27.12atm
Tb r 1 Ta Tb 101.41 300 Tb 753.57K
b c:
Tc
Ui f CV Tf Ti
Qi f Wi f Ui f
(J)
(J)
CV Ta Tb
CV Tb Ta
0
0
49.86
CV Tc Tb
(J)
0.831 300753.57 376.91
cd
expansão
adiabática
da
isocórica
a ...a
CV Tc Td
406.92
0
a
b
c
d
0.0984
0.98
CV
CV
P
(atm)
1
25.12
27.12
1.079
nR
1
0.04 8.31
J
CV 0.831
1.4 1
mol
CP
n R
1
1.4
0.04 8.31
1.4 1
J
CP 1.1634
mol
CP
T
(K)
300
753.57
813.57
323.89
49.86
0
C
Ta Td)
V (
C
Ta Td)
V (
14
406.92
19.852
0
QC
19.852
QH QC
30.01
Wciclo
30.01
60.12%
QH
49.86
1
r 1
1
1 1.41
10
60.12%
1
Pc
27.12
Pd 1.4 Pd 1.079atm
r
10
V
(L)
0.98
CV Ta Tb
CV Td Tc
30.01
Tc
813.57
Td 1.41 Td 323.89K
r 1
10
Processo / Estado
(PiViTi)
376.91
A Wciclo
Pd Pa
T
323.89
Pd d Pa Pd
1 Pd 1.079atm
Td Ta
Ta
300
Pd
PdV
Vi
QH
27.12
753.57 Tc 813.57 K
25.12
c d : Td
d a:
Pb Pc
P
Tc c Tb
Tb Tc
Pb
Vf
Wi f
Exemplo 10 - Uma máquina de Carnot cujo
reservatório quente está a uma temperatura de 620 K absorve
550 J de calor nesta temperatura em cada ciclo e fornece 335
J para o reservatório frio.
(a) Qual é o trabalho produzido pela máquina
durante cada ciclo?
(b) Qual é a temperatura da fonte fria?
(c) Qual é a eficiência térmica do ciclo?
(d) Adotando:
n = 0.05 e = 1.4 e Va = 0.01m3, encontre as
pressões e os volumes nos pontos a, b, c e d.
(e) Determine o trabalho, o calor e a energia interna
em cada etapa do ciclo de Carnot dado.
Solução:
(a) Wciclo QH QC Wciclo 620 335
Wciclo 245J
Wciclo
Q QC
H
(c)
QH
QH
QC
QC
; 1
QH
QH
335
215
1
0.39
;
550
550
1
14
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
TC
TH
T
T
0.39 1 C C 1 0.39
620
620
TC
0.61 TC 378.2 K
620
V
(d) QH n R TH ln b
Va
(b)
1
Pd
Estado
V
550 0, 05 8.31 620 ln b
Va
V
ln b 2.135
Va
Vi(m³) Pi (Pa) Ti (K) Vf(m³) Pf (Pa)
Tf (K)
a -> b: isotérmica:
expansão
0,01
25761
620
0,08457 3046,
b -> c: adiabática
:expansão
0,08457
3046
620
0,29099
540
378,2
c -> d: isotérmica
:compressão
0,2909 540,00
378
0,034
4566,
378,2
d -> a: adiabática
:compressão
0,0344
378
0,01
25761
620
4566
620
Matriz: E,W,Q[6,4]
Trabalho Energia
(J)
Interna (J)
Etapa
Calor (J)
a -> b: isotérmica: expansão
549,99
0
549,99
Vb 2.135
e
Va
b -> c: adiabática :expansão
251,2
-251,2
0
c -> d: isotérmica
:compressão
-335,497
0
-335,49
Vb
8.457
Va
c -> d: adiabática
:compressão
-251,2
251,2
0
Ciclo de Carnot
214,49
0
214,498
Rendimento
39 %
Vb 8.457 Va
1
T 1
TH Vb 1 TC Vc 1 Vc H Vb
TC
1
620 1.41
Vc
0.08457 Vc 0.2909m3
378.2
n R TC
0.05 8.31 378.2
Pc
Pc
Vc
0.2909
Pc 540.19Pa
1
T 1
TC Vd 1 TH Va 1 Vd H Va
TC
620 1.41
Vd
0.01 Vd 0.0344m3
378.2
Ciclo de Carnot
P (Pa)
Vb 8.457 0.01 Vb 0.08457m3
n R TH
0.05 8.31 620
Pa
Pa
Va
0.01
Pa 25761Pa
n R TH
0.05 8.31 620
Pb
Pb
Vb
0.08457
Pb 3046.12Pa
1
n R TC
0.05 8.31 378.2
Pc
Vd
0.0344
Pd 4568.08Pa
20.000
10.000
0,034
4.566,854
0,291
540,009
0
0,05
0,1
g a -> b: isotérmica: expansão
b
c
d
e
f
b c -> d: isotérmica :compressão
c
d
e
f
g
b b -> c: adiabática :expansão
c
d
e
f
g
b Series9
c
d
e
f
g
0,15
V (m³)
0,2
0,25
g c -> d: adiabática :compressão
b
c
d
e
f
b c -> d: adiabática :compressão
c
d
e
f
g
b c -> d: adiabática :compressão
c
d
e
f
g
b Series16
c
d
e
f
g
Exemplo 11 - Comparação entre processos
termodinâmicos. Um cilindro contém l,20 mol de gás ideal
monoatômico inicialmente a uma pressão de 3,60.10 5 Pa e à
temperatura de 300 K e se expande até o triplo do seu
volume inicial. Calcule o trabalho realizado pelo gás quando
a expansão é:
(a) isotérmica;
(b) adiabática;
(c) isobárica;
(d) Usando um diagrama pV, indique cada um
destes processos. Em qual deles o trabalho realizado pelo gás
possui o maior valor absoluto? E o menor valor absoluto?
(e) Em qual destes processos o calor trocado possui
o maior valor absoluto? E o menor valor absoluto?
(f) Em qual destes processos a variação da energia
interna possui o maior valor absoluto? E o menor valor
absoluto?
15
15
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
Solução
(a) A que temperatura correspondem os pontos A, B
E,W,Q[5,4]
e C?
Calor
(J)
a -> b: isotérmica:
expansão
3286,60
0
3286,60
a -> b: adiabática
:expansão
2330,08
-2330,08
0
a -> b: isobárica
5983,2
8974,8
14958
(b) Calcular W, Q e U para cada processo e para
todo o ciclo.
P(atm)
2.4
A
B
1.2
2.2
360000
0,00831
300
0,0249
120000
300
4,4
2,4
Transformações gasosas
2,4
P (atm)
360000
0,00831
2
1,8
1,6
4,4
1,2
1,4
300
0,0249
57689,9
144,22
1,2
3
4
V (L)
g
b
c
d
e
f
b
c
d
e
f
g
b
c
d
e
f
g
300
0,0249
360000
B -> C: isocórica
A -> B: isobárica
A -> B: isobárica
g
b
c
d
e
f
b
c
d
e
f
g
b
c
d
e
f
g
B -> C: isocórica
Series12
Series15
g
b
c
d
e
f
b
c
d
e
f
g
: compressão
C -> A: isotérmica
900
Diagrama PV
300.000
P (Pa)
V(L)
2,2
360000
a -> b:
isobárica
a -> b:
adiabát
ica
:expans
ão
4.4
Solução
0,00831
a -> b:
isotérm
ica:
expansã
o
16
C
Tf (K)
Pf (Pa)
Vf(m³)
Ti (K)
Pi (Pa)
Energia
Interna (J)
Vi(m³)
Trabalho
(J)
Estado
Etapa
200.000
Energia
Interna
(atm.L)
Etapa
Trabalho
(atm.L)
Calor
(atm.L)
A -> B: isobárica
5,28
7,92
13,2
B -> C: isocórica
0
-7,92
-7,92
C -> A:
isotérmica:
compressão
-3,6597
0
-3,65979
Ciclo
1,62020
0
1,62020
100.000
0,01
g
b
c
d
e
f
b
c
d
e
f
g
b
c
d
e
f
g
b
c
d
e
f
g
0,012
0,014
0,016
0,018
V (m³)
Series2
: expansão
a -> b: adiabática :expansão
a -> b: isobárica
g
b
c
d
e
f
b
c
d
e
f
g
b
c
d
e
f
g
b
c
d
e
f
g
0,02
0,022
0,024
Series3
a -> b: isobárica
a -> b: isotérmica
a -> b: adiabática
Exemplo 12 - Um sistema constituído por 0,32 mol
de gás ideal monoatômico, cm cv = 3R/2, ocupa um volume
de 2,2 L sob a pressão de 2,4 atm, no estado do ponto A da
figura.
O sistema efetua um ciclo constituído por 3
processos:
(i) O gás é aquecido isobaricamente até atingir o
volume de 4,4 L n ponto B.
(ii) O gás é então resfriado isocoricamente até a
pressão se reduzir a 1,2 atm (Ponto C).
(iii) O gás retorna ao ponto A por meio de uma
compressão isotérmica.
Estado
Vi
(L)
Pi
(atm)
Ti
(K)
Vf
Pf
(L) (atm)
Tf
(K)
A -> B: isobárica
2,2
2,4
201,2 4,4
2,4
402,43
B -> C: isocórica
4,4
2,4
402,4 4,4
1,2
201,2
C -> A: isotérmica:
compressão
4,39
1,2
201,2 2,2 2,399
201,2
16
Resumo e Exemplos Resolvidos – Processos Termodinâmicos - Física – Prof. Dr. Cláudio S. Sartori
17
17