PROFESSOR: DEMETRIUS
SÉRIE: 2º ANO
DISCIPLINA: FÍSICA 1
Primeira Lei da Termodinâmica:
uma ideia geral...
Um gás possui
energia
interna
Ao receber uma
quantidade de
calor, sua energia
interna aumenta
Ao ceder uma
quantidade de
calor, sua energia
interna diminui
A energia interna de um gás depende
da temperatura
• Para um gás perfeito monoatômico, a sua
energia interna U é a soma das energias
cinéticas Ec médias de todas as suas moléculas:
3
U EC nRT
2
3
U EC nRT
2
SOBRE O GÁS:
• Se a temperatura aumenta (ΔT>0), a energia
interna do gás aumenta: ΔU>0
• Se a temperatura diminui (ΔT<0), a energia
interna do gás diminui: ΔU<0
• Se a temperatura não varia (ΔT=0), a energia
interna do gás não muda: ΔU=0
A velocidade média das moléculas
3RT
v
M
2
• v – velocidade média (m/s)
• R – Constante Universal do Gases ideais
(8,31 J/mol.k)
• T – Temperatura do gás (K)
• M – Massa molar do gás (kg/mol)
A energia cinética média por
molécula
3
e kT
2
• e – energia cinética (J)
• k – Constante de Boltzmann (1,38.10-23
J/K)
• T – Temperatura do gás (K)
PRIMEIRO PRINCÍPIO DA
TREMODINÂMICA
• A variação da energia interna ΔU de um
sistema é expressa por meio da diferença
entre a quantidade de calor Q trocada com o
meio ambiente e o trabalho τ realizado
durante a transformação.
U Q
EXEMPLO
• Um gás recebe 50 J de calor de uma fonte
térmica e se expande, realizando um trabalho
de 5 J. Quanto vale a variação da energia
interna desse gás?
45 J
CONSIDERAÇÕES
• Convenção de sinais:
Calor recebido pelo gás
Calor cedido pelo gás
Trabalho realizado pelo gás (expansão)
Trabalho realizado sobre o gás (compressão)
Q>0
Q<0
τ >0
τ <0
Vamos fazer alguns exercícios do livro?
Página 325 (Verificação e Aplicação)
Página 327 (A11)
Página 328 (V11)
PARTE II
APLICAÇÃO DA PRIMEIRA LEI
DA TERMODINÂMICA A
ALGUMAS
TRANSFORMAÇÕES
GASOSAS PARTICULARES
U Q
NUMA TRANSFORMAÇÃO
ISOCÓRICA...
• Sendo o volume invariável numa transformação
isocórica, não há realização de trabalho (τ=0)
ΔU = Q – τ
ΔU = Q – 0
ΔU = Q
• EXEMPLO: Num processo isocórico, um gás
recebe 20 J de calor. Quanto vale a variação da
sua energia interna?
NUMA TRANSFORMAÇÃO
ISOTÉRMICA...
• Numa transformação isotérmica, ΔT = 0.
Se ΔT = 0, ΔU=0
ΔU = Q – τ
0=Q–τ
τ= Q
EXEMPLO: Em um processo isotérmico, um gás
recebe 30 J de calor, e se expande. Qual o
trabalho realizado pelo gás nesse processo?
NUMA TRANSFORMAÇÃO
ADIABÁTICA...
MAS O
QUE É UMA
TRANSFOR
MAÇÃO
ADIABÁTIC
• Numa transformação adiabática o gás não
troca calor com o meio – ou porque o gás
está termicamente isolado ou porque o
processo é razoavelmente rápido para que
qualquer troca de calor possa ser
considerada.
NUMA TRANSFORMAÇÃO
ADIABÁTICA...
• Numa transformação adiabática, Q=0.
ΔU = Q – τ
ΔU = 0 – τ
ΔU = – τ
• Numa EXPANSÃO gasosa adiabática, a
temperatura DIMINUI, a energia interna
DIMINUI e o volume do gás AUMENTA.
• Numa COMPRESSÃO gasosa adiabática, a
temperatura AUMENTA, a energia interna
AUMENTA e o volume do gás DIMINUI.
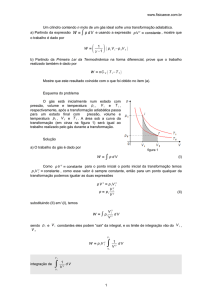
O gráfico p x V de
uma transformação
adiabática é uma
curva mais
acentuada que a
isotérmica.
Vamos fazer alguns exercícios do livro?
Aplicação(pág. 327-328)
Aplicação (pág. 331)
SEM PREGUIÇA