AULA 16
TERMODINÂMICA
1- INTRODUÇÃO
Neste capítulo estudaremos a relação entre duas formas de energia
em trânsito. Uma delas é o calor, energia térmica em trânsito, e a outra
é o trabalho, energia mecânica em trânsito. O calor, já estudamos
anteriormente e o trabalho será definido a seguir.
2- TRABALHO (t)
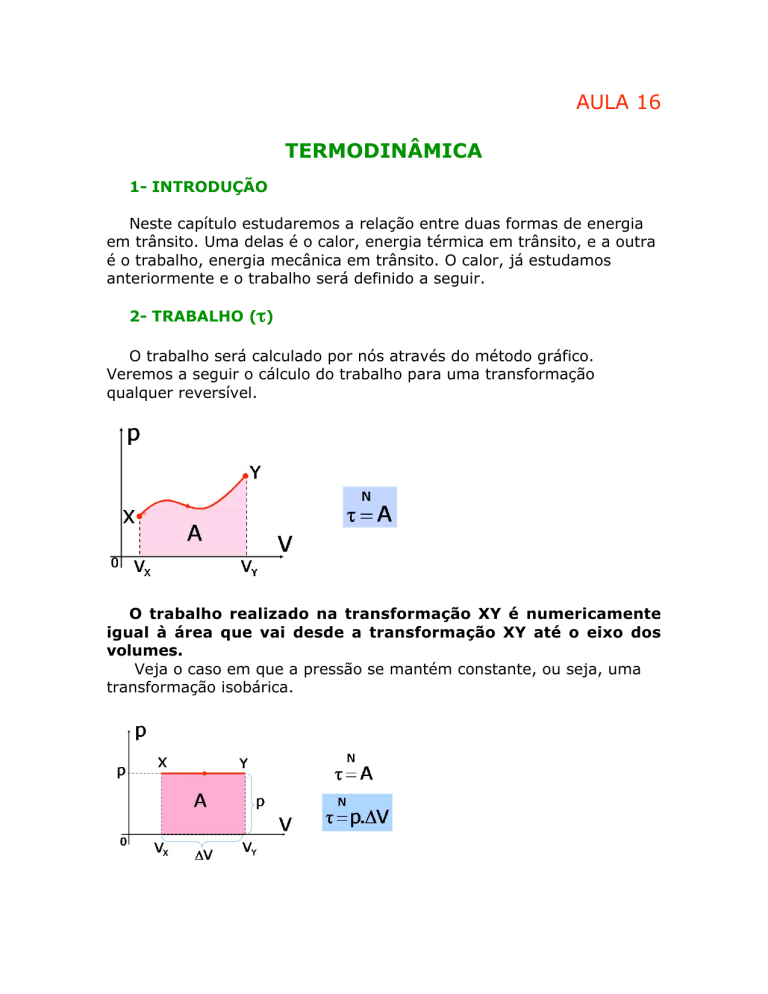
O trabalho será calculado por nós através do método gráfico.
Veremos a seguir o cálculo do trabalho para uma transformação
qualquer reversível.
O trabalho realizado na transformação XY é numericamente
igual à área que vai desde a transformação XY até o eixo dos
volumes.
Veja o caso em que a pressão se mantém constante, ou seja, uma
transformação isobárica.
Fazendo uma análise em uma transformação isobárica podemos
verificar que o trabalho depende da variação de volume, isto é, se o
volume varia o sistema troca trabalho com o meio e se o volume
permanece constante o sistema não troca trabalho com o meio.
Quando o sistema se expande, ele empurra o meio externo
realizando trabalho sobre o meio. O trabalho realizado é
positivo, pois o volume do sistema está aumentando.
Quando o sistema sofre uma compressão, ele está sendo
comprimido pelo meio externo e, portanto, recebendo trabalho
do meio. O trabalho recebido é negativo, pois o volume do
sistema está diminuindo.
3- TRABALHO NAS TRANSFORMAÇÕES CÍCLICAS
Considerando o ciclo ABCDA, podemos observar que o trabalho
realizado pelo sistema é dado pela soma entre os trabalhos realizados
nas transformações AB e CD uma vez que os trabalhos nas
transformações BC e DA são nulos, pois essas transformações são
isocóricas (volume constante).
Note que na transformação AB o sistema sofre uma expande
isobárica (realiza trabalho) e na transformação CD o sistema sofre uma
compressão isobárica (recebe trabalho).
Como o trabalho na transformação AB é a área A1 e o trabalho na
transformação CD é a área A2 e lembrando que na expansão o trabalho
é positivo e na compressão o trabalho é negativo, temos:
tciclo = t AB + tCD fi tciclo = A1 + (-A 2 ) fi tciclo = A1 - A 2
Observando as figuras acima, você nota que a diferença entre as
áreas é igual a área do ciclo.
Quando o ciclo é percorrido no sentido horário, ele realiza
trabalho sobre o meio externo. O trabalho realizado é positivo.
Quando o ciclo é percorrido no sentido anti-horário, ele está
recebendo trabalho do meio externo. O trabalho recebido é
negativo.
4- ENERGIA INTERNA (U)
A energia interna de um gás se resume à soma das energias cinéticas
de translação de cada molécula. A energia interna é diretamente
proporcional à temperatura absoluta do gás, e é dada pela expressão
abaixo:
U=
3
.n.R.T
2
U=
3
.p.V
2
Como p.V=n.R.T, temos:
A energia interna de um gás depende exclusivamente da temperatura
absoluta do gás.
Podemos afirmar então que se a temperatura aumenta a
energia interna aumenta, se a temperatura diminui a energia
interna diminui e se a temperatura se mantém constante a
energia interna se mantém constante. Estas propriedades não
valem para mudanças de estado.
5- PRIMEIRA LEI DA TERMODINÂMICA
A primeira lei ou primeiro princípio da Termodinâmica é o Princípio da
Conservação de Energia.
Considere um sistema recebendo calor. O calor recebido será
transformado integralmente em trabalho ou integralmente em energia
interna ou ainda um pouco do calor recebido será transformado em
trabalho e o restante em energia interna.
Considere uma transformação isotérmica. Nesta transformação o
sistema não sofre alteração na sua energia interna, portanto, todo calor
recebido será transformado integralmente em trabalho ou todo trabalho
recebido será transformado integralmente em calor.
Considere uma transformação isocórica. Nesta transformação o
sistema não troca trabalho com o meio externo, portanto, todo calor
recebido será transformado integralmente em energia interna ou todo
calor cedido será proveniente da energia interna do sistema.
Considere uma transformação adiabática. Nesta transformação o
sistema não troca calor com o meio externo, portanto, todo trabalho
recebido será transformado integralmente em energia interna ou todo
trabalho realizado será proveniente da energia interna do sistema.
EXERCÍCIOS
1- (UFL-PR) – Numa transformação gasosa reversível, a
diminuição da energia interna é de 300J. Houve compressão e o
trabalho realizado pela força de pressão do gás é, em módulo,
200J. Então, é verdade que o gás
a) cedeu 500J de calor ao meio.
b) cedeu 100J de calor ao meio.
c) recebeu 500J de calor do meio.
d) recebeu 100J de calor do meio.
e) sofreu uma transformação adiabática.
2- (UFLA-MG) – Abaixo temos o diagrama pV, que mostra uma
transformação isotérmica de 1 mol de um gás perfeito.
pressão
p1
p2
V1
V2
volume
A área hachurada mede:
a) a variação da pressão.
b) a variação da energia interna.
c) o trabalho realizado pelo gás.
d) o calor cedido pelo gás.
e) o calor específico sensível do gás a temperatura constante.
3- (UFES) – Um gás é submetido ao processo ABC indicado no
gráfico p x V. O trabalho total realizado pelo gás, nesse processo,
é:
a) 4 p0V0
b) 6 p0V0
c) 9 p0V0
d) -4 p0V0
e) -9 p0V0
pressão
3p 0
A
p0
0
B
C
V0
volume
3V0
4- (UNIP-SP) – O gráfico abaixo representa a pressão em
função do volume para um mol de um gás perfeito. O gás vai do
estado A para o estado B segundo a transformação indicada no
gráfico. Assinale a opção correta:
a) a transformação indicada é isotérmica;
b) a área assinalada na figura mede a variação de energia interna
do gás;
c) na transformação de A para B o gás recebe um calor Q, realiza
um trabalho t, de modo que Q = t ;
d) a transformação de A para B é adiabática porque não houve
acréscimo de energia interna do gás;
e) a área assinalada na figura não pode ser usada para se medir
o calor recebido pelo gás.
p
4a
a
V
0
4b
b
5- (ACAFE-SC) – Um gás ideal recebe calor e fornece trabalho
após uma das transformações:
a) adiabática e isobárica
b) isométrica e isotérmica
c)
isotérmica e adiabática
d) isobárica e
isotérmica
e) isométrica e adiabática
RESPOSTAS
1.
2.
3.
4.
5.
ALTERNATIVA
ALTERNATIVA
ALTERNATIVA
ALTERNATIVA
ALTERNATIVA
A
C
B
C
D