Tópico.05
DIAGRAMA DE FASES
Diagrama de Fases
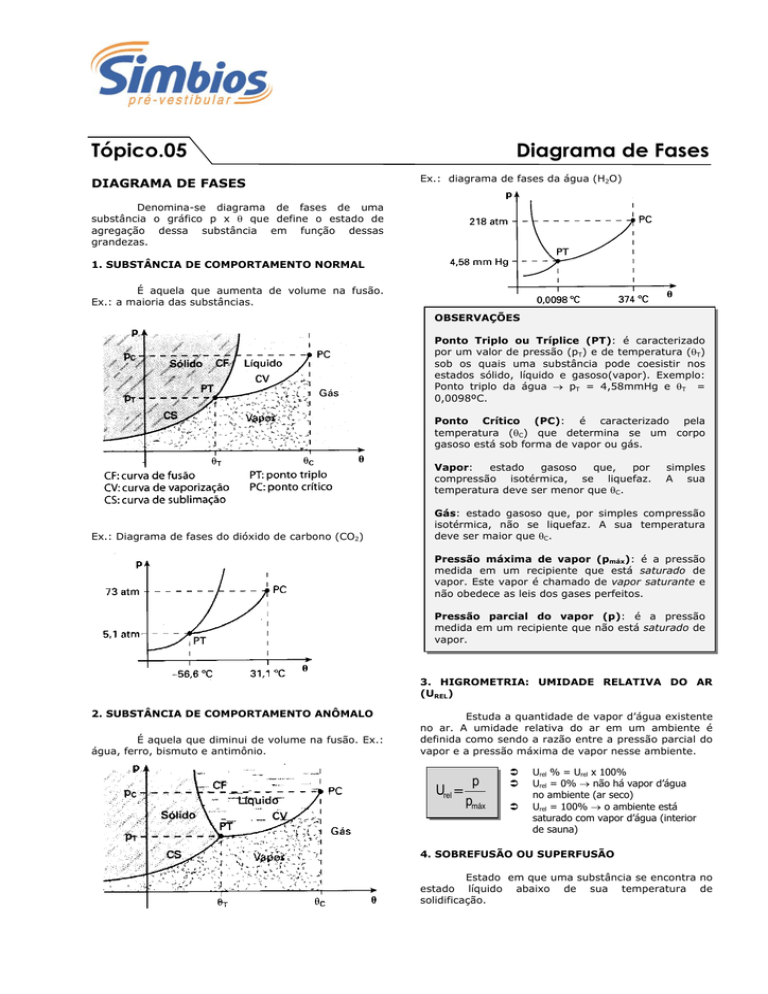
Ex.: diagrama de fases da água (H2O)
Denomina-se diagrama de fases de uma
substância o gráfico p x que define o estado de
agregação dessa substância em função dessas
grandezas.
1. SUBSTÂNCIA DE COMPORTAMENTO NORMAL
É aquela que aumenta de volume na fusão.
Ex.: a maioria das substâncias.
OBSERVAÇÕES
Ponto Triplo ou Tríplice (PT): é caracterizado
por um valor de pressão (pT) e de temperatura (T)
sob os quais uma substância pode coesistir nos
estados sólido, líquido e gasoso(vapor). Exemplo:
Ponto triplo da água pT = 4,58mmHg e T =
0,0098ºC.
Ponto Crítico (PC): é caracterizado pela
temperatura (C) que determina se um corpo
gasoso está sob forma de vapor ou gás.
Vapor:
estado
gasoso
que,
por
compressão isotérmica, se liquefaz.
temperatura deve ser menor que C.
Ex.: Diagrama de fases do dióxido de carbono (CO2)
simples
A sua
Gás: estado gasoso que, por simples compressão
isotérmica, não se liquefaz. A sua temperatura
deve ser maior que C.
Pressão máxima de vapor (pmáx): é a pressão
medida em um recipiente que está saturado de
vapor. Este vapor é chamado de vapor saturante e
não obedece as leis dos gases perfeitos.
Pressão parcial do vapor (p): é a pressão
medida em um recipiente que não está saturado de
vapor.
3. HIGROMETRIA: UMIDADE RELATIVA DO AR
(UREL)
2. SUBSTÂNCIA DE COMPORTAMENTO ANÔMALO
É aquela que diminui de volume na fusão. Ex.:
água, ferro, bismuto e antimônio.
Estuda a quantidade de vapor d’água existente
no ar. A umidade relativa do ar em um ambiente é
definida como sendo a razão entre a pressão parcial do
vapor e a pressão máxima de vapor nesse ambiente.
p
Urel
pmáx
Urel % = Urel x 100%
Urel = 0% não há vapor d’água
no ambiente (ar seco)
Urel = 100% o ambiente está
saturado com vapor d’água (interior
de sauna)
4. SOBREFUSÃO OU SUPERFUSÃO
Estado em que uma substância se encontra no
estado líquido abaixo de sua temperatura de
solidificação.
A sobrefusão é um estado metaestável, ou
seja, em que existe aparentemente equilíbrio, mas a há
uma passagem muito lenta para outro estado. Uma
simples agitação, ou mesmo a introdução de uma
pequena porção sólida, perturba o fenômeno e provoca
uma brusca solidificação parcia ou total do líquido. A
temperatura eleva-se até o ponto de solidificação. Essa
elevação de temperatura é provocada pelo calor
liberado pela parte do líquido que se solidifica (a
solidificação é uma transformação exotérmica).
Veja o gráfico que representa um resfriamento
com supefusão:
m.LS = M.clíq.( - S)
Onde:
m é a massa solidificada;
M é a massa total do do líquido;
LS é o calor latente de solidificação;
S é a temperatura de solidificação;
é a temperatura de superfusão.
EXERCÍCIOS PROPOSTOS
01. (Fuvest/SP)
Enche-se uma seringa com pequena quantidade de
água destilada a uma temperatura um pouco abaixo da
temperatura de ebulição. Fechando o bico, como
mostra a figura A a seguir, e puxando rapidamente o
êmbolo, verifica-se que a água entra em ebulição
durante alguns instantes (veja figura B).
Podemos explicar este fenômeno considerando que:
a) na água há sempre ar dissolvido e a ebulição nada
mais é do que a transformação do ar dissolvido em
vapor.
b) com a diminuição da pressão a temperatura de
ebulição da água fica menor do que a temperatura da
água na seringa.
c) com a diminuição da pressão há um aumento da
temperatura da água na seringa.
d) o trabalho realizado com o movimento rápido do
êmbolo se transforma em calor que faz a água ferver.
e) calor específico da água diminui com a diminuição da
pressão.
I. Um copo de água gelada apresenta gotículas de água
em sua volta porque a temperatura da parede do copo
é menor que a temperatura de orvalho do ar ambiente.
II. A névoa (chamada por alguns de "vapor") que sai do
bico de uma chaleira com água quente é tanto mais
perceptível quanto menor for a temperatura ambiente.
III. Ao se fechar um "freezer", se sua vedação fosse
perfeita, não permitindo a entrada e a saída de ar de
seu interior, a pressão interna ficaria inferior à pressão
do ar ambiente.
a) todas são corretas.
b) somente I e II são corretas.
c) somente II e III são corretas.
d) somente I e III são corretas.
e) nenhuma delas é correta.
04. (Unicamp/SP)
No Rio de Janeiro (ao nível do mar), uma certa
quantidade de feijão demora 40 minutos em água
fervente para ficar pronta. A tabela adiante fornece o
valor da temperatura da fervura da água em função da
pressão atmosférica, enquanto a gráfico fornece o
tempo de cozimento dessa quantidade de feijão em
função da temperatura. A pressão atmosférica ao nível
do mar vale 760 mm de mercúrio e ela diminui 10 mm
de mercúrio para cada 100 m de altitude.
Temperatura de fervura da água em função da pressão
02. Quando passamos éter sobre a pele sentimos o
local mais frio. Isto acontece por que:
a) o éter está a uma temperatura mais baixa que a pele
b) o éter está a uma temperatura mais baixa que o ar
c) o éter é muito volátil
d) o éter absorve calor para se vaporizar
e) o éter é um isolante térmico
Pressão
Temp.
Pressão
Temp.
(mmHg)
(ºC)
(mmHg)
(ºC)
600
94
840
103
640
95
880
105
680
97
920
106
720
98
960
108
03. (ITA/SP)
Considere as seguintes afirmativas:
760
100
1000
109
800
102
1040
110
a) Se o feijão fosse colocado em uma panela de
pressão a 880 mm de mercúrio, em quanto tempo ele
ficaria pronto?
b) Em uma panela aberta, em quanto tempo o feijão
ficará pronto na cidade de gramado (RS) na altitude de
800 m ?
c) Em que altitude o tempo de cozimento do feijão (em
uma panela aberta) será o dobro do tempo de
cozimento ao nível do mar
05. (UFF/RJ)
Marque a opção que apresenta a afirmativa falsa:
a) uma substância não existe na fase líquida quando
submetida a pressões abaixo daquela de seu ponto
triplo
b) a sublimação de uma substância é possível se esta
estiver submetida a pressões mais baixas que a do seu
ponto triplo
c) uma substância só pode existir na fase líquida se a
temperatura a que estiver submetida for mais elevada
que sua temperatura crítica
d) uma substância não sofre condensação a
temperaturas mais elevadas que sua temperatura
crítica
e) na Lua, um bloco de gelo pode passar diretamente
para fase gasosa
06. (Fuvest/SP)
Quando água pura é cuidadosamente resfriada, nas
condições normais de pressão, pode permanecer no
estado líquido até temperaturas inferiores a 0°C, num
estado instável de "superfusão". Se o sistema é
perturbado, por exemplo, por vibração, parte da água
se transforma em gelo e o sistema se aquece até se
estabilizar em 0°C. O calor latente de fusão da água é L
= 80 cal/g.
Considerando-se um recipiente termicamente isolado e
de capacidade térmica desprezível, contendo um litro
de água a -5,6°C, à pressão normal, determine:
a) A quantidade, em g, de gelo formada, quando o
sistema é perturbado e atinge uma situação de
equilíbrio a 0°C.
b) A temperatura final de equilíbrio do sistema e a
quantidade de gelo existente (considerando-se o
sistema inicial no estado de "superfusão" a -5,6°C), ao
colocar-se, no recipiente, um bloco metálico de
capacidade térmica C=400cal/°C, na temperatura de
91°C.
Tópico.06
Gases e Termodinâmica
TERMODINÂMICA
É o ramo da termologia que procura
estabelecer as condições de equilíbrio entre um sistema
(uma amostra de gás, por exemplo), relacionando as
quantidades de calor (Q) trocadas com a variação de
energia interna (U) e os trabalhos ( ) realizados
durante o processo.
2. TRABALHO ()
pressão constante
1. QUANTIDADE DE CALOR (Q)
Nos tópicos anteriores as trocas de calor foram
amplamente discutidas. Vamos aqui apenas relembrar
a sua convenção de sinais.
Q > 0: O sistema (gás) recebe calor;
Q < 0: O sistema (gás) perde calor;
Q = 0: O sistema (gás) não troca calor;
(TRANSFORMAÇAO ADIABÁTICA)
2. VARIAÇÃO DE ENERGIA INTERNA (U)
d V
V0
= p.V
F
V
Onde:
é o trabalho em J
P é a pressão em N/m2 (=Pa)
V é a variação de volume em m3 V = V–V0
Energia Interna (U): é o somatório das energias
cinéticas de translação, rotação e vibração das
moléculas, da energia potencial de interação molecular
e a energia dos elétrons.
OBSERVAÇÕES
Não havendo mudança de estado, a energia interna
é função exclusiva da temperatura absoluta.
1) A equação = p.V só é válida se a pressão
for constante.
U
2) Se V aumenta (expansão) V > 0 > 0
3
n.R .T
2
Onde:
T é a temperatura em Kelvin
R é a constante universal do gás ideal
(R = 0,082atm.L/mol.K = 8,31J/mol.K)
n é o nº de mols
n
massa
moléc. grama
U = U – U0
ou
Energia interna
3) Temperatura constante Energia interna
constante U = 0
4) Numa mudança de estado, a temperatura
não varia, mas a energia interna varia de
acordo com a quantidade de calor que o
sistema recebe ou perde;
5) A variação da energia interna não depende
do
processo,
depende
apenas
das
temperaturas inicial e final do processo.
F F
“O meio externo realiza
trabalho sobre o gás
(sistema)”.
OBSERVAÇÕES
2) Temperatura diminui
diminui U < 0
“O gás (sistema) realiza
trabalho sobre o meio
externo”.
3) Se V diminui (contração) V < 0 < 0
3
U n.R . T
2
1) Temperatura aumenta Energia interna
aumenta U > 0
F
F
4) Se V constante V = 0 = 0
(TRANSFORMAÇAO ISOCÓRICA, ISOMÉTRICA
OU ISOVOLUMÉTRICA)
Como em uma transformação cíclica a temperatura
de início do ciclo é igual a temperatura final do ciclo
podemos concluir que:
3. DIAGRAMA P X V
U CICLO = 0
pressão
Da 1ª Lei da termodinâmica temos que:
N
= Área p x V
p
U
Área
CICLO
= Q CICLO - CICLO
Volume
0
V0
V
Na expansão V e > 0
Q CICLO = CICLO Na contração V e < 0
6. ESTUDO DOS GASES
a) Equação de Clapeyron
pressão
pressão
p.V=n.R.T
Área
Área
0
v0
v
Onde:
P é a pressão
V é o volume
T é a temperatura em Kelvin
R é a constante universal do gás ideal
(R=0,082atm.L/mol.K=8,31J/mol.K)
Volume
Volume
0
v0
v
A equação = p . V só é válida para p
constante, mas o cálculo do trabalho através da
área do diagrama p x V não tem restrições, ou
seja, pode ser utilizado tanto para p constante
como para p variável.
n é o nº de mols
Trabalho
Q = + U
p1.V1 p2.V2
T1
T2
7. TRANSFORMAÇÕES GASOSAS PARTICULARES
a) Isobárica
p constante
Calor (Q)
U = Q -
U
5. TRANSFORMAÇÕES CÍCLICAS
P
V variável
0
T variável
U 0
L.G.G.P. :
V 1
V
2
T1
T2
N
CICLO = Área
B
C
CICLO >
Área CICLO
A
CICLO
D
V
0
<0
1ª Lei da termodinâmica: U = Q -
OBSERVAÇÃO
Qp = m.cP. onde cP é o calor
específico a pressão constante.
Como
massa
moléc. grama
b) Lei Geral do Gás Perfeito (L.G.G.P)
4. PRIMEIRA LEI DA TERMODINÂMICA
Representa o princípio da conservação da
energia para sistemas termodinâmicos.
n
n
m
m n .M
M
QP = n.M.cP.
Calor Molar a pressão
= M.cP, e então:
daí temos que:
M.cP é o
constante(CP) CP
onde
Gráficos
Gráficos
Gráfico p x V
Gráfico p x V
Gráfico V x T
V
V
T ( ºC ou K)
0
0
P
P
V
P
Gráfico p x T
T ( ºC ou K)
0
0
Gráfico p x T
Gráfico V x T
V
V
0
T(K)
- 273
0
p
p
T ( ºC )
0
T(K)
- 273
T ( ºC )
0
c) Isotérmica
b) Isocórica, Isométrica ou Isovolumétrica
T constante U = 0
V constante = 0
p variável
p variável
V variável 0
T variável U 0
1ª Lei da termodinâmica:
U = Q - como U = 0
1ª Lei da termodinâmica:
=Q
U = Q - como = 0
U = Q
Temperatura
Recebe Calor (Q > 0) Aumenta
Volume
(expansão > 0) e diminui pressão
EXPANSÃO ISOTÉRMICA.
Perde Calor (Q < 0) Diminui Temperatura (U <
0) e pressão.
Perde Calor (Q < 0) Diminui Volume (contração
< 0) e aumenta pressão (compressão)
CONTRAÇÃO ou COMPRESSÃO ISOTÉRMICA.
Recebe Calor (Q > 0) Aumenta
(U > 0) e pressão.
L.G.G.P. :
p
1 p2
T1 T2
L.G.G.P. :
p1 .V1 = p2 .V2
Gráficos
Gráfico p x T
OBSERVAÇÃO
Gráfico V x T
V
p
QV = m.cV. onde cP é o calor
específico a volume constante.
Como
m
m n .M
M
n
daí temos que:
Qv = n.M.cv. onde M.cP é o Calor
Cv =
Molar a volume constante(Cv)
M.cv, e então:
Qv = n.Cv.
0
T ( ºC ou K)
0
T ( ºC ou K)
Gráfico p x V
Gráfico p x V
p
p
T1 e T2 são isotermas
Adiabática
A
B
T2
T2
T1
0
T1
V
0
As curvas T1 e T2 são hipérboles equiláteras
chamadas de ISOTERMAS de temperaturas
respectivamente iguais a T1 e T2 .
T2 > T1 pois quanto maior o produto p.V, maior
a temperatura
V
OBSERVAÇÕES
1) A curva adiabática é uma curva exponencial,
caracterizada pela equação:
d) Adiabática
É uma transformação gasosa em que o gás não
troca calor com o meio externo (Q = 0). Isso ocorre em
transformações gasosas rápidas ou em sistemas
termicamente isolados.
p . V = K
Onde: coeficiente de Poisson
CP
Cv
K é uma constante;
1ª Lei da termodinâmica:
U = Q - como Q = 0
U = –
Aumenta Volume (expansão > 0) Diminui
Temperatura (U < 0) e pressão EXPANSÃO
ADIABÁTICA.
Diminui Volume (contração < 0) Aumenta
Temperatura (U > 0) e pressão (compressão).
CONTRAÇÃO ou COMPRESSÃO ADIABÁTICA.
2) Em uma transformação adiabática, entre dois
estados A e B, vale a relação:
pA . V A = pB . V B 3) Nas transformações isotérmicas = 1 e a curva é
uma hipérbole.
4) CP –
C P > CV .
CV = R
é a Relação de Mayer onde
EXERCÍCIOS PROPOSTOS
1. Um sistema gasoso passa de um estado A para um
outro estado B. Nesse processo, ele troca calor e
trabalho com a sua vizinhança. Adote 1cal=4J e calcule
a variação da energia interna do sistema nos seguintes
casos:
a) O sistema absorve 2000 calorias de calor e realiza
um trabalho de 3000J.
b) O sistema absorve 2000 calorias de calor e um
trabalho de 3000J é realizado sobre ele.
c) O sistema cede 2000 calorias de calor e um trabalho
de 3000J é realizado sobre ele.
2. (UFPE/PE)
Um gás ideal realiza o processo ABC indicado no
diagrama PV, abaixo. Na transformação isotérmica BC,
onde a temperatura permanece constante, o gás
absorve 1,4×105 J de calor. Qual o trabalho total
realizado pelo gás, em joules, durante a transformação
ABC?
à presença de um êmbolo que pode deslizar sem atrito,
como mostra a figura a seguir.
3. Um gás sofre a transformação cíclica ABCA, indicada
no gráfico a seguir.
Calcule a quantidade de calor fornecida pela fonte, em
um segundo, para que a temperatura do gás não se
altere. Considere g=10m/s2 e que êmbolo, de massa
igual a 2kg, movimenta-se verticalmente para cima,
com velocidade constante e igual a 0,4m/s.
6. (Unicamp/SP)
Um mol de gás ideal sofre transformação ABC indicada
no diafragma pressão x volume da figura a seguir.
A variação da energia interna e o trabalho realizado
pelo gás, valem, respectivamente:
a) 0 J e 0 J
b) 0 J e 8,0 x 102 J
c) 0,5 x 102 J e 1,5 x 103 J
d) 8,0 x 102 J e 0 J
e) 8,5 x 102 J e 8,0 x 102 J
4. O gráfico representa uma transformação AB sofrida
por 1,0 mol de um gás ideal.
p (104N/m2)
3
2
0
200
400
V (L)
Sendo a constante universal do gás ideal 8,3J/mol.K,
determine:
a) as temperaturas do gás nos estados A e B;
b) as energias internas dos estados A e B;
c) a variação da energia interna na transformação AB;
d) o trabalho realizado na transformação AB;
e) a quantidade de calor trocada com o meio externo
durante a transformação AB.
5. (UFG/GO)
Um recipiente, em contato com uma fonte térmica,
contém um gás ideal, confinado em seu interior devido
a) qual é a temperatura do gás no estado A?
b) Qual é o trabalho realizado pelo gás na expansão
AB?
c) qual é a temperatura pelo gás no estado C?
Dado: R (constante dos gases) = 0,082 atm.L/mol.K =
8,3J/mol K
7. (UFMG/MG)
Como conseqüência da compressão adiabática sofrida
por um gás, pode-se afirmar que
a) a densidade do gás aumenta, e sua temperatura
diminui.
b) a densidade do gás e sua temperatura diminuem.
c) a densidade do gás aumenta, e sua temperatura
permanece constante.
d) a densidade do gás e sua temperatura aumentam.
e) a densidade do gás e sua temperatura permanecem
constantes.
8. (UEL/PR)
Considere
as
proposições
a
seguir
sobre
transformações gasosas.
I. Numa expansão isotérmica de um gás perfeito, sua
pressão aumenta.
II. Numa compressão isobárica de um gás perfeito, sua
temperatura absoluta aumenta.
III. Numa expansão adiabática de um gás perfeito, sua
temperatura absoluta diminui.
Pode-se afirmar que apenas
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
9. (Mackenzie/SP)
Com relação às transformações sofridas por um gás
perfeito, assinale a alternativa INCORRETA.
a) Na transformação adiabática, a variação de energia
cinética das moléculas é nula
b) Na transformação isobárica, não há variação da
pressão do gás.
c) Na transformação isotérmica, a energia cinética
média das moléculas não se altera.
d) Na transformação adiabática, não há troca de calor
com o meio exterior.
e) Na transformação isotérmica, há troca de calor com
o meio exterior.
10. (UFMG/MG)
O gráfico da pressão p em função do volume V de um
gás ideal representa uma transformação cíclica ocorrida
em três fases. Inicia-se o ciclo por uma transformação
isobárica,
seguida
de
uma
transformação
isovolumétrica e finalmente, de uma transformação
isotérmica.
Com base nesses dados pode-se afirmar que
a) o trabalho realizado na transformação isotérmica é
calculado pela expressão p3(V1-V3).
b) o trabalho realizado pelo gás é nulo durante a
transformação isotérmica.
c) o trabalho realizado pelo gás na transformação
isotérmica é igual ao calor que esse gás absorve.
d) o trabalho realizado sobre o gás durante a
transformação isovolumétrica é o mesmo que na
transformação isobárica.
e) o trabalho realizado sobre o gás, na transformação
isovolumétrica, é maior do que o trabalho realizado
pelo gás na transformação isotérmica.
11. (UnB/DF)
O calor, uma das mais importantes formas conhecidas
de energia, pode ser aproveitado de diversas maneiras:
no aquecimento de ambientes ou de água; em usinas
térmicas, para a geração de energia elétrica; nas
locomotivas a vapor, para o transporte de passageiros
e de carga; etc. Assim, devido à grande importância da
energia calorífica, desenvolveram-se diversos sistemas
que possibilitam a sua utilização. O diagrama adiante
representa um desses sistemas.
Considere que, na passagem do estado A para o estado
B, segundo a trajetória ACB, esse sistema receba 40
kcal de calor e realize 15kcal de trabalho, e julgue os
seguintes itens.
(1) Se, na passagem do estado A para o estado B, o
caminho seguido for ADB e o trabalho realizado for
igual a 5kcal, a quantidade de calor recebida pelo
sistema será igual a 30kcal.
(2) Se, na passagem do estado B para o estado A, ao
longo da curva BA, o sistema realizar 10kcal de
trabalho, então ele liberará 35kcal de calor.
(3) Se a energia interna, no estado A, é igual a zero e,
no estado D, igual a 20kcal, então o calor absorvido
pelo sistema, no processo DB, é igual a 5kcal.
(4) Os trabalhos realizados pelo sistema nos trajetos
ACBA e ADBA são iguais.
(5) O funcionamento dos pistões (êmbolos) de uma
locomotiva
a
vapor
baseia-se
em
sucessivas
transformações dos tipos AC e CA.
12. (UFRJ/RJ)
A figura representa, num gráfico pressão × volume, um
ciclo de um gás ideal.
a) Calcule o trabalho realizado pelo gás durante este
ciclo.
b) Calcule a razão entre a mais alta e a mais baixa
temperatura do gás (em kelvin) durante este ciclo.
13. (Fuvest/SP)
Um cilindro contém uma certa massa M0 de um gás a T0
= 7 ºC (280 K) e pressão P0. Ele possui uma válvula de
segurança que impede a pressão interna de alcançar
valores superiores a P0. Se essa pressão ultrapassar P0,
parte do gás é liberada para o ambiente. Ao ser
aquecido até T = 77 ºC (350 K), a válvula do cilindro
libera parte do gás, mantendo a pressão interna no
valor P0. No final do aquecimento, a massa de gás que
permanece no cilindro é, aproximadamente, de:
a) 1,0 M0
b) 0,8 M0
c) 0,7 M0
d) 0,5 M0
e) 0,1 M0
14. (UFG/GO)
Uma caixa térmica rígida e hermeticamente fechada
contém um mol de ar a 27 ºC e 1 atm. Se 100 g de
mercúrio a 327 ºC forem injetados na caixa, calcule a
pressão e a temperatura do ar após o equilíbrio térmico
ter sido atingido. Despreze a capacidade térmica da
caixa e a variação de volume do ar com a injeção do
mercúrio. (Dados: calor molar do ar a volume
constante = 21 J/mol K; calor específico do mercúrio
líquido = 0,14 J/g K.)
15. (UFG/GO/2007)
Transformações termodinâmicas, realizadas sobre um
gás de número de mols constante que obedece à lei
geral dos gases ideais, são mostradas na figura abaixo.
5) 8J
2
6) a) 293 K; b) 6,1.10 J; c)293 K.
7) D
8) C
9) A
10) C
11) CCCEE
12) a) 1,0 × 10
-7
J; b) TB /TD = 4,5.
13) B
As transformações I, II e III são, respectivamente,
a) adiabática, isobárica e isotérmica.
b) isobárica, adiabática e isotérmica.
c) isotérmica, isobárica e adiabática.
d) adiabática, isotérmica e isobárica.
e) isotérmica, adiabática e isobárica.
16. (UFG/GO/2007)
A figura abaixo mostra o comportamento de n mols de
um gás ideal numa expansão adiabática AB entre as
isotermas TA e TB. Dado:
CP 5
CV 3
Com base no gráfico, calcule:
a) A pressão pB.
b) A temperatura TB.
GABARITO
TÓPICO.05.DIAGRAMA.DE.FASES
1) b;
2) d;
3) a;
4) a) 20min; b) 60min; c) 1200m;
5) c;
6) a) 70g; b) 22ºC; massa de gelo nula.
TÓPICO.06.GASES.E.TERMODINÂMICA
1)
5
2) 2,4.10 J
3) B;
4)
14) 147ºC e 1,4atm
15) A
16)












