1
UNIVERSIDADE VALE DO RIO DOCE
FACULDADE DE CIÊNCIAS DA SAÚDE
MESTRADO EM CIÊNCIAS BIOLÓGICAS
Tatiane Figueiredo de Morais Papini
VARIAÇÕES
NA
NUCLEOTIDASES
TEMPERATURA
E
SUAS
E
AÇÕES
CONSEQUÊNCIAS
DE
INIBIDORES
DE
NA
HIDRÓLISE
DE
NUCLEOTÍDEOS POR PROMASTIGOTAS Leishmania infantum chagasi.
Governador Valadares
2011
2
TATIANE FIGUEIREDO DE MORAIS PAPINI
VARIAÇÕES
NA
NUCLEOTIDASES
TEMPERATURA
E
SUAS
E
AÇÕES
CONSEQUÊNCIAS
DE
INIBIDORES
DE
NA
HIDRÓLISE
DE
NUCLEOTÍDEOS POR PROMASTIGOTAS Leishmania infantum chagasi
Dissertação
Programa
de
de
mestrado
apresentada
Pós-Graduação
em
ao
Ciências
Biológicas da Faculdade de Ciências da Saúde
da Univale, como requisito parcial para a
obtenção do título de Mestre em Ciências
Biológicas.
Área
de
Concentração:
Imunopatologia das doenças infectocontagiosas.
Linha de Pesquisa: Protozoologia de Parasitos.
Orientadora: Drª. Gulnara Patrícia Borja Cabrera
Co-orientador: Dr. Luís Carlos Crocco Afonso
Co-orientador: Dr. Eduardo de Almeida
Marques-da-Silva
Governador Valadares
2011
3
Ficha catalográfica elaborada pela “Biblioteca Dr. Geraldo Vianna Cruz” UNIVALE
Papini, Tatiane Figueiredo de Morais
Variações na temperatura e ações de inibidores de
nucleotidases e suas conseqüências na hidrólise de nucleotídeos
por promastigotas Leishmania infantum chagasi / Tatiane Figueiredo
de Morais Papini. -- 2011.
53 f.
Dissertação (mestrado) -- Universidade Vale do Rio Doce,
Programa de Pós-Graduação Stricto Sensu em Ciências Biológicas,
Governador Valadares, MG, 2011.
Orientadora: Gulnara Patrícia Borja Cabrera
1. Leishmaniose. 2. Epidemiologia. 3. Ectonucleotidases. I.
Borja-Cabrera, Gulnara Patrícia. II. Universidade Vale do Rio Doce.
III. Título.
CDD 614.534
4
TATIANE FIGUEIREDO DE MORAIS PAPINI
VARIAÇÕES
NA
NUCLEOTIDASES
TEMPERATURA
E
SUAS
E
AÇÕES
CONSEQUÊNCIAS
DE
INIBIDORES
DE
NA
HIDRÓLISE
DE
NUCLEOTÍDEOS POR PROMASTIGOTAS Leishmania infantum chagasi
Dissertação
de
mestrado
apresentada
ao
Programa de Pós-Graduação em Ciências
Biológicas da Faculdade de Ciências da Saúde
da Univale, como requisito parcial para a
obtenção do título de Mestre em Ciências
Biológicas.
Área
Imunopatologia
infectocontagiosas.
de
Concentração:
das
doenças
Linha
de
Protozoologia de Parasitos.
Governador Valadares, ___ de ____________ de _____.
Banca Examinadora:
______________________________________________________
Nilton Barnabé Rodrigues
__________________________________________
Ricardo Gonçalves
_______________________________________
Orientadora: Drª: Gulnara Patrícia Borja Cabrera
_________________________________________
Co-orientador: Dr. Luis Carlos Crocco Afonso
Pesquisa:
5
AGRADECIMENTOS
Agradeço a Deus por não ter me deixado desistir perante as dificuldades
encontradas no caminho.
Agradeço a minha linda família, meu filhote Davi, meu esposo Helinho, que
compreenderam minha ausência. A minha mãe que abriu mão de sua vida para que
eu pudesse terminar a pesquisa, e ao meu irmão, pelo apoio.
Agradeço a Marlucy, pelo apoio, dedicação e companhia nesta difícil batalha, pois
sem ela, seria impossível vencê-la; a professora Lucinha, por ter acreditado no meu
trabalho, já que para muitos, ele já estava perdido; ao Eduardo, que mostrou que eu
estava no caminho certo; ao Luis, pelos seus conhecimentos, e pela disponibilidade.
À querida Gulnara, agradeço pela orientação, amizade, que mesmo naqueles
momentos difíceis, estampa no rosto um lindo sorriso, mostrando que a minha
dificuldade em executar o trabalho, não é nada frente aos outros problemas da vida.
Aos técnicos do laboratório de Imunologia da Univale, Lilia, Wallace e Fátima, pela
ajuda técnica e, principalmente, pelas palavras de apoio.
Aos alunos de Iniciação Científica do Nupeb, da Universidade Federal de Ouro
Preto, que foram decisivos na etapa inicial da minha aprendizagem.
E por último, mas não menos importante, à minha amiga Vanessa, companheira de
estrada, de república, e principalmente, por estar do meu lado, não me deixando
fraquejar, quando minha vontade era dizer o que muitos queriam escutar: eu desisto!
6
RESUMO
Parasitos do gênero Leishmania possuem na sua superfície enzimas denominadas
ectonucleotidases que são importantes para o metabolismo de nucleotídeos
purínicos e pirimidínicos. Nesta família de enzimas destaca-se a NTPDase,
importante para a hidrólise do ATP a ADP e deste a AMP e a 5’-nucleotidase
responsável pela etapa final da degradação do ATP, ou seja, a formação adenosina.
Estas enzimas são prováveis fatores de virulência destes parasitos já que com a
hidrólise do ATP, e conseqüente formação da adenosina, ocorre modulação da
reposta inflamatória. Além do mais, Leishmania não realiza a síntese de novo de
purinas, necessitando captá-la do meio extracelular. Visto isto, o presente trabalho
teve como objetivo determinar a atividade enzimática em Leishmania infantum
chagasi nas temperaturas de 30ºC ou 34ºC e sob influência da suramina e/ou
molibdato de amônio, sendo o primeiro inibidor da NTPDase, e o segundo, da 5’nucleotidase e fosfatoases ácidas. A determinação da atividade enzimática foi
mensurada pela dosagem de fosfato inorgânico liberado. Os resultados obtidos
mostraram que a hidrólise do ATP, ADP ou AMP foi maior na temperatura de 34ºC e
que a cepa do parasito utilizada, hidrolisa, preferencialmente, o ADP. A suramina
não foi capaz de inibir a hidrólise de ATP em ambas as temperaturas. Já o molibdato
de amônio inibiu a hidrólise do ADP e AMP na temperatura de 30ºC e apenas do
AMP na temperatura de 34ºC. Estes dados sugerem que em L.infantum chagasi a
apirase, possívelmente, é uma isoforma diferente das encontradas em outras
espécies ou que a hidrólise de nucleotídeos seja devido a fosfatases ácidas.
Palavras-chave: Fatores de virulência. Ectonucleotidases
7
ABSTRACT
Parasites of the genus Leishmania have on their surface enzymes called
ectonucleotidases that are important for the metabolism of purine nucleotides and
pyrimidine. In this family of enzymes there is the NTPDase, important for the
hydrolysis of ATP and ADP of AMP and 5'-nucleotidase responsible for the final
stage of degradation of ATP, or adenosine formation. These enzymes are probable
virulence factors such as parasites with the ATP hydrolysis, and consequently the
formation of adenosine is the modulation of inflammatory response. Moreover,
Leishmania doesn’t perform de novo synthesis of purines, needing to capture it from
the extracellular medium. Given this, the present study aimed to determine the
enzyme in Leishmania infantum chagasi in temperatures of 30ºC or 34°C and under
the influence of suramin and/ or ammonium molybdate, the first inhibitor of NTPDase,
and second, the 5'-nucleotidase fosfatoases and acidic. The determination of enzyme
activity was measured by measuring inorganic phosphate released. The results
showed that the hydrolysis of ATP, ADP or AMP was higher at 34°C and the parasite
strain used, hydrolyzes, preferably, the ADP. The suramin was not able to inhibit ATP
hydrolysis at both temperatures. Since the ammonium molybdate inhibited the
hydrolysis of ADP and AMP at 30ºC and only AMP in 34°C. These data suggest that
in the apyrase L.infantum chagasi, arguably, is an isoform different from those found
in other species or that nucleotide hydrolysis is due to acid phosphatase.
Keywords: Virulence factors. Ectonucleotidases
8
LISTA DE FIGURAS
Figura 1-
Ciclo Biológico da Leishmania infantum chagasi ...................................13
Figura 2-
Topografia de membrana e propriedades catalíticas dos membros da
Família das E-NTPDases .......................................................................18
Figura 3-
Modelo molecular da 5’-nucleotidase e seus derivados solúveis..........19
Figura 4-
Metabolismo
dos
nucleotídeos
purínicos
e
pirimidínicos
pelas
Ectoenzimas ...........................................................................................20
Figura 5-
Modelo topológico de receptores de vias de sinalização purinérgica
................................................................................................................22
Figura 6-
Família de receptores P2X e P2Y com as respectivas vias de
sinalização...............................................................................................22
Figura 7-
Medida da atividade ectonucleotidásica da cepa M2682 de L. infantum
chagasi realizada com promastigotas totais na temperatura de 30ºC ou
34ºC .......................................................................................................32
Figura 8-
Relação entre a hidrólise de nucleotídeos tri, difosfatados em L. infantum
chagasi ...................................................................................................33
Figura 9-
Efeito da suramina na atividade enzimática de promastigotas totais de
L. infantum chagasi na temperatura de 30ºC.........................................34
Figura 10- Efeito da suramina na atividade enzimática de promastigotas totais de L.
infantum chagasi na temperatura de 34ºC .............................................34
Figura 11- Efeito da suramina na atividade enzimática de promastigotas totais de L.
amazonensis cepa PH8 na temperatura de 30ºC .................................35
Figura 12- Efeito da suramina na atividade enzimática de promastigotas totais de L.
amazonensis cepa PH8 na temperatura de 34ºC ..................................35
Figura 13- Efeito do bloqueio da 5’- nucleotidase na atividade enzimática de
promastigotas totais de L. infantum chagasi a 30ºC.............................36
Figura 14- Efeito do bloqueio da 5’- nucleotidase na atividade enzimática de
promastigotas totais de L. infantum chagasi a 34ºC...............................37
9
LISTA DE SIGLAS
AMP- Monofosfato de adenosina A
AMPc- AMP cíclico
Ado- Adenosina
ADP- Difosfato de adenosina
ATP- Trifosfato de adenosina
CD39- E-NTPDase
CD73- 5’-nucleotidase
DCs- Células dendríticas
iNOS- Óxido nítrico sintase induzida
NO- Óxido nítrico
TCD4+- Linfócitos T que expressam a molécula CD4+
TCD8+- Linfócitos T que expressam a molécula CD8+
TNF-α- Fator de Necrose Tumoral
Treg- Células t reguladoras
10
SUMÁRIO
1 INTRODUÇÃO........................................................................................................11
2 REVISÃO LITERÁRIA............................................................................................13
3 OBJETIVOS ...........................................................................................................28
3.1OBJETIVO GERAL................................................................................................28
3.2 OBJETIVOS ESPECÍFICOS................................................................................28
4 JUSTIFICATIVA......................................................................................................29
5 MATERIAL E MÉTODOS.......................................................................................30
5.1 DELINEAMENTO EXPERIMENTAL....................................................................30
5.1.1 Ensaio de atividade enzimática.....................................................................30
5.2 PREPARO DO PARASITO..................................................................................31
5.3 ENSAIO DE ATIVIDADE ENZIMÁTICA...............................................................31
5.4 ANÁLISE ESTATÍSTICA......................................................................................32
6 RESULTADOS.......................................................................................................33
7 DISCUSSÃO...........................................................................................................39
8 CONCLUSÃO.........................................................................................................45
REFERÊNCIAS..........................................................................................................46
11
1 INTRODUÇÃO
As leishmanioses são doenças que acometem milhares de pessoas no
mundo, principalmente em países em desenvolvimento. Essas doenças apresentamse sob diversas formas clínicas, sendo a Leishmaniose visceral (LV), a forma mais
grave, devido à elevada morbidade e mortalidade (AWASTHI et al., 2004).
Entender a interação parasito/hospedeiro é de grande relevância, pois a
compreensão dos mecanismos envolvidos pode estimular o desenvolvimento de
novas drogas para o tratamento da doença, ou então prevenir, com o uso de
vacinas.
Os parasitos, para conseguirem escapar das defesas do hospedeiro, e
consequentemente, sobreviverem, desenvolveram mecanismos de defesa que,
muitas vezes, estão relacionados com moléculas presentes na superfície do
parasito. Dentre essas moléculas, pode-se citar o lipofosglicano (LPG) e
glicoproteína (gp63) (RITTIG; BOGDAN, 2000), que induzem a fagocitose e a
sobrevivência das amastigotas no interior dos fagócitos (MOSSER et al.,1992).
Outras moléculas que podem estar envolvidas na infecciosidade dos parasitos
são as ectonucleotidases (MEYER-FERNANDES, 2002), uma família de enzimas
responsáveis pela hidrólise de nucleotídeos purínicos e pirimidínicos (ZIMERMANN,
2002). Essas enzimas, ao agirem em nucleotídeos tri-, di- e monofosfatados, com
diferentes afinidades, aumentam a concentração de adenosina (Ado) no meio
extracelular, que exerce importante ação imunomoduladora, que é fundamental para
a sobrevivência do parasito (BOURS, 2006).
Protozoários
como
Toxoplasma
gondii
(BERMUDES
et
al.,
1994),
Trichomonas foetus (JESUS et al., 2002), Leishmania tropica (MEYER-FERNANDES
et al., 1997) e Leishmania amazonensis (BERRÊDO-PINHO et al., 2001) possuem,
na
sua
superfície,
as
ectoenzimas.
Alguns
membros
da
família
das
ectonucleotidases podem ser inibidos por substancias como a suramina, um
bloqueador das E-ATPases, pertencentes à família das ectoenzimas e importantes
para a hidrólise de ATP e ADP (BERREDO-PINHO e cols., 2001; LAMBRECHET,
2000) ou molibdato de amônio, um potente inibidor de ecto-5’-nucleotidase que age
12
em nucleotídeos monofosfatados 5’purínicos e pirimidínicos (DUTRA et al., 2000), e
importantes para a etapa final da hidrólise de ATP, com formação de adenosina, que
além da ação moduladora já referida, é importante para a Leishmania, já que ela não
realiza a “síntese de novo de purinas” (GHOSH , MUKHERJEE, 2000; MARR et al.,
1978)
Perez-Sampaio et al., (2008) verificaram que a atividade ectonucleotidásica,
de L. amazonensis, eleva-se com o aumento da expressão de proteínas
denominadas Proteínas do Choque Térmico (Hsps), cuja atividade aumenta com a
elevação da temperatura. Esta associação, ao que tudo indica, é benéfica para o
parasito, já que as Hsps possuem propriedades imunomoduladoras (BORGES et al.,
2010).
Portanto, investigar os mecanismos de interação dos parasitos com os seus
hospedeiros é de grande relevância para se desenvolverem alternativas terapêuticas
para prevenir ou controlar a infecção.
Como existem poucos estudos relacionados à atividade ectonucleotidásica
em promastigotas de Leishmania infantum chagasi, o presente trabalho teve como
objetivo verificar a ação da temperatura sobre a atividade dessas enzimas. Para
tanto, foram utilizadas as temperaturas de 30°C ou 34°C, já que, durante o ciclo
biológico, o protozoário sofre um choque térmico passando de uma temperatura
mais baixa, cerca de 22°C, no invertebrado, a 35°C, no mamífero (ZILBERSTEIN &
SHAPIRA, 1994).
13
2 REVISÃO LITERÁRIA
As leishmanioses são um conjunto de doenças que afetam milhares de
pessoas em todo mundo, principalmente em países subdesenvolvidos (SILVA et al.,
2005). Tais doenças podem ser clinicamente divididas em leishmaniose cutânea,
cutaneomucosa e visceral (kala azar), sendo que as manifestações variam de
acordo com as características do hospedeiro e da espécie envolvida (AWASTHI et
al., 2004 ; SAHA et al., 2006).
O perfil epidemiológico das leishmanioses tem alterado nos últimos anos, pois
esta zoonose tem acometido pessoas de áreas urbanas, que eram infectadas
apenas quando penetravam em florestas, o que caracteriza um estado de
urbanização das diferentes formas das doenças. Por outro lado, a maior incidência
de casos graves, nas últimas décadas, pode ser explicada pelo fato das
leishmanioses serem consideradas doenças oportunistas em indivíduos infectados
pelo Vírus da Imunodeficiência Humana (HIV). No Brasil, a Leishmaniose Visceral
(LV), considerada a forma mais grave da doença, atinge 19 estados, sendo a região
nordeste a de maior incidência, mas as outras regiões (norte, centro-oeste e
sudeste) também apresentam casos (BRASIL, 2002).
A Leishmania donovani e a Leishmania infantum chagasi são agentes
etiológicos da leishmaniose visceral, no Velho e no Novo Mundo, respectivamente
(THALHOFER et al., 2010). Estes parasitos apresentam, no seu ciclo de vida, dois
hospedeiros: o vetor, fêmea do inseto hematófago Lutzomyia longipalpis (Novo
Mundo) e Phlebotomus (Velho Mundo), e os mamíferos, incluindo o homem
(COURRET et al., 2002). Estes parasitos, unicelulares, pertencem à ordem
Kinetoplastida, família Trypanosomatidae e ao gênero Leishmania (RIBEIRO-DEJESUS et al.,1998; SAHA et al., 2006). Morfologicamente, a L. infantum chagasi
pode ser classificada como forma promastigota flagelada, presente no trato
gastrintestinal do inseto hematófago (vetor) e a forma amastigota, imóvel, que vive
dentro dos fagolisossomos presentes no interior dos macrófagos dos hospedeiros
mamíferos, onde vive e se multiplica, já que consegue resistir ao baixo pH (entre 4,5
e 6) presente no interior de tal estrutura (ANTOINE et al., 1990).
14
O vetor, durante o repasto sanguíneo (Figura 1), dilacera a pele do mamífero
levando à formação de uma poça de sangue. Se o hospedeiro vertebrado estiver
infectado com Leishmania, ocorrerá ingestão de formas amastigotas pelo vetor,
dando início ao ciclo de vida destes parasitos. No intestino do inseto, as amastigotas
transformam-se
em
formas
alongadas,
com
mobilidade,
denominadas
promastigotas, que se multiplicam por fissão binária. No interior do hospedeiro
invertebrado, as formas promastigotas procíclicas (não infectantes) se diferenciam
em promastigotas metacíclicas (formas infectantes), que se localizam na porção
anterior do intestino, onde ficam até serem regurgitadas pelo inseto durante nova
tentativa de alimentação. Em um segundo repasto sanguíneo do vetor, este deposita
os parasitos na poça de sangue, dando início à infecção no mamífero, que começa
na pele e se dissemina pelo organismo por um mecanismo, até o momento,
desconhecido. Os parasitos são inicialmente fagocitados por neutrófilos no sítio da
inoculação (THALHOFER et al., 2010) e posteriormente fagocitados por macrófagos.
No interior dos fagócitos, as formas promastigotas são convertidas em amastigotas,
onde se reproduzem. Os macrófagos, repletos de amastigotas, podem se romper,
liberando os parasitos que podem infectar novas células, principalmente os fagócitos
presentes no baço, fígado e medula óssea e/ou serem capturadas pelo vetor,
quando este for se alimentar novamente, dando continuidade ao ciclo de vida do
parasito (AWASTHI et al., 2004; RITTIG; BOGDAN, 2006; SAHA et al., 2006).
Figura 1: Ciclo Biológico da leishmaniose (SACKS & NOBEN-TRAUTH, 2002)
15
Na leishmaniose visceral, o período de incubação pode variar de dez dias a
um ano, sendo que a infecção pode ser assintomática ou não. Inicialmente ocorre
febre baixa e mal-estar e, independente da forma clínica, ocorre hiperplasia do
sistema fagocítico mononuclear de órgãos acometidos como fígado, baço, intestino,
medula óssea devido ao acúmulo de fagócitos mononucleares, linfócitos e células
plasmáticas. A hematopoiese, inicialmente é normal, mas com o passar do tempo,
ela se torna reduzida, causando granulocitopenia e anemia; ocorre também,
diminuição da protrombina produzida pelo fígado, e esta, juntamente com a
trombocitopenia, pode gerar quadros graves de hemorragia. Além do mais, pode
ocorrer edema decorrente da hipoalbuminemia, diarréia devido ao aumento do
parasitismo intestinal ou enterite (MALLA & MAHAJAN, 2006). Portanto, caso não
receba tratamento adequado e em tempo hábil, o paciente pode vir a óbito
decorrente da própria doença ou por infecções como pneumonia, tuberculose que
são favorecidas pelo quadro imunodeprimido do indivíduo (BRASIL, 2006).
Alguns indivíduos, especialmente aqueles infectados com L. donovani,
apresentam leishmaniose dérmica pós-calazar (LPDK) após tratamento para
leishmaniose visceral. Esta manifestação pode ocorrer de 6 meses a 5 anos após
cura clínica do calazar, e caracteriza-se por aparecimento de lesões com áreas
hipopigmentadas, pápulas ou nódulos principalmente na face, troncos e membros
(AWASTHI et al., 2004; MALLA & MAHAJAN, 2006).
Em relação ao tratamento da leishmaniose visceral, este pode ser dividido em
tratamento específico e de suporte. O primeiro refere-se ao uso de fármacos como
antimoniais pentavalentes (Sb5+), com comprovada eficácia terapêutica e fármaco de
primeira escolha na maioria dos países. Porém, estes fármacos são responsáveis
por graves reações adversas como artralgias, mialgias, dor abdominal, arritmias
cardíacas graves, hepatotoxicidade, nefrotoxicidade e pancreatite. Outro fármaco
utilizado é a anfotericina B, considerado o melhor fármaco leishmanicida disponível
na atualidade. Seu uso é indicado aos pacientes que não respondem ao tratamento
convencional ou que apresentam alguma contra-indicação ao uso dos antimoniais,
além de ser o único fármaco que pode ser usado pelas gestantes. A anfotericina B
apresenta-se na forma de desoxicolato de anfotericina B e anfotericina B lipossomal,
cuja vantagem da última em relação à primeira, deve-se a menor toxicidade. A
anfotericina B lipossomal é o fármaco de primeira escolha em pacientes com
16
leishmaniose visceral grave (idade inferior a 6 meses de idade ou maior que 65
anos, desnutrição grave, co-morbidades como infecções bacterianas, icterícia,
edema generalizado e sinais de toxemia como letargia, cianose, taquicardia ou
bradicardia, hipoventilação ou hiperventilação e alterações hemodinâmicas). Já o
tratamento de suporte, deve ser utilizado nos pacientes mais graves e
hospitalizados, o qual inclui medidas de hidratação, dieta, antitérmicos, suporte
hemoterápicos (concentrado de hemácias, plaquetas e plasma fresco congelado e
antimicrobianos, se necessário (BRASIL, 2006).
Compreender a interação parasita/ hospedeiro é de extrema importância na
leishmaniose, já que essa influencia as manifestações clínicas e o controle da
doença. Em camundongos C57BL/6, infectados com Leishmania major, observou-se
que os camundongos são resistentes e que tal característica deve-se à indução de
resposta imunológica do tipo Th1, com produção de citocinas como a interleucina 2
(IL-2), fator de necrose tumoral-alfa (TNF-α) e IFN-γ, que levam a eliminação do
parasito, principalmente pelo aumento da produção do óxido nítrico e de radicais de
oxigênio (ROS) pelos fagócitos. Em contrapartida, camundongos BALB/c são
suscetíveis a infecção por L. major, já que desenvolvem uma resposta precoce do
tipo Th2 com produção de interlerleucina-4 (IL-4) e interleucina-10 (IL-10) (AWASTHI
et al., 2004; SACKS; NOBEN-TRAUTH, 2002). Porém, esta distinção clara, no perfil
imunológico, não está bem definida em humanos, pois segundo Castelhano et al.,
(2009), em indivíduos com infecção ativa na leishmaniose cutânea, há uma mistura
de resposta Th1/Th2 com produção de citocinas como TNF-α, IFN-γ, IL-4 e IL-10 e
em indivíduos curados, altos níveis de IFN-γ, sugerindo, assim, que este predomínio
de resposta Th1 é importante para o controle da infecção e cura das lesões,
enquanto a presença concomitante de citocinas IL-4 e IL-10 é importante para a
sobrevivência do parasita e persistência da lesão.
Em infecções por L. infantum chagasi não existe uma distinção entre resposta
Th1/Th2, ou seja, há uma mistura das duas. Em indivíduos com a doença ativa,
observa-se que há uma redução na resposta Th1, com diminuição dos níveis de
IFN-γ. Portanto, a diminuição da resposta imune celular está diretamente
relacionada com a suscetibilidade à infecção e a progressão da imunopatologia da
leishmaniose visceral. Tal redução deve-se a ação moduladora de IL-10, que
provavelmente inibe a produção de IL-12, produzida por macrófagos e células
dendríticas. Além do mais, linfócitos Th2 produzem citocinas, como a IL-4, que
17
inibem a ação dos macrófagos e a produção de óxido nítrico (substância
microbicida) e ainda estimulam linfócitos B policlonais. Já na doença estabelecida,
ocorre um quadro de anergia, que pode ser explicado pela deficiência na
apresentação de antígenos aos linfócitos T, indução de IL-10 e IL-4 (MALLA &
MAHAJAN, 2006).
A IL-12, ao contrário da IL-10, é importante para a produção de IFN- γ por
linfócitos T e células Natural Killer (NK). Em murinos, observou-se que o aumento da
IL-12 é um importante indutor de resposta Th1, consequentemente, de IFN- γ. Esta
citocina estimula a resposta imune inata e adaptativa potencializando as ações
microbicidas dos macrófagos ativados, além de estar envolvida na produção de
TNF-α e interleucina 1 (IL-1), que são importantes em infecções microbianas. Em
indivíduos curados, ao contrário dos indivíduos doentes com LV, observou-se a
produção de IL-12, reforçando a idéia de que a proteção do indivíduo está
relacionada com a resposta Th1. Portanto, IL-10 e IL-12 desempenham importante
papel na modulação da resposta Th1/Th2 (SAHA, 2006).
Além das ações das células Th1, Pitta et al., (2009) demonstraram que, em
indivíduos resistentes à infecção por L. donovani, há aumento da expressão das
interleucinas IL-17 (IL-17) e IL-22, quando comparados com indivíduos que
desenvolveram
a
doença.
Essas
citocinas
são
produzidas
por
células
mononucleares do sangue periférico. A IL-17, uma citocina pró-inflamatória,
produzida principalmente por células Th17, um subtipo de células TCD4+ e NK,
estimula células epiteliais e monócitos a produzirem citocinas como IL-6 e TNF. Já a
IL-22, produzida por células Th17, e, em menor quantidade por células Th1 e NK,
está envolvida na imunidade do epitélio e mucosas. Acredita-se que citocinas como
IL-6, IL-23, e IL-1β, produzidas durante a infecção por L. donovani, possam ser
importantes para a indução de células Th17. Ambas citocinas, IL-17 e IL-22,
aumentam a proteção da barreira epitelial e o recrutamento de células inflamatórias,
aumentando o efeito da imunidade inata e o recrutamento das células Th1 para o
tecido, o que é importante para a atividade microbicida dos macrófagos devido à
produção de IFN-γ. Portanto, células Th17 e Th1 possuem propriedades
complementares na proteção de indivíduos com leishmaniose visceral (PANZER et
al., 2006).
Em relação à suscetibilidade a infecção, estudos têm mostrado que a ação de
citocinas imunossupressoras, como a IL-10, é benéfica para a sobrevivência do
18
parasito e para a evolução da doença, pois inibem a atividade microbicida de
macrófagos dependentes de IFN-γ (RIBEIRO-DE-JESUS, 1998; SAHA et al., 2006).
Além das ações inibitórias da IL-10, pode-se citar a participação das células T
reguladoras (TReg), um subtipo de células TCD4+, que constitui cerca de 5 a 10% de
células T presentes no sangue periférico, as quais pode exercer sua ação inibidora
pelo contato celular ou pela liberação de citocinas como IL-10 e TGF-β (SAHA et al.,
2006).
Como foi dito anteriormente, a L. infantum chagasi, assim como outras
espécies do gênero Leishmania, infectam macrófagos de mamíferos onde
conseguem viver e se multiplicar. Esta interação parasito/hospedeiro é mediada por
componentes presentes na membrana do parasito, denominados fatores de
virulência, que contribuem para o sucesso da infecção, tais como lipofosglicano
(LPG) e glicoproteína gp63 (RITTIG; BOGDAN, 2000), que induzem a fagocitose e a
sobrevivência das amastigotas, no interior dos fagócitos (MOSSER et al.,1992).
O LPG é um lipofosfoglicano ancorado na membrana plasmática por uma
âncora de glicosil-fosfatidil-inositol, cuja estrutura é constituída por dissacarídeos
fosfatados [Gal(β1,4)Man(α1-PO4→6). Esta molécula pode ser encontrada nas
formas promastigotas e amastigotas de Leishmania, porém, sua concentração é
maior nas primeiras, sugerindo importante papel do LPG no estabelecimento da
infecção, ou seja, durante a conversão de promastigotas em amastigotas no interior
dos fagócitos (DESJARDINS & DESCOTEAUX, 1997). No hospedeiro invertebrado,
ela é importante para a conversão de formas promastigotas procíclicas (não
infectivas) em promastigotas metacíclicas (forma infectante). O LPG e a
glicoproteína
gp63,
uma
metaloproteína
presente
tanto
na
superfície
de
promastigotas quanto de amastigotas, em proporções semelhantes, podem interagir
com receptores de açúcares presentes na superfície de macrófagos, assim como
receptores do complemento CR1 e CR3, através das respectivas opsoninas C3b e
C3bi facilitando a fagocitose e o aumento da sobrevida das amastigotas. Além do
mais, o LPG de formas promastigotas metacíclicas protege o parasito da ação do
complemento por impedirem a formação do complexo de ataque a membrana
(MAC). Ambos, o LPG e gp63, agem diminuindo a síntese de óxido nítrico (NO) por
inibir a transcrição da enzima óxido nítrico sintase induzida (iNOS), uma enzima
presente em macrófagos, neutrófilos, fibroblastos, e assim, regulando a ação
“leishmanicida dos macrófagos”. O LPG inibe, também, a expressão de IL-12, que é
19
a principal citocina responsável pela indução da resposta Th1, com elevada
produção de IFN-γ (LIEW et al., 1997) e age impedindo a fusão do fagossomo com o
endossomo, protegendo, assim, o parasito das ações de enzimas hidrolíticas
(DESJARDINS & DESCOTEAUX, 1997).
Outras substâncias, que parecem estar envolvidas na infecciosidade do
parasito, são as ectonucleotidases, enzimas presentes na superfície da célula. Esta
família de enzimas é constituída pelas ATPase e a ADPase, responsáveis pelas
respectivas
hidrólises
de
ATP
e
ADP,
pela
ecto-nucleosídeo
trifosfato
difosfohidrolase (E-NTPDase) que pode hidrolisar ambos nucleotídeos 5’-tri e
difosfatados com diferentes afinidades. As E-NTPDases, são constituídas por 7
membros (NTPDase 1 a 6 e NTPDase 8) nos quais estão incluídas as apirases.
(BOURS et al., 2006; ZIMMERMANN, 2000). As apirases (CD39 em humanos) são
importantes para a hidrólise do ATP em ADP e deste a AMP, sendo esta ação
dependente de íons Ca++ e Mg++ (PLESNER, 1995; ZIMMERMANN, 2000). Todas
estas enzimas apresentam uma sequência de 5 domínios altamente conservados
(regiões conservadas da apirase), que provavelmente estão relacionados com a
atividade catalítica (Figura 2).
Figura 2: Topografia de membrana e propriedades catalíticas dos membros da Família das ENTPDases. A E-NTPDase 5 ocorre como enzima solúvel (seta). Da forma putativa (E-NTPDase 6)
apenas a estrutura primária é conhecida. A nomenclatura anteriomente utilizada está entre
parênteses (ZIMMERMANN, 2000).
As 5’- nucleotidases são uma família de enzimas que já foram observadas em
Trichomonas vaginalis (TASCA et al., 2003), Leishmania donovani (GOTTILEIB &
DWYER, 1983) além dos vertebrados (ZIMMERMANN,1992). Estas enzimas diferem
20
na especificidade ao substrato, mas todas elas agem em nucleotídeos 5’purínicos e
pirimidínicos monofosfatados, podendo também agir sobre nucleotídeos mais
complexos como 5´-nucleotídeo difosfatados e trifosfatados, UDP- glicose ou
dinucleotídeos de flavina adenina (FAD). Estas enzimas, de acordo com a sua
localização celular e propriedades cinéticas, podem se apresentar como enzimas
aderidas à membrana plasmática (ecto-5’-nucleotidase, e-N, CD73 em humanos) ou
como forma solúvel (e-Ns), sendo que as primeiras são dímeros unidos por ligações
dissulfeto e as últimas podem ser dímeros ou tetrâmeros (Figura 3). A forma solúvel
é responsável pelo controle interno de nucleotídeos 5’-monofosfatados, e a forma
aderida à membrana, pela etapa final da hidrólise do ATP a adenonina, portanto, é a
principal
responsável
pela
formação
da
adenosina
no
meio
extracelular
(ZIMMERMANN, 1992).
Figura 3: Modelo molecular da 5’-nucleotidase e seus derivados solúveis (ZIMMERMANN, 2000).
Além
dos
dois
membros
citados
anteriormente,
a
família
das
ectonucleotidases é constituída pelas ectofosfodiesterase/pirofosfatases (E-NPP1, 2
e 3). A falta de especificidade enzimática, faz com que todos os membros, desta
família de enzimas, sejam responsáveis pela hidrólise do AMP cíclico (AMPc) a
AMP, ATP a AMP e ADP a AMP. Outro representante das ectonucleotidases é a
família das fosfatases alcalina, que hidrolisam nucleotídeos tri, di e monofosfatados.
21
Estas enzimas podem ser encontradas ancoradas à membrana plasmática por um
grupamento glicosilfostatidilinositol (GPI) ou no soro, livre (ZIMMERMANN, 2000).
Além do mais, existem duas outras enzimas que são importantes para o controle de
adenosina (Ado) extracelular: a adenosina deaminase (ADA) e a adenosina quinase.
A ADA é uma enzima principalmente citosólica, mas que pode ser encontrada na
membrana plasmática (Ecto ADA) de células do sistema imune ou não. Esta enzima
é de grande importância para o metabolismo das purinas, já que é responsável pela
conversão irreversível da adenosina em inosina. A adenosina quinase é responsável
pela fosforilação da adenosina, com consequente formação de AMP no meio
intracelular regulando a concentração da Ado no meio extracelular, já que este
nucleosídeo é transportado através da membrana plasmática por diferença no
gradiente de concentração (BOURS et al., 2006).
Figura 4: Metabolismo dos nucleotídeos purínicos e pirimidínicos pelas Ectoenzimas (BOURS et al.,
2006).
Nucleotídeos extracelulares são importantes moléculas sinalizadoras que
modulam uma variedade de ações dentro do organismo, dependendo do tipo de
receptor envolvido. Dentre seus efeitos, pode-se citar a indução de agregação
plaquetária, degranulação de mastócitos, eosinófilos e neutrófilos, da produção de
22
citocinas por macrófagos e linfócitos T e auxílio na ativação e diferenciação de
linfócitos T por ação das células dendríticas (GOUNARIS & SELKIRK, 2005).
O ATP extracelular e seus metabólitos, como ADP e adenosina, agem em
receptores purinérgicos, divididos em receptores P1 e P2 (Figura 5) (BURNSTOCK,
2007). As ações da adenosina são mediadas pela sua ligação aos receptores P1,
que de acordo com suas características bioquímicas e farmacológicas podem ser
subdivididos em 4 subtipos : A1, A2a, A2b e A3. Os receptores A2a, A2b, de alta e baixa
afinidade pela adenosina, respectivamente, são acoplados à proteína Gs e agem
aumentando a concentração de cAMP no interior das células, já que estimulam a
enzima adenilato ciclase. Este efeito é importante pois, através do aumento do
cAMP, há modulação da resposta imune celular, o que evita a geração de uma
resposta imunológica exagerada, que poderia causar danos ao organismo
(JACOBSON ; GAO, 2006). O efeito modulador deve-se, principalmente, pela
inibição da produção de citocinas como IL-12, IFN-γ e TNF-α (LAPPAS et al., 2005;
HASKO et al.,2000; KRECKLER et al., 2006) e pelo estímulo à produção de IL-10
(PANTHER et al., 2003). Já os outros dois subtipos, A1 e A3, exercem efeito
contrário, pois inibem a adenilato ciclase por estimular proteína Gi, impedindo que as
células do sistema imune sejam inativadas prematuramente, o que facilitaria a
sobrevivência dos parasitos (FREDHOLM et al., 1994).
Os receptores P2 são divididos em receptores P2X e P2Y, sendo que o
primeiro é acoplado a canais iônicos (ionotrópicos) e o segundo, é um exemplo de
receptor ligado a proteína G (metabotrópicos) (Figura 5), que podem ativar a
fosfolipase C ou inibir a adenilato ciclase com diminuição de cAMP (Figura 6)
(ABBRACCHIO et al., 2006; NORTH, 2002; RALEVIC; BURNSTOCK, 1998). Os
receptores P2X são divididos em sete subtipos (P2X1-7), sendo o ligante natural o
ATP. Já os receptores P2Y são subdivididos em vários subtipos, sendo os
P2Y1,2,4,6,11,14 bem caracterizados. Estes receptores podem se ligar a purinas e
pirimidinas como ATP, ADP ou UDP com diferentes afinidades e preferência de
ligação dependendo do subtipo (GOUNARIS & SELKIRK, 2005). Os receptores P2X
estão distribuídos em várias células do organismo como plaquetas, neurônios e
células musculares (LA SALA, 2003). Dentre os diferentes subtipos de receptores
P2X, destaca-se o P2X7, presente em mastócitos, linfócitos, macrófagos e células de
Langerhans (BURNSTOCK, 2007; SURPRENANT et al., 1996), importantes para a
defesa
do
organismo
e
cujas
ações,
nestas
células,
serão
detalhadas
23
posteriormente, além de promover poros na membrana do microrganismo,
culminando com a lise celular (LA SALA, 2003).
Figura 5: Modelo topológico de receptores de vias de sinalização purinérgica. Nucleotídeos mediam
efeitos sinalizadores em uma série de receptores ionotrópicos P2X e metabotrópicos P2Y que são
classificados de acordo com sua afinidade por ATP, ADP e outros nucleotídeos alternativos e outros
nucleotídeos ligados a açúcares. A geração de adenosina age em quatro receptores específicos
(YEGUTKIN, 2008).
Figura 6: Família de receptores P2X e P2Y com as respectivas vias de sinalização (LAZAROWAKI et
al., 2003).
O ATP, no meio intracelular, exerce importante papel no metabolismo
energético, sendo que sua concentração no citoplasma está na faixa de mM, ao
passo que no espaço extracelular, em nM. O aumento da concentração extracelular
do ATP devido a uma lesão celular ou à estimulação por patógenos e pelo fato dele
ser rapidamente degrado após ser liberado, faz deste nucleotídeo um sinalizador
endógeno (BOURS et al. , 2006). O ATP informa ao sistema imunológico que algo
24
está errado, o que desencadeia o processo inflamatório e a resposta imune (LA
SALA et al., 2003; LANGSTON et al., 2003), com estímulo à liberação de lisozima,
importante para a morte de bactérias e aumento da síntese de substâncias tóxicas
pelos polimorfonucleares, como o óxido nítrico e radicais de oxigênio (Di VIRGILIO,
2007) .
Monócitos e macrófagos são células importantes para a inflamação e
resposta imunológica. Estas células possuem, em sua superfície, receptores P2X e
P2Y, cujas expressões variam de acordo com o estágio de maturação celular e com
o estímulo presente no ambiente celular. Por exemplo, quando os macrófagos
sofrem ação do IFN-γ, lipopolissacarídeo (LPS) ou TNF-α ocorre aumento na
expressão de receptores P2X7 que estimula a adesão celular ao endotélio vascular,
etapa importante para a diapedese, e para a produção de quimiocinas para
monócitos (provavelmente devido à ligação do ADP em receptores P2Y). Além do
mais, o ATP extracelular em concentrações micromolares ao se ligar em receptores
P2X7 é um importante estímulo para a produção de citocinas como IL-1α, IL-1β, IL-6,
IL-18 e TNF-α. Outro mecanismo efetor dos macrófagos, na eliminação dos
patógenos, relaciona-se à produção do óxido nítrico, que é formado a partir da ação
da enzima óxido nítrico sintase induzida (iNOS). Porém, a ação de citocinas Th2
como IL-4, IL-10 diminui a expressão de receptores P2X7 em macrófagos alveolares
de ratos. Este mecanismo modulador, na expressão de receptores purínicos, é
importante para evitar que ocorra lesão celular por intenso processo inflamatório, já
que o óxido nítrico pode provocar danos ao organismo. Além disso, os fagócitos
possuem em sua superfície, ectoenzimas como a CD39 e CD73, que são
importantes para o metabolismo dos nucleotídeos.
O ATP extracelular, ao se ligar em receptores P2Y, provavelmente o subtipo
P2Y11, estimula a resposta imune do organismo por promover a maturação das
células dendríticas (DCs). Estas células exercem importante papel na resposta
imune primária, já que são responsáveis pela apresentação dos antígenos aos
linfócitos T “naive”. As DCs liberam citocinas que estimulam a diferenciação de
linfócitos T helper em Th1 ou Th2, dependendo das citocinas produzidas. Por
exemplo, a liberação de citocinas como IL-12 por células dendríticas maduras,
estimula a diferenciação em linfócitos Th1, ao passo que, a produção de IL-10 com
diminuição de IL-12 estimula uma resposta Th2 ou ação das células T supressoras
(SCHNURR et al., 2000; WILKIN et al., 2001).
25
Os linfócitos exercem importante papel na resposta imune já que são
essenciais tanto na resposta humoral (linfócito B) quanto celular (linfócito T). A
imunidade humoral é importante para patógenos extracelulares e suas toxinas, e a
celular, para intracelulares. Os linfócitos T podem ser divididos em TCD4+ e TCD8+
sendo que os primeiros exercem papel central no sistema imunológico, pois
estimulam mecanismos da imunidade inata, contribuem para a produção de
anticorpos através da estimulação de linfócitos B. Os segundos agem destruindo
células infectadas (fagocitárias ou não) através da ação da perforina e granzimas,
que são proteínas responsáveis pela formação de poros na superfície celular e
indução da apoptose respectivamente. Estas células, assim como macrófagos e
células dendríticas também sofrem ação dos nucleotídeos extracelulares, uma vez
que estas possuem em sua superfície, receptores P2, principalmente o subtipo
P2X7. Além destas ações, o ATP parece ser importante para a adesão dos linfócitos
por estimular a produção de L-selectinas, migração destas células aos sítios de
inflamação, proliferação celular, provavelmente por aumentar a transcrição de IL-2,
além de estimular o processo de apoptose após eliminação do patógeno devido ao
influxo de íons cálcio na célula.
Todos os processos inflamatórios e imunológicos citados nos parágrafos
anteriores podem causar danos às células saudáveis. Para evitar que isto ocorra, o
organismo possui mecanismos como a liberação de moléculas reguladoras como o
próprio ATP e adenosina, presença de ectoenzimas (CD39 e CD73) que levarão
diminuição de nucleotídeos extracelulares e aumento dos nucleosídeos. Além do
mais, a expressão de receptores P2Y contribui para a diminuição da produção de
citocinas pró-inflamatórias pelos monócitos/macrófagos, diminui a capacidade de
diferenciação de linfócitos T em Th1 pelas células dendríticas e diminui a ação
efetora dos linfócitos. Portanto, dependendo da concentração extracelular dos
nucleotídeos, assim como o tipo de receptor no qual estas moléculas se ligam, o
efeito pode ser pró-inflamatório ou modulador.
Além da importância das ectonucleotidases na resposta imune frente a
diversos parasitos, elas são importantes também para o fornecimento de
nucleotídeos purínicos para parasitos do gênero Leishmania, já que estes não
possuem enzimas necessárias para a síntese de purinas, necessitando captar estas
do meio extracelular através do transporte pela membrana plasmática. Portanto,
captar purinas presentes no ambiente extracelular de seus hospedeiros é de
26
extrema importância para a sobrevivência destes parasitos (GHOSH , MUKHERJEE,
2000; MARR et al., 1978). Além do mais, a geração de adenosina no interior de
macrófago é importante para a sobrevivência das amastigotas, já que esta purina
inibe a produção de óxido nítrico e radical de oxigênio, produzidos pelos fagócitos
(PINHEIRO, 2006).
Como foi dito anteriormente, as ectonucleotidases estariam envolvidas na
virulência do parasito, como foi verificado por Marques-da-Silva et al. (2008); pois,
se constatou que a presença de ectonucleotidases na superfície de Leishmania
amazonensis, L. braziliense, L. major, está relacionada com a infecciosidade. Neste
estudo, camundongos C57BL/6 foram infectados com promastigotas metacíclicas
das três espécies de Leishmania e observou-se que camundongos infectados com
L. amazonensis apresentaram lesões crônicas que não regrediam espontaneamente
e eram capazes de hidrolisar altos níveis de nucleotídeos (ATP, ADP e AMP)
quando comparados com as outras duas espécies.
A Leishmania, durante seu ciclo biológico, transita entre o hospedeiro
invertebrado (vetor) e vertebrado (mamífero), movimento este, que faz com que o
parasito passe por um estresse térmico proporcionado pela diferença de
temperatura existente entre os dois hospedeiros. A elevação da temperatura
estimula a expressão de proteínas, como a Proteínas do Choque Térmico (Hsps),
que podem contribuir para a sobrevivência do parasito no hospedeiro, já que em
formas amastigotas, a expressão das mesmas, foi maior do que em promastigotas.
As duas principais proteínas produzidas, pela elevação da temperatura, são as
Hsp70 e Hsp83, sugerindo a participação destas enzimas durante a invasão do
parasito. Estas proteínas já foram descritas em parasitos do gênero Leishmania
como nas espécies de Leishmania tropica, Leishmania donovani e Leishmania
enrietti (LAWRENCE & ROBERT-GERO, 1985) em Trypanosoma, Giardia,
Plasmodium, Schistosoma e alguns fungos como Candida (ALCINA et al., 1988;
MARESCA & CARRATO, 1992).
Em Leishmania mexicana, a elevação da
temperatura promoveu a expressão das Hsps, assim como a conversão de
promastigotas em amastigotas (LAWRENCE AND ROBERT GERO, 1985). PeresSampaio et al., (2008) mostraram que as Hsps produzem elevação da atividade
ecto-ATPase em L.amazonensis, porém o mesmo efeito não foi verificado em outras
ectoenzimas, reforçando a idéia de que as ecto-ATPase e as HSP estão
27
relacionadas com a superfamília de actin/Heat shock 70/sugar kinase, já que esta
observação já havia sido feita anteriormente (SMITH & KIRLEY, 1999)
Como existem poucos estudos relacionando a atividade ectonucleotidásica
com infecciosidade em espécies de Leishmania, principalmente em L. infantum
chagasi, agente responsável pela forma mais severa da doença, o presente trabalho
tem como objetivo verificar a atividade ectonucleotidásica em L. infantum chagasi
em diferentes temperaturas.
28
3 OBJETIVOS
3.1 OBJETIVO GERAL
Verificar, in vitro, o efeito de diferentes temperaturas e de inibidores de
ectonucleotidases na atividade ectonucleotidásica de formas promastigotas totais de
L. infantum chagasi.
3.2 OBJETIVOS ESPECÍFICOS
Verificar se o efeito de diferentes temperaturas, 30ºC ou 34ºC, interfere na
atividade ectonucleotidásica em L. infantum chagasi
Verificar o uso de inibidores das ectonucleotidases como molibdato de amônio
e suramina sobre a atividade ectonucleotidásica na temperatura de 30ºC ou
34ºC em L. infantum chagasi
29
4 JUSTIFICATIVA
Parasitos do gênero Leishmania estão envolvidos em doenças que variam de
acordo com a forma clínica e gravidade. Dentre as diferentes formas da doença,
destaca-se a leishmaniose visceral, considerada a forma mais grave, pois pode levar
o indivíduo à morte, caso ele não receba o tratamento adequado. Além do mais, os
fármacos utilizados no tratamento desta enfermidade, causam graves reações
adversas
aos
pacientes
como
arritmias
cardíacas,
hepatotoxicidade
e
nefrotoxicidade contribuindo para a morbidade e a mortalidade.
Nos últimos anos, estudos têm tentado desvendar o metabolismo destes
parasitos com o intuito de, futuramente, propiciar o desenvolvimento de novas
“armas” que possam impedir ou controlar a infecção, já que existem poucas
alternativas para o tratamento desta patologia. Além do mais, em algumas partes do
mundo, já é possível observar resistência parasitária ao antimônio pentavalente,
fármaco de primeira linha para o tratamento em muitos países.
Estudos feitos com protozoários e, dentre eles, espécies de Leishmania,
verificaram que enzimas envolvidas no metabolismo de nucleotídeos purínicos,
como as apirases, que são responsáveis pela hidrólise do ATP, podem estar
também envolvidas na virulência destes parasitos. Além do mais, o aumento da
concentração de adenosina no meio é de extrema importância para a sobrevivência
da Leishmania, pois esta não realiza a síntese de novo de nucleotídeos, além de
exercer ação imunomoduladora.
Portanto, determinar os fatores de virulência dos parasitos e como eles
interferem na infecção, é de grande relevância para a ciência, pois através dessa
compreensão poderão se desenvolver novas alternativas terapêuticas, como as
vacinas já que estudos têm mostrado que as ectonucleotidases possuem ação
imunogênica. Além do mais, o uso de inibidores das ectonucleotidases, citados
anteriormente, podem ser utilizados no tratamento da leishmaniose, desde que
sejam feitos testes de toxicidade sobre os seres humanos.
30
5 MATERIAL E MÉTODOS
5.1 DELINEAMENTO EXPERIMENTAL
5.1.1 Ensaio de atividade enzimática
L.infantum chagasi cepa M2682
25ºC / 5 dias de cultivo
Lavagem 3 x com salina 0,9% /
1.540x g / 4ºC / 10 min
Grupo 1: Parasitos sem inibidores
Grupo 2: Parasitos com suramina 20µM
Grupo 3: parasitos com molibdato de amônio 5 µM
Incubação (banho-maria) a
30ºC ou 34ºC
1h
Dosagem da hidrólise indireta dos
nucleotídeos ATP, ADP e AMP
31
5.2 PREPARO DO PARASITO
Cepa de Leishmania infantum chagasi M2682 e cepa PH8 de L. amazonensis,
foram cultivadas em meio de Grace (GIBCO BRL, Grand Island, N.Y., USA),
suplementado com 10% de soro fetal bovino inativado (SFB; Cripion, Andradina, SP,
Brazil), L-glutamina 2 mM (GIBCO BRL) e penicilina G 100 U/mL (USB Corporation,
Cleveland, OH, USA), pH 6,5, a 25 °C por 5 dias (final da fase logarítmica) já que
segundo Pinheiro et al., (2006) a atividade ectonucleotidásica é maior, sendo as
culturas iniciadas a partir de 1,0 x 105 parasitos/ mL. Para os ensaios de atividade
enzimática, os parasitos foram lavados três vezes com salina 0,9% sendo este
preparado centrifugado a 1.540 x g/ 4ºC/ 10min. O precipitado foi ressuspendido em
tampão da reação. Para verificar a integridade e viabilidade celular foi azul de
tripam, antes e após o ensaio de atividade enzimática.
5.3 ENSAIO DE ATIVIDADE ENZIMÁTICA
As atividades de ATPase, ADPase e 5’-nucleotidásica foram medidas após a
incubação dos parasitos (4,0x106 parasitos/reação), no tampão da reação
constituído por 116,0 mM NaCl, 5,4 mM KCl, 5,5 mM D-glicose, 5,0 mM MgCl2, e
50,0 mM do tampão Hepes-Tris na presença de 5 mM ATP, ADP ou AMP (SIGMA)
por uma hora nas temperaturas de 30ºC ou 34ºC. Para o bloqueio da atividade
apirásica, aos parasitos foi adicionado suramina (SIGMA), no momento do ensaio de
atividade enzimática, cuja concentração final no tampão da reação foi de 20,0µM e
para o bloqueio da atividade 5’-nucleotidásica, foi adicionado molibdato de amônio,
cuja concentração final foi de 5,0µM. A reação foi interrompida pela adição de HCl
0,2 mM gelado (FIETTO e cols., 2004). As suspensões foram centrifugadas e
alíquotas dos sobrenadantes foram utilizadas para a quantificação do fosfato
inorgânico(Pi) liberado, adicionando-se, na proporção de 1:1, uma mistura contendo
FeSO4.7H2O 8,8%, H2SO4 163, O mM e 53,0% de uma solução de molibdato de
amônio 2%/ H2SO4 5,55%, preparada imediatamente antes do uso. Foi feita uma
curva padrão utilizando diferentes concentrações de soluções de Na 3PO4, reagindo
com a mistura acima descrita. A quantificação de fosfato liberado foi feita por
espectofotometria, sob comprimento de onda de 650nm (TAUSSKY & SHORR,
1953) e a atividade enzimática, indiretamente determinada pela quantidade de Pi
32
liberado. Como os nucleotídeos sofrem hidrólise espontânea, é de extrema
relevância determinar a mesma. Para tanto, além de se determinar a concentração
de fosfato nos tubos testes, tubos, denominados de brancos, que possuem todos os
reagentes e as mesmas condições experimentais dos tubos testes, exceto pela
ausência do parasito durante o ensaio de reação enzimática (1 hora à 30ºC ou 34ºC)
são utilizados. Portanto, a concentração de Pi liberado é determinada pela diferença
do Pi livre nos tubos testes pelo Pi livre nos tubos brancos e os valores ajustados
para a concentração final de 1x108 parasitos/h.
5.4 ANÁLISE ESTATÍSTICA
Os dados foram submetidos à análise estatística por Teste t de Student, cujos
valores de p < 0,05 foram considerados como significativo.
33
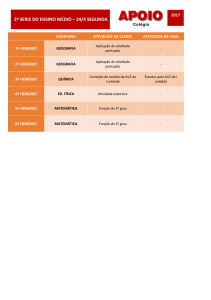
6 RESULTADOS
O presente trabalho procurou verificar o efeito da temperatura sobre a
atividade ectonucleotidásica de L. infantum chagasi. Como pode ser visto (Figura 7),
na temperatura de 30ºC, a hidrólise dos nucleotídeos, em nmol de Pi liberado, foi de
384,33 (ATP), 677,67 (ADP) e 348,68 (AMP), valores estes, significativamente
menores que a hidrólise dos nucleotídeos na temperatura de 34ºC, 541,07 (ATP),
825,83 (ADP) e 441,14 (AMP). Posteriormente, investigou-se a afinidade das
enzimas envolvidas por nucleotídeos, e como pode ser visto na figura 8, as enzimas
hidrolisam preferencialmente o ADP em relação ao ATP tanto na temperatura de
30ºC quanto na temperatura de 34ºC.
*
*
Figura 7: Medida da atividade ectonucleotidásica da cepa M2682 de L. infantum chagasi realizada
6
com promastigotas totais sem tratamento. Os parasitos (4,0x10 parasitos/reação) foram incubados
por 1 hora à temperatura de 30ºC ou 34ºC na presença de ATP, ADP ou AMP na concentração de
5,0 mM. As barras representam as médias + o desvio padrão das médias de 4 experimentos
independentes. Símbolo *(p<0,05) significa diferença estatística do grupo na qual houve incubação a
34ºC em relação grupo a 30ºC.
34
*
Figura 8: Relação entre a hidrólise de nucleotídeos tri e difosfatados em L. infantum chagasi cepa
M2682 realizada com promastigotas totais sob temperatura de 30ºC ou 34ºC, na presença de ATP,
ADP na concentração de 5,0 mM. As barras representam as médias + o desvio padrão das médias de
4 experimentos independentes. Símbolo *(p<0,05) significa diferença estatística.
Para verificar se o aumento da hidrólise de nucleotídeos, provocada pela
elevação da temperatura, foi devido à atividade apirásica, decidiu-se utilizar a
suramina, bloqueador de algumas ectonucleotidases (BERREDO-PINHO e cols.,
2001; LAMBRECHET, 2000).
Figura 9: Efeito do bloqueio da apirase na atividade enzimática de promastigotas totais de L. infantum
6
chagasi. Os parasitos (4x10 parasitos/reação) foram incubados com suramina 20,0µM por 1 hora a
30ºC na presença de ATP ou ADP ou AMP na concentração de 5,0 mM. As barras representam as
médias + o desvio padrão das médias de 4 experimentos independentes.
35
*
Figura 10: Efeito do bloqueio da apirase na atividade enzimática de promastigotas totais de L.
6
infantum chagasi. Os parasitos (4x10 parasitos/reação) foram incubados com suramina 20,0µM por 1
hora a 34 ºC na presença de ATP ou ADP ou AMP na concentração de 5,0 mM. As barras
representam as médias + o desvio padrão das médias de 4 experimentos independentes. Símbolo
*(p<0,05) significa diferença estatística.
De acordo com os dados apresentados nas figuras 9 e 10, não houve diferença na
inibição da hidrólise do ATP e do ADP dos grupos nos quais foi adicionado suramina
no momento da atividade enzimática em relação ao grupo controle (sem tratamento)
sob temperatura de 30ºC ou 34ºC. Porém, a suramina foi capaz de inibir,
parcialmente, a hidrólise do AMP na temperatura de 34ºC (Figura 10).
Com o objetivo de verificar se a concentração de suramina (20µM) foi ideal,
decidiu-se realizar o ensaio de atividade enzimática em Leishmania amazonensis
cepa PH8, já que os efeitos da suramina sobre esta espécie de Leishmania já foram
descritos. Como pode ser observado a suramina (20µM) inibiu a hidrólise do ATP,
em relação ao grupo controle, na temperatura de 30ºC (Figura 11), porém o mesmo
efeito não foi observado na temperatura de 34ºC (Figura 12).
36
Figura 11: Efeito do bloqueio da apirase na atividade enzimática de promastigotas totais de L.
6
amazonenses. Os parasitos (4x10 parasitos/reação) foram incubados com suramina 20,0µM, por 1
hora a 30ºC, na presença de ATP ou ADP ou AMP na concentração de 5,0 mM. As barras
representam as médias + o desvio padrão das médias de 2 experimentos independentes. Símbolo
*(p<0,05) significa diferença estatística.
Figura 12: Efeito do bloqueio da apirase na atividade enzimática de promastigotas totais de L.
6
amazonensis. Os parasitos (4x10 parasitos/reação) foram incubados com suramina 20,0µM por 1
hora à 34ºC na presença de ATP ou ADP ou AMP na concentração de 5,0 mM. As barras
representam as médias + o desvio padrão das médias de 2 experimentos independentes.
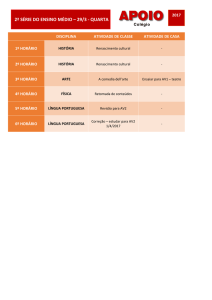
Para verificar se o aumento da hidrólise dos nucleotídeos, observada a 34ºC
em relação à temperatura de 30ºC, seria produzida por fosfatases ou outras
NTPDases, utilizou-se
o molibdato de amônio 5,0µM, um potente inibidor de
fosfatases ácidas assim como da ecto-5’- nucleotidase (DUTRA et al., 1998). De
acordo com os dados apresentados (Figura 13), pode-se observar que o molibdato
de amônio, na temperatura de 30ºC, foi capaz de inibir estatisticamente e
parcialmente, a hidrólise do AMP, além de inibir a hidrólise do ADP. Porém, quando
37
se observa a ação do molibdato de amônio 5,0µM a 34ºC (Figura 14) pode-se
perceber que a inibição ocorreu apenas na hidrólise do AMP.
Figura 13: Efeito do bloqueio da 5’- nucleotidase na atividade enzimática de promastigotas totais de L.
6
infantum chagasi. Os parasitos (4x10 parasitos/reação) foram incubados com molibdato de amônio
5,0µM por 1 hora a 30 ºC na presença de ATP ou ADP ou AMP na concentração de 5,0mM. As
barras representam as médias + o desvio padrão das médias de 4 experimentos independentes.
Símbolo * (p<0,05) significa diferença estatística do grupo tratado com o inibidor em relação ao grupo
controle (sem tratamento).
Figura 14: Efeito do bloqueio da 5’- nucleotidase na atividade enzimática de promastigotas totais de L.
6
infantum chagasi. Os parasitos (4x10 parasitos/reação) foram incubados com molibdato de amônio
5,0µM por 1 hora a 30 ºC na presença de ATP, ADP e AMP na concentração de 5,0 mM. As barras
representam as médias + o desvio padrão das médias de 4 experimentos independentes. Símbolo *
(p<0,05) significa diferença estatística do grupo tratado com o inibidor em relação ao grupo controle
(sem tratamento)
38
DISCUSSÃO
Dados na literatura mostram que diferentes protozoários como Toxoplasma
gondii (ASAI et al., 1995), Trichomonas foetus (JESUS et al., 2002), Leishmania
tropica (MEYER-FERNANDES et al., 1997) e L. amazonensis (BERRÊDO-PINHO et
al., 2001) possuem, na sua superfície, as ectoenzimas. Estas são capazes de
hidrolisar nucleotídeos purínicos e pirimidínicos, e, suas ações, podem estar
relacionadas com a infecciosidade dos parasitos (MEYER-FERNANDES, 2002).
A Leishmania, durante o tempo que permanece no hospedeiro invertebrado,
está sujeita a temperaturas de 22ºC a 28ºC, porém, no hospedeiro vertebrado, esta
temperatura é mais elevada, sendo na pele cerca de 33ºC, e nas vísceras, 37ºC. As
elevações de temperaturas podem produzir danos celulares ao parasito (REVISADO
POR ZILBERSTEIN & SHAPIRA, 1994) que para conseguir sobreviver, nos
hospedeiros, possuem mecanismos termorreguladores que estão relacionados com
a alteração da expressão de genes que são modulados por fatores ambientais como
a temperatura e substâncias químicas como os metais (LAWRENCE & ROBERTGERO, 1985).
Para verificar o efeito da temperatura sobre a atividade ectonucleotidásica de
L. infantum chagasi, os parasitos foram incubados por uma hora sob temperatura de
30ºC ou 34ºC, e a atividade enzimática medida indiretamente, pela concentração de
fosfato inorgânico liberado como descrito na metodologia.
Como pode ser visto (Figura 7), houve aumento estatisticamente significativo
na hidrólise dos nucleotídeos purínicos (ATP, ADP e AMP) sob temperatura de 34ºC
em relação à temperatura de 30ºC. Estes dados sugerem que a elevação da
temperatura possivelmente esteja interferindo na atividade de ecto-ATPDase como
também em outras ectoenzimas como 5’-nucleotidase, ecto-fosfatases em
Leishmania infantum chagasi ou estimulando a expressão de outras proteínas como
as proteínas do choque térmico (HPSs) (LAWRENCE & ROBERT-GERO, 1985).
Estudos têm mostrado que a elevação da temperatura interfere no aumento da
atividade enzimática. Trabalho realizado por Peres-Sampaio et al., (2008) com L.
amazonensis, mostra que a atividade ecto-ATPase é maior nos parasitos que foram
cultivados a 28ºC em relação a 22ºC, e que a atividade de ecto-ATPase dos
parasitos aumentou no grupo a 22ºC após sofrer estresse térmico (37ºC/ 2 horas)
39
antes de realizar o ensaio de atividade enzimática. Porém, outras enzimas como 3’ e
5’-nucleotidases e fosfatases ácidas não sofreram interferência da temperatura.
Estes dados sugerem que espécies de Leishmania diferem na suscetibilidade à
elevação da temperatura e isto pode ser refletido pela capacidade que as diferentes
espécies possuem em causar doenças com formas clínicas variadas (ZILBERSTEIN
& SHAPIRA, 1994).
As ectonucleotidases, como as ecto-NTPDases, são enzimas responsáveis
pela hidrólise do ATP a ADP e deste a AMP, e as ecto-5’-nucleotidases
responsáveis
pela
conversão
do
último
a
adenosina
(PLESNER,
1995;
ZIMMERMANN, 2000). Parasitos, como a Leishmania, apresentam na sua superfície
tais enzimas e estas parecem desempenhar importante papel na infecciosidade do
parasito e para sua sobrevivência devido à ação antiinflamatória da adenosina. Além
do mais, Leishmania não realizam a “síntese de novo” para a síntese de purinas
necessitando de captar, do meio extracelular, este nucleosídeo (MEYERFERNANDES, 2002).
As NTPDases, importantes para o metabolismo dos nucleotídeos, podem
estar aderidas a membrana plasmática, como as NTPDases 1, 2, 3 e 8 ou podem
estar ligadas à membrana de organelas citoplasmáticas como a NTPDase 4, 5, 6 e
7. Essas enzimas, quando analisadas individualmente, podem diferir quanto à
“preferência por substratos” (MUNKONDA et al., 2007). Algumas podem agir sobre
substratos 5’-trifosfatados e 5’-difosfatados de forma igual (NTPDase 1) e outras
agem preferencialmente em um destes substratos, como a NTPDase 2
(trifosfatados). Fonseca et al., (2006) observou em T.rangeli preferência das ectoenzimas por nucleotídeos trifosfatados. Faria-Pinto et al., (2004), ao trabalhar com
homogeneizados de ovos de Schistosoma mansoni observou que a hidrólise de ATP
e ADP foram semelhantes. Porém, ao comparar a hidrólise de nucleotídeos di e tri
fosfatados em antígenos solúveis do ovo, ele observou que estes hidrolisavam ATP,
porém em menor proporção do que ADP, demonstrando, assim, a presença de
isoformas diferentes de ATP difosfohidrolases no ovo do parasito. Já Fietto et al.,
(2004) verificou que em formas infectantes (tripomastigotas) de Trypanosoma cruzi
em relação a formas não infectantes (epimastigotas), a hidrólise de ATP foi maior
que a hidrólise de ADP. Santos et al., (2009), também verificou que diferentes cepas
de T.cruzi metabolizam nucleotídeos purínicos de forma diferenciada. Marques-daSilva et al., (2008) verificou que L. amazonensis também apresenta hidrólise de
40
ATP, ADP, AMP, sendo que a hidrólise do primeiro foi maior em relação aos demais
nucleotídeos. Já Asai et al., (1995), trabalhando com Toxoplasma gondii, verificou
que a NTPAse é formada por duas isoenzimas, as NTPases I e II, sendo que a
primeira hidrolisa quase que exclusivamente nucleotídeos trifosfatados e a segunda
ambos nucleotídeos tri e difosfatados quase na mesma taxa. Ele, observou também,
que a NTPase I está presente apenas nas cepas virulentas de T.gondii e a NTPase
II, pode ser encontrada nas cepas virulentas e não virulentas. Ao analisar os dados
do presente trabalho (Figura 8) pode-se verificar que em L. infantum chagasi, a
hidrólise de nucleotídeos difosfatados em relação ao trifosfatados é maior sob
temperatura de 30ºC ou 34ºC, ou seja, a cepa do parasito utilizada no
desenvolvimento
desta
pesquisa
hidrolisa,
preferencialmente,
o
ADP.
Adicionalmente, a elevação da temperatura aumenta a hidrólise do mesmo
nucleotídeo, sugerindo que a elevação da temperatura possa estar interferindo de
alguma forma na atividade da enzima ou estimulando outra proteína que possa estar
potencializando a ação da apirase ou agindo de forma sinérgica. Como pode ser
visto, diferentes protozoários patogênicos possuem diferentes afinidades por
nucleotídeos, e as formas virulentas parecem possuir maior afinidade por
nucleotídeos trifosfatados, sugerindo a participação das NTPAse na infecciosidade
(MEYER-FERNANDES, 2002). Maioli et al., (2004), ao comparar a hidrólise de
nucleotídeos purínicos de L. amazonensis e L. braziliensis, a 37ºC, verificou que a
hidrólise de AMP , na primeira espécie foi bem maior que na segunda, sugerindo
que aumento de adenosina estaria inibindo a produção de citocinas pró-inflamatórias
como IFN-γ e TNF, o que justificaria a presença de lesões crônicas no camundongo
infectado, reforçando a idéia de que o aumento da atividade enzimática estaria
relacionado com a infecciosidade. Estudos complementares são necessários para
poder caracterizar melhor a enzima ou enzimas envolvidas na hidrólise destes
nucleotídeos em L. infantum chagasi, e uma alternativa seria o uso anticorpos antiapirase de batata, que já mostrou ser capaz de reconhecer apirase de protozoários
como S.mansoni (FARIA-PINTO et al., 2004) e L.amazonensis (COIMBRA et al.,
2008).
Para verificar se o aumento da hidrólise de nucleotídeos, provocada pela
elevação da temperatura, foi devido à atividade apirásica, decidiu-se utilizar a
suramina, bloqueador de algumas ectonucleotidases (BERREDO-PINHO e cols.,
2001; LAMBRECHET, 2000). Tal inibidor foi adicionado aos parasitos no momento
41
da incubação a 30ºC ou 34ºC por uma hora na concentração de 20µM, pois segundo
Fonseca et al., (2006), em seu trabalho com Trypanossoma rangeli, esta
concentração seria suficiente para produzir inibição de aproximadamente 40% da
atividade apirásica, já que o efeito é dose dependente. De acordo com os dados
apresentados (Figuras 9 e 10), não houve diferença estatística na inibição da
hidrólise do ATP ou do ADP dos grupos nos quais foi adicionado suramina no
momento da atividade enzimática em relação ao grupo controle (sem tratamento) na
temperatura de 30ºC ou na temperatura de 34ºC. Porém, a suramina foi capaz de
inibir a hidrólise do AMP na temperatura de 34ºC. Estes resultados podem ter
ocorrido pelas seguintes hipóteses: 1- participação de outras enzimas, como
fosfatases, E-NPP (família das pirofosfatases/fosfodiesterases) na hidrólise dos
nucleotídeos, em L. infantum chagasi, e não a apirase; 2- a NTPDase, nesta cepa de
L. infantum chagasi, poderia ser constituída por isoformas diferentes insensíveis a
ação da
suramina, segundo comunicação pessoal feita por Fietto. Segundo
Munkonda et al.,(2007) em NTPDase humana, a suramina, cuja concentração variou
entre 10 µM e 100 µM agiu de forma diferenciada, onde a inibição na NTPDase 3 foi
maior que na NTPDase 1 e esta igual a NTPDase 2. Por último, observou-se que a
NTPDase 8 foi a que menos sofreu ação da suramina; 3- uso do inibidor em baixas
concentrações.
Como pode ser visto muitas dúvidas precisam ser esclarecidas, e para isto é
necessário o uso de outros inibidores das ectonucleotidases, já que em parasitos do
gênero Leishmania tem sido descritas outras enzimas presentes na superfície da
membrana plasmática além das ecto-ATPases como as fosfatases ácidas (HASSAN
& COOMBS, 1983). Para excluir a possibilidade de que a hidrólise de ATP não
estaria sendo produzida por nenhuma fosfatase, recomenda-se utilizar o NaF e
vanadato (GLEW & CZUCZMAN, 1982) dois potentes inibidores para fosfatases
ácidas, levamizole e tetramizole, inibidores de fosfatases alcalinas (VAN BELLE,
1972). Outros inibidores que devem ser testados para verificar a atividade ectoATPase, são os oligomicina e azida sódica, dois inibidores de Mg+2 ATPase
mitocondrial. Segundo Meyer-Fernandes et al., (1997), uma ecto-ATPase pode ser
caracterizada pela ausência de resposta aos inibidores acima, além de ser inibida
por um inibidor de ecto-ATPase impermeável como 2’,2’-diisothiocyanostylbene
disulfonic acid (DIDS).
42
Para testar a terceira hipótese, ou seja, uso de inibidor em baixas
concentrações, utilizou-se a suramina na concentração de 20µM em Leishmania
amazonenses cepa PH8. Como pode ser observado (Figura 11) a suramina 20µM
inibiu parcialmente e de forma significativa a hidrólise do ATP em relação ao grupo
controle na temperatura de 30ºC, porém o mesmo efeito não foi observado na
temperatura de 34ºC (Figura 12). Estes dados excluem a possibilidade de que a
ausência da inibição da suramina em L. infantum chagasi foi devida a baixas
concentrações e reforçam a teoria de que o aumento da hidrólise dos nucleotídeos
purínicos observados pela elevação da temperatura no parasito em estudo,
provavelmente deve-se a ação de outras enzimas como fosfatases e não de
apirases.
A 5’-nucleotidase foi descrita em vários organismos como plantas, bactérias,
tecidos de vertebrados (ZIMMERMANN, 1992) e protozoários como Trichomonas
vaginalis (TASCA et al., 2003) e Trichomonas gallinae (BORGES et al., 2006). Esta
enzima é responsável pela hidrólise de nucleotídeos monofosfatados, sendo o AMP
considerado o principal substrato, e é expressa em vários tipos celulares em
condições fisiológicas ou não (ZIMMERMANN, 1992, 1996). A ação da 5’nucleotidase é importante porque a hidrólise do AMP leva à formação de adenosina
que se liga em receptores P1 modulando o processo inflamatório. Além do mais,
Leishmania não realiza a “síntese de novo” de purinas, necessitando de utilizar a via
de salvação. Portanto, a ação desta enzima pode ser relacionada com a
infecciosidade do parasito. Para excluir a possibilidade de que a hidrólise de ATP
seria produzida pela 5’-nucleotidase, outra
Leishmania,
enzima presente na superfície de
decidiu-se utilizar o molibdato de amônio, um potente inibidor de
fosfatases ácidas, assim como da ecto-5’-nucleotidase (DUTRA et al., 1998). De
acordo com os dados apresentados (Figura 13), pode-se observar que o molibdato
de amônio a 5µM, na temperatura de 30ºC, foi capaz de inibir estatisticamente e
parcialmente, a hidrólise do AMP e não exerceu nenhum efeito na hidrólise do ATP.
Estes resultados estão de acordo com Fietto et al., (2004) em Trypanosoma cruzi e
em Schistosoma mansoni (FARIA-PINTO et al., 2004) sugere a participação da 5’nucleotidase na hidrólise do AMP e não sobre o ATP. A 30ºC pode-se observar,
também, que o molibdato de amônio foi capaz de inibir, estatisticamente, a hidrólise
do ADP, sugerindo a participação de ecto-fosfatases envolvidas na hidrólise de
dinucleotídeos ou uma isoforma diferente da ecto-5’nucleotidase, pois segundo
43
Zimmermann (1992) esta enzima pode agir em substratos difosfatados. Outra
hipótese levantada possa ser devido à presença, de uma isoforma diferente de
apirase, sensível ao molibdato de amônio. Ao analisar a ação do molibdato de
amônio 5µM na atividade ectonucleotidásica na temperatura de 34ºC (Figura 14)
pode-se observar que a inibição estatística ocorreu apenas na hidrólise do AMP.
Estes dados reforçam a participação da ecto-5’-nucleotidase hidrólise de
nucleotídeos em L. infantum chagasi.
A elevação da temperatura, além de poder interferir nas ectonucleotidases,
pode estar relacionada com a indução da expressão de polipeptídeos denominados
como Hsps (SCHLESINGER et al., 1982). Em Leishmania donovani e Leishmania
major, a máxima produção de Hsps ocorre na temperatura de 34ºC e 37ºC
(BRANDAU et al., 1995; FEHNIGER et al., 1990; SHAPIRA et al., 1988). As Hsps
são proteínas altamente conservadas entre os microrganismos e mamíferos, sendo
a mais conservada de todas as Hsp70. Estudos têm mostrado, que algumas destas
proteínas, exibem propriedades imunomoduladoras, como os feitos com ratos com
artrite e tratados com Hsp70 de Mycobacterium tuberculosis (TBHsp70). Os ratos,
tratados com a (TBHsp70), tiveram melhora das manifestações clínicas quando
comparado àqueles que não a receberam. Outro estudo observou-se aumento dos
níveis de IL-10 e redução dos níveis de TGF-β e IFN-γ em monócitos e células
sinoviais em pacientes com artrite (PRAKKEN et al., 2001). Borges et al., (2010)
mostra que Hsp70 de Mycobacterium tuberculosis foi capaz de inibir a rejeição de
aloenxertos em camundongos BALB-c, sendo este efeito depende de células Treg,
com elevação dos níveis de IL-10 e inibição de TGF-β nos linfonodos. Estes
resultados dão suporte à ação imunossupressora das Hsps70 de Mycobacterium
tuberculosis. Além do mais, neste mesmo estudo, verificou-se que a atividade
imunossupressora não é compartilhada por todas as Hsps, pois a Hsp90, não
apresentou atividade imunossupressora.
A interação entre o parasito e o hospedeiro é muito complexa e envolve várias
moléculas, como já foi dito. Peres-Sampaio et al., (2008) correlacionou a atividade
ecto-ATPase com as Hsps, e verificou que o aumento da atividade enzimática devese a ação das proteínas. Portanto, em Leishmania, as Hsps é um forte candidato a
fator de virulência, seja por estimular a ação da Ecto-ATPse ou por modular a
resposta imune.
44
Todas as constatações obtidas, no presente trabalho, são de grande
relevância para a área científica, pois muitas questões precisam ser respondidas
para que se determinem os mecanismos envolvidos na sobrevivência do parasito no
hospedeiro, e consequentemente, se consiga desenvolver vacinas, diminuindo,
assim, a morbimortalidade da leishmaniose visceral.
45
8 CONCLUSÃO
O
aumento
da
temperatura
provocou
elevação
da
atividade
ecto-
nucleotidásica na cepa M2682 de L. infantum chagasi;
As ectoenzimas de L. infantum chagasi hidrolisam preferencialmente
nucleotídeos purínicos difosfatados;
A atividade da NTPDase não sofreu influência da suramina a 20µM,
na
temperatura de 30ºC ou 34ºC;
A hidrólise do ADP foi parcialmente inibida, à 30ºC, por molibdato de
amônio 5µM;
A hidrólise do AMP foi parcialmente inibida, à 30ºC ou 34º C, por molibdato
de amônio 5µM;
A hidrólise do ATP não foi inibida na temperatura de 30ºC ou 34º C, por
molibdato de amônio 5 µM;
Experimentos complementares são necessários para confirmar as enzimas
envolvidas no metabolismo de nucleotídeos purínicos em L. infantum chagasi.
46
REFERÊNCIAS
ABBRANCHIO, M. P. et al. International Union of Pharmacology LVII: update on P2Y
G protein coupled nucleotide receptors: from molecular mechanisms pathophysiology
to therapy.Pharmacol. Rev. 58. p.281-341, 2006.
ALCINA, A.; URZAINQUI, A.; CARRASCO, L. The heat-shock response in
Trypanosoma cruzi. European Journal of Biochemistry, 1988
ANTOINE, J. et al. Parasitophorus vacuoles of Leishmania amazonensis-infected
macrophages maintain an acidic pH. Infect. Immun. 58:779-87, 1990.
ASAI, T. et al.Biochemical and molecular characterization of nucleoside triphosphate
hydrolase isozymes from the parasitic protozoan Toxoplasma gondii.
J.Biol.Chem.Vol. 270, p.11391-11397, 1995.
AWASTHI, A.; MATHUR, R. K.; SAHA, B. Immune response to Leishmania infection.
Indian J Med Res, nº 119, p. 238-258, 2004.
BERREDO-PINHO, M. et al. A Mg-dependent ecto-ATPase in Leishmania
amazonensis and its possible role in adenosine acquisition and virulence. Arch.
Biochem.Biophys. 391, p.16-24, 2001
BORGES,T. J. et al. Prolonged Survival of Allografts Induced by Mycobacterial
Hsp70 Is Dependent on CD4+CD25+ Regulatory T Cells. Neglected Tropical
Disease, nº12, v.5, 2010.
BORGES, F. P. et al. Characterization of an ecto-5’-nucleotidase (EC 3.1.3.5) activity
in intact trophozoites of Trichomonas gallinae. Veterinary Parasitology. 2006
BOURS, M. J. L. et al. Adenosine 5′-triphosphate and adenosine as endogenous
signaling molecules in immunity and inflammation. Pharmacology & Therapeutics,
112, p. 358-404, 2006.
BRANDAU, S.; DRESEL, A.; AND CLOS, J. High constitutive levels of heat-shock
proteins in human-pathogenic parasites of the genus Leishmania. Biochem J.,
Vol.310, p.225-232, 1995.
47
BRASIL. MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Guia de
vigilância epidemiológica. Série A. Normas e Manuais Técnicos. 6 ed. – Brasília :
Ministério da Saúde, p.816, 2005.
BRASIL. MINISTÉRIO DA SAÚDE. Fundação Nacional de Saúde. Boletin
eletrônico epidemilógico. Nº 06. 2002. Disponível em < http:www.funasa.gov.br>
Acessado em 02/02/2010.
BRASIL. MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde.
Departamento de Vigilância Epidemiológica. Leishmaiose visceral grave: Normas
e condutas. Disponível em
<http://portal.saude.gov.br/portal/arquivos/pdf/manual_lv_grave_nc.pdf> Acessado
em 21/10/2010.
BURNSTOCK, G. Purine and pyrimidine receptors. Cell Mol.Life Sci. Vol 64,
p.1471-1483, 2007.
CASTELHANO, L. R. et al. Th1/Th2 imune responses are associated with active
cutaneus leishmaniasis and clinical cure is associated with strong interferon-γ
production. Human Immunology, Vol.70, p.383-390, 2009.
COIMBRA, E. S. et al. Leishmania (L.) amazonensis ATP
diphosphohydrolaseisoform and potato apyrase share epitopes: antigenicityand
correlation with disease progression. Parasitology, Vol. 135, p. 327-335, 2008.
COURRET, N. et al. Biogenesis of Leishmania-harbouring parasitophorous vacuoles
following phagocytosis of the metacyclic promastigote or amastigote stages of the
parasites. Journal of Cell Science, nº 115, p. 2303-2316, 2002.
DESJARDINS, M.; DESCOTEAUX, A. Inhibition of Phagolysosomal Biogenesis by
the Leishmania Lipophosphoglycan. J. Exp.Med.Vol.185, nº12, p.2061-2068, 1997.
DI VIRGILIO, F. Purinergic signalling in the immune system. A brief update.
Purinergic Signalling 3, p.1-3, 2007.
DUTRA, P. M. L. et al. A Novel Ecto-Phosphatase Activity of Herpetomonas
muscarum muscarum Inhibited by Platelet-Activating Factor. Biochemical and
Biophysical Research Communications 253, p.164–169, 1998.
48
FARIA-PINTO, P. et al. ATP diphosphohydrolase from Schistosoma mansoni
egg:characterization and immunocytochemical localization of a new antigen.
Parasitology , nº 129, p.51-57, 2004.
FEHNIGER, T. et al. Changes in the antigenic profile of Leishmania parasites
following shifts in temperature. Acta tropica, 47(4):227-36, 1990.
FIETTO, J. L. R. et al. Characterization and immunolocalization of an NTP
diphosphohydrolase of Trypanosoma cruzi. Biochemical and Biophysical
Research Communications, nº316, p. 454–460, 2004.
FONSECA, F. V. et al. Trypanosoma rangeli: Characterization of a Mg-dependent
ecto ATP-diphosphohydrolase activity. Experimental Parasitology, Vol.112, p.7684, 2006.
FREDHOLM, B. B. et al. Nomenclature and classification of purinoceptors.
Pharmacol.Rev.Vol 46, p.143-156, 1994.
GHOSH, M.; MUKHERJEE, T. Stage-specific development of a novel adenosine
transporter in Leishmania donovani amastigotes. Molecular and Biochemical
Parasitology. nº108, p.93-99, 2000.
GOTTLIEB, M. & DWYER, D.M. Evidence for distinct 5'- and 3'-nucleotidase
activities in the surface membrane fraction of Leishmania donovani promastigotes.
Mol.Biochem.Parasitol. 7, p.303-317, 1983.
GLEW, R. H. et al. Partial purification and characterization of particulate acid
phosphatase of Leishmania donovani promastigotes.Comparative Biochemistry.
Physiology. B 72, p.581–590, 1982
GOUNARIS , K., SELKIRK, M. E. Parasite nucleotide-metabolizing enzymes and
host purinergic signalling. Trends in parasitology. Vol.21, nº1, 2005.
HASKO, G. et al. Adenosine inhibits IL-12 and TNF-[alpha] production via adenosine
A2a receptor-dependent andindependent mechanisms. FASEB J.Vol. 14, p.20652074, 2000.
49
HASSAN, H. F.; COOMBS, G. H. Phosphomonoesterases of Leishmania mexicana
mexicana and other flagellates. Mol. Biochem. Parasitol. 23, p.285–296, 1987.
JACOBSON, K. A. & GAO, Z.G. Adenosine receptors as therapeutic targets.
Nat.Rev. Drug Discov.Vol 5, p.247-264, 2006.
KRECKLER, L. M. et al. Adenosine inhibits tumor necrosis factor-alpha release from
mouse peritoneal macrophages via A2A and A2B but not the A3 adenosine receptor.
J.Pharmacol.Exp.Ther.Vol.317, p.172-180, 2006.
LA SALA , A. et al. Alerting and tuning the immune response by extracellular
nucleotides. J.Leukoc.Biol. Vol.73. p.339-343, 2003.
LAMBRECHT, G. Agonists and antagonists acting at P2X receptors: selectivity
profiles and functional implications. Naunyn Schmiedebergs Arch.Pharmacol. 362,
p.340-350, 2000.
LANGSTON H, P. et al. Secretion of IL-2 and IFN-gamma, but not IL-4, by
antigen-specific Tcells requires extracellular ATP. J.Immunol.Vol. 170, p.29622970, 2003.
LAPPAS, C. M.; RIEGER, J. M. & LINDEN, J. A2A adenosine receptor induction
inhibits IFN-gamma production in murine CD4+ T cells. J.Immunol. Vol.174, p.10731080, 2005.
LAZAROWSKI, E. R.; BOUCHER, R. C.; HARDEN, T. K. Mechanisms of release of
nucleotides and integration of their action as P2X- and P2Yreceptor activating
molecules. Mol Pharmacol. 64(4), p.785–795, 2003.
LAWRENCE, F.; ROBERT-GERO, M. Induction of heat shock and stress proteins in
promastigotes of three Leishmania species. Proc. Natl. Acad. Sci. USA 82: p.441417, 1985.
LIEW, F.Y.; WEI, X. Q.; PROUDFOOT, L. Cytokines and nitric oxide as e¡ector
molecules against parasitic infections. The Royal society 352, p.1311-1315, 1997.
MAIOLI, T. U. et al. Immune response induced by New World Leishmania species in
C57BL/6 mice. Parasitol Res, nº94, p. 207–212, 2004.
50
MALLA, N. & MAHAJAN, R. C. Pathophysiology of visceral leishmaniasis - some
recent concepts. Indian J Med Res 123, p.267-274, 2006.
MARESCA, B., CARRATU, L.The biology of the heat shock response in parasites.
Parasitology Today 8, p.260–266, 1992.
MARQUES-DA-SILVA, E. A. et al. Extracellular nucleotide metabolism in
Leishmania: influence of adenosine in the establishment of infection. Microbes and
Infection, Vol. 10, p. 850-857, 2008.
MARR, J. J.; BERENS, R.L. & NELSON, D. J. Purine metabolism in Leishmania
donovani and Leishmania braziliensis. Biochim.Biophys.Acta 544, p.360-371,
1978.
MARR, J.J.; BERENS, R.L. & NELSON, D.J. Purine metabolism in Leishmania
donovani and Leishmania braziliensis. Biochim.Biophys. 544, p.360-371, 1978.
MEYER-FERNANDES, J. R. et al. Mg-Dependent Ecto-ATPase Activity in
Leishmania tropica. Archives of Biochemistry and Biophysics, Vol. 341, nº 1,
p.40–46, 1997.
MEYER-FERNANDES, J. R. Ecto-ATPases in protozoa parasites: looking for a
function. Parasitology International, 51, p. 299–303, 2002.
MOSSER, D. M.; SPRINGER, T. A.; DIAMOND, M. S. Leishmania Promastigotes
Require Opsonic Complement to Bind to the Human Leukocyte Integrin Mac1(CD11b/CD18). The Journal of Cell Biology, Vol. 116, nº2, p. 511-520, 1992.
MUNKONDA, M. N. et al. Inhibition of human and mouse plasma membrane bound
NTPDases by P2 receptor Antagonists. Biochemical Pharmacology. Rev.74. p.
1524 – 1534, 2007.
NORTH, R. A. Molecular physiology of P2X receptors. Physiol Rev. 82. p.10131067, 2002.
PANZER, U. et al. Compartment-specific expression andfunction of the chemokine
IP-10/CXCL10 in a model of renal endothelialmicrovascular injury.
J.Am.Soc.Nephrol. Vol.17. p. 454-464, 2006.
51
PERES-SAMPAIO, C. E. et al. Leishmania amazonensis: effects of heat shock on
ecto-ATPase activity. Experimental parasitology, 119. p.135-143, 2008.
PINHEIRO, C. M. et al. Induction of IL-10 and inhibition of experimental arthritis are
specific features of microbial heat shock proteins that are absent for other
evolutionarily conserved immunodominant proteins. J. Immunol 167, p.4147–4153,
2001.
PITTA, M. G. R. et al. The Journal of Clinical Investigation, Vol.119, nº8, p.23792387, 2009.
PLESNER, L. Ecto-ATPases: identities and functions. Int.Rev.Cytol. Vol.158, p.141214, 1995.
RALEVIC ,V. & BURNSTOCK, G. Receptors for purines and pyrimidines.
Pharmacol. Rev. 50, 413-492. 1998.
RIBEIRO-DE-JESUS, A. et al. Cytokine profile and pathology in human
leishmaniasis. Brazilian Journal of Medicall and Biologicall Research, nº 31, p.
143-148, 1998.
RITTIG, M.G.; BOGDAN, C. Leishmania–Host-cell Interaction: Complexities and
Alternative Views. Parasitology Today, Vol. 16, nº 7, 2000.
SACKS, D.; NOBEN-TRAUTH, N. The Immunology of Susceptibility and Resistance
to Leishmania major in Mice. Nature Reviews, Vol. 2, p. 845-858, 2002.
SAHA, A. K. et al. Inhibition of Human Seminal Fluid and Leishmania donovani
Phosphatases by Molybdate Heteropolyanions. The Journal of Biological
Chemistry, Vol. 266, nº 6, p. 3511-3517, 1981.
SAHA, S. et al. Immune responses in kala-azar. Indian J Med Res, nº123, p. 245266, 2006.
RAMON, F. et al. Influence of Ecto-Nucleoside Triphosphate Diphosphohydrolase
Activity on Trypanosoma cruzi Infectivity and Virulence. Neglected Tropical
Disease, Vol.3, n.3, 2009.
52
SCHNURR, M. et al. Extracellular ATP and TNF-alpha synergize in the activation and
maturation of human dendritic cells. J.Immunol. 165. p.4704-4709, 2000.
SCHLESINGER, M. J.; ASHBURNER, M. P. & TISSIERES, A. Heat-Shock from
Bacteria to Man (Cold Spring HarborLaboratory, Cold Spring Harbor, NY), 1982
SILVA, F. et al. Inflammatory Cell Infiltration and High Antibody Production in Balb/C
Mice Caused by Natural Exposure to Lutzomyia longipalpis Bites. American Journal
of Tropical Medicine and Hygiene, Vol. 72, nº 1, p. 94–98, 2005.
SURPRENANT, A. et al. The cytolytic P2Z receptor for extracellular ATP identified as
a P2X receptor (P2X7). Science 272. p.735-738, 1996.
TASCA, T. et al. Characterization of an ecto-5'-nucleotidase (EC 3.1.3.5) activity in
intact cells of Trichomonas vaginalis. Exp.Parasitol. 105, 167-173, 2003.
TAUSSKY, H. H. and SCHORR, E. A microcolorimetric method for the determination
of inorganic phosphorus. J.Biol.Chem.202.675-685, 1953.
THALHOFER, C. J. et al. Leukocytes Infiltrate the Skin and Draining Lymph Nodes in
Response to the Protozoan Leishmania infantum chagasi. Infection and Immunity.
Vol. 79, nº 1, p.108-117, 2011.
VAN BELLE, H. Kinetics and inhibition of alkaline phosphatases from canine tissues.
Biochimica et Biophysica Acta 289, p.158–168, 1972.
YEGUTKIN, G.G. Nucleotide- and nucleoside-converting ectoenzimes: Important
modulators of purinergic signaling cascade. Biochimica et Biophysica acta.1783,
673-694, 2008.
ZIMMERMANN, H. 5-Nucleotidase: molecular structure and functional aspects '.
Biochem.J. 285, p.345-365, 1992.
ZIMMERMANN, H. Extracellular metabolism of ATP and other nucleotides. Naunyn
Schmiedebergs Arch.Pharmacol. 362. p.299-309, 2000.
ZILBERSTEIN, D.; SHAPIRA, M. The role of ph and temperature in the development
of Leishmania parasites. Annu. Rev. Microbiol. 48, p.449-70, 1994.
53
WILKIN, F. et al. The P2Y11 receptor mediates the ATP-induced maturation of
human monocyte-derived dendritic cells. J.Immunol. 166, p.7172-7177, 2001.