UNIVERSIDADE FEDERAL DE GOIÁS
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA TROPICAL
E SAÚDE PÚBLICA
ANÁLIA CIRQUEIRA MILHOMEM
ASPECTOS HISTOPATOLÓGICOS DA
NEUROCISTICERCOSE EXPERIMENTAL E PERFIL DE
CITOCINAS EM CAMUNDONGOS C57BL/6
Goiânia
2017
ii
ANÁLIA CIRQUEIRA MILHOMEM
ASPECTOS HISTOPATOLÓGICOS DA
NEUROCISTICERCOSE EXPERIMENTAL E PERFIL DE
CITOCINAS EM CAMUNDONGOS C57BL/6
Dissertação de Mestrado apresentada
ao Programa de Pós-Graduação em
Medicina Tropical e Saúde Pública da
Universidade Federal de Goiás para
obtenção do Título de Mestre em
Medicina Tropical e Saúde Pública.
Área de concentração: Patologia.
Orientador: Prof.º Dr.º Ruy de Souza
Lino Júnior.
Co-orientadora:
Prof.ª
Dr.ª
Juliana
Reis Machado e Silva
Goiânia
2017
iii
iv
v
Programa de Pós-Graduação em Medicina Tropical e Saúde Pública
da Universidade Federal de Goiás
BANCA EXAMINADORA DA DISSERTAÇÃO DE MESTRADO
Aluno (a): Anália Cirqueira Milhomem
Orientador (a): Profº Dr. Ruy de Souza Lino Júnior
Membros:
1. Ruy de Souza Lino Júnior
2. Milton Adriano Pelli Oliveira
3. Mauro Cunha Xavier Pinto
4. Fernanda Cristina Alcântara dos Santos
5. Aline Araújo Freitas
6. Mara Rúbia Nunes Celes
Data: 15/03/2017
vi
A Deus por ser comigo;
À minha mãe, por acreditar nas minhas conquistas e no meu crescimento
intelectual.
vii
AGRADECIMENTO
À Deus sobre todas as coisas, por me conceder vida a cada amanhecer, por me dar
forças e sempre me mostrar que é Ele quem me guia, à Ele toda honra, poder e glória.
Ao meu orientador Prof.º Dr.º Ruy de Souza Lino Júnior pela confiança e
credibilidade em mim depositadas. Pelos conselhos, companheirismo, pela forma
irreverente e singular de orientar e por sempre me fazer refletir novos caminhos,
novos desafios.
À minha co-orientadora Prof.ª Dr.ª Juliana Reis Machado e Silva por acreditar no
meu potencial e pelo auxílio no delineamento experimental deste trabalho. Por
sempre se mostrar solícita a me ajudar e não medir esforços para extrair o melhor
de mim.
A toda minha família, tias, primos, avós e sobrinhos, mas principalmente à minha
mãe Erotides Cirqueira por mesmo longe conseguir acalmar meu coração em
momentos de turbulências e incertezas. Por sempre acreditar em mim e me
encorajar a ir sempre mais longe.
Ao meu namorado Felipe Gonçalves de Souza Camargos por sempre me oferecer
o que preciso, apoio, presença, carinho, amor, calma e tranquilidade. Obrigada
por estar presente sempre.
Ao Laboratório de Citocinas especialmente ao Prof.º Dr. º Milton Adriano Pelli
de Oliveira e a Pollyana por possibilitarem a realização do ELISA, além de
demonstrarem dispostos a sanar dúvidas sempre que necessário.
Ao LAERPH – Laboratório de Estudos da Relação Parasito Hospedeiro
especialmente à Prof.ª Marina Clare Vinaud e a Guaraciara pela disponibilidade
em emprestar instrumentos e em auxiliar no uso dos mesmos possibilitando que o
homogenato encefálico fosse produzido.
Aos colegas do Laboratório de Patologia Experimental, principalmente Amanda,
Vera, Hidelberto, Renato e Advaldo, pela amizade, companheirismo, apoio
técnico e convívio diário.
viii
Á Vânia, ex-colega de laboratório e eterna amiga, pela prontidão em me ajudar
sempre que necessário.
Aos professores que compuseram minha banca de qualificação, Prof.º Dr. º
Milton Adriano Pelli de Oliveira, Prof.ª Dr.ª Juliana Reis Machado e Silva e
Prof.ª Dr.ª Aline de Araújo Freitas que facilitaram a melhoria deste trabalho com
suas sugestões e críticas construtivas.
Aos professores do PPGMTSP – Programa de Pós-Graduação em Medicina
Tropical e Saúde Pública pelo auxílio no desenvolvimento do meu conhecimento
científico e do meu censo crítico.
Aos funcionários do IPTSP/UFG de forma geral, Kariny, José Clementino, Alex
pela atenção e competência.
Aos funcionários do Biotério do IPTSP/UFG pelo cuidado com os camundongos
e pela competência.
Ao CNPq pela bolsa de estudos concedida e pelo financiamento da pesquisa, o
que possibilitou o desenvolvimento da mesma.
A todos que contribuíram direta e indiretamente para o meu crescimento pessoal
e profissional.
ix
SUMÁRIO
TABELAS, FIGURAS E ANEXOS ............................................................................................ xi
SÍMBOLOS, SIGLAS E ABREVIATURAS ............................................................................ xiii
RESUMO ................................................................................................................................... xiv
1 INTRODUÇÃO ......................................................................................................................... 1
1.1
Complexo teníase/cisticercose ...................................................................................... 1
1.2 Neurocisticercose humana .................................................................................................. 3
1.3 Taenia crassiceps .............................................................................................................. 10
1.4 Modelos experimentais de cisticercose: intraperitoneal, subcutâneo e neurocisticercose. 12
1.5 Susceptibilidade e resistência de camundongos BALB/c e C57BL/6 na cisticercose
experimental............................................................................................................................ 16
2 JUSTIFICATIVA ..................................................................................................................... 19
3 OBJETIVOS ............................................................................................................................ 20
3.1 Objetivo geral: .................................................................................................................. 20
3.2 Objetivos específicos: ....................................................................................................... 20
4 MÉTODOS .............................................................................................................................. 21
4.1 Princípios éticos ................................................................................................................ 21
4.2 Manutenção de ciclo ......................................................................................................... 21
4.3 Infecção e eutanásia dos animais ...................................................................................... 21
4.4 Preparo do Homogenato encefálico .................................................................................. 22
4.5 Análise histopatológica ..................................................................................................... 22
4.6 Cultura das células do baço............................................................................................... 23
4.7 Ensaios Imunoenzimáticos (ELISA)................................................................................. 24
4.8 Análises estatísticas .......................................................................................................... 24
5 RESULTADOS ........................................................................................................................ 26
5.1 Análise histopatológica ..................................................................................................... 26
5.2 Análise de citocinas sistêmicas ......................................................................................... 29
5.3 Análise do peso dos baços ................................................................................................ 32
5.4 Análise de citocinas in situ ............................................................................................... 32
5.5 Análise do peso do cérebro ............................................................................................... 34
6 DISCUSSÃO............................................................................................................................ 35
7 CONCLUSÃO ......................................................................................................................... 41
REFERÊNCIAS .......................................................................................................................... 42
ANEXOS..................................................................................................................................... 52
x
TABELAS, FIGURAS E ANEXOS
Tabela 1: Processos patológicos gerais encontrados em camundongos C57BL/6,
inoculados ou não com cisticercos viáveis de T. crassiceps aos 90 DAI ...................... 27
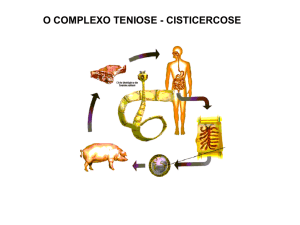
Figura 1: Ciclo biológico da Taenia solium .................................................................... 2
Figura 2: Endemicidade da Taenia solium em 2015 ....................................................... 3
Figura 3: Fotomicroscopia de encéfalo humano evidenciando os diferentes estágios de
desenvolvimento do cisticerco de T. solium ................................................................... 5
Figura 4: Ciclo biológico da Taenia crassiceps ............................................................ 11
Figura 5: Fotomicrografia dos processos patológicos gerais encontrados em
camundongos C57BL/6, inoculados com cisticercos viáveis de T. crassiceps aos 90 DAI
........................................................................................................................................ 28
Figura 6: Mesoscopia dos encéfalos de camundongos C57BL/6 inoculados ou não por
cisticercos de T. crassiceps ............................................................................................ 29
Figura 7: Concentração sistêmica das citocinas IL-4, IL-10 e IFN-γ, entre diferentes
estímulos utilizados na suspensão de células do baço de camundongos C57BL/6 dos três
grupos analisados ........................................................................................................... 30
Figura 8: Porcentagem do peso do baço em relação ao peso do camundongo dos grupos
experimentais CT saudável, CT cirúrgico e INF ........................................................... 31
Figura 9: Concentração das citocinas IL-4, IL-10 e IFN-γ no encéfalo (in situ) de
camundongos C57BL/6 dos grupos experimentais CT saudável, CT cirúrgico e INF, 90
dias após inoculação ...................................................................................................... 32
xi
Figura 10: Análise do peso da porção encefálica reservada para produção de
homogenato em camundongos C57BL/6 inoculados ou não com cisticercos viáveis de
T. crassiceps .................................................................................................................. 34
Anexo 1: Aprovação do CEUA-UFG............................................................................ 55
xii
SÍMBOLOS, SIGLAS E ABREVIATURAS
Ag – Antígeno
CD – Do inglês: Cluster of Differentation
Con-A – Concanavalina A
CSF – Flúido cerebrospinal
CT – Controle
DAI – Dias após inoculação/infecção
ELISA – Do inglês: Enzyme Linked Immuno Sorbent Assay
EUA – Estados Unidos da América
H&E – Hematoxilina-eosina
IFN-γ – Interferon gama
IgE – Imunoglobulina E
IL – Interleucina
INF – Infectado
KO – Do inglês: Nokaute
MHC – Complexo Principal de Histocompatibilidade
MN – Células mononucleares
NCC – Neurocisticercose
NK – Do inglês: Natural Killers
NO – Óxido nítrico
OMS – Organização Mundial de Saúde
ORF – Ontario Research Facilities
PBS – Tampão fosfato-salino
SBF – Soro Bovino
SNC – Sistema Nervoso Central
TGF-β – Fator de crescimento transformador β
Th – Linfócitos T helper
TLR2 – Do inglês: Toll Like Receptor 2
TNF – Fator de Necrose Tumoral
Treg – Linfócitos T reguladores
WT – Do inglês: Wilde Type/selvagem
xiii
RESUMO
A neurocisticercose (NCC) é uma das doenças negligenciadas pela Organização
Mundial de Saúde (OMS), e a infecção parasitária que mais acomete o Sistema Nervoso
Central (SNC) em todo o mundo. Dessa forma, faz-se necessário aprofundar os
conhecimentos quanto a sua imunopatogênese e fisiopatologia com o intuito de elucidar
mecanismos pelos quais a NCC provoca lesão tecidual nos pacientes infectados. Com o
advento desta necessidade a busca por formas de facilitar o estudo experimental desta
doença surgiram, e hoje, a utilização da espécie de cisticercos de Taenia crassiceps está
bem difundida no meio científico. O objetivo deste trabalho foi descrever os processos
patológicos gerais e o perfil de citocinas sistêmicas e in situ em camundongos C57BL/6,
após inoculação intracraniana de cisticercos viáveis de T. crassiceps. Para isso foram
utilizados três grupos experimentais: controle saudável, controle cirúrgico e grupo
infectado. Após 90 dias de infecção foi realizada eutanásia dos camundongos e
posteriormente foi realizada análise histopatológica dos encéfalos, cultura de células do
baço, produção de homogenato e ELISA para dosagem de IL-4, IL10 e IFN-γ. A análise
histopatológica dos encéfalos permitiu comprovar a presença do cisticerco, nos
ventrículos laterais ou na região extraparenquimal, presença de infiltrado inflamatório
mononuclear (MN) ao redor do parasito, microgliose e meningite discretas. As análises
dos perfis imunes sistêmico e in situ dos camundongos infectados não apresentou
diferenças estatisticamente significativas entre os grupos analisados, o que nos fazer
deduzir que o cisticerco exerce imunomodulação buscando sua sobrevivência, além do
que se beneficia também do imunoprivilégio cerebral. Em conclusão, correlacionando
os aspectos imunes e histológicos descritos após as análises realizadas, podemos sugerir
que a infecção por cisticercos de T. crassiceps em camundongos C57BL/6, desencadeia
resposta inflamatória com a presença infiltrado inflamatório MN, meningite e
microgliose.
Palavras-chave: neurocisticercose experimental, doenças negligenciadas, Taenia
crassiceps.
xiv
ABSTRACT
Neurocysticercosis (NCC) is one of the diseases neglected by the World Health
Organization (WHO), and the parasitic infection that most affects the Central Nervous
System (CNS) throughout the world. Thus, it is necessary to deepen the knowledge
regarding its immunopathogenesis and physiopathology in order to elucidate
mechanisms by which NCC causes tissue injury in infected patients. With the advent of
this necessity the search for ways to facilitate the experimental study of this disease has
arisen, and today, the use of the cysticercus species of Taenia crassiceps is well diffused
in the scientific environment. The objective of this work was to describe the general
pathological processes and the profile of systemic and in situ cytokines in C57BL / 6
mice after intracranial inoculation of viable cysticerci of T. crassiceps. Three
experimental groups were used: healthy control, surgical control and infected group.
After 90 days of infection, mice were euthanized and histopathological analysis of the
brain, spleen cell culture, homogenate production and ELISA for IL-4, IL10 and IFN-γ
were performed. The histopathological analysis of the encephalus allowed to verify the
presence of cysticercus in the lateral ventricles or in the extraparenchymal region,
presence of mononuclear inflammatory infiltrate (MN) around the parasite, microgliosis
and meningitis. The analysis of the systemic and in situ immune profiles of the infected
mice showed a predominance of Th2-type response, with high IL-4 concentration, low
IFN-γ and IL-10 levels modulating the two responses, but mainly Th1. The in situ
cytokine dosage was similar between the experimental groups, which leads us to
conclude that the cysticercus exerts immunomodulation for its survival, in addition to
which it also benefits from the cerebral immunoprivilege. In conclusion, correlating the
immune and histological aspects described after the analysis, we can suggest that T.
crassiceps cysticercosis infection in C57BL / 6 mice triggers an inflammatory response,
a predominance of Th2 type profile with MN inflammatory infiltrate presence,
Meningitis and microgliosis.
Key words: experimental neurocysticercosis, neglected diseases, Taenia crassiceps.
xv
1 INTRODUÇÃO
1.1 Complexo teníase/cisticercose
A teníase é definida como o parasitismo humano pela fase adulta do cestódeo
Taenia solium ou Taenia saginata; enquanto que a cisticercose é definida pelo
parasitismo da fase larval da T. solium em suínos e humanos. Ambas são consideradas
doenças parasitárias negligenciadas segundo a Organização Mundial de Saúde
(OMS/WHO) (NASH; MAHANTY; GARCÍA, 2013; CANTEY et al., 2014; WHO,
2015). No ciclo biológico da T. solium (Figura 1), o ser humano se comporta como
hospedeiro definitivo ao ingerir carne de porco malcozida e contaminada, adquirindo
teníase por meio do desenvolvimento do verme adulto em seu intestino o que possibilita
a eventual liberação de proglótes grávidas no meio ambiente através das fezes. Quando
os ovos de T. solium encontram-se no meio ambiente, passíveis de contaminar
alimentos e água, ocasionalmente porcos podem infectar-se, por serem hospedeiros
intermediários desse parasito, ou seja, abrigarem a sua fase de reprodução assexuada;
uma vez no trato digestório de suínos, os ovos de T. solium evaginam-se e passam a ser
chamados de oncosferas, penetram a mucosa intestinal do animal e alcançam as regiões
pelas quais tem tropismo, geralmente a musculatura esquelética; ao instalar-se recebem
o nome de larva metacestóide ou cisticerco. O ser humano pode desempenhar papel de
hospedeiro paratênico da T. solium, ou seja, abrigar uma forma do parasito que não se
desenvolverá; o cisticerco. Quando o homem assume esse papel e ingere ovos do
parasito em água ou vegetais contaminados, o mesmo desenvolve a cisticercose
(heteroinfestação); dependendo do local de instalação do cisticerco, a doença recebe um
determinado nome, sendo a mais comum e mais grave delas, a neurocisticercose (NCC),
quando o cisticerco se aloja no sistema nervoso central (SNC) do ser humano
(FLISSER, 1991).
Outras formas de aquisição de cisticercose são a auto infestação interna e externa,
ambas restritas a indivíduos portadores de teníase. A primeira ocorre quando há a
regurgitação e imediata deglutição de ovos, os quais rompem-se no estômago por ação
do suco gástrico e liberam os embriões que penetram o intestino delgado, alcançam a
1
circulação e instalam-se no tecido neural; e a autoinfestação externa também em
portadores de teníase, por meio de mãos contaminadas (FLISSER, 1991; DANTAS et
al., 1999; TAKAYANAGUI; LEITE, 2001).
Figura 1: Ciclo biológico da Taenia solium
Fonte: Adaptado de http://www.cdc.gov/dpdx/cysticercosis/index.htmL
O complexo teníase/cisticercose incapacita e leva à óbito milhões de pessoas
todos os anos, representando uma necessidade médica importante que permanece não
atendida, recebendo pouco investimento em pesquisa, tratamento, controle e prevenção;
o que a classifica como uma doença negligenciada (CANTEY et al., 2014). Todos esses
fatores somados à economia desfavorecida dos países onde a T. solium é endêmica
2
dificultam a identificação e o tratamento das doenças causadas por esse parasito, a partir
do momento em que para que se tenha um diagnóstico confiável das mesmas, há
diversos obstáculos, como a baixa sensibilidade de testes sorológicos, a falta de
infraestrutura e disponibilidade de tomografias computadorizadas e ressonâncias;
exames que facilitariam a identificação de cisticercos no tecido neural de pacientes com
NCC (NASH; MAHANTY; GÁRCIA, 2013).
1.2 Neurocisticercose humana
A NCC é a infecção parasitária que mais acomete o SNC, é a principal causa de
epilepsia adquirida em todo o mundo, o que representa, em média, 29% das pessoas
com epilepsia em países endêmicos (WHO, 2015; CANTEY et al., 2014; CARPIO &
ROMO, 2014). A Organização Mundial de Saúde (WHO, 2015) estima que pelo menos
50 milhões de pessoas no mundo têm epilepsia, e que cerca de um terço de todos os
casos ocorrem em regiões onde a infecção por T. solium é endêmica (Figura 2).
Figura 2: Endemicidade da Taenia solium em 2015.
Fonte: Adaptado de http://www.who.int/taeniasis/Endemicity_Taenia_Solium_2015.jpg?ua=1
3
A NCC se manifesta de diferentes formas no hospedeiro humano, na maioria dos
casos, ela é assintomática, mas quando sintomática, leva a convulsões (80%), cefaleia
(38%), déficits neurológicos focais (16%), declínios cognitivos (5%) e sinais de
hipertensão intracraniana (12%). Essas manifestações clínicas são dependentes de fatos
relacionados tanto com o parasito (tamanho, localização, estágio de desenvolvimento)
quanto com o hospedeiro (resposta imune do mesmo) (SCIUTTO et al., 2007;
CARABIN et al., 2011; GARCÍA; NASH; DEL BRUTTO, 2014; FOGANG et al.,
2015). A grande diversidade das formas clínicas variam de completa ausência de
resposta imune (NCC assintomática com cisticerco viável modulando a resposta imune)
à intensa resposta inflamatória (NCC sintomática com cisticerco inviável)
(CÁRDENAS et al., 2011; TUERO et al., 2015; FLEURY et al., 2016).
Quanto aos estágios de desenvolvimento do cisticerco, este apresenta-se
polimorfo (Figura 3), pois quando alcança o SNC do hospedeiro o mesmo se encontra
em sua fase viável, ou seja, na etapa vesicular, a qual se caracteriza por uma vesícula de
membrana transparente, contendo um escólex invaginado rodeado de um líquido
translúcido. Após esta fase, o cisticerco está susceptível à ação do sistema imune
humano, podendo se manter viável por anos ou começar a sofrer degradações
gradativas. A primeira característica de involução do cisticerco é a necrose da larva e
degeneração hialina do escólex o que deixa o líquido vesicular mais turvo,
esbranquiçado, classificando essa fase como etapa vesicular coloidal. Após essa fase, há
progressão da involução do cisticerco para fase granular, com a diminuição da vesícula
e a granulação do escólex, até a calcificação, chegando a etapa final de degradação do
parasito, a nodular calcificada. É comum encontrar cisticercos em diferentes fases de
degradação no mesmo hospedeiro (LINO-JÚNIOR et al., 2002; GUIMARÃES et al.,
2009; FOGANG et al., 2015).
4
Figura 3: Fotomicroscopia de encéfalo humano evidenciando os diferentes estágios de desenvolvimento
do cisticerco de T. solium. A – Etapa vesicular/ PAS; B – Etapa vesicular coloidal/Hematoxilina férrica;
C – Etapa granular nodular/ H&E; D – Etapa nodular calcificada/ H&E. Objetiva de 50x em todas as
fotomicrografias.
Fonte: Adaptado de Lino-Júnior, 2000.
O organismo humano imunologicamente competente, quando entra em contato
com algum patógeno, gera uma resposta imunológica inata ou natural e adaptativa ou
adquirida objetivando a destruição do patógeno. A eficácia protetora ou patogênica da
resposta inata depende grandemente da geração de fenômenos inflamatórios
inespecíficos localmente na vizinhança do patógeno, enquanto a da resposta imune
adaptativa repousa sobre uma proliferação clonal seletiva sistêmica de células linfoides
e posterior diferenciação efetora das células Th1, Th2, Treg, Th17, dentro outros perfis
recém descobertos; com a produção subsequente de várias citocinas, ou de células
plasmáticas com produção de anticorpos específicos (ABBAS et al., 2017; SCIUTTO et
al., 2007; TURVEY et al., 2009).
A imunidade inata é a primeira linha de defesa do organismo e fazem parte dela
as barreiras anatômicas e fisiológicas, as células e os componentes humorais (TURVEY
et al., 2009). Apesar de possuir alguns mecanismos de defesa envolvendo macrófagos
5
classicamente e alternativamente ativados, células NK, mastócitos, neutrófilos e
eosinófilos, estes possuem especificidade baixa reconhecendo os patógenos por um
número limitado de receptores, chamados de receptores de reconhecimento de padrões
(PRRs) (HOLZL et al., 2008). No entanto, este número limitado de receptores é
compensado pelo reconhecimento de componentes microbianos chamados de padrões
moleculares associados à patógenos (PAMPs) que são compartilhados pela maioria dos
grupos de agentes patogênicos (TURVEY et al., 2009). Quando em contato com
helminto, os fagócitos da imunidade inata secretam substâncias microbicidas para
destruir organismos que são muito grandes para serem fagocitados. Entretanto, muitos
desses parasitos possuem o tegumento espesso, o que os torna resistentes a este
mecanismo (ABBAS et al., 2005).
A imunidade adquirida é ativada e desenvolvida apenas após a exposição ao
antígeno e envolve componentes celulares e humorais, sendo os linfócitos T e B, as
principais células que compõem esta resposta; possui grande diversidade de receptores,
sendo estes, muito específicos; o benefício desta diversidade é que esta imunidade
reconhece praticamente qualquer tipo de antígeno (ABBAS et al., 2005; TURVEY et
al., 2009). Esta é caracterizada por perfis de células T que utilizam de diferentes
mecanismos com a intenção de matar o parasito quando a imune inata não foi capaz de
fazê-lo. Vários perfis imunes de células T já foram descritos, os primeiros foram os
perfis Th1 e Th2 (MOSMANN et al., 1986; MOSMANN & SAD, 1996); e
posteriormente os demais, Th17 e T regulador (Treg) (BOYTON et al., 2002).
A diferenciação de linfócitos Th em Th1, Th2, Th17 ou Treg ocorre a partir de
uma célula T naive precursora ou T auxiliar periférica (Thp), em resposta aos estímulos
fornecidos pela célula apresentadora de antígenos (APC) no momento da apresentação
do mesmo (BOYTON et al., 2002; ANSEM et al., 2009). O perfil Th1 é caracterizado
pela produção de IFNℽ, através da fosforilação dos fatores de transcrição STAT-4 e Tbet, por estímulo de IL-12; e está envolvido na imunidade celular à patógenos
intracelulares, mas também estimula alguns anticorpos; com posterior ativação de
macrófagos classicamente ativados (BOYTON et al., 2002; ANSEM et al., 2009). O
perfil Th2 permite a produção de IL-4, IL-5 e IL-13 e participa na imunidade humoral,
ou seja, produção de anticorpos em infecções helmínticas e outros patógenos
6
extracelulares; além de estimular a produção de macrófagos alternativamente ativados.
Este processo é ativado pelo estímulo de IL-4 à célula T naive que leva à transcrição do
fator STAT-6 e expressão de GATA-3 (ANSEM et al., 2009).
O perfil Th17 é induzido por TGFβ, IL-6, IL-21 e IL-23, e requer ativação de
um fator de transcrição chamado RORɣt e a fosforilação do fator STAT-3. O perfil
Th17 é caracterizado pela produção de IL-17 e IL-22 e participa na defesa contra
bactérias e fungos extracelulares, principalmente na superfície de mucosas (CHEN et
al., 2007). Por fim, o perfil Treg que é responsável por regular/modular os demais perfis
para que haja efetivo controle das infecções e prevenção de doenças autoimunes através
do controle dos potenciais efeitos patogênicos dos perfis efetores (VIGNALI et al.,
2008; SHEVACH 2009). O perfil Treg é desencadeado pela estimulação por IL-10
principalmente, IL-12 e TGFβ1 de células T naive, que acarreta na fosforilação dos
fatores de transcrição STAT-5 e Foxp3, resultando em produção de IL-10 e TGFβ1
(HORI et al., 2003; FONTENOT et al., 2003). Este perfil exerce função supressora
sobre as respostas Th1 e Th2 (KANANGAT et al., 1996; KIM et al.,2007).
A imunidade adquirida frente à muitas infecções helmínticas, é geralmente
mediada pela ativação de linfócitos Th2, a qual resulta na produção de anticorpos IgE e
na ativação de eosinófilos. Este quadro é atribuído à capacidade dos helmintos de
estimular a subpopulação de linfócitos Th2 através da alta secreção de IL-4 e IL-5. Os
anticorpos IgE produzidos ligam-se à superfície do helminto e os eosinófilos se aderem
aos seus receptores, sendo ativados e liberando grânulos com enzimas que destroem o
parasita (ABBAS et al., 2005; HEWITSON et al., 2009).
As lesões na SNC induzem imunossupressão sistémica, que é caracterizada por
desvio sistêmico para um padrão de citocinas do perfil Th2 que resulta em aumento da
neuroproteção e regeneração, além de expansão de células Treg que produzem IL-10
e/ou TGFβ (SCIUTTO et al., 2007; TERRAZAS 2008; JACKSON et al., 2008). No
entanto, a resposta imunológica sistêmica na NCC raramente foi explorada em relação
às várias formas clínicas da infecção. A escassa informação relatada não coincide
totalmente entre os estudos. A falta de coincidência pode estar apontando para a
heterogeneidade da NNC ou para diferenças significativas nos critérios de inclusão dos
estudos de casos em NCC (SCIUTTO et al., 2007).
7
É importante ressaltar que dentro do quadro de NCC, a resposta imune e
inflamatória do organismo humano parece se estabelecer de forma peculiar, sob
interferência do imunoprivilégio cerebral, o qual afeta diretamente a forma como o
cisticerco gera inflamação e alterações no microambiente cerebral, este pode ser um dos
fatores que tornam a NCC tão polimórfica e heterogênea. O cérebro, assim como outros
órgãos, é considerado imunoprivilegiado, por possuir mecanismos e componentes que
buscam minimizar a resposta imune frente à infecções, inflamações e distúrbios
neurológicos, como a barreira hematoencefálica, os astrócitos, a circulação
intracerebral; além de produção de citocinas imunossupressoras, neuropeptídios,
limitação da expressão de MHC classe I e II, proteínas reguladoras do complemento e
inibidores de células NK (FERGUSON; GRIFFITH, 1997; CARDONA et al., 1999;
SIETSKE et al., 2000).
A presença do cisticerco viável de T. solium no tecido encefálico de seres
humanos desencadeia aumento local de células inflamatórias através das principais vias
de infiltração leucocitária (vasos parenquimais e do espaço subaracnóide e plexo
coroide) (RANSOHOFF et al., 2003). Dentro do SNC os parasitas podem se instalar no
parênquima encefálico, no espaço subaracnóide, no sistema ventricular (DEL BRUTTO,
2014) de forma menos frequente podem ser encontrados também no tronco cerebral
(DEL BRUTTO, O; DEL BRUTTO, V, 2013) e na medula espinhal (CÁRDENAS et
al., 2016).
Em 2015 pesquisadores testaram e provaram a hipótese de que a resposta imune
e inflamatória frente à NCC está diretamente relacionada à localização do parasito e às
manifestações clínicas da infecção. Foi comparada a resposta imune do hospedeiro na
NCC subaracnóide, caracterizada por um crescimento descontrolado da membrana do
parasito, com a NCC parenquimatosa, associada com granulomas e calcificações;
comparando com um grupo controle não infectado que combinavam em idade e sexo
com os pacientes infectados; Concluindo que a localização da infecção influencia a
natureza da resposta imune periférica e que, a NCC subaracnóide tem um ambiente
imunológico mais regulatório do que a NCC parenquimatosa, entretanto, não puderam
determinar se este estado regulador na doença subaracnóide é a consequência de uma
resposta anti-inflamatória (ou reguladora) mais intensa do que a observada na NCC
parenquimatosa (TUERO et al., 2015).
8
Cisticercos na fase vesicular no parênquima encefálico induzem pouca reação
inflamatória, presença de poucos fibroblastos e discreta gliose. Na fase vesicular
coloidal normalmente estão rodeados por infiltrado inflamatório com linfócitos,
neutrófilos, monócitos e células gigantes do tipo corpo estranho, além de fibroblastos e
fibras colágenas (LINO-JÚNIOR et al., 2002; DEL BRUTTO, 2014; FLEURY et al.,
2016).
Durante a fase vesicular coloidal há a predominância de uma resposta imune
Th1 (FLEURY et al., 2016). O edema regride quando os parasitos entram em fase
granular e nodular calcificada, onde aparecem rodeados de células mononucleares
(MN), que estão associadas à gravidade da doença, uma vez que a intensa inflamação
passa a causar danos graves no parênquima do hospedeiro, onde finalmente, o parasito
passa a se caracterizar por um nódulo fibroso rodeado por uma intensa gliose
astrocitária com proliferação microglial (LINO-JÚNIOR et al., 2002; DEL BRUTTO,
2014; FLEURY et al., 2016).
Os tipos de células mais abundantes no infiltrado em torno do parasito nas duas
últimas fases evolutivas são plasmócitos, linfócitos B e T, macrófagos e mastócitos.
Citocinas do perfil Th1 são predominantes e incluem IFN-γ e IL-18; citocinas do perfil
Th2, como IL-4, IL-13 também estão presentes, assim como as do perfil Treg como IL10 e TGF-β (FLEURY et al., 2016).
Essa característica de inflamação branda no início da infecção e mais intensa
conforme ela progride, se deve aos mecanismos de imunomodulação por parte do
cisticerco que possui diversas formas de evadir à resposta imune do hospedeiro,
protegendo-se e permanecendo viável por mais tempo. Uma dessas formas é
possivelmente a alta diferenciação de linfócitos Treg no local de instalação do parasito,
o que limita a neuroinflamação na NCC (FLEURY et al., 2016); esta hipótese foi
testada in vitro e in vivo onde cisticercos viáveis foram capazes de induzir um fenótipo
tolerogênico e particular de células dendríticas, o que por sua vez induziu a
diferenciação de linfócitos Tregs, o que favorece o prolongamento da doença e diminui
a possibilidade de agressão ao cisticerco (ADALID-PERALTA et al., 2003); outra
forma de induzir a produção de linfócitos Tregs é através da produção de IL-10 e TGFβ, por indução dos cisticercos (FLEURY et al., 2016).
9
Outra forma de evasão do sistema imune pelo cisticerco é através da liberação
de fatores imunomoduladores que promovem a geração de macrófagos alternativamente
ativados (FLEURY et al., 2016); Sob condições experimentais, tem sido referido que os
macrófagos alternativamente ativados podem mediar o controle da neuroinflamação
pela regulação positiva do receptor de tipo Toll 2 (TLR2); Sendo os TLR2 um dos
responsáveis por exacerbar a resposta inflamatória no microambiente do SNC, essa
regulação se dá com a intenção de minimizar a intensidade dessa resposta e
consequentemente os danos ao tecido encefálico (GUNDRA et al., 2011).
No espaço subaracnóide a reação inflamatória é intensa, causada pela instalação
do parasito nas meninges, composta por exsudado celular denso com fibras colágenas,
linfócitos, células gigantes e eosinófilos; aumento dos níveis de IL-5, IL-6 e IL-10
(FLEURY et al., 2016); a disseminação dessa reação pode danificar o quiasma óptico e
os nervos cranianos. É possível que esse quadro cause hipertensão intracraniana,
convulsões parciais e sinais neurológicos focais como declínio cognitivo e motor
(TAKAYANAGUI, 2013; DEL BRUTTO, 2014).
O cisticerco ventricular gera uma reação inflamatória quando em contato com o
plexo coroide ou com a parede do ventrículo. Nesses casos o revestimento ependimário
interrompido pode sobressair para as cavidades ventriculares e bloquear o trânsito do
fluido cerebrospinal (CSF), causando hidrocefalia; este bloqueio pode ser físico, pelo
próprio cisticerco. Esse tipo de NCC ocorre em cerca de 20-40% dos casos, e suas
características inflamatórias e obstrutivas são muitas vezes fatais, tendo, assim como a
NCC subaracnóide, a sintomatologia mais grave dessa parasitose (CHAVARRIA et al.,
2005; KOTHA, 2013; DEL BRUTTO, 2014; FLEURY et al., 2016).
1.3 Taenia crassiceps
Devido à alta semelhança antigênica com a T. solium, a T. crassiceps é utilizada
de forma experimental; é uma espécie de helminto da família Taenidae, ordem
Cyclophyllidae e classe Cestoda (FREEMAN, 1962; AROCKER-METTINGER et al.,
1992; MAILLARD, 1998). Em sua fase adulta o verme se aloja no intestino delgado de
10
canídeos como raposas, coiotes e cães domésticos; sendo estes considerados
hospedeiros definitivos desse parasito (Figura 4).
Eventualmente estes canídeos liberam em suas fezes, proglótes grávidas repletas
de ovos férteis, os quais são posteriormente ingeridos pelos hospedeiros intermediários,
os roedores. O embrião hexacanto eclode do ovo no trato digestório desses animais e
penetra a mucosa; alcança a circulação linfática e se instala em órgãos ou cavidades. As
áreas pelas quais este estágio embrionário tem mais tropismo são o tecido subcutâneo e
as cavidades pleural e abdominal onde desenvolve a larva metacestóide ou cisticerco
que se multiplica por diversos brotamentos formados a partir de sua membrana externa.
Sendo o hospedeiro definitivo predador do intermediário, estes ingerem os cisticercos e
desenvolvem o verme adulto, completando o ciclo biológico do parasito (SHIMALOY
& SHIMALOY, 2003).
Figura 4.: Ciclo biológico da Taenia crassiceps, com seus hospedeiros: (1) canídeos como hospedeiros
definitivos; (2) ovo presente nas fezes; (3) roedores como hospedeiros intermediários; (4) cisticerco; (5)
mamíferos como hospedeiros paratênico como o homem, lêmures e animais domésticos.
Fonte: Adaptado de Vinaud et al., 2007.
Apesar de raro é possível encontrar relatos de cisticercose por T. crassiceps em
seres humanos, quando este se comporta como hospedeiro paratênico, casos restritos à
indivíduos imunocomprometidos, os quais, podem ocasionalmente ingerir o cisticerco
em água ou alimentos contaminados, este migra para vários locais como fígado, SNC,
intraocular, intrapleural e região subcutânea (FREEMAN, 1962; DEBLOCK &
11
PETAVY, 1983; DYER & GREEVE, 1998; BROJER et al., 2002; VINAUD et al.,
2007).
A manutenção do ciclo da cepa ORF de T. crassiceps em laboratório para fins
experimentais é considerada acessível, uma vez que este patógeno se reproduz de forma
assexuada com boa reprodutibilidade, não desenvolve escólex, o que impede o
desenvolvimento do verme adulto; a produção demanda pouco investimento financeiro,
pode ser manuseada por qualquer profissional com treinamento rápido e fácil, além de
demandar pouco espaço físico. De forma oposta, infecções experimentais com T. solium
(e seus diferentes estágios larvais) poderiam trazer graves consequência ambientais,
com a possibilidade de disseminação de ovos com potencial infectante. Assim, a
multiplicação de cisticercos de T. crassiceps em laboratório, com condições controladas
e padronizadas, abre boas perspectivas para seu uso, como produção de antígenos
heterólogos e modelos experimentais (VAZ et al.,1997; GUSSO, 2000).
A resposta imune e sistêmica frente à infecção por T. crassiceps está pouco
descrita na literatura em modelos de NCC; entretanto Moura et al., 2015 descreveram
que em camundongos BALB/c a infecção por T. crassiceps desencadeou predomínio de
perfil Th1.
1.4 Modelos experimentais de cisticercose: intraperitoneal, subcutâneo e
neurocisticercose.
Diante da importância epidemiológica da NCC e da necessidade de maiores
estudos sobre esta doença, métodos de estudo foram criados para elucidar dúvidas
quanto às características da doença e de que forma ela poderia ser melhor tratada e
consequentemente diminuir as taxas de incapacitação e de mortalidade dessa
enfermidade. O primeiro obstáculo para entender a fisiopatologia da NCC é manter o
ciclo do parasito em laboratório, uma vez que a T. solium necessita de suínos para
completar seu desenvolvimento, exigindo uma infraestrutura ampla, alto custo para
manutenção desses animais, profissionais capacitados para o manuseio, dentre outras
condições específicas. Diante desta problemática e com o desenvolvimento de estudos
nesta área; surgir a possibilidade de trabalhar com uma cepa de parasito que fosse
12
antigenicamente semelhante a T. solium afim de reproduzir a NCC em modelos animais,
facilitando a compreensão desta doença tão antiga, mas ao mesmo tempo tão pouco
elucidada e perigosa.
Assim, a utilização da cepa Ontario Research Facilities (ORF) de T. crassiceps
que induz experimentalmente a NCC está amplamente difundida no meio científico,
uma vez que, esta demonstra-se como uma cepa de fácil manutenção, reprodução
assexuada e alta semelhança antigênica com a T. solium (VAZ et al., 1997;
ESPÍNDOLA et al., 2000, 2002). Prova disto é a existência de diversos estudos que
utilizam T. crassiceps com diferentes objetivos e evidenciam, cada dia mais sua
eficácia: como modelo experimental de NCC (MATOS-SILVA et al., 2012;
HAMAMOTO et al., 2016) como substrato para o desenvolvimento de testes
sorológicos que objetivam diagnosticar a NCC tanto em humanos como em modelos
animais (BUENO et al., 2000a, 2000b; PARDINI et al., 2001, 2002; PERALTA et al.,
2002, 2010; SILVA et al., 2015) e para desenvolvimento de vacinas contra cisticercose,
inicialmente, em modelos animais (TOLEDO et al., 1999; SCIUTTO et al., 2013a,
2013b).
Atualmente existem cinco tipos diferentes de modelos para NCC experimental.
O de Cardona et al (1999), MATOS-SILVA et al (2012), Verastegui et al (2015), Fleury
et al (2015) e Hamamoto et al (2016). O primeiro foi desenvolvido nos EUA por
Cardona et al (1999), utilizando camundongos BALB/c fêmeas infectadas com
Mesocestoides corti. Este trabalho foi pioneiro na área de NCC e foi o responsável por
desencadear o desenvolvimento de diversos outros trabalhos aprofundando o tema,
como a análise do papel dos linfócitos Tɣδ (CARDONA et al., 1999, 2002, 2003)
expressão e distribuição dos receptores Toll-Like (MISHRA et al., 2006) a migração de
leucócitos para o SNC (ALVAREZ & TEALE, 2006, 2008) estudo das proteínas do
complexo juncional (ALVAREZ & TEALE, 2007a, 2007b) estratégias de evasão imune
do hospedeiro pelo cisticerco (ALVAREZ; RIVERA; TEALE, 2008) o papel dos
macrófagos
alternativamente ativados
(MISHRA;
GUNDRA; TEALE,
2011;
GUNDRA et al., 2011) a função dos granulócitos na infecção (MAKEPEACE et al.,
2012); além de incentivar o desenvolvimento de outros modelos.
Posteriormente, no Brasil, nosso grupo de pesquisa desenvolveu um modelo de
NCC experimental utilizando cisticercos de T. crassiceps em camundongos das
13
linhagens BALB/c e C57BL/6 e caracterizamos a reação inflamatória desencadeada por
ela, descrevendo que os animais BALB/c são mais susceptíveis à NCC experimental
quando comparados com os C57BL/6 (MATOS-SILVA et al., 2012). Observaram
também que a presença de IL-4 na resposta inflamatória frente ao cisticerco instalado
pode estar relacionada com a exacerbação da mesma e destruição precoce do cisticerco,
uma vez que, após infectarem animais KO para IL-4, perceberam que os camundongos
nesta condição apresentaram menor intensidade no infiltrado inflamatório, assim como
menor ventriculomegalia e perivasculite (Matos-Silva, 2011).
Em 2015 foram desenvolvidos outros dois novos modelos experimentais para
NCC, um no Peru, por Verastegui et al (2015), com a inoculação de oncosferas ativas
de T. solium em ratos, e o outro no México, por Fleury et al (2015), através da
inoculação de oncosferas ativas de T. solium no espaço subaracnóide cerebral de suínos
jovens.
Verastegui et al (2015) descreveram que os ratos infectados desenvolveram
cisticercose no SNC depois de 4 meses, sendo os cisticercos encontrados no
parênquima, nos ventrículos ou na região meningo-cortical. Apesar de não haver
dependência de dose para a eficácia da infecção, a idade do animal era crucial para o
sucesso. A análise histológica evidenciou ao redor do cisticerco: colágeno, infiltrado
inflamatório, perivasculite, angiogênese e alteração de consistência do tecido.
Já Fleury et al (2015) perceberam que após a inoculação de oncosferas ativas em
suínos, houve a indução da NCC nesses animais; após 4 meses de infecção e posterior
eutanásia dos animais, os cisticercos tiveram suas características macroscópicas e
microscópicas descritas. A maioria dos cisticercos (60,3%) foram classificados como
calcificados ou caseosos e microscopicamente estavam cercados por resposta
inflamatória exacerbada com infiltrado MN e expressão elevada de CD80, CD106,
CD69 e IL-10; expressão moderada de IL4, TNF-α, e CD54, baixa expressão da IL-17 e
IL-6.
O mais recente modelo experimental para NCC foi desenvolvido por Hamamoto
et al (2016). Os quais simularam radiologicamente e morfologicamente a NCC
racemosa/racêmica ou extraparenquimal em ratos, por meio da inoculação de cistos de
T. crassiceps. Após ressonância magnética e avaliação histológica, os autores deste
trabalho confirmaram que os achados são semelhantes aos encontrados na NCC
14
recêmica humana, incluindo aumento das cisternas basais, hidrocefalia e infiltração
inflamatória através do ependima e do plexo coróide em espaços de ocupados por
líquido cefalorraquidiano.
Freitas et al., (2012) descreveram modelo de cisticercose subcutânea utilizando
também T. crassiceps. Este estudo tinha por objetivo avaliar as alterações
histopatológicas e imunológicas, que se seguiram à inoculação deste parasito, no tecido
subcutâneo de camundongos C57BL/6. Microscopicamente, granulomas formados por
neutrófilos e macrófagos foram observados nos locais de inoculação. A concentração,
no soro, de IFN-γ aumentou ao longo do curso da infecção, enquanto que a
concentração IL-4 aumentou durante o período de transição da fase inicial (7-30 dias
após infecção - DAI) à fase tardia (60-90 DAI) da infecção. Por fim, este trabalho
possibilitou descrever que a destruição do parasito parece estar associada a um aumento
de IFN-γ, uma vez que o aumento da concentração dessa citocina está diretamente
relacionada com o aumento do número de parasitos mortos; o que sugere que uma
resposta do tipo Th1 é importante no controlo do parasito.
Por outro lado, o modelo de cisticercose subcutânea desenvolvido por Gaspar;
Sakai; Gaspari (2014) foi realizado por meio da injeção de 50 cisticercos sem
brotamento (T. crassiceps) que gerou a formação de uma bolha de ar na região dorsal de
camundongos BALB/c. Aos 7 e 30 DAI os camundongos foram eutanasiados e tiveram
o fluido da bolsa recolhido para determinar o número de células acumuladas e as
concentrações de IFN- γ, IL-2, IL-4, IL-6, IL-10 e de óxido nítrico (NO). Este modelo
induziu nível elevado de IFN-ɣ e alta produção de NO em relação à carga do parasito. A
bolsa de ar fornece uma cavidade conveniente que permite estudar os aspectos
imunológicos celulares da T. crassiceps, permitindo demonstrar que este modelo é uma
ferramenta alternativa para a avaliação das características imunitárias de infecção por
este parasito.
Por ser o modelo de indução de cisticercose mais antigo, há inúmeros relatos de
inoculação intraperitoneal em diferentes animais, com diversas espécies de parasitos. Os
que mais contribuem para esse trabalho e serão citados aqui são os modelos de Toenjes
& Kuhn (2003) e Zepeda et al (2010). Toenjes & Kuhn (2003) inocularam
intraperitonealmente cisticercos de T. crassiceps em camundongos da linhagem
BALB/c e para determinar a produção de citocinas (IL-4, IL-10 e IFN-γ) realizaram
15
ELISA sanduíche com o sobrenadante da cultura de células do baço, de nódulo linfático
mesentérico (MLN) e das células do exsudato peritoneal (PECs) e diante dessas análises
puderam encontraram um perfil de resposta mista (Th1/Th2) frente à cisticercose,
levando a um controle maior do desenvolvimento parasitário; estes achados foram
baseados na descrição de altos níveis séricos de IL-4 na fase inicial da infecção e de
IFN-ɣ na fase tardia. Essas citocinas também foram altamente produzidas por PECs em
resposta a estimulação antigênica específica.
Em seu modelo de cisticercose intraperitoneal Zepeda et al (2010) inocularam
cisticercos de T. crassiceps em camundongos BALB/c fêmeas e analisaram por
citometria de fluxo as células inflamatórias peritoneais; além de investigar a existência
de apoptose por ensaio de TUNEL, a atividade de caspase-3 por imunofluorescência, a
possível fragmentação do DNA por eletroforese e análise da densidade das células
peritoneais por microscopia eletrônica de transmissão. Ao fim das análises, os autores
descreveram uma importante diminuição contínua de linfócitos CD4+, CD8+ e CD19+,
e um aumento de eosinófilos e macrófagos durante todo o tempo de infecção. A
apoptose de eosinófilos foi quantificada durante o período experimental com um pico a
6 DAI (67,27%) e outro aos 12 dias (92,3%) além e uma redução significativa de
linfócitos CD4+, CD8+, CD19+ nesse dia experimental. A atividade da caspase-3 no
fluido peritoneal, a fragmentação de DNA de células peritoneais e a apoptose de
eosinófilos e monócitos foram encontrados. Os autores sugerem que a diminuição
dramática de linfócitos T e B peritoneais e o elevado nível de apoptose de eosinófilos
em camundongos infectados por T. crassiceps podem ser fatores importantes da
imunossupressão observada na cisticercose intraperitoneal.
1.5 Susceptibilidade e resistência de camundongos BALB/c e C57BL/6 na
cisticercose experimental.
É importante ressaltar as diferenças existentes entre a resposta inflamatória, o
perfil celular e de citocinas de diferentes linhagens de camundongos, frente a
cisticercose experimental. Fragoso et al (2008) fizeram um estudo retrospectivo de seus
próprios registros, nos últimos 14 anos em cisticercose experimental intraperitoneal por
16
T. crassiceps e perceberam que em 16, de 17 diferentes linhagens de camundongos, as
fêmeas são mais frequentemente infectadas e transportam carga individual parasitária
maior que os machos, o que evidencia um maior potencial dos machos em conter o
crescimento do cisticerco. No mesmo ano Terrazas (2008) relatou que os camundongos
da linhagem BALB/c são particularmente suscetíveis à infecção com T. crassiceps, com
uma predominância da resposta imune Th2. Por outro lado, os camundongos da
linhagem C57BL/6 são conhecidos por terem uma resistência genética à infecção por
este parasito com predomínio de uma resposta mista Th1/Th2. Corroborando com
Toenjes & Kuhn (2003) que observou nos animais da linhagem BALB/c, um perfil de
resposta anti-inflamatória e, em camundongos C57BL/6, o perfil de resposta observado
é mais pró-inflamatório.
Ao analisar a cinética da resposta inflamatória na cisticercose subcutânea
induzida em camundongos C57BL/6 e BALB/c, por T. crassiceps, Freitas et al (2012)
observaram que os camundongos BALB/c são mais susceptíveis à infecção por T.
crassiceps uma vez que nesses animais foi encontrado um maior número de cisticercos
na cavidade peritoneal ou no nódulo subcutâneo, quando comparado com a outra
linhagem estudada. O número de cisticercos encontrados nos animais C57BL/6 não foi
apenas menor que nos BALB/c, como também, estes estavam em estado de calcificação,
demonstrando que o sistema imune desses animais desencadeou uma morte mais eficaz
e mais rápida desse parasito.
Os achados acima citados corroboram com Matos-Silva et al (2012) (NCC) e
Pereira et al (2016) (cisticercose subcutânea) os quais observaram que os camundongos
BALB/c, são menos eficientes em destruir precocemente o parasito, permitindo sua
propagação e que apresentam intensidade inflamatória maior na fase aguda da infecção,
caracterizada pelo predomínio de células polimorfonucleares e macrófagos. Enquanto a
linhagem de camundongos C57BL/6 é mais capaz de provocar a morte do parasito, com
intensidade inflamatória na fase mais tardia da infecção com menos alterações e lesões;
com predomínio de células MN, portanto, é considerada mais resistente à cisticercose
por T. crassiceps. Portanto a resistência de camundongos C57BL/6 à cisticercose por T.
crassiceps foi confirmada na cisticercose subcutânea e intraperitoneal; e sugerida na
encefálica (NCC). O que é possível perceber com as análises citadas é que as
cisticercoses subcutânea e intraperitoneal desencadeiam perfis imunes diferentes dos
17
observados na NCC, afetados diretamente pela linhagem de camundongos utilizada e
pelo sexo dos mesmos.
18
2 JUSTIFICATIVA
A importância de estudar a NCC está bem evidenciada na literatura, uma vez
que é uma doença negligenciada, leva a óbito e incapacita milhares de pessoas em todo
o mundo; além de ser a principal infecção parasitária que acomete o SNC em todo o
mundo. Essa importância se torna ainda mais evidente quando se nota a emersão dessa
doença, uma vez que, a cada ano aumentam-se os casos notificados da mesma em
regiões não endêmicas, em países desenvolvidos; e junto a este fato, nota-se também o
aumento das taxas de emigração, o que é um fator determinante para a disseminação da
NCC em países não endêmicos, estando disponível diversos relatos de casos sob esta
condição na literatura.
Na NCC humana as lesões teciduais encontradas são diretamente dependentes
do estágio de desenvolvimento e do local de instalação do parasito, além da intensidade
da resposta imune do hospedeiro frente ao parasito. Assim como observado nos
modelos animais, os seres humanos também parecem apresentar certa resistência ou
susceptibilidade à NCC, uma vez que alguns indivíduos apresentam lesões teciduais
graves quando o cisticerco se aloja no parênquima encefálico, enquanto outros
desenvolvem a NCC assintomática na mesma condição.
Em modelos experimentais a linhagem de camundongos C57BL/6 é mais
resistente à cisticercose intraperitoneal e subcutânea quando comparada com a BALB/c.
Nosso estudo, visa descrever as lesões encefálicas na linhagem de camundongos
C57BL/6 e avaliar a resposta imune sistêmica e in situ frente à inoculação de cisticercos
de T. crassiceps; sendo o primeiro trabalho a fazer essa descrição nesta linhagem.
19
3 OBJETIVOS
3.1 Objetivo geral:
Descrever as lesões teciduais e o perfil de citocinas sistêmicas e in situ de
camundongos C57BL/6, após inoculação intracraniana de cisticercos viáveis de T.
crassiceps.
3.2 Objetivos específicos:
✓ Descrever as lesões encefálicas causadas pela inoculação ou não de cisticercos
viáveis de T. crassiceps;
✓ Descrever o perfil de citocinas IFN-ℽ, IL-4 e IL-10 sistêmicas e in situ de
camundongos infectados ou não com cisticercos de T. crassiceps;
20
4 MÉTODOS
4.1 Princípios éticos
Este estudo obedeceu às normas estabelecidas pela Sociedade Brasileira de
Ciências em Animais de Laboratório; foi aprovado pela Comissão de Ética do Uso de
Animais (CEUA/UFG) protocolo nº 065/2015.
4.2 Manutenção de ciclo
A manutenção da cepa ORF de T. crassiceps, foi realizada por passagens
sucessivas intraperitoneais, a cada 90 dias, em camundongos fêmeas BALB/c de 8 a 12
semanas de idade, desde 2002, de acordo com Vaz et al (1997). Esta cepa é mantida no
Biotério do Instituto de Patologia Tropical e Saúde Pública da Universidade Federal de
Goiás (IPTSP/UFG).
4.3 Infecção e eutanásia dos animais
Para o delineamento experimental foram utilizados camundongos da linhagem
C57BL/6 WT (Wild type) fêmeas com 8 a 12 semanas de idade, pesando entre 20-30
gramas (n=34). Estes foram divididos em três grupos: controle saudável (CT saudável),
controle cirúrgico (CT cirúrgico) e infectados (INF), em apenas um dia experimental
(90 DAI). Os grupos CT cirúrgico e INF foram sujeitos a mesma metodologia inicial:
foram pesados e anestesiados intraperitonealmente com uma solução de Cetamina 100
mg/mL e Xilazina 20 mg/mL na proporção de 0,1mL/10g; após tricotomia dos pelos da
porção superior da cabeça seguida por antissepsia com iodo tópico, uma incisão
longitudinal e mediana na pele e tecido subcutâneo foi realizada, com lâmina de bisturi,
21
para expor a superfície do crânio. O orifício de trepanação foi realizado com uma broca
diamantada (44,5mmX2mm) movida por micromotor (LB100 – Beltec) (MATOSSILVA et al., 2012).
O grupo INF recebeu de 3 a 5 cisticercos viáveis de T. crassiceps
intracranialmente, enquanto o grupo CT cirúrgico foi inoculado com 10µL de salina
estéril, ambos com 2-3 mm de profundidade; e em seguida, o orifício de trepanação foi
fechado com massa plástica estéril (Jeltrate®) e a incisão com cola instantânea
(MATOS-SILVA et al., 2012). O grupo CT saudável foi utilizado como controle
positivo das metodologias realizadas, e eram equivalentes em idade aos animais
inoculados.
Aos 90 DAI, os camundongos dos grupos CT cirúrgico e INF foram
eutanasiados por deslocamento cervical e tiveram seus encéfalos e baços retirados.
Imediatamente após a retirada dos baços, foi realizada a pesagem desse órgão e a
cultura de células dos mesmos. Os encéfalos foram cortados no local da perfuração para
inoculação, as porções anteriores foram fixados em paraformaldeído 4%, por 24 horas e
posteriormente em solução alcoólica 70% para análise histopatológica. Enquanto que as
porções posteriores foram congeladas à -80ºC para produção de homogenato e dosagem
de citocinas in situ.
4.4 Preparo do Homogenato encefálico
Após extração, o fragmento de tecido encefálico reservado para esta
metodologia foi congelado à -80ºC. Posteriormente foi preparada a solução utilizada
para sonicar o tecido. A solução era composta de Tris HCl, NP40 1% (SIGMA) e
inibidor de protease (MACHADO et al., 2014).
4.5 Análise histopatológica
22
A análise histopatológica foi realizada com fragmentos de tecido encefálico
cortados em matriz para corte de cérebro de camundongos (Insight®) fixados em
paraformaldeído 4% e solução alcoólica 70%, desidratados em álcoois, diafanizados em
xilol, incluídos em parafina, confeccionados blocos e posterior confecção de cortes com
4 µm de espessura. Os fragmentos foram capturados em lâminas de vidro e
posteriormente, corados pela técnica de hematoxilina-eosina (H&E) (LINO-JR et al.,
2002).
Os processos patológicos gerais analisados no tecido do hospedeiro, em todos os
grupos experimentais, foram: meningite, edema parenquimal e perivascular, hiperemia,
perivasculite, infiltrado inflamatório, microgliose, ventriculomegalia, alterações no
hipocampo, coroidite, ependimite, hemorragia, perda de tecido no local da inoculação e
compressão do hemisfério com desvio da linha média. Foram descritos e classificados
de forma semi-quantitativa, seguindo os seguintes critérios: ausente (quando não
compromete o tecido do hospedeiro) e atribuído score = 0; discreto (com
comprometimento de até 25% da área) e atribuído score = 1; moderado (de 26 a 50%) e
atribuído score = 2; e acentuado quando há acima de 50% de comprometimento e
atribuído score = 3 (LINO-JR et al., 2002; MATOS-SILVA et al., 2012). Foram
considerados todos os achados de todos os camundongos, em todas as intensidades para
considerar as características patológicas de cada grupo experimental.
4.6 Cultura das células do baço
Após a eutanásia os baços removidos foram pesados e transferidos para uma
placa de Petri com 2mL de RPMI. O órgão foi macerado e as células em suspensão
foram lavadas duas vezes por centrifugação (10 minutos à 10ºC). O sobrenadante foi
descartado e as células obtidas foram homogeneizadas no vortex e posteriormente
incubadas com solução concentrada de lise para hemácias (TRIS HCl 17mM e Cloreto
de Amônio 0,144M em água milli-Q) à 37ºC por 5 minutos. Ao fim do tempo
necessário o meio de cultura RPMI completo suplementado com 10% de Soro Bovino
Fetal (SBF) inativado, 200 mM de L-glutamina, 100 U/mL de penicilina, de 100 mg/mL
23
de estrepmicina e 50 mM de 2-mercaptoetanol. As células foram novamente lavadas
duas vezes e ressuspendidas com RPMI completo.
Para contagem das células foi realizada uma diluição de 1/10 com azul de
Tripan, permitindo quantificação e análise da viabilidade celular por meio de uma
câmara de Newbauer em Microscópio óptico. A concentração das células foi ajustada
para 5x106 células/mL em RPMI completo. Um mililitro de suspensão do baço de cada
amostra foi adicionado à concanavalina-A (20µL a 250µg/mL), ou extrato antigênico de
cisticercos viáveis de T. crassiceps (25µL a 50µg/mL), ou não receberam estímulo;
foram acondicionados à 36ºC em estufa com 5% de CO2 durante 48 horas. Após este
período o sobrenadante foi recolhido e utilizado para a quantificação de IFN-γ, IL-10 e
IL-4 por meio de ensaio Imunoenzimático (ELISA).
4.7 Ensaios Imunoenzimáticos (ELISA)
As citocinas IL-4, IFN-ɣ e IL-10 foram quantificadas por ELISA sanduíche de
acordo com as instruções do fabricante (BD OptEIA™), a partir do homogenato
encefálico. Para a dosagem de IL-4 e IL-10 foram utilizados os kits Mouse IL-4 ELISA
(Lote: 26389) e Mouse IL-10 ELISA (Lote: 20169) Set BD OptEIA™ (BD Biosciences,
San Diego, CA) enquanto que para a dosagem de IFN-ɣ as microplacas para ELISA
High biding foram sensibilizadas com 80µL de anticorpo monoclonal para IFN-ɣ
(5μg/mL do clone XMG 1,2 em PBS). A densidade optica foi detectada por leitor de
microplacas Thermo Labsystems, com filtros específicos para cada citocina (OLIVEIRA
et al., 2000).
4.8 Análises estatísticas
Os processos patológicos gerais analisados histopatologicamente foram
submetidos à teste estatístico por meio do programa Sigma Stat 2.3. Foi utilizado o teste
24
de Mann-Whitney uma vez que as variáveis qualitativas foram transformadas em
quantitativas. As diferenças foram consideradas estatisticamente significativas quando
p=0,05.
Para análise estatística da porcentagem do peso dos baços dos camundongos
infectados e controles, foi elaborado um banco de dados eletrônicos no programa
Microsoft Office Excel (2007) relacionando o peso do camundongo ao peso do baço.
Por meio do programa GraphPadPrism 5.0 aplicou-se o teste ANOVA, pois, as
variáveis tinham distribuição normal. Comparou-se as diferenças estatísticas entre os
grupos, as quais foram consideradas estatisticamente significativa quando p≤0,05.
Para análise estatística das dosagens de citocinas sistêmicas e in situ também foi
elaborado um banco de dados eletrônico no programa Microsoft Office Excel (2007).
Em seguida, as variáveis foram testadas utilizando o programa GraphPadPrism 5.0, uma
vez estabelecida a distribuição e a variância foi aplicado os testes: teste-t ou MannWhitney, ANOVA ou Kruskal-Wallis e foram consideradas estatisticamente
significativas quando p≤0,05.
25
5 RESULTADOS
5.1 Análise histopatológica
A análise histopatológica dos encéfalos permitiu avaliar as consequências do
procedimento cirúrgico e da infecção de camundongos C57BL/6 com cisticercos viáveis
de T. crassiceps. Um único observador realizou esta análise, de forma independente e
sem interferência. Os processos patológicos gerais encontrados foram listados e
descritos quanto à sua intensidade na Tabela 1. Foram observadas lesões e alterações
teciduais que estariam relacionadas com o procedimento cirúrgico ou que fossem
especificamente reacionais à presença do cisticerco.
Os
processos
patológicos
encontrados
que
apresentaram
diferenças
estatisticamente maiores no grupo INF quando comparado com o grupo CT cirúrgico
foram: meningite (p=0,05), edema parenquimal (p=0,05), infiltrado inflamatório MN
(p=0,05), microgliose (p=0,05) e compressão dos hemisférios (p=0,001) (Figuras 5 e 6).
26
Tabela 1: Processos patológicos gerais em camundongos C57BL/6, inoculados ou não com cisticercos
viáveis de T. crassiceps aos 90 DAI.
Processo Patológico
CT cirúrgico
Mediana
(min.-máx.)
INF
Mediana
(min.-máx.)
Meningite
0
(0-0)
0
(0-1)
0,05*
Edema parenquimal
0
(0-1)
1
(0-3)
0,05*
Hiperemia
0
(0-0)
0
(0-1)
0,153
Perivasculite
0
(0-0)
0
(0-2)
0,154
Infiltrado
inflamatório (MN)
0
(0-0)
0
(0-2)
0,05*
Microgliose
0
(0-1)
0
(0-2)
0,05*
Edema Perivascular
0
(0-0)
0
(0-1)
0,462
Ventriculomegalia
0
(0-0)
0
(0-3)
0,154
Alterações no
hipocampo
0
(0-0)
0
(0-3)
0,263
Coroidite
0
(0-0)
0
(0-0)
1
Ependimite
0
(0-0)
0
(0-0)
1
Perda de tecido
0
(0-2)
0
(0-3)
0,972
Compressão
0
(0-0)
2
(0-3)
0,001*
P
Legenda: CT = controle; INF = infectado; MN = células mononucleares; * = diferenças estatisticamente
significativas (p≤0,05). n = 10 grupo CT cirúrgico; n = 15 grupo INF.
27
Figura 5: Fotomicrografia dos processos patológicos gerais encontrados em camundongos C57BL/6,
inoculados com cisticercos viáveis de T. crassiceps aos 90 DAI. A – Meningite discreta no grupo INF
(seta); B – Edema parenquimal acentuado no grupo INF (seta); C – Perivasculite moderada no grupo INF
(seta); E – Microgliose moderada no grupo INF (setas). Escala de 100µm em A, B e D; Escala de 50µm
em C. CT = controle; INF = infectado. H & E. n = 15 no grupo INF.
A compressão dos hemisférios cerebrais com consequente deslocamento da
linha média, a qual foi ocasionado pela instalação e crescimento do cisticerco, tanto na
região meningo-cortical como nos ventrículos laterais, foi encontrada de forma
expressiva em todos os camundongos (n=15) do grupo INF. Os camundongos que
compõem o grupo CT cirúrgico não apresentaram tal alteração, o que pode ser
observado na Figura 6.
28
Figura 6: Mesoscopia dos encéfalos de camundongos C57BL/6 inoculados ou não por cisticercos de T.
crassiceps. A – Ausência de compressão dos hemisférios em camundongo do grupo CT cirúrgico; a seta
evidencia a perfuração do cérebro, com discreta perda de tecido local, provocada pela inoculação B, C e
D – Compressão dos hemisférios, deslocamento da linha média, do hipocampo e dos ventrículos laterais,
em camundongos do grupo INF (seta); Em D a seta evidencia a presença do cisticerco no ventrículo
lateral. CT = controle; INF = infectados. H & E (escala=1mm). n = 10 grupo CT cirúrgico; n = 15 grupo
INF.
5.2 Análise de citocinas sistêmicas
Como qualquer interferência na homeostase de um organismo leva à uma reação
do sistema imune, buscamos analisar a expressão de três importantes citocinas (IL-4,
IFN-ℽ e IL-10), características de três diferentes perfis imunes (Th2, Th1 e Treg
29
respectivamente) frente às circunstâncias experimentais delineadas neste estudo. Esta
análise foi realizada de forma sistêmica e in situ. Para a análise sistêmica foi realizada
cultura de células do baço dos camundongos que compõem os três grupos
experimentais; a suspensão de células obtida no fim deste procedimento foi utilizada
para realizar ELISA a fim de dosar as concentrações das citocinas de interesse.
Na Figura 7 há a comparação entre os diferentes estímulos à suspensão de
esplenócitos em cultura nos três grupos estudados. Quando analisadas as diferenças
estatisticamente significativas na dosagem de IL-4 o grupo CT saudável – meio
apresentou menor dosagem que o grupo CT cirúrgico – meio e que o grupo INF - meio,
onde o p<0,0001; as amostras estimuladas com Con-A ou com Ag não apresentaram
diferenças estatisticamente significativas entre os grupos analisados. Quando analisada a
dosagem de IL-10, o grupo CT saudável - meio apresentou menor dosagem em relação
ao grupo CT cirúrgico – meio e e INF – meio com p=0,0043; as amostras estimuladas
com Con-A ou com Ag não apresentaram diferenças estatisticamente significativas
entre os grupos analisados. Na dosagem de IFN-ℽ os grupos não estimulados, ou
estimulados com Con-A ou com Ag não apresentaram diferenças estatisticamente
significativas entre si.
30
Figura 7: Concentração sistêmica das citocinas IL-4, IL-10 e IFN-γ, entre diferentes estímulos utilizados
na suspensão de células do baço de camundongos C57BL/6 dos três grupos analisados. CT = controle;
Meio = sem estímulo; Con-A = Concanavalina A; Ag = extrato antigênico de cisticercos viáveis de
Taenia crassiceps. Resultado estatisticamente significativo quando p≤0,05, ANOVA.
31
5.3 Análise do peso dos baços
Como os grupos experimentais apresentaram alterações nas citocinas sistêmicas
após o procedimento cirúrgico, analisamos se essas alterações refletiram no peso do
baço desses camundongos. O grupo INF apresentou maior porcentagem do peso do
baço em relação ao peso do camundongo quando comparado com os demais grupos,
onde p<0,0001 (Figura 10).
Figura 8: Porcentagem do peso do baço em relação ao peso do camundongo dos grupos experimentais
CT saudável, CT cirúrgico e INF. CT = controle; INF = infectados. Resultado estatisticamente
significativo quando p≤0,05, ANOVA. n = 9 grupo CT saudável, n = 10 grupo CT cirúrgico e n = 15
grupo INF.
5.4 Análise de citocinas in situ
A análise das dosagens in situ (Figura 9) foi realizada para avaliar a expressão
das citocinas citadas frente à infecção por cisticercos viáveis de T. crassiceps, a análise
foi realizada entre os três grupos experimentais. Observando a figura 9 encontrou-se que
houve diferença estatisticamente significativa na dosagem de IFN-ℽ entre o grupo CT
saudável com o grupo CT saudável e os grupos CT cirúrgico e INF, onde o p=0;
entretanto, as outras comparações realizadas em todas as citocinas não apresentaram
diferenças significativas.
32
Figura 9: Concentração das citocinas IL-4, IL-10 e IFN-γ no encéfalo (in situ) de camundongos C57BL/6
dos grupos experimentais CT saudável, CT cirúrgico e INF, 90 dias após inoculação. CT = controle.
Resultado estatisticamente significativo quando p≤0,05; ANOVA.
33
5.5 Análise do peso do cérebro
O encéfalo dos camundongos de todos os grupos experimentais foi retirado após
eutanásia; os mesmos foram cortados em matriz de corte encefálica no local da
inoculação e pesados. Esta porção encefálica pesada foi reservada para produção de
homogenato e posterior dosagem de citocinas por ELISA. Os dados obtidos após
pesagem foram organizados em banco de dados no programa Microsoft Excel (2016) e
posteriormente a eles foi aplicado o teste de ANOVA no programa Graph Prisma 5.0. A
Figura 10 permite-nos observar que os grupos experimentais analisados não
apresentaram diferenças estatisticamente significativas entre si quanto ao peso da
porção encefálica utilizada para produção de homogenato; mesmo o grupo INF tendo
apresentado peso relativamente maior que os demais grupos.
Figura 10: Análise do peso da porção encefálica reservada para produção de homogenato em
camundongos C57BL/6 inoculados ou não com cisticercos viáveis de T. crassiceps. CT = controle; INF =
infectados. Resultado estatisticamente significativo quando p≤0,05, ANOVA.
34
6 DISCUSSÃO
Os mecanismos pelos quais as lesões provocadas pelo cisticerco se desenvolvem
no SNC dependem de uma combinação de diversos fatores, mas principalmente, o local
de instalação do parasito e a resposta imuno-inflamatória do hospedeiro (DEL
BRUTTO, 2014; FOGANG et al., 2015), a qual é mediada por citocinas produzidas por
células residentes e infiltrantes, ativadas por antígenos do cisticerco, principalmente as
micróglias (SOTELO & MARIN, 1987; GARCIA et al., 2014).
Após análise histopatológica, descrevemos que os camundongos do grupo INF,
apresentaram microgliose com intensidade moderada, enquanto os do grupo CT
cirúrgico com intensidade discreta. A micróglia é uma célula imune fagocítica residente
no SNC, considerada estável e que, por possuir propriedades dinâmicas, é a célula
responsável pela homeostase do SNC. Estas características estão presentes em cérebro
saudável, entretanto, uma vez em que este microambiente regulado é modificado por
estímulos externos ou alterações patológicas, a micróglia é rapidamente ativada. Uma
vez ativada, esta diminui seus processos e altera a dinâmica de seus ramos e marcadores
de superfície. Além disso, o seu número é progressivamente aumentado em torno do
local da lesão, o que é denominado de microgliose (ALLIOT; GODIN e PASSAC,
1999; LI & ZHANG, 2016).
Os cisticercos que inoculamos instalaram-se nos ventrículos ou na região
extraparenquimal/meningo-cortical e desencadearam resposta inflamatória discreta, com
pouco infiltrado inflamatório MN e quando presente próximo ao parasito; meningite
discreta quando o helminto se instalava em contato com esta membrana. Os relatos na
literatura descrevem discreto infiltrado inflamatório mononuclear ao redor do cisticerco
quando este está viável no SNC (RODRIGUES JR et al., 2000; LINO-JÚNIOR et al.,
2002; DEL BRUTTO, 2014; FLEURY et al., 2016).
Nossos achados histopatológicos corroboram com os de Matos-Silva et al., 2012
que induziram NCC intraventricular experimental por cisticercos de T. crassiceps em
camundongos C57BL/6. Os animais apresentaram infiltrado inflamatório discreto à
moderado e predominantemente composto por células MN; além de microgliose, edema
parenquimal e meningite discretas. É importante ressaltar que esses resultados foram
encontrados em camundongos equivalentes aos usados neste estudo, em idade,
linhagem, gênero, parasito utilizado e tempo experimental, entretanto há diferença entre
35
o local de instalação do cisticerco, uma vez que no nosso estudo houve instalação
predominantemente na região meningo-cortical.
A compressão dos hemisférios ocasionada pela presença e pelo crescimento do
cisticerco foi bastante expressiva nos camundongos utilizados neste estudo. A principal
consequência deste processo é o aumento da pressão intracraniana, o que pode levar à
obstrução do CSF em alguns casos e ao edema em diferentes graus (APUZZO et
al.,1984; KHADE et al., 2013), provavelmente a presença de edema parenquimal nos
grupos experimentais deste trabalho, mesmo aos 90 DAI, se deve a esse processo de
compressão.
Uma vez que a barreira hematoencefálica dos camundongos submetidos à
experimentação foi afetada ocasionando afrouxamento, no momento da inoculação, a
presença do cisticerco permite que seus antígenos de membrana e os liberados por ele,
entrem nos capilares desta barreira e alcancem outras regiões, assim como permite
também o influxo de células inflamatórias (RANSOHOFF et al., 2003). Esse
mecanismo permite que haja a ativação de resposta imune sistêmica que reflete nas
células de defesa que compõem o baço desses camundongos. A análise das citocinas de
forma sistêmica não apresentou diferenças estatisticamente significativas entre os
grupos analisados, mas se houvesse provavelmente caracterizaria predomínio de
resposta imune com perfil Th2, devido à alta concentração de IL-4 no grupo INF em
relação a expressão de IFN-ɣ.
Esta possibilidade de resultado complementaria os achados de Moura et al.,
2015 os quais realizaram inoculação intracraniana de cisticercos viáveis de T. crassiceps
com posterior análise sistêmica e in situ das mesmas citocinas aqui discutidas,
distinguindo-se deste estudo quanto à linhagem de camundongos utilizada. Como já foi
citado, encontramos alta concentração de IL-4 sistêmica enquanto Moura et al., 2015
descreveram alta dosagem de IFN-ℽ sistêmico, ou seja, camundongos BALB/c
apresentam resposta predominantemente Th1 frente à presença do cisticerco, enquanto
que camundongos C57BL/6 apresentaram predomínio de resposta Th2 e lesões mais
brandas, protegendo o hospedeiro de danos neurológicos graves e degradantes.
O IFN-ℽ é produzido principalmente por células NK durante a resposta imune
inata e por linfócitos T CD4+ do tipo Th1 durante a resposta imune adquirida. É
considerada a principal citocina ativadora de fagócitos para que estes tenham um
36
aumento na sua capacidade microbicida (MARTINEZ; HELMING; GORDON, 2009).
Enquanto que a IL-4 está relacionada à um perfil Th2 da resposta imune adquirida e
com a ativação e expansão de plasmócitos, secreção de IgE, eosinófilos, mastócitos e
basófilos (ANTONY et al., 2007); está também relacionada com a ativação de
macrófagos alternativamente ativados, os quais têm menor potencial microbicida
(MOSSER; EDWARDS, 2008).
Analisando nossos resultados sistêmicos com os de Moura et al., 2015, é
possível inferir a tendência da linhagem de camundongos C57BL/6 à resistência pela
infecção por T. crassiceps, enquanto que a linhagem BALB/c tende a caracterizar
susceptibilidade. Descrevemos no presente trabalho o predomínio de perfil imune Th2
em camundongos C57BL/6 fêmeas enquanto Moura et al., 2015 descreveram o
predomínio do perfil Th1 em camundongos BALB/c fêmeas. Nossos resultados
corroboram com Fragoso et al., 2008 que revisaram modelos de cisticercose
intraperitoneal por T. crassiceps que descreveram este mesmo perfil de susceptibilidade
e resistência entre essas linhagens; além de descrever também que o camundongo fêmea
de 16 diferentes linhagens é mais permissivo ao crescimento parasitário.
É possível estabelecer correlação entre os resultados encontrados não apenas
com a NCC experimental, mas também com outros trabalhos que induziram cisticercose
subcutânea, como o de Freitas et al., 2012, Lima, S. B. 2014 e Gaspar; Sakai; Gaspari,
2014, além de Toenjes & Kuhn (2003) que inoculou cisticercose intraperitoneal, o tipo
de cisticercose mais difundido no meio científico.
Em nosso trabalho, descrevemos baixa dosagem de IFN-ℽ, fato que associado às
descrições histopatológicas, nos permite sugerir que a pouca expressão desta citocina
está relacionada com a resistência da linhagem C57BL/6 à cisticercose e à destruição
tardia do cisticerco. Estes resultados corroboram com os de Freitas et al., 2012 que
induziram cisticercose subcutânea em camundongos C57BL/6 convencionais e IFN-ℽ KO concluindo que a presença de IFN-ℽ na cisticercose subcutânea induz resposta mista
Th1/Th2, desta forma, a morte do parasito poderia estar ocorrendo por aumento da
atividade microbicida de macrófagos, via eixo Th1 ou por mecanismos Th2 clássicos;
enquanto que com a ausência de IFN-ℽ, há o favorecimento do crescimento parasitário e
o desenvolvimento de resposta imune sistêmica Th2. Corroboram também com o de
Gaspar; Sakai; Gaspari (2014) que inocularam cisticercos de T. crassiceps no
37
subcutâneo de camundongos BALB/c e constataram que este modelo induziu nível
elevado de IFN-ɣ e alta produção de NO.
Descrevemos também a alta dosagem de IL-4 sistêmica no grupo INF,
acreditamos que esta citocina está relacionada com a proteção tecidual e
consequentemente a minimização das lesões, apesar de manter a viabilidade do parasito
por mais tempo devido seu baixo potencial microbicida na ativação de macrófagos
alternativamente ativados (MOSSER; EDWARDS, 2008). Estes achados corroboram
com Lima, S. B. 2014 que induziu cisticercose subcutânea com cisticercos de T.
crassiceps em camundongos BALB/c convencionais e IL-4 KO, onde os animais
apresentaram maior intensidade de lesões, e menor resolução da inflamação, com
ausência de cura, mesmo aos 90 DAI, na presença de IL-4. Entretanto, a deficiência de
IL-4 direcionou a inflamação para um maior potencial microbicida, destruição do
parasito já nos primeiros dias de infecção e redução significativa de eosinófilos e
predomínio de resposta imune do tipo Th1.
O modelo intraperitoneal que pode ser correlacionado com este estudo é o de
Toenjes & Kuhn (2003) que utilizaram cisticercos de T. crassiceps em camundongos
BALB/c, descrevendo perfil misto de resposta imune (Th1/Th2) com a dosagem de
altos níveis de IL-4 e IFN-ℽ. Provavelmente por conta da localização da inoculação, os
resultados de Toenjes & Kun, distinguiram-se dos encontrados no presente trabalho,
mas ainda assim permitem correlaciona-los, no ponto em que na fase mais tardia da
infecção há diminuição dos níveis de IFN-ℽ, assim como relatamos neste estudo.
Neste trabalho realizamos a análise da porcentagem do peso do baço em relação
ao peso do camundongo, em todos os grupos experimentais, após procedimento
cirúrgico ou não. Encontramos diferença estatística entre os grupos CT saudável e INF e
entre os grupos CT cirúrgico e INF, onde o grupo INF apresentou maior porcentagem
de peso do baço em ambos os casos, acreditamos que isto se deve ao fato de ter sido o
grupo que recebeu o cisticerco, e provavelmente o que mais reagiu de forma imune a
esse procedimento. Esses resultados nos permitem sugerir que houve reação local no
baço desses animais, provavelmente o aumento da ativação celular neste órgão por
conta da infecção intracraniana refletiu no aumento do peso do mesmo.
A dosagem de citocinas in situ não apresentou resultados estatisticamente
significativos, uma vez que a concentração das citocinas analisadas foi semelhante em
38
todos os grupos experimentais, supondo que aos 30 DAI o quadro imune fosse
diferente, podemos inferir que o cisticerco provavelmente exerce imunomodulação para
permanecer viável à longo prazo. Para confirmar essa hipótese de possibilidade de
diferente perfil imune não só in situ, mas também sistêmico, há a necessidade de
repetição dos experimentos, com estabelecimento de dias experimentais progressivos.
Corroborando com a ausência de diferenças estatisticamente significativas entre os
grupos na análise in situ apresentamos a mesma ausência na análise do peso encefálico
destes animais.
Os antígenos do cisticerco estimulam a produção de anticorpos e a liberação de
mediadores químicos que, na maioria das vezes, são insuficientes na tentativa de
destruir o metacestóide, pois ao mesmo tempo em que este parasito ativa estas reações,
ele também modula a ação destes componentes imunes, com o objetivo de manter-se
viável por mais tempo (HICKEY et al., 1991; CAMPANELLA et al., 2002; JACKSON
et al., 2008). Podemos atribuir este resultado à imunomodulação pelo cisticerco bem
como à interferência do imunoprivilégio do cérebro refletindo no comprometimento
deste tecido.
O cisticerco desempenha esta imunomodulação com o auxílio de diferentes
mecanismos, entre eles: diferenciação de células em linfócitos Treg limitando a
neuroinflamação na NCC e favorecendo um ambiente supressivo (ADALID-PERALTA
et al., 2003; FLEURY et al., 2016); liberação de fatores imunomoduladores que
promovem a geração de macrófagos alternativamente ativados (GUNDRA et al., 2011;
FLEURY et al., 2016) e pelo próprio aproveitamento do imunoprivilégio cerebral
(TREVOR et al., 1994).
O cérebro, assim como olhos, testículos e ovários, é considerado órgão
imunoprivilegiado, este é um termo aplicado à órgãos que têm uma relação única com a
resposta imunitária. Estes locais amenizam a propagação da inflamação, uma vez que,
mesmo episódios pequenos, podem ameaçar a integridade e funcionalidade do órgão
(SOTELO & MARIN, 1987; GARCIA et al., 2014b); tal mecanismo se deve à fatores
passivos, como à presença da barreira hematoencefálica e a circulação intracerebral; e
ativos como produção de citocinas imunossupressoras, neuropeptídios, limitação da
expressão de MHC classe I e II, proteínas reguladoras do complemento e inibidores de
células NK, os quais também contribuem para este privilégio (FERGUSON;
39
GRIFFITH, 1997; SIETSKE et al., 2000). Na NCC, o imunoprivilégio do cérebro
parece comporta-se como fator protetor para os possíveis danos teciduais ao parênquima
encefálico, mas também como ajudante do cisticerco na evasão ao sistema imune,
favorecendo o prolongamento da vida deste parasito (GIMSA, MITCHISON,
BRUNNER-WEINZIERL, 2013)
Assim como nós, Moura et al., (2015) também não encontraram diferenças
estatisticamente significativas na dosagem de citocinas in situ após indução de NCC
experimental em camundongos BALB/c. Entretanto descreveram concentração maior de
IFN-ℽ do que de IL-4, o que foi descrito de forma oposta neste estudo, confirmando o
predomínio de resposta Th1 em camundongos BALB/c e de Th2 em C57BL/6. Moura
et al., 2015 atribuiu seus resultados presença de poucas células inflamatórias no sítio de
infecção e à diluição da amostra.
A dosagem de IL-10, tanto sistêmica quanto in situ, avaliadas neste estudo, nos
permite deduzir que esta citocina está presente e provavelmente ativada modulando as
respostas, tanto Th1 como Th2. A IL-10 é um potente inibidor de apresentação
antigênica e de produção de mediadores e citocinas pró-inflamatórias de macrófagos,
células dendríticas e células Th1; tem um papel regulador importante sobre a resposta
inflamatória do hospedeiro durante a infecção; a inflamação é essencial no início da
resposta ao patógeno, mas se não for controlada pode resultar em complicações
inflamatórias graves (TERRAZAS et al., 1998; MOSSER & ZHANG, 2008; HEDRICH
& BREAM, 2010). Além de ser capaz de ativar linfócitos T regulatórios diminuindo o
dano tecidual (TERRAZAS, 2008). Dessa forma, no presente estudo, a produção de IL10 pode contribuir para a sobrevivência do parasito, ou seja, para o estabelecimento de
uma infecção persistente.
40
7 CONCLUSÃO
Concluímos que a infecção por cisticercos viáveis de T. crassiceps em
camundongos C57BL/6 após 90 dias de infecção, desencadeou resposta inflamatória
com presença de meningite, microgliose, infiltrado inflamatório MN, edema
parenquimal e compressão dos hemisférios cerebrais em diferentes intensidades.
Entretanto as análises de citocinas sistêmicas e in situ nestes animais não permitiu
avaliar diferenças estatisticamente significativas entre os grupos experimentais
analisados.
41
REFERÊNCIAS
ABBAS, K. A; LICHTMAN, H. A. 2005. Imunologia celular e molecular. Guanabara
Koogan, Elsevier Editora, São Paulo.: 368-372
ADALID-PERALTA L. et al. Cysticerci Drive Dendritic Cells to Promote In
Vitro and In Vivo Tregs Differentiation. Clinical and Developmental Immunology. v.
2013.
ALLIOT, F. GODIM, I. PASSAC, B. Microglia derive from progenitors, originating
from the yolk sac, and which proliferate in the brain. Developmental Brain Research. v.
117, n. 2, p. 145–152. November 1999.
ALVAREZ J. I. & TEALE J. M. Breakdown of the blood brain barrier and bloodcerebrospinal fluid barrier is associated with differential leukocyte migration in distinct
compartments of the CNS during the course of murine NCC. Journal of
Neuroimmunology. v. 172, n. 1-2, p. 45-55, May 2006.
ALVAREZ J. I. & TEALE J. M. Differential changes in junctional complex proteins
suggest the ependymal lining as the main source of leukocyte infiltration into ventricles
in murine neurocysticercosis. Journal Neuroimmunology. v. 187, n. 1-2, p. 102-113,
July 2007a.
ALVAREZ J. I. & TEALE J. M. Evidence for differential changes of junctional
complex proteins in murine neurocysticerosis dependent upon CNS vasculature. Brain
Research Reviews. v. 1169, p. 98-111, September 2007b.
ALVAREZ J. I. & TEALE J. M. Multiple Expression of Matrix Metalloproteinases in
Murine Neurocysticercosis: Implications for Leukocyte Migration Through Multiple
Central Nervous System Barriers. Brain Research Reviews. v. 1214, p. 145-158, June
2008.
ALVAREZ J. I.; RIVERA J.; TEALE J. M. Differential Release and Phagocytosis of
Tegument Glycoconjugates in Neurocysticercosis: Implications for Immune Evasion
Strategies. PLoS Neglected Tropical Diseases. California, v. 2, n. 4, April 2008.
ANSEM, D. SPILIANAKIS, C. G. FLAVEL, R. A. How ate Th1 and Th2 effector cells
made? Curr. Opin. Immunol 21:153-160. 2009
ANTONY, R. M. et al. Protective immune mechanisms in helminth infection. Nat. Rev.
Immunol., v. 7, p. 975–987. 2007
42
APUZZO, M. L. J.et al. Surgical considerations in the treatment of intraventricular
neurocysticercosis: an analysis of 45cases. Journal of Neurosurgery. v. 60, p. 400–407.
1984.
AROCKER-METTINGE E. et al. Taenia crassiceps in the anterior chamber of the
human eye. A case report. Klinische Monatsblätter für Augenheilkunde. v. 201, n. 1, p.
34-37, July 1992.
BROJER C. M. et al. Cerebral cysticercosis in a Woodchuck (Marmota monax). Journal
of Wildlife Diseases. Lawrence, v. 38, n. 3, p. 621-624, July 2002.
BUENO E. C. et al. Neurocysticercosis: Detection of IgG, IgA and IgE antibodies in
cerebrospinal fluid, serum and saliva samples by ELISA with Taenia solium and Taenia
crassiceps antigens. Arquivos de Neuro-Psiquiatria. São Paulo, v. 58, n. 1, p. 18-24,
March 2000b.
BUENO E. C. et al. Specific Taenia crassiceps and Taenia solium Antigenic Peptides
for Neurocysticercosis Immunodiagnosis Using Serum Samples. Journal of Clinical
Microbiology. Washington, v. 38, n. 1, p. 146-151, January 2000a.
BOYTON, R. J. ALTMANN, D. M. 2002. Is selection for TCR affinity a factor in
Cytokine polarization? Trends Immunol 23:526-529.
CAMPANELLA, M. et al. Flow cytometric analysis of inflammatory cells in ischemic
rat brain. Stroke. v. 33, n. 2, p. 586-92. February, 2002.
CANTEY, P. T. et al. Neglected Parasitic Infections in the United States: Cysticercosis.
The American Journal of Tropical Medicine and Hygiene. Atlanta, v. 90, n. 5, p. 805809, May 2014.
CARABIN, H. et al. The relationship between neurocysticercosis and epilepsy: an
endless debate. PLoS Neglected Tropical Diseases. California, v. 5, n. 5, May 2011.
CÁRDENAS G. et al. Impact of Taenia solium neurocysticercosis upon endocrine
status and its relation with immuno-inflammatory parameters. International Journal for
Parasitology. Austrália, v. 42, n. 2, p. 171-176, February 2011.
CÁRDENAS G. et al. Spinal Taenia solium cysticercosis in Mexican and Indian
patients: a comparison of 30-year experience in two neurological referral centers and
review of literature. European Spine Journal. v. 25, n.4, p. 1073-1081, April 2016.
CARDONA A. E. & TEALE J. M. Gamma/delta T cell-deficient mice exhibit reduced
disease severity and decreased inflammatory response in the brain in murine
43
neurocysticercosis. The Journal of Immunology. v. 196, n. 6, p. 3163-3171, Setember
2002.
CARDONA A. E. et al. Development of an Animal Model for Neurocysticercosis:
Immune Response in the Central Nervous System Is Characterized by a Predominance
of γδ T Cells. The Journal of Immunology. v. 162, n. 2, p. 995-1002, January 1999.
CARDONA A. E.; GONZALEZ P. A.; TEALE J. M. CC chemokines mediate
leukocyte trafficking into the central nervous system during murine neurocysticercosis:
role of gamma delta T cells in amplification of the host immune response. Infection and
Immunity. Washington, v. 71, n. 5, p. 2634-2642, May 2003.
CARPIO, A.; ROMO, M. L. The relationship between neurocysticercosis and epilepsy:
an endless debate. Arquivos de Neuro-Psiquiatria, São Paulo, v. 72, n. 5, May 2014.
CHAVARRIA A. et al. Relationship between the clinical heterogeneity of
neurocysticercosis and the immune-inflammatory profiles. Clinical Immunology. v.
116, n. 3, p. 271-278, September 2005.
CHEN, Z. LAURENCE, A. O’SHEA, J. J.Signal transduction pathways and
transcriptional regulation in the control of Th17 differentiation. Semin. Immunol
19:400-408. 2007.
DANTAS, F. L. M. R. et al. Cisticercose intramedular. Arquivos de Neuro-Psiquiatria,
São Paulo, v. 57, n. 2ª, Junho 1999.
DEBLOCK S. & PETAVY A. F. Hepatic larvae of cestode parasites of the vole rat
Arvicola terrestris in Auvergne, France. Annales de Parasitologie Humaine et
Comparée. v. 58, n. 5, p. 423-437, 1983.
DEL BRUTTO O. H. Neurocysticercosis. The Neurohospitalist. v. 4, n.4, p. 205-212,
October 2014.
DEL BRUTTO O.H. DEL BRUTTO V. J. Isolated brainstem cysticercosis: A review.
Clinical Neurology & Neurosurgery. v. 115, n. 5, 507-511, May 2013.
DYER N. W. & GREVE J. H. Severe Cysticercus longicollis cysticercosis in a black
lemur (Eulemur macaco macaco). Journal of Veterinary Diagnostic Investigation. v. 10,
n. 4, p. 362-364, 1998.
ESPÍNDOLA M. N. et al. Excretory/secretory antigens (ES) from in-vitro cultures of
Taenia crassiceps cysticerci, and use of an anti-ES monoclonal antibody for antigen
44
detection in samples of cerebrospinal fluid from patients with neurocysticercosis.
Annals of Tropical Medicine and Parasitology. v. 96, n. 4, June 2002.
ESPÍNDOLA M. N. et al. Production of Monoclonal antibodies anti-Taenia
crassiceps cysticerci with cross-reactivity with Taenia solium antigens. Revista do
Instituto de Medicina Tropical de São Paulo. São Paulo, v. 42, n. 3, May/June 2000.
FERGUSON, T. A. GRIFFITH, T. S. A vision of cell death: insights into immune
privilegie. Immunological Reviews. v. 156, n. 1, p. 167-184. April 1997.
FLEURY A. et al. Immunopathology in Taenia solium neurocysticercosis. Parasite
Immunology. EUA, v. 38, n. 3, March 2016.
FLEURY A. Taenia solium: Development of an Experimental Model of Porcine
Neurocysticercosis. PLoS Neglected Tropical Diseases. California, v. 9, n. 8, August
2015.
FLISSER, A. Taeniasis-cysticercosis: an introduction. Southeast Asian Journal Tropical
Medicine and Public Health. Bankok, v. 233, n. 5, December 1991.
FOGANG, Y. F. et al. Managing neurocysticercosis: challenges and solutions.
International Journal of General Medicine. Auckland, v. 8, p. 333-344, October 2015.
FONTENOT, J. D. GAVIN, M. A. RUDENSKY, A. Y. 2003. Foxp3 programs the
development and function of CD4+ CD25+ regulatory T cells. Nat Immunol 4:330-336.
FRAGOSO G. et al. Preferential Growth of Taenia crassiceps Cysticerci in Female
Mice Holds Across Several Laboratory Mice Strains and Parasite Lines. Journal of
Parasitology. v. 94, n. 2, p. 551-553, April 2008.
FREEMAN R. S. Studies on the biology of Taenia crassiceps (Zeder 1800)
Rudolphi, 1810 (Cestoda). Canadian Journal of Zoology. Ottawa, v. 40, n. 6, p. 969990, 1962.
FREITAS A. A. et al. Kinetics of the Inflammatory Response in Subcutaneous
Cysticercosis Induced in Mice by Taenia crassiceps. Journal of Comparative Pathology.
v. 147, n. 2-3, p. 267-274, August/October 2012.
GARCIA H. H.; NASH, T. E.; DEL BRUTTO, O. H. Clinical symptoms, diagnosis, and
treatment of neurocysticercosis. The Lancet Neurology. V. 13, n. 12, p. 1202-1215,
December 2014.
GARCIA, H. H. et al. Immunology of Taenia solium taeniasis and human cysticercosis.
Parasite Immunology. v. 36, n. 8, p. 388-96. August 2014.
45
GASPAR E. B.; SAKAI Y. I.; DE GASPARI E. A mouse air pouch model for
evaluating the immune response to Taenia crassiceps infection. Experimental
Parasitology. Washington, v. 137, p. 66-73, February 2014.
GIMSA, U. MITCHISON, N. A. BRUNNER-WEINZIERL, M. C. Immune Privilege as
an Intrinsic CNS Property: Astrocytes Protect the CNS against T-Cell-Mediated
Neuroinflammation. Mediators Inflamm. V. 2013, n. 2013. August 2013.
GUIMARÃES R. R. et al. Neurocisticercose: Atualização sobre uma antiga doença.
Revista Neurociências. São Paulo, v. 18, n.4, p. 581-594, August 2009.
GUNDRA U. M. et al. Increased Disease Severity of Parasite-Infected TLR2−/− Mice
Is Correlated with Decreased Central Nervous System Inflammation and Reduced
Numbers of Cells with Alternatively Activated Macrophage Phenotypes in a Murine
Model of Neurocysticercosis. Infection and Immunity. v. 79, n. 7, p. 2586-2596, Jule
2011.
GUSSO, R. L. F. Estudo comparative dos antígenos de Cysticercus longicollis e
Cysticercus cellulosae no imunodiagnóstico da neurocisticercose humana. Dissertação
(Mestrado) – Universidade Federal do Paraná, 2000.
HAMAMOTO FILHO, P. T. Taenia crassiceps injection into the subarachnoid space of
rats simulates radiological and morphological features of racemose neurocysticercosis.
v. 33, n. 1, p. 119-123, September 2016.
HEDRICH, C. M. & BREAM, J. H. Cell type-specific relation od IL-10 expression in
inflammation and disease. Immunologic Research. v. 47, n, 1-3, p. 185-206. 2010.
HICKEY, W. F. Migration of hematogenous cells through the blood-brain barrier and
the initiation of CNS inflammation. Brain Pathol. v. 2, p. 97-105. January, 1991.
HEWITSON, P. J. GRAINGER, R. J. MAIZELS, M. R. Helminth immunoregulation:
The role of parasite secreted proteins in modulating host immunity. Mol Biochem
Parasitol. 167:1-11. 2009.
HOLZL, M.A. et al. Host antimicrobial proteins as endogenous immunomodulators.
2008. Immunol Lett 15:119 (1-2).
HORI, S. NOMURA, T. SAKAGUCHI, S. Controlo f regulatory T cell development by
the transcription fator Foxp3. Science 299:1057-1061.2008.
46
JACKSON, A. J. et al. Review eries on helminths, imune modulation and the hygiene
hypothesis: Immunity against helminths and immunological phenomena in modern
human populations: coevolutionary legacies? Immunology 126:18-27. 2008.
JACKSON, F. Nutrition and immunity of nematodes of livestock. Parasite
Immunology. v. 30, n. 2, p. 61-62. February 2008.
KANANGAT, S. et al. Disease in the scurty mouse is associated of cytokine genes. Eur.
J. Immunol 26:161-165. 1996.
KHADE, P. et al. What is the utility of postoperative antihelminthic therapy after
resection for intraventricular neurocysticercosis? World Neurosurery. v. 79, p. 558–567.
2013.
KIM, H. P. et al. CREB/ATF-dependent T cell receptor induced Foxp3 gene
expression.: A role for DNA methylation. J. Exp. Med. 204:1543-1551. 2007.
KOTHA V. K. Migration of intraventricular neurocysticercus after ventriculostomy.
Asian Journal of Neurosurgery. v. 8, n. 1, p. 54-56, Jan-Mar 2013.
LI, T. & ZHANG, S. Microgliosis in the Injured Brain. The Neuroscientist. v. 22, n. 2,
p. 165 –170. 2016.
LIMA, SARAH BUZAIM. Avaliação da resposta inflamatória local e sistêmica em
modelo experimental de cisticercose subcutânea por Taenia crassiceps nas linhagens
BALB/c convencional e deficiente para o gene de IL-4. Dissertação (Mestrado –
Patologia) — UFG. Goiânia. 2014.
LINO-JÚNIOR R. S. et al. Características evolutivas do Cysticercus cellulosae no
encéfalo e no coração humanos. Revista da Sociedade Brasileira de Medicina Tropical.
Uberaba, v. 35, n. 6, p. 617-622, novembro/dezembro 2002.
MACHADO J. R. et al. Immunopathological Aspects of Experimental Trypanosoma
cruzi Reinfections. Journal of Biomedicine and Biotechnology, v. 2014, p. 1-9, 2014.
MAILLARD H. et al. Taenia crassiceps cysticerci and AIDS. AIDS. v. 12, n. 12, p.
1551-1552, August 1998.
MAKEPEACE B. L. Granulocytes in Helminth Infection - Who is Calling the Shots?
Current Medicinal Chemistry. Cambridge, v. 19, n. 10, p. 1567-1586, April 2012.
MARTINEZ, F. O. HELMING, L. GORDON, S. Alternative activation of
macrophages: an immunologic functional perspective. Annu Rev Immunol. v. 27, p.
451-83. 2009.
47
MATOS-SILVA
H.
et
al.
Experimental
encephalitis
caused
by Taenia
crassiceps cysticerci in mice. Arquivos de Neuro-Psiquiatria. São Paulo, v. 70, n.4, p.
287-292, February 2012.
MATOS-SILVA, HIDELBERTO. Neurocisticercose intraventricular experimental:
análise da resposta inflamatória. Dissertação (Mestrado – Patologia) — UFG. Goiânia.
2011.
MISHRA B. B.; GUDRA U. M.; TEALE J. M. STAT6−/− mice exhibit decreased cells
with alternatively activated macrophage phenotypes and enhanced disease severity in
murine neurocysticercosis. Journal Neuroimmunology. v. 232, n. 1-2, p. 26-34, March
2011.
MISHRA B. B.; MISHRA P. K.; TEALE J. M. Expression and distribution of Toll like
receptors in the brain during murine neurocysticercosis. Journal of Neuroimmunology.
v. 118, n. 1-2, p. 46-56, December 2006.
MOSSER, D. M. EDWARDS, J. P. Exploring the full spectrum of macrophage
activation. Nat Rev Immunol. v. 8, p. 958-969. 2008
MOSSER, D. M. ZHANG, X. Interleukin-10: new perspectives on na old cytokine.
Immunological Reviews. v. 226, p. 205-218. 2008.
MOSMANN, T. R. & SAD, S. 1986. The expanding universe of T cell subsets: Th1,
Th2 and more. Immunol Today 17(3): 142-156.
MOSMANN et al. 1986. Two types of murine helper T cell clone. J. Immunolo 136(7):
2348-2357.
MOURA, V. B. L. et al. Cellular immune response in intraventricular experimental
neurocysticercosis. Parasitology. v. 143, p. 334–342. 2015.
NASH, T. E.; MAHANTY, S.; GÁRCIA, H. H. Neurocysticercosis — More Than a
Neglected Disease. PLoS Neglected Tropical Diseases. California, v.7, n. 4, April 2013.
OLIVEIRA, M. A. P. et al. Leishmania sp: Comparative study with Toxoplasma gondii
and Trypanosoma cruzi in their ability to initialize IL-12 and IFN-g synthesis.
Experimental Parasitology, Estados Unidos, v. 95, p. 96-105, 2000.
PARDINI A. X. et al. Cysticercus Antigens in Cerebrospinal Fluid Samples from
Patients with Neurocysticercosis. Journal of Clinical Microbiology. Washington, v. 39,
n. 9, p. 3368-3372, Setember 2001.
48
PARDINI A. X. et al. Use of Taenia crassiceps Cysticercus Antigen Preparations for
Detection of Antibodies in Cerebrospinal Fluid Samples from Patients with
Neurocysticercosis (Taenia solium). Clinical and Diagnostic Laboratory Immunology.
v. 9, n. 1, p. 190-193, January 2002.
PERALTA R. H. et al. Taenia crassiceps cysticerci: Characterization of the 14-kDa
glycoprotein with homologies to antigens from Taenia solium cysticerci. Experimental
Parasitology. Washington, v. 124, n. 3, p. 295-300, March 2010.
PERALTA R. H. S. et al. Evaluation of an antigen from Taenia crassiceps cysticercus
for the serodiagnosis of neurocysticercosis. Acta Tropica. v. 83, n. 2, p. 159-168,
August 2002.
PEREIRA I. M. et al. Experimental Subcutaneous cysticercosis by Taenia crassiceps in
BALB/c and C57BL/6 mice. Revista do Instituto de Medicina Tropical de São Paulo.
São Paulo, v. 58, n. 55, May 2016.
RANSOHOFF R. M.; KIVISAKK P.; KIDD G. Three or more routes for leukocyte
migration into the central nervous system. Nature Reviews Immunology. v.3, n.7, p.
569-581, July 2003.
RODRIGUES JR, V. et al. Interleukin-5 and interleukin-10 are major cytokines in
cerebrospinal fluid from patients with active neurocysticercosis. Brazilian Journal of
Medical and Biological Research. v. 33, n. 9. Ribeirão Preto September 2000.
SCIUTTO E. et al. Development of the S3Pvac Vaccine Against Murine Taenia
crassiceps Cysticercosis: A Historical Review. The Journal of Parasilogy. Washington,
v. 99, n. 4, p. 693-702, August 2013b.
SCIUTTO E. et al. Development of the S3Pvac Vaccine Against Porcine Taenia solium
Cysticercosis: A Historical Review. The Journal of Parasilogy. Washington, v. 99, n. 4,
p. 686-692, August 2013a.
SCIUTTO, E. et al. The immune response in Taenia solium cysticercosis: protection
and injury. México, v.29, n. 12, December 2007.
SHEVACH, E. M. Mechanisms of Foxp3 T regulatory cell-mediated supression.
Immunuty 30:636-645. 2009.
SHIMALOV V. V. & SHIMALOV V. T. Helminth fauna of the red fox (Vulpes vulpes
Linnaeus, 1758) in southern Belarus. Parasitology Research. v. 89, n. 1, p. 77-78,
January 2003.
49
SIETSKE, A. et al Extensive genetic alterations of the HLA region, including
homozygous deletions of HLA class II genes in B-cell lymphomas arising in immuneprivileged sites. Blood. v. 96, p. 3569-3577. 2000.
SILVA L. F. et al. Relevant peptides of Taenia crassiceps for the diagnosis of bovine
cysticercosis by immunoblot. Arquivo Brasileiro de Medicina Veterinária e Zootecnia.
Belo Horizonte, v. 67, n. 3, p. 891-898, May/June 2015.
SOTELO, J. & MARIN, C.. Hydrocephalus secondary to cysticercotic arachnoiditis. A
long-term follow-up review of 92 cases. Journal of Neurosurgery. v. 66, n. 5, p. 686-9.
June 1987.
TAKAYANAGUI O. M. Neurocysticercosis. Arquivos de Neuro-Psiquiatria. São
Paulo, v. 71, n. 9, September 2013.
TAKAYANAGUI, O. M.; LEITE, J. P. Neurocysticercosis. Revista da Sociedade
Brasileira de Medicina Tropical. Uberaba, v. 34, n. 3, May/June 2001.
TERRAZAS L. I. The Complex Role of Pro- and Anti-Inflammatory Cytokines in
Cysticercosis: Immunological Lessons from Experimental and Natural Hosts. Current
Tropics in Medicinal Chemistry. v. 8, n. 5, p. 383-392, March 2008.
TERRAZAS, L. I. et al. Shift from na early protective Th1-Type imune response to a
late permissive Th2-type response in murine cyticercosis (Taenia crassiceps). Journal
Parasitology. v. 84, p. 74-81. 1998.
TOENJES S. A. & KUHN R. E. The initial immune response during experimental
cysticercosis is of the mixed Th1/Th2 type. Parasitology Research. v. 89, n. 5, p. 407413, March 2003.
TOLEDO A. et al. Towards a Taenia solium Cysticercosis Vaccine: an Epitope Shared
by Taenia
crassiceps and Taenia
solium Protects
Mice
against
Experimental
Cysticercosis. Infection and Immunity. Washington, v. 67, n. 5, p. 2522-2530, May
1999.
TREVOR, O. et al. Inflammatory cytokines in the brain: Does the CNS shape immune
responses? Immunology Today. v. 15, n.12, p. 566-571. December 1994.
TUERO E. et al. A Comparative Study of Peripheral Immune Responses to Taenia
solium in Individuals with Parenchymal and Subarachnoid Neurocysticercosis. PLoS
Neglected Tropical Diseases. California, v. 9, n. 10, October 2015.
TURVEY, S. E. et al. Innate Immunity. J Allergy Clin Immunol: 1-9.
50
VAZ A. J. et al. Immunoblot with cerebrospinal fluid from patients with
neurocysticercosis using antigen from cysticerci of Taenia solium and Taenia
crassiceps. The American Journal of Tropical Medicine and Hygiene. Atlanta, v. 57, n.
3, p. 354-357, 1997.
VERASTÉGUI M. R. et al. Novel Rat Model for Neurocysticercosis Using Taenia
solium. The American Journal of Pathology. v. 185, n. 8, p. 2259-2268, August 2015.
VIGNALI, D. A. COLLISON, L.W. WORKMAN, C.J. How regulatory T cells work.
Nat. Ver. Immunol 8:523-532. 2008.
VINAUD, MARINA CLAIRE. Vias do metabolismo energético e respiratório em
cisticercos de Taenia crassiceps in vivo e seu estudo in vitro sob a ação de fármacos
anti-helmínticos. (Tese – Parasitologia) — UFG. Goiânia, 2007.
WORLD
HEALTH
ORGANIZATION.
Disponível
em:
<http://
http://www.who.int/taeniasis/en/>. Acesso em: 20 junho 2016.
ZEPEDA N. et al. Decrease of peritoneal inflammatory CD4(+), CD8(+), CD19(+)
lymphocytes and apoptosis of eosinophils in a murine Taenia crassiceps infection.
Parasitology Research. v. 197, n. 5, p. 1129-1135, October 2010.
51
ANEXOS
Anexo 1 – Aprovação da CEUA
52
53