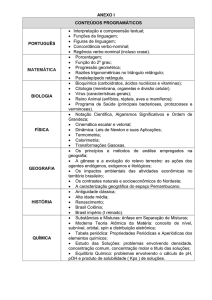
SUBSTÂNCIAS E
MISTURAS
Não contavam com a minha
“ASTÚSIA”
OS ELEMENTOS QUÍMICOS E SEUS SÍMBOLOS
Apesar de conhecermos uma infinidade de materiais
diferentes, os cientistas só conhecem, até hoje, pouco mais
de uma centena de tipos de átomos quimicamente
diferentes.
Cada um desses tipos representa um elemento químico.
Cada elemento químico recebe um nome e uma abreviação
chamada símbolo. Por exemplo:
Os símbolos foram introduzidos na Química pelo cientista
sueco Jöns Jacob Berzelius, em 1813, para facilitar a
escrita e a comunicação entre os químicos.
Não é necessário decorar todos esses nomes e símbolos,
pois, os mais comuns e importantes você irá aprendendo
no decorrer do nosso curso.
Fazendo uma comparação, podemos dizer que os
símbolos são tão úteis para os químicos como as notas
musicais para os músicos.
A representação gráfica de uma substância em que são
utilizados os símbolos e os índices numéricos é
denominada fórmula e representa a constituição de cada
unidade formadora da substância. Essas unidades são
denominadas moléculas.
SUBSTÂNCIA
Uma pessoa é reconhecida por suas características físicas:
fisionomia, massa, altura, cor da pele, cor dos olhos etc.
Considerando que a população de um país é muito grande, o
governo criou a cédula de identidade para facilitar a
identificação das pessoas.
Pois bem, a quantidade de materiais diferentes existente
no mundo é também enorme. É obrigação da Química
reconhecer e identificar cada um desses materiais.
Quando um material apresenta constantes físicas bem
definidas e invariáveis, concluímos que se trata de matéria
isenta de outros materiais e a denominamos substância
pura. Assim, temos a seguinte definição:
Substância pura (ou simplesmente substância, ou, ainda,
espécie química) é um material único, isento de outros materiais
e que apresenta constantes físicas bem definidas.
temperatura (graus Celsius)
100
água
0
gelo
gelo
água
vapor
d'água
+
vapor
d'água
+
água
estado
sólido
fusão
solidificação
estado
líquido
ebulição
condensação
estado
gasoso
As constantes físicas são catalogadas em livros e tabelas
especiais. Os químicos se baseiam nelas tanto para
identificar as substâncias como também para constatar sua
pureza. Por esse motivo, dizemos que as constantes
físicas são utilizadas como critérios de pureza das
substâncias químicas.
Sempre que uma substância é extraída da natureza ou é
produzida num laboratório, determinam-se suas constantes
físicas. Desse modo, ficamos sabendo se ela é uma
substância nova ou já conhecida. Sendo conhecida, temos
também uma idéia de sua pureza.
Ao contrário das substâncias puras, as misturas não
apresentam constantes físicas definidas.
As substâncias puras podem ser classificadas como
simples ou compostas.
SUBSTÂNCIAS SIMPLES
A substância formada por um ou mais átomos de um
mesmo elemento químico é classificada como substância
pura simples ou, simplesmente, substância simples.
ALOTROPIA: fenômeno onde um único elemento químico
forma duas ou mais substâncias diferentes, denominadas
variedades alotrópicas do elemento.
A diferença entre as variedades alotrópicas é o arranjo
molecular que formam cristais diferentes (veja as figuras a
baixo).
SUBSTÂNCIAS COMPOSTAS
Quando as moléculas de determinada substância são
formadas por dois ou mais elementos químicos, ela é
classificada como substância pura composta ou,
simplesmente, substância composta.
Substância composta: é constituída por uma molécula formada
por mais de um elemento químico.
O negocio é mais fácil do que eu
IMAGINAVA !
MISTURAS
Mistura: é formada por duas ou mais substâncias, cada uma
delas sendo denominada componente.
Como as misturas apresentam composição variável, têm
propriedades — como ponto de fusão, ponto de ebulição,
densidade — diferentes daquelas apresentadas pelas
substâncias quando estudadas separadamente.
A maioria dos materiais que nos cercam são misturas. O ar
que respiramos, por exemplo, é formado por uma mistura de
três tipos principais de gases:
OBS: Estamos considerando o ar seco, na ausência de poluentes.
Algumas misturas têm o comportamento igual ao de
substâncias puras quando submetidas à ebulição e
fusão, apesar de serem formadas por dois elementos ou
compostos distintos. Elas podem se classificar em
AZEOTRÓPICAS ou EUTÉTICAS:
Misturas Azeotrópicas: se comportam como se fossem
substâncias puras em relação à ebulição, isto é, a temperatura
mantém-se inalterada do início ao fim da ebulição (PE
constante).
PF varia e PE permanece constante. O intervalo de fusão
é indicado após o líquido passar pelo estado sólido.
Exemplos: álcool etílico + água, acetona + metanol, álcool
etílico + clorofórmio.
Misturas Eutéticas: se comportam como se fossem substâncias
puras no processo de fusão, isto é, a temperatura mantém-se
inalterada do início ao fim da fusão (PF constante).
PF constante e PE variando. O intervalo de ebulição é
indicado pela ascensão da reta, ou seja, a temperatura
aumenta (varia), enquanto que o ponto de fusão é indicado
pelo traço linear (constante).
Exemplos: ligas metálicas em geral. A solda é uma mistura
eutética de Estanho e Chumbo. O bronze é uma mistura de
cobre com estanho, impossível separar por fusão.
De acordo com o aspecto visual de uma mistura, podemos
classificá-la em função do seu número de fases:
Fase: cada uma das porções que apresenta aspecto visual
homogêneo (uniforme), o qual pode ser contínuo ou não, mesmo
quando observado ao microscópio comum.
Considere as seguintes misturas:
Dessa maneira, as misturas são classificadas em função de
seu número de fases:
Mistura homogênea: toda mistura que apresenta uma única
fase.
As misturas homogêneas são chamadas soluções. Alguns
exemplos: água de torneira, vinagre, ar, álcool hidratado,
pinga, gasolina, soro caseiro, soro fisiológico e algumas
ligas metálicas. Além dessas, todas as misturas de
quaisquer gases são sempre misturas homogêneas.
Mistura heterogênea: toda mistura que apresenta pelo menos duas
fases.
Alguns exemplos de misturas heterogêneas: água e óleo,
areia, granito, madeira, sangue, leite, água com gás. As
misturas formadas por n sólidos apresentam n fases,
desde que estes sólidos não formem uma liga ou um
cristal misto.
Independentemente de uma amostra de qualquer material
ser uma substância ou uma mistura, ela será denominada
um sistema — tudo que é objeto da observação humana
— e também poderá ser classificada em função do seu
aspecto visual.
Resumindo o que foi dito até agora, chegamos ao seguinte
esquema:
REFERÊNCIAS
1. Feltre, Ricardo, 1928- .Química / Ricardo Feltre. — 6. ed.
—São Paulo : Moderna, 2004.
2. Usberco, João - Química — volume único / João Usberco,
Edgard Salvador.— 5. ed.reform. — São Paulo : Saraiva,
2002.
Isso, isso, isso, isso ...
Viram como é fácil !!!





![Roteiro Mensal [3ª série] – Biologia – Química – Empreendedorismo](http://s1.studylibpt.com/store/data/000321355_1-fe20122337e00be7fc133cc291bfacca-300x300.png)