Introdução ao Metabolismo
Mapa 1
Alimentos
Polissacarídeos
Lipídios
Proteínas
glicose
aminoácidos
ácido graxo
CO2
NADH
FADH2
O2
ADP+Pi
NAD+
FAD
CO2
ATP
Mapa 2
Polissacarídeos
Proteínas
Lipídeos
glicose
aminoácidos
ácido graxo
Asp
Gly
Ala
Ser
Cys
Leu Glu
Ile
Lys
Phe
Piruvato
(3)
CO2
Acetil-CoA
(2)
CO2
Oxaloacetato(4)
Citrato(6)
Malato(4)
Isocitrato(6)
CO2
Fumarato(4)
-cetoglutaratoato(5)
Succinato(4)
CO2
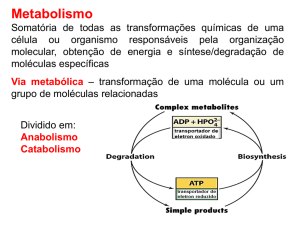
METABOLISMO- Conceitos fundamentais e estudos dirigidos
M1
INTRODUÇÃO AO METABOLISMO
A - MAPA I: DEGRADAÇÃO (OXIDAÇÃO) DE ALIMENTOS:
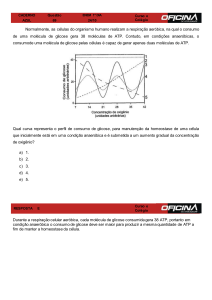
1. Qual a finalidade biológica dos processos descritos no mapa?
2. Analisar a função das coenzimas e do oxigênio na oxidação dos alimentos.
3. Quais os compostos aceptores de hidrogênio? Quais os compostos necessários
para a conversão da forma reduzida das coenzimas na forma oxidada?
B - DISCUTIR AS SEGUINTES AFIRMAÇÕES:
4. A energia dos alimentos é obtida por oxidação. A oxidação biológica consiste na
retirada de hidrogênio (H2) do substrato.
5. Os processos celulares que requerem energia utilizam a energia térmica
proveniente da oxidação dos alimentos.
6. Uma parte da energia derivada da oxidação de alimentos é usada para sintetizar
um composto rico em energia, o ATP. A única função dos alimentos é fornecer
energia.
7. Os compostos característicos de um dado organismo devem ser supridos pela
dieta.
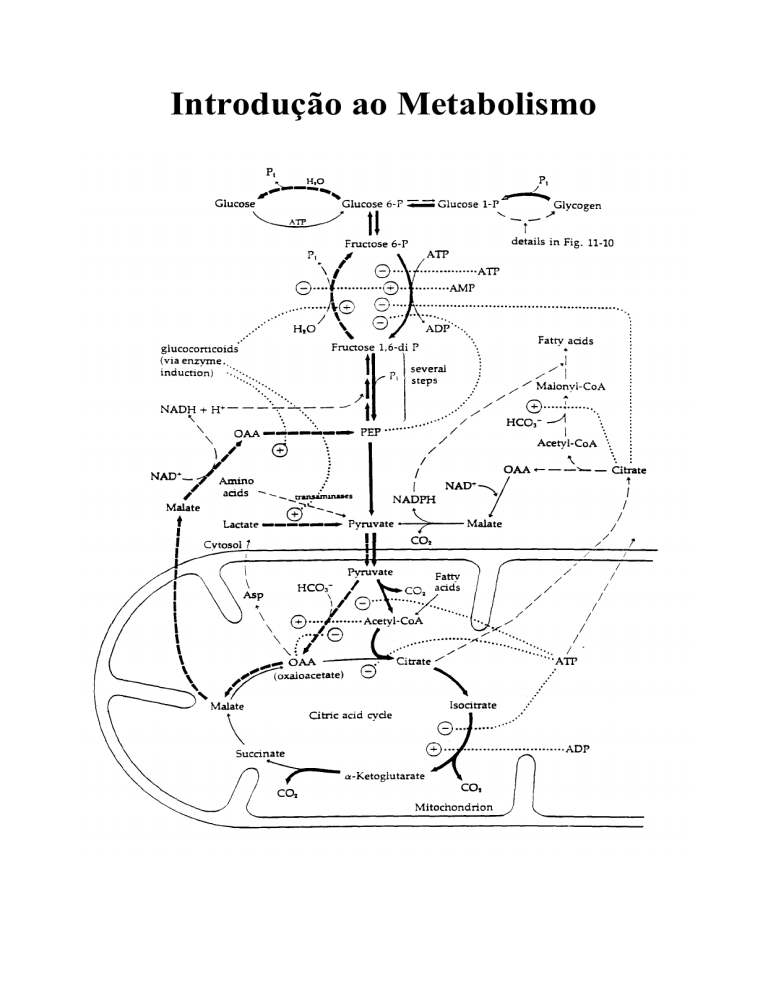
C - MAPA II:
8. Quais são os passos irreversíveis que aparecem no mapa anexo? Qual o primeiro
composto comum à degradação de proteínas, lipídios e carboidratos?
9. Animais de laboratório foram submetidos a dietas compostas exclusivamente de
carboidratos, lipídios, ou proteínas. Estes três tipos de compostos são essenciais
para a sobrevivência. Não havendo outras restrições na dieta, prever que grupo
de animais sobreviveria, verificando se é possível sintetizar:
a) ácido graxo a partir de glicose
b) proteína a partir de glicose
c) glicose a partir de ácido graxo
d) proteína a partir de ácido graxo
e) glicose a partir de proteína
f) ácido graxo a partir de proteína
Indicar no mapa a via utilizada em cada item.
O SENTIDO DAS REAÇÕES
Conceitos Fundamentais
Energia Livre de Gibbs - Mede a quantidade de energia utilizada pelos seres
vivos para realizar trabalho em condições de temperaturas e pressão constantes. É
representada pelo símbolo G.
Variação de Energia Livre (de uma reação química)- Se refere à diferença
entre o conteúdo de energia de reagentes e produtos, que acompanha qualquer
reação química.
G°’ - O sinal atribuído ao G°’ indica o sentido em que a reação tende a
ocorrer em condições padrão (pH 7,0; concentração de reagentes e produtos de 1M;
temperatura de 273 K, pressão de 1 atmosfera).
Nas células, reações com G>0, que não aconteceriam espontaneamente,
passam a acontecer se forem acopladas a reações com G<0 e a somatória das duas
reações produzir um G<0.
Compostos ricos em energia são compostos que contém uma ligação química
(muitas vezes a ligação da qual faz parte o grupamento fosfato), cuja hidrólise
(quebra) é acompanhada de uma grande liberação de energia. Quando o G°’ da
reação de hidrólise de dado composto é negativo e tem valor absoluto maior que
25 kJ/mol o composto é classificado como rico em energia. Procurar no livro texto
uma tabela de compostos ricos em energia.
Nas reações de óxido-redução, para um composto ser oxidado (perder elétrons
ou átomos de hidrogênio) algum outro composto tem que necessariamente ser
reduzido (ganhar elétrons ou átomos de hidrogênio).
A tendência de um par redox ganhar ou perder elétrons é determinada pelo valor
do potencial de óxido-redução padrão (E°) de cada par.
Questões
1.
Desenhe a estrutura do ATP. Aponte na estrutura química da molécula de ATP,
os componentes responsáveis por seu nome: adenosina trifosfato. Explique porquê o
ATP é um composto rico em energia.
2.
Leia sobre variação de energia livre em reações de óxido-redução e explique
como se pode medir o potencial redox de determinada reação.
3.
A uma solução com concentração 1M de NAD+, NADH, piruvato e lactato,
adicionou-se lactato desidrogenase. O potencial de óxido-redução padrão (E°) dos
sistemas NAD+/NADH e piruvato/lactato é igual a –0,32V e –0,19V,
respectivamente.
a) Em que sentido ocorrerá a reação?
b) Como variam os potenciais de óxido-redução dos sistemas à medida que
a reação ocorre?
c) Em que condições a reação atingirá o equilíbrio? Qual o valor do
potencial de óxido-redução dos dois sistemas nesta situação?
d) Qual o valor G’ da reação?
M2
GLICÓLISE / DESTINOS DO PIRUVATO
Conceitos fundamentais
Glicose: principal substrato oxidável para a maioria dos organismos; única fonte de
energia utilizável pelas hemácias e tecido nervoso.
A glicólise é uma via de degradação da glicose que ocorre no citossol de células
procarióticas e eucarióticas.
A glicólise é uma seqüência de 10 reações catalisadas por enzimas, por meio das
quais uma molécula de glicose (6C) é convertida a duas moléculas de piruvato (3C),
com a produção líquida de dois ATPs e a redução de dois NAD+ a dois NADH.
No primeiro estágio da glicólise, a glicose é fosforilada pela hexoquinase originando
glicose-6-fosfato; esta é isomerizada pela fosfoglicose-isomerase produzindo
frutose-6-fosfato que é então fosforilada pela fosfofrutoquinase formando frutose1,6-bisfosfato. Sua clivagem pela aldolase produz duas trioses: gliceraldeído-3fosfato e diidroxiacetona-fosfato, que são interconvertidas pela triose-fosfatoisomerase. Essas reações consomem 2 ATP por glicose.
No segundo estágio da glicólise, o gliceraldeído-3-fosfato é fosforilado pela
gliceraldeído-3-fosfato-desidrogenase, formando o 1,3-bisfosfoglicerato que é
defosforilado pela fosfoglicerato-quinase para produzir ATP. O 3-fosfoglicerato é
isomerizado pela fosfoglicerato-mutase produzindo 2-fosfoglicerato que é
desidratado pela enolase levando à formação de fosfoenolpiruvato, que sofre
defosforilação pela piruvato-quinase produzindo um segundo ATP e um piruvato.
Esse estágio produz 4 ATP por glicose, entretanto, descontando os ATP usados para
as fosforilações iniciais da via, houve um rendimento líquido de 2 ATP por glicose.
Em condições anaeróbicas (fermentação), o piruvato é reduzido pelo NADH a
lactato regenerando NAD+ para prosseguimento da glicólise (fermentação lática).
Na fermentação alcoólica, o piruvato é descarboxilado formando acetaldeído e este
recebe os elétrons provenientes do NADH. O acetaldeído é reduzido a etanol
recebendo o hidrogênio do NADH que se reoxida.
As reações da via glicolítica catalisadas pela hexoquinase, fosfofrutoquinase e
piruvato-quinase são irreversíveis.
Os possíveis destinos do piruvato são: 1) via aeróbica completa após
descarboxilação oxidativa e formação de acetil-CoA para entrada em Krebs; 2)
fermentação lática (músculo); 3) fermentação alcoólica (leveduras ou bactérias).
Questões
1. Escreva as reações da glicólise mostrando as fórmulas estruturais dos intermediários
e os nomes das enzimas que catalisam as reações.
2. Baseado no mapa da glicólise, responda as seguintes questões:
a. Qual a finalidade da via glicolítica?
b. Escreva a reação de oxidação da coenzima NADH (nicotinamida-adeninadinucleotídeo) apresentando as estruturas químicas completas.
c. Qual(is) o(s) composto(s) que aceitam os átomos de hidrogênio na via
glicolítica?
d. Escrever as reações de óxido-redução que ocorrem na via glicolítica
identificando os pares redox, compostos oxidados e compostos reduzidos nessas
reações.
e. Associar formação de ATP e reações de óxido-redução.
f. Quais são os passos irreversíveis da glicólise?
3. Indicar os compostos ricos em energia formados na glicólise.
4. Descrever os três possíveis destinos do piruvato.
5. Indicar os principais tipos de reação encontrados na via glicolítica. Esses tipos serão
comuns a diversas vias metabólicas que serão estudadas mais adiante.
6. Discutir se é verdadeiro ou falso:
( ) A quantidade de NAD+ é um dos limitantes da glicólise.
( ) Quando a razão ATP/ADP está baixa, a via glicolítica está inibida.
7. Quantas moléculas de piruvato se formam a partir de uma molécula de glicose?
8. Verificar na via metabólica os compostos que apresentam ligações do tipo: a)
fosfoenol, b) anidrido fosfórico, c) éster fosfórico.
9. Identificar também as reações catalisadas pelas seguintes enzimas: a) quinase, b)
mutase, c) isomerase, d) aldolase, e) desidrogenase.
10. Considerando o número de moléculas de ATP consumidas e formadas, estabelecer o
saldo final de ATP na oxidação de uma molécula de glicose pela via glicolítica.
11. Citar os compostos que devem ser fornecidos à via glicolítica para haver formação
de lactato (iniciar a via) ou mantê-la em funcionamento.
12. Esquematizar as reações de fermentação alcoólica que possibilitam a obtenção de
NAD+ na forma oxidada. Citar exemplos de tecidos ou organismos onde ocorrem
fermentação lática e alcoólica. Em que condições o músculo oxida glicose a lactato?
Formação de Acetil-CoA
13. Escrever a reação de formação de acetil-CoA a partir de piruvato e indicar: a) as 5
coenzimas necessárias, b) as vitaminas envolvidas e c) a sua localização celular
14. Esquematizar as reações que permitem a oxidação de etanol a acetil-CoA.
15. Quando glicose é metabolizada a acetil-CoA, citar o número de moléculas de ATP,
NADH e CO2 formadas.
Sentido das reações da via glicolítica em condições fisiológicas e regulação da via
1. Reações irreversíveis possuem G 0.
2. Reações reversíveis possuem G ~ 0.
3. O controle de uma via metabólica ocorre sempre através do controle das etapas
irreversíveis dessa via.
4. Para controlar dada reação irreversível deve-se controlar a enzima que a catalisa.
5. As enzimas podem aumentar ou diminuir suas atividades de acordo com o meio
ambiente onde se encontram. Por exemplo, a fosfofrutoquinase torna-se
praticamente inativa quando há abundância de ATP na célula.
Estudo dirigido
1. Determinar o sentido das reações da via glicolítica.
2. Discutir porque etapas irreversíveis em geral estão acopladas ao gasto de ATP.
3. Como fatores alostéricos regulam enzimas?Quais as enzimas que são reguladas
por fatores alostéricos na via glicolítica?
4. Discutir como a glicólise é regulada a partir do mapa metabólico geral.
M3
GLICONEOGÊNESE E CICLO DE CORI
Conceitos fundamentais
Os principais reagentes que irão produzir glicose pela gliconeogênese são:
1)lactato; 2)aminoácidos conversíveis a piruvato; 2) aminoácidos conversíveis a
oxaloacetato; 3) glicerol conversível a dihidroxicetona fosfato.
A conversão dos reagentes da gliconeogênese a glicose requer substituição de
enzimas da glicólise que catalisam etapas irreversíveis. A piruvato-carboxilase e
a fosfoenolpiruvato-carboxiquinase substituem a piruvato-quinase. A frutose-
1,6-bisfosfatase substitui a fosfofrutoquinase. A glicose-6-fosfatase substitui a
hexoquinase.
A regulação da glicólise e da gliconeogênese é recíproca: se uma via está ativada
a outra estará desativada. A gliconeogênese é favorecida e a glicólise é
desfavorecida, quando a célula está com carga energética alta. A gliconeogênese
é regulada por alterações na síntese das enzimas e por efetuadores alostéricos,
incluindo a frutose-2,6-bisfosfato, que inibe a frutose-1,6-bisfosfatase (enzima
da gliconeogênese) e ativa a fosfofrutoquinase (enzima da glicólise).
Estudo dirigido
1. Definir gliconeogênese. Citar o tecido responsável pela gliconeogênese.
2. Observar a Figura 11. 17 com o esquema da lançadeira malato-aspartato.
Identificar na capa da apostila a mesma lançadeira. Porque a lançadeira malatoaspartato é importante para a gliconeogênese? Qual o nome das enzimas
importantes para a conversão de aminoácidos como o aspartato em piruvato?
3. Comparar as três reações irreversíveis da glicólise com as reações da
gliconeogênese que as substituem, quanto a reagentes, produtos, enzimas e
coenzimas.
4. Porque o fosfoenolpiruvato é um composto rico em energia? Dar a base
estrutural para a ocorrência de ligação altamente energética.
5. Comparar a estequiometria da glicólise e a da gliconeogênese e explicar porquê
uma simples reversão da glicólise não foi o esquema adotado pela natureza para
obtenção de glicose. Explicar através de energética das vias.
6. O que é o ciclo de Cori?
M4
VIA DAS PENTOSES
Conceitos Fundamentais
Muitas funções celulares que envolvem reações endergônicas são efetuadas
graças à hidrólise exergônica de ATP. Outras reações endergônicas, como a
síntese de ácidos graxos e colesterol e a fotossíntese, requerem NADPH, que
tem um grande poder redutor.
O grupo fosforila no carbono 2 de uma das unidades de ribose do NADPH o
diferencia de NADH. NADH é oxidado pela cadeia respiratória para gerar ATP,
enquanto que NADPH serve como um doador de elétrons em reações
biossintéticas redutoras.
Na via das pentoses, NADPH é gerado quando a glicose-6-fosfato é oxidada a
ribose-5-fosfato, que é um açúcar de 5 carbonos, componente de vários
compostos importantes, como ATP, CoA, NAD+, FAD, RNA e DNA.
A via das pentoses também catalisa a interconversão de açúcares de 3, 4, 5, 6 e 7
carbonos, em uma série de reações não oxidativas que ocorrem no citosol.
As reações da via das pentoses são as seguintes:
glicose-6-fosfato é desidrogenado e convertido a ribulose-5-fosfato, em três
reações, produzindo 2 NADPH + H+.
ribulose-5-fosfato é isomerizada a ribose-5-fosfato.
Nestas reações, 2 NADPH + H+ e uma ribose-5-fosfato são gerados para cada glicose6-fosfato oxidada.
ribose-5-fosfato é convertida a gliceraldeído-3-fosfato e frutose-6-fosfato pela
transcetolase e transaldolase. A transcetolase catalisa a transferência de unidades
de C2 de uma cetose para uma aldose. A transaldolase transfere unidades de C3
de uma aldose para uma cetose.
As reações de transcetolase e transaldolase criam uma ligação reversível entre a
via das pentoses e a via glicolítica. O resultado dessas reações é a formação de 2
hexoses e 1 triose a partir de 3 pentoses:
C5 + C5
C3 + C7
Transcetolase
C7 + C3
C4 + C6
Transaldolase
C5 + C4
C3 + C6
Transcetolase
O excesso de ribose-5-fosfato formado pela vias das pentoses pode ser
completamente convertido em intermediários da via glicolítica.
A primeira reação da via das pentoses, a desidrogenação da glicose-6-fosfato, é
praticamente irreversível. E é essa a reação em que a via das pentoses é
controlada. O fator regulatório mais importante é o nível de NADP+, o receptor
de elétrons na oxidação da glicose-6-fosfato a 6-fosfogluconolactona. Além
disso, NADPH compete com NADP+ pela ligação à enzima. A parte não
oxidativa da via das pentoses é controlada principalmente pela disponibilidade
de substratos.
A via percorrida pela glicose-6-fosfato depende da necessidade celular de
NADPH + H+, ribose-5-fosfato e ATP:
Quando muito mais ribose-5-fosfato é requerida que NADPH + H+, a maior parte
de glicose-6-fosfato é convertida a frutose-6-fostato e gliceraldeído-3-fosfato pela
via glicolítica, a transaldolase e a transcetolase convertem esses em ribose-3fosfato.
Quando a necessidade de NADPH + H+ e ribose-5-fosfato estão balanceadas, a
reação predominante é a formação de 2 NADPH e uma ribose-5-fosfato de
glicose-6-fosfato pela fase oxidativa da via das pentoses.
Quando muito mais NADPH + H+ é requerido que ribose-5-fosfato, a glicose-6fosfato é completamente oxidada a CO2, ou convertida a piruvato.
Estudo dirigido
1.Mostre a parte oxidativa do ciclo das pentoses com as equações das reações
envolvidas, indicando os agentes oxidantes e a origem do carbono presente no CO2
liberado.
2.Compare NADH e NADPH, indicando suas funções no metabolismo de carboidratos.
Explique porque a via da pentose-fosfato é muito mais ativa no tecido adiposo que no
músculo.
3.Quando há necessidade de NADPH, o ciclo das pentoses pode funcionar dando um
resultado líquido que equivale à oxidação total de glicose a CO2. Explique este processo
através das respectivas reações estequiometricamente equilibradas.
4. Ribose 5-fosfato pode ser obtida para a síntese de nucleotídeos através da via das
pentoses, com ou sem oxidação da glicose. Mostre como isso é possível com as
respectivas equações químicas.
5.Explique como a via da pentose–fosfato é controlada, tendo em vista que grande parte
das reações dessa via é reversível.
6.Compare as reações catalisadas por transaldolases e transcetolases, indicando
reagentes, produtos e a natureza das reações.
M5
Metabolismo de ácidos graxos
Biosíntese de ácidos graxos
Conceitos Básicos
1. Na síntese de ácidos graxos, a acetil-CoA mitocondrial é translocada ao citosol via
sistema de transporte de tricarboxilato e ativada a malonil-CoA pela ação de acetilCoA-carboxilase.
2. Uma série de atividades enzimáticas, que em mamíferos estão contidas em uma
enzima homodimérica multifuncional, estende cadeias acil-ACP (ACP é o grupo
carreador de acila) em dois carbonos por vez. Um grupo acila ligado à enzima e uma
malonil-CoA condensam-se para formar um intermediário -cetoacil e CO2. Duas
reduções e uma desidratação fornecem uma acil-ACP em uma série de reações
similares ao reverso da -oxidação, mas são catalisadas por enzimas distintas no
citosol. O palmitato (C16), o produto normal da biossíntese de ácidos graxos, é
sintetizado em sete desses ciclos de reações, sendo, então, hidrolisados da ACP por
uma tioeterase.
3. As rotas opostas de degradação e síntese de ácidos graxos são reguladas por
hormônios. O glucagon e a epinefrina ativam a lípase sensível a hormônio no tecido
adiposo, aumentando o suprimento de substrato para a acil-CoA-carboxilase. A
insulina tem o efeito oposto. Os hormônios também regulam os níveis de acetilCoA-carboxilase e do ácido graxo sintase controlando a taxa de biosíntese dessas
enzimas.
Estudo dirigido
Síntese de ácidos graxos
01. Relacionar o nível de citrato com o nível de ATP na mitocôndria.
02. Esquematizar a reação catalisada pela citrato liase.
03. Esquematizar as reações que permitem a transferência de acetil-CoA da mitocôndria
para o citossol, mostrando a regeneração do oxaloacetato mitocondrial, com
participação da enzima málica.
04. Escrever a reação catalisada pela acetil-CoA carboxilase. Citar as coenzimas
envolvidas na reação e os efetuadores alostéricos dessa enzima.
05. Citar as proteínas componentes do complexo multienzimático de síntese de ácidos
graxos.
06. Definir ACP e comparar sua função com a da coenzima A.
07. Analisar as reações que levam à formação de um ácido graxo a partir de acetil-CoA
e malonil-CoA no complexo multienzimático.
08. Citar o agente redutor na biossíntese de ácidos graxos e as suas fontes.
09. Indicar a localização celular da biossíntese de ácidos graxos.
10. Citar tecidos onde ocorre essa biossíntese.
11. Indicar o composto presente nos depósitos do tecido adiposo e as reações que levam
à sua síntese.
12. Esquematizar a via de síntese do glicerol-fosfato, precursor de triacilgliceróis.
13. Definir ácido graxo essencial. Citar exemplos indicando o número de insaturações.
14. Escrever a estrutura química dos corpos cetônicos, o órgão e as condições que
determinam sua síntese.
15. Analisar as reações que levam à sua produção.
16. Esquematizar as reações que permitem o aproveitamento dos corpos cetônicos. Citar
os tecidos onde ocorrem essas reações.
17. Indicar as condições metabólicas que levam a um aumento na produção de corpos
cetônicos.
18. Citar as consequências de uma produção excessiva de corpos cetônicos.
19. Descrever as alterações metabólicas decorrentes da falta de insulina (diabetes).
20. Citar o precursor básico e as coenzimas necessárias para a síntese de colesterol.
Analisar a regulação desta via.
21. Citar compostos derivados do colesterol.
22. Verificar a ação do glucagon e adrenalina no metabolismo de triacilgliceróis.
22. A insulina estimula a síntese de triacilgliceróis. Explicar porque.
Beta-oxidação de ácidos graxos
Conceitos Fundamentais
A digestão de triacilgliceróis depende da atividade emulsificante dos ácidos
biliares e da ativação de lipases na interface lipídeo-água. Depois de serem
absorvidos, os produtos da digestão de lipídeos são arranjados em lipoproteínas
para transporte aos tecidos pela corrente sanguínea.
Triacilgliceróis são lipídeos formados pela esterificação dos ácidos graxos pelo
glicerol, são muito abundantes na dieta e constituem a forma de armazenamento
de todo o excesso de nutrientes. A vantagem de se armazenar lipídeos (na forma
de triacilgliceróis) ao invés de carboidratos é que a oxidação de lípides tem um
rendimento energético muito maior.
Os ácidos graxos são liberados dos triacilgliceróis nos seus sítios de
armazenamento no tecido adiposo pela triacilglicerol-lipase sensível a hormônio,
e são carregados pelo sangue aos seus sítios de oxidação complexados com
albumina.
A oxidação de ácidos graxos é a principal fonte de energia liberada na
degradação de lipídeos. Depois da ativação no citossol, essa degradação tem
lugar na matriz mitocondrial através de um processo chamado -oxidação ou
ciclo de Lynen.
A oxidação de ácidos graxos inicia-se com a ação da enzima acil-CoA sintetase
que transformam ácidos graxos em acil-CoA. Como a membrana interna da
mitocôndria é impermeável a esta molécula, os radicais acila dos ácidos graxos
são ligados à carnitina e desta forma transportados para a mitocôndria.
Neste processo, unidades de dois carbonos são sucessivamente removidas a
partir do terminal carboxílico do ácido graxo para produzir acetil-CoA.
A -oxidação ocorre em quatro reações: (1) formação de uma ligação dupla ,
; (2) hidratação da ligação dupla; (3) desidrogenação para formar uma -
cetoacil-CoA; (4) tiólise pela CoA para produzir acetil-CoA e uma acil-CoA
encurtada em dois carbonos. Esse processo é repetido até que os ácidos graxos
com número par de carbonos sejam convertidos em acetil-CoA e uma molécula
de propionil-CoA. A acetil-CoA é oxidada pelo ciclo de Krebs e pela
fosforilação oxidativa para geração de ATP. Propionil-CoA é convertida em
succinil-CoA, um intermediário do ciclo de Krebs.
A oxidação de ácidos graxos insaturados requer uma isomerase para converter as
ligações duplas 3 para ligações duplas 2 e uma redutase para remover ligações
duplas 4. A oxidação de ácidos graxos de cadeia ímpar fornece propionil-CoA,
que é convertida em succinil-CoA através da rota dependente de cobalamina
(B12). Os ácidos graxos de cadeia muito longa são parcialmente oxidados por um
sistema de três enzimas nos peroxissomas.
O fígado utiliza o excesso de acetil-CoA para sintetizar acetoacetato e hidroxibutirato, que são liberados na circulação sanguínea. Os tecidos que usam
estes corpos cetônicos como combustível os convertem de volta em acetil-CoA.
A degradação de triacilgliceróis é estimulada por glucagon e adrenalina e inibida
por insulina.
Estudo dirigido
1. Esquematizar a reação catalisada por lipases de tecido adiposo.
2. Esquematizar as reações de conversão de glicerol a compostos intermediários da via
glicolítica.
3. Esquematizar o primeiro passo necessário para a degradação de um ácido graxo
(ativação).
4. Indicar o papel da carnitina na oxidação dos ácidos graxos.
5. Citar os compostos formados no fim de cada volta do ciclo de Lynen.
6. Citar as enzimas envolvidas na -oxidação.
7. Citar as vitaminas que participam do ciclo de Lynen.
8. Quantas moléculas de ATP são necessárias para degradar uma molécula de ácido
graxo?
9. Indicar a reação irreversível do ciclo de Lynen e a enzima que catalisa essa reação.
10. Citar a localização celular da beta-oxidação. Explicar a origem da denominação
“beta-oxidação” para a via de degradação de ácidos graxos.
11. Citar os tecidos que não oxidam ácidos graxos.
12. Escrever a equação geral da beta-oxidação do derivado acila do ácido palmítico a
acetil-CoA.
M6
CICLO DE KREBS
Conceitos Fundamentais
O ciclo de Krebs é a via metabólica final comum para a oxidação de carboidratos,
lipídeos e proteínas.
Ocorre na membrana interna da mitocôndria e é conhecido também como Ciclo do
Ácido Cítrico.
As reações do ciclo de Krebs estão relacionadas à cadeia de transporte de elétrons e
a fosforilação oxidativa, que conduzem ao oxigênio. Os receptores de elétrons nas
reações de oxidação são o NAD+ e o FAD.
As oito enzimas do ciclo de Krebs funcionam em ciclo catalítico de múltiplas
etapas, promovendo a oxidação um grupo acetil-CoA a duas moléculas de CO2, com
geração concomitante de três NADH, um FADH2 e um GTP. A energia livre
sintetizar ATP.
Os grupos acetila entram no ciclo como acetil-CoA. O complexo multienzimático da
piruvato-desidrogenase, que contém três enzimas e cinco coenzimas, produz acetilCoA a partir do piruvato.
A citrato sintase catalisa a condensação da acetil-CoA e do oxaloacetato em uma
reação altamente exergônica.
A aconitase catalisa a isomerização do citrato a isocitrato, e a isocitratodesidrogenase catalisa a descarboxilação oxidativa do isocitrato a -cetoglutarato e
produz o primeiro CO2 e NADH do ciclo de Krebs.
A -cetoglutarato desidrogenase catalisa a descarboxilação oxidativa do cetoglutarato, produzindo succinil-CoA e a segunda molécula de CO2 e NADH do
ciclo.
A succinil-CoA sintetase acopla a clivagem da succinil-CoA à síntese da GTP.
No ciclo de Krebs ocorrem ainda mais três reações catalisadas pela succinatodesidrogenase (succinato fumarato), pela fumarase (fumarato malato) e pela
malato desidrogenase (malato oxaloacetato), que regeneram o oxaloacetato para a
continuação do ciclo.
A entrada de acetil-CoA no ciclo de Krebs é regulada pela carga energética da
célula, pois o ATP funciona como efetuador alostérico negativo do complexo
piruvato desidrogenase na etapa de conversão de piruvato a acetil-CoA.
O ciclo de Krebs é regulado fundamentalmente pela carga energética da célula uma
vez que o ATP é efetuador alostérico negativo das enzimas citrato sintase e
isocitrato desidrogenase NAD+-dependente e -cetoglutarato desidrogenase. Além
disso, ocorre ainda regulação pela disponibilidade de substrato, inibição pelo
produto e inibição por retroalimentação.
O ciclo do glioxilato, que ocorre apenas em plantas e em algumas bactérias,
necessita de duas enzimas para ocorrer, a isocitrato liase e a malato sintase. Essa
variação no ciclo de Krebs permite a síntese de glicose a partir da acetil-CoA.
Estudo dirigido
1. Descreva as cinco reações do complexo multienzimático da piruvato-desidrogenase.
2. Desenhe a estrutura dos oito intermediários do ciclo de Krebs e o nome das enzimas
que catalisam as suas interconversões. Consultar em livros de Bioquímica o valor da
variação de energia livre de cada reação em condições padrão.
3. Citar as funções do Ciclo de Krebs.
4. Citar as vitaminas que participam do Ciclo de Krebs.
5. Indicar a localização celular do Ciclo de Krebs.
6. A isomerização do citrato a cis-aconitato possui variação de energia livre em
condições padrão positiva. Discutir as implicações da inibição do ciclo por alta
carga energética quanto ao deslocamento dessa reação de isomerização.
7. Escreva a equação resultante da soma de todas as reações de: 1)glicose a CO2; 2)
glicose a piruvato; 3) piruvato a acetilCoA; 4) acetilCoA a CO2.
8. Compare a energética de reações do ciclo de Krebs envolvendo FAD ou NAD+.
9. Na oxidação de uma molécula de acetil-CoA no Ciclo de Krebs, indicar a enzima
que catalisa a reação onde há produção ou consumo de: a) CO2, b) GTP, c) NADH,
d) FADH2, e) H2O.
REGULAÇÃO DO CICLO DE KREBS
O controle do ciclo de Krebs é exercido em três pontos, ou seja, três enzimas do
ciclo exercem papel regulatório.
Os pontos de controle são as reações catalisadas pela citrato sintase, pela
isocitrato desidrogenase e pelo complexo -cetoglutarato desidrogenase.
A citrato sintase é uma enzima inibida por ATP, NADH e succinil-CoA. Há
também inibição pelo produto, neste caso, o citrato.
ADP e NAD+ são ativadores alostéricos da isocitrato desidrogenase; ATP e
NADH são inibidores.
O complexo -cetoglutarato desidrogenase é inibido por ATP e por NADH e
ativado por ADP e NAD+.
Células em estado metabólico de repouso necessitam e usam pouca energia; alto
nível de ATP, baixo nível de ADP (ATP/ADP alto); alto nível de NADH e baixo
nível de NAD+ (alto NADH/NAD+).
Células em estado metabólico ativo necessitam e usam mais energia do que
células em repouso; baixo nível de ATP e alto nível de ADP (ATP/ADP baixo);
baixo nível de NADH, alto nível de NAD+ (NADH/NAD+ baixo).
Estudo dirigido
1. Determinar o sentido das reações do ciclo de Krebs e verificar G destas
reações.
2. De que modo um aumento na relação ADP/ATP influencia a atividade da
isocitrato desidrogenase?
3. Você esperaria que o ciclo de Krebs fosse mais ou menos ativo quando uma
célula tem uma relação de ATP/ADP e de NADH/NAD+ alta? Justifique.
M7
CADEIA RESPIRATÓRIA e FOSFORILAÇÃO OXIDATIVA
Conceitos Fundamentais
Todas as coenzimas reduzidas obtidas pelo catabolismo são reoxidadas
graças à cadeia de transporte de elétrons. Então, as moléculas de NADH e
FADH2, em uma série de reações, transferem os elétrons para o oxigênio,
sendo este o aceptor final. Essas reações ocorrem na cadeia transportadora
de elétrons, cuja localização é a membrana mitocondrial interna.
A cadeia de transporte de elétrons corresponde a uma organização
estratégica de biomoléculas na membrana mitocondrial interna dispostas
segundo seu potencial de óxido-redução.
O transporte de elétrons das coenzimas até o O2 requer quatro complexos
ligados à membrana. São eles: complexo I (NADH-CoQ oxidoredutase);
complexo II (succinato-CoQ oxidoredutase); complexo III (CoQH2citocromo c oxidoredutase e complexo IV (citocromo c oxidase).
A operação da cadeia transportadora de elétrons conduz ao bombeamento de
prótons (íons hidrogênio), criando um gradiente de pH (também chamado de
gradiente de prótons) entre o espaço intermembranas mitocondriais e a
matriz mitocondrial.
O gradiente de prótons é dissipado através de um canal que existe na ATPsintase da membrana mitocondrial interna. Essa variação de energia
potencial é convertida parcialmente em energia de ligação química da
molécula de ATP que é sintetizada por essa mesma enzima.
Em resumo, a energia liberada pela oxidação dos nutrientes é usada pelos
organismos sob a forma de energia química contida no ATP. A produção de
ATP na mitocôndria é o resultado da fosforilação oxidativa, no qual o ADP
é fosforilado obtendo-se ATP.
A cadeia transportadora de elétrons e a fosforilação oxidativa são processos
acoplados.
O acoplamento quimiosmótico é o mecanismo mais amplamente utilizado
para explicar o modo pelo qual o transporte de elétrons e a fosforilação
oxidativa estão acoplados.
A maneira pela qual o gradiente de prótons leva à produção de ATP depende
de canais iônicos, que atravessam a membrana mitocondrial interna; esses
canais são uma característica estrutural da ATP-sintase.
A síntese de ATP depende da cadeia transportadora de elétrons. O fluxo de
elétrons só ocorre enquanto houver a síntese de ATP.
A oxidação dos substratos é impedida sempre que a concentração de ATP
tem níveis compatíveis com a demanda.
A velocidade de produção de ATP é determinada pela concentração de ADP
e Pi, substratos da ATP-sintase.
A síntese de ATP processa-se em velocidade paralela à sua oxidação.
Estudo dirigido
1. Citar os compostos que fazem parte da cadeia de transporte de elétrons e
caracterizá-los quimicamente.
2. Esquematizar a seqüência dos compostos da cadeia de transporte de elétrons,
indicando os transportadores de elétrons e os transportadores de prótons e
elétrons.
3. Citar a localização celular da cadeia de transporte de elétrons.
4. Citar 3 inibidores da cadeia de transporte de elétrons, indicando os
transportadores sobre os quais atuam.
5. Verificar se é possível a oxidação de malato e de succinato em presença de
rotenona.
6. Qual seria o estado de oxidação (oxidado/reduzido) dos componentes da cadeia
de transporte de elétrons em presença de malato e de antimicina A?
7. Definir fosforilação oxidativa.
8. Descrever a hipótese do acoplamento quimiosmótico para a fosforilação
oxidativa.
9. Indicar o número de ATP sintetizados para cada NADH e FADH2 oxidados.
Citar exemplos de processos biológicos que utilizam ATP.
10. Definir desacoplador e citar um exemplo.
11. Definir inibidor de fosforilação oxidativa e citar um exemplo.
12. Definir controle respiratório.
a) Definir fosforilação ao nível do substrato e citar as reações onde ocorre esta
fosforilação.
13. Dinitrofenol acelera o consumo de oxigênio pela cadeia de transporte de
elétrons. Justifique.
14. Citar as conseqüências dos seguintes fatores para o funcionamento da cadeia de
transporte de elétrons e da fosforilação oxidativa:
a) presença de CN- ou CO
b) carência de Pi
c) carência de ADP
d) presença de DNP (dinitrofenol)
e) carência de Pi e/ou ADP em presença de DNP
f) presença de oligomicina
g) presença de oligomicina + DNP
15. Calcular o saldo de ATP formado na oxidação total de glicose.Qual o destino da
energia não armazenada sob a forma de ATP? Qual seria o resultado na presença
de dinitrofenol?
M8
METABOLISMO DO GLICOGÊNIO E SUA REGULAÇÃO
Conceitos Fundamentais
O glicogênio é um polissacarídeo de glicose que funciona como forma de reserva de energia em
animais e microrganismos. Em animais, o glicogênio está depositado no fígado, um órgão
central de reserva de energia, e, também, nos músculos, onde é degradado localmente. O
glicogênio hepático é exportado para manter a glicemia.
A natureza polimérica e semi-solúvel do glicogênio constitui-se numa maneira perfeita de
armazenar energia na forma de glicose. O estoque de glicogênio do fígado na forma de glicose
causaria tamanha pressão osmótica, que a viabilidade do hepatócito seria impossível.
O glicogênio é um polímero de -D-glico-piranose altamente ramificado. Na cadeia os
monômeros são interligados por ligações glicosídicas (14); nos pontos de ramificação a
ligação também é glicosídica, mas (16).
A glicose, na forma de glicose-1-P, é liberada da reserva de glicogênio pela fosforólise da
ligação (14) da extremidade não redutora do polímero. Esta reação é catalisada pela
glicogênio fosforilase.
A glicogênio fosforilase degrada até restarem 4 resíduos antes de uma ramificação até que a
enzima desramificadora transfere 3 dos 4 resíduos para outra extremidade da cadeia de
glicogênio formando uma nova ligação (14). O resíduo restante está ligado a cadeia pela
ligação (16) que é hidrolisada pela enzima desramificadora através de sua atividade
(16) glicosidase.
Glicose-1-fosfato é convertida a glicose-6-fosfato pela fosfoglicomutase, esta pode ser liberada
pela circulação no fígado pela ação da glicose-6-fosfatase ou degradada pelo músculo.
A síntese do glicogênio se dá através de via uma diferente da de degradação. A glicose-1-P é
primeiro ativada à uridinadifosfato-glicose, ou simplesmente UDP-G. UDP-G é o substrato da
glicogênio sintase que catalisa a adição de um resíduo de glicose ao carbono 4 da glicose de uma
extremidade não redutora do glicogênio, liberando ainda como produto UDP. Esta reação
necessita de cadeias glicogênicas pré-existentes que funcionam como PRIMER da reação,
oferecendo extremidades não redutoras para reagir com UDP-G.
Gli 6-P
Glicose 1-P
Gli 1-P + UTP UDP-Gli + PPI (1-fosfato uridil transferase)
UDP-Gli + glicogênio (n) UDP + glicogênio (n + 1)
O UDP é convertido a UTP às custas da utilização de ATP:
PPI + H2O 2 PI (pirofosfatase)
UDP + ATP UTP + ATP (nucleosídeo difosfato quinase)
A glicogênio fosforilase e glicogênio sintase formam um ciclo que, respectivamente, libera e
deposita glicose-1-P a partir do estoque de glicogênio:
UTP + H2O
Glicose-1P
2 Pi
UDPG
Glicogênion
Fosforilase
Pi
Sintase I
Glicogênion+1
UDP
É fácil notar que se estas enzimas funcionarem concomitantemente o ciclo será fútil, cujo único
resultado líquido será dissipação de energia através da reação:
UTP + H2O UDP + Pi
Conclui-se que, necessariamente, no hepatócito estas enzimas são coordenadamente reguladas,
isto é, quando a fosforilase é ativada para mobilizar glicose-1-P, a sintase é desativada, e viceversa, conforme a necessidade celular.
Ambas fosforilase e sintase são reguladas por fosforilação (modificação covalente) em resíduos
específicos de serina, reações catalisadas pela mesma proteína-quinase que possui dupla
especificidade, sendo por isso chamada de sintase-fosforilase quinase. A fosforilase e a sintase
são espécies fosforiladas, portanto a fosforilação, catalisada pela sintase-fosforilase quinase,
causa ativação da fosforilase e inativação da sintase.
A fosforilase a e a sintase I (formas ativas), por um lado, e a fosforilase b e a sintase D (formas
não ativas), por outro, são, respectivamente interconversíveis. Para tanto é necessário que
fosforilase a e a sintase I sejam desfosforiladas, através de uma reação que requer catálise. A
principal enzima, catalisadora comum destas desfosforilações, é a fosfoproteína fosfatase 1.
Hormônios específicos regulam a síntese e a degradação de glicogênio no músculo e no fígado.
A adrenalina aumenta degradação no músculo enquanto que o glucagon faz o mesmo no fígado.
A insulina aumenta a síntese de glicogênio tanto no músculo quanto no fígado.
Os hormônios mencionados são hidrosolúveis e atuam via segundo mensageiro com ativação da
adenilato ciclase e formação de AMP-cíclico. Isso porque os hormônios não conseguem penetrar
no interior das células.
A degradação e a síntese de glicogênio possuem regulação recíproca, ou seja, quando a
degradação está ativada, a síntese está inibida. Essa regulação é feita através dos hormônios e de
fosforilações estratégicas que culminam na fosforilação final da fosforilase com sua ativação e
na fosforilação final da sintetase com sua inibição.
A liberação de Ca2+ no músculo juntamente com a regulação hormonal são responsáveis pela
degradação de glicogênio no músculo.
Estudo dirigido
1.
2.
3.
4.
Definir polissacarídeo. Citar exemplos de polissacarídeos estruturais e de reserva.
Descrever a estrutura do glicogênio.
Esquematizar as reações de degradação do glicogênio a glicose 1-fosfato.
Citar os hormônios que estimulam a degradação do glicogênio no fígado e no músculo e mostrar
seu modo de ação.
5.
Esquematizar as reações de síntese do glicogênio a partir de glicose.
6.
Esquematizar as reações de conversão de glicose 1-fosfato a glicose. Citar os tecidos onde estas
reações ocorrem.
7.
Esquematizar as reações de síntese de glicogênio a partir de glicose.
8.
Mostrar a relação entre AMP cíclico e a síntese de glicogênio.
9.
Descrever a ação de insulina sobre o metabolismo de carboidratos quanto à:
a) permeabilidade da célula à glicose.
b) síntese de glicogênio.
c) síntese de glicoquinase (fígado).
10.
Citar a função do glicogênio hepático e do glicogênio muscular.
11. Indicar os efeitos da adrenalina e insulina no músculo sobre o metabolismo do glicogênio muscular.
Idem para o glucagon e insulina no fígado.
M9
Metabolismo de aminoácidos
DEGRADAÇÃO DE PROTEÍNAS E AMINOÁCIDOS/ CICLO DA URÉIA
Conceitos fundamentais
As proteínas intracelulares são degradadas por proteínas lisossomais ou, após
serem ubiquitinizadas, pela ação de proteossomos.
A degradação de um aminoácido quase sempre se inicia com a remoção de seu
grupo amino em uma reação de transaminação que consiste na transferência de
um grupo amino para um alfa-cetoácido. Por desaminação oxidativa envolvendo
NAD+, o grupo amino transferido é convertido em íon amônio. Ocorre ainda a
transformação dos esqueletos de C em intermediários da glicólise e do ciclo de
Krebs.
Duas reações principais permitem a eliminação do amino grupo. Diversos
aminoácidos podem transferir o grupo amino para o alfa-cetoglutarato numa
reação catalisada por transaminases:
aspartato + alfa-cetoglutarato oxalacetato + glutamato
Por outro lado, glutamina e glutamato podem ser desaminados em reações
catalisadas pela glutaminase e desidrogenase glutâmica, respectivamente:
glutamina + H2O glutamato + NH4+
glutamato + NAD+ (ou NADP+) + H2O NH4+ + alfa-cetoglutarato +
NADH (ou NADPH) + H+
O cátion amônio é tóxico, sendo utilizado para a síntese de glutamina ou
convertido em uréia no ciclo correspondente, para fins de excreção.
O grupo prostético das transaminases é a vitamina B6 (piridoxina) na forma de
piridoxal fosfato ou PLP.
No ciclo da uréia, um átomo de nitrogênio desse íon amônio (um produto da
desaminação oxidativa de glutamato) e um átomo de nitrogênio do aspartato
combinam-se com HCO3- para formar uréia para a excreção. O passo limitante
da velocidade desse processo é catalisado pela carbamoil-fosfato-sintetase.
Os 20 aminoácidos-padrão são degradados para formar: 1) compostos
intermediários da glicólise, 2) corpos cetônicos, 3) ácidos graxos. Exemplos de
compostos formados pela degradação: piruvato, -cetoglutarato, succinil-CoA,
fumarato, oxaloacetato, acetil-CoA ou acetoacetato.
Aminoácidos como alanina, aspartato e glutamato são ditos glicogênicos porque
podem ser convertidos em, respectivamente, piruvato, oxalacetato e alfacetoglutarato, que, por sua vez, podem ser transformados em fosfoenolpiruvato
para síntese de glicose. Já os aminoácidos leucina e lisina são chamados
cetogênicos por produzirem exclusivamente acetil-CoA como produto de
degradação, portanto servindo à síntese de corpos cetônicos, mas não de glicose.
Ciclo da Uréia
Estudo dirigido
1. Escrever as três reações que levam à desaminação de um alfa-aminoácido com
formação do íon amônio. Incluir as enzimas envolvidas.
2. Comente sobre o papel essencial das vitaminas no metabolismo. Escreva a estrutura
química da vitamina B6 e do piridoxal fosfato.
3. Explique por que a degradação de proteínas pelo proteossomos requer ATP, apesar
da proteólise ser um processo exergônico.
4. Explique por que uma alta concentração de amônia diminui a taxa do ciclo de
Krebs.
5. Quais dos 20 aminoácidos-padrão são (a) puramente glicogênicos, (b) puramente
cetogênicos e (c) tanto glicogênicos como cetogênicos?
6. Desenhe o ciclo da uréia e escreva a reação geral do ciclo.
7. Faça um esquema geral mostrando os destinos dos esqueletos de carbono dos
aminoácidos glicogênicos e cetogênicos.
8. Analisar o destino da cadeia carbônica dos aminoácidos e o balanço de nitrogênio
que ocorrem com as seguintes dietas:
a) normal em carboidratos, lipídios e proteínas
b) rica em proteínas e normal nos demais componentes
c) pobre em carboidratos e normal nos demais componentes
d) pobre em proteínas e normal nos demais componentes
BIOSSÍNTESE DE AMINOÁCIDOS
Conceitos fundamentais
Os gases mais abundantes no ar atmosférico, O2 e N2, são essenciais para a
existência da vida biológica no planeta Terra, mas divergem quanto à reatividade
química. O O2 tem propriedades de radical livre reagindo com relativa
facilidade, daí servir muito bem como oxidante final na respiração de todos os
organismos. Já o N2 possui uma tripla ligação altamente estável que lhe confere
baixíssima reatividade química. Apesar disso, o N2 gasoso da atmosfera é a fonte
do elemento N que garante a vida na Terra. Por essas razões físico-químicas a
redução do N2 atmosférico pelos sistemas biológicos tem características muito
peculiares.
A redução química do N2 a NH3 exige condições drásticas, 500 graus Celsius de
temperatura e 300 atm de pressão, certamente incompatíveis com a vida
biológica. Mas bactérias especializadas do gênero Rhyzobium, que são
simbiontes de plantas leguminosas, reduzem eficientemente N2 a NH4+, uma
espécie química totalmente compatível com o metabolismo de todos os
organismos. Portanto, o N2 fixado por essa simbiose entre planta e bactéria
garante a disponibilidade do elemento N para todas as formas de vida terrestre.
As bactérias fixadoras de N2 possuem um complexo enzimático singular, a
nitrogenase. A reação de redução do N2 a NH4+ (fixação de nitrogênio), qual
envolve um redutor poderoso a grande investimento de energia na forma de
ATP, é catalisado pela nitrogenase, qual usa NADPH + H+ como doador de
elétrons:
N2 + 8 H+ + 8 e- + 16 ATP + 16 H2O 2 NH3 + H2 + 16 ADP +16 Pi
A volatilidade do NH4+ (NH3 + H+) não favorece sua permanência no solo, mas
existem bactérias autotróficas de vida livre, muito abundantes e largamente
disseminadas, que são especializadas na oxidação do cátion amônio a nitrito e
nitrato para fins de obtenção de energia metabólica. Desta maneira o elemento N
é estavelmente depositado no solo na forma de espécies químicas, sais de nitrito
e nitrato, que são eficientemente absorvidas pelas raízes das plantas e
prontamente reduzidas a NH4+ no interior da célula vegetal.
As etapas sumariamente mencionadas compreendem o ciclo do nitrogênio na
natureza: a) redução do N2 a NH4+; b) oxidação de NH4+ a nitrito e nitrato; c)
redução de nitrito e nitrato a NH4+ e d) transformação do elemento N de
inorgânico para orgânico com a síntese de aminoácidos a partir de NH4+, reação
possível em todas a formas de organismos biológicos.
Em animais, o N do grupo amino dos aminoácidos é eficientemente obtido a
partir de NH4+ pelas reações catalisadas pelas enzimas desidrogenase glutâmica
e glutamina sintetase, fornecendo, respectivamente, glutamato e glutamina.
Ainda em animais de forma geral, os aminoácidos alanina e aspartato podem ser
obtidos a partir de, respectivamente, piruvato e oxalacetato, através da reação de
transaminação tendo glutamato como doador de grupo amino. Outros
aminoácidos exigem reações adicionais, além da transaminação para sua síntese
final. Mas, como regra, os esqueletos de C dos aminoácidos são obtidos a partir
dos intermediários da glicólise, do ciclo de Krebs e do ciclo das pentoses.
Há, no entanto, aminoácidos que não podem ser sintetizados por animais devido
a falta do precursor que fornece o esqueleto de C. Estes são ditos aminoácidos
essenciais e tem que ser obtidos na dieta. Por exemplo, humanos tem que
conseguir da dieta 9 aminoácidos essenciais.
Estudo Dirigido
1. Defina fixação do nitrogênio.
2. Equacione a reação da nitrogenase e mostre aonde ocorre.
3. Definir aminoácido essencial e citar os aminoácidos essenciais para o organismo
humano.
4. Qual a importância dos aminoácidos para os organismos?
5. Verificar por que a glutamina e o glutamato são doadores de nitrogênio para a
síntese de aminoácidos
M10
INTEGRAÇÃO METABÓLICA E REGULAÇÃO HORMONAL DO
METABOLISMO
Conceitos Fundamentais
A regulação metabólica é feita de interferência direta de determinadas reações
químicas que compõem o metabolismo, aumentando ou reduzindo sua
velocidade. O resultado direto deste processo é a maior oferta de substratos ou
acúmulo de metabólitos que acabará por influenciar outras vidas dependentes
destes compostos e a forma mais eficiente de regulação desta rede é aumentar a
concentração ou alterar a eficiência da enzima.
Pode se controlar a síntese ou degradação enzimática; também se pode modular
a atividade enzimática através de mudanças conformacionais da própria enzima
provocada através da ligação de compostos ou grupos na cadeia peptídica:
regulação alostérica e regulação por modificação covalente. A concentração
enzimática também pode variar conforme a oferta do substrato; alteração
mediada através de hormônios.
Os hormônios estão envolvidos no metabolismo em dois níveis: indução ou
repressão gênica de determinadas enzimas ou através da modificação covalente:
A fosforilação é mediada pelas proteínas quinases que transferem o grupo
fosfato do ATP para resíduos específicos de serina, treonina e tirosina, formando
uma ligação éster fosfórico ou a retirada do grupo fosfato é catalisada pela ação
de fosfoproteínas fosfatases através da hidrólise.
Os hormônios transmitem sinais regulatórios para os tecidos-alvo por meio da
ligação a receptores que traduz o sinal em respostas no interior da célula. A
insulina e o glucagon pancreáticos e a adrenalina e noradrenalina da medula
adrenal são os principais hormônios envolvidos no metabolismo energético dos
mamíferos.
Dois hormônios são os principais responsáveis pelo equilíbrio da concentração
da glicose circulante: Glucagon e insulina.
O glucagon é um hormônio que tem efeitos equivalentes ao da adrenalina no
controle do metabolismo do glicogênio: possui um receptor da família dos
receptores acoplados a proteína-G e ativa a cascata que se inicia com
cAMP/PKA. Este é liberado em condições de hipoglicemia ativando processos
degradativos para manutenção da glicemia sanguínea. A PKA (proteína quinase
ativada por cAMP) fosforila a fosforilase quinase tornando-a ativa. A fosforilase
quinase fosforila agora glicogênio fosforilase. A glicogênio fosforilase ativada
(quando fosforilada, glicogênio fosforilase b a) catalisa a hidrólise de
resíduos de glicose do glicogênio liberando grupos de glicose-1-fosfato. No
mesmo tempo, a fosforilase quinase, ativada pela cascata do receptor de
glucagon-proteína-G, cAMP/PKA, fosforila a glicogênio síntase , a qual se torna
inativa quando fosforilada (síntase I sintase D).
A insulina tem efeito oposto, promove a absorção de glicose pelo fígado e
músculos e usa deposição nas reservas de glicogênio. Mas é importante notar
que a insulina tem mecanismos de ação totalmente diferentes da adrenalina e do
glucagon. Os receptores de insulina não pertencem à família dos receptores
acoplados a proteína-G e não têm ação sobre a adenilato ciclase. Seus receptores
são do grupo de receptores cujo domínio intracelular apresenta atividade
intrínseca de proteína-quinase de tirosina. A insulina estimula fosfoproteínas
fosfatases. Para reverter a ação do glucagon, a insulina promove a ativação da
fosfoproteína fosfatase que catalisa a desfosforilação da glicogênio fosforilase e
da glicogênio sintase, levando a inativação da primeira (fosforilase a b) e
ativação da segunda (síntase D sintase I). Desta forma o fluxo
glicoseglicogênio é favorecido. O transporte da glicose no interior das células
com a atuação da insulina é um processo passivo mediado por uma família de
permeases denominadas GLUT (glicose transporter).
Respostas celulares rápidas desencadeadas por hormônios só podem ser obtidas
através da ativação, ou da inibição, de enzimas pré-existentes. Hormônios
esteróides (por exemplo, cortisol) quando secretados difundem-se pela
membrana citoplasmática e ligam-se ao seus receptores intracelulares os quais,
quando ativados, promovem no núcleo a regulação do metabolismo pela
indução da transcrição de genes que codificam enzimas específicas, levando à
síntese de novo das proteínas correspondentes, fenômeno conhecido como
indução enzimática. Mas o mecanismo de indução enzimática desencadeado por
hormônios resulta necessariamente numa resposta celular lenta, uma vez que os
RNAs mensageiros
(mRNAs) precisam ser transcritos, processados,
transportados para o citoplasma e finalmente traduzidos para produzir as
proteínas enzimáticas exigidas.
A adrenalina estimula uma resposta local no músculo. A liberação de adrenalina
é induzida por estímulo nervoso autônomo em situações de perigo, exercício
físico, e hipoglicemia e induz a degradação do glicogênio com os fins de
fornecer glicose-1-fosfato como fonte de energia para atividades musculares
que permitem ao animal reagir a estas situações.
As vias de síntese e de degradação dos combustíveis metabólicos principais
(glicose, ácidos graxos e aminoácidos) convergem na acetil-COA e no piruvato.
Nos mamíferos, o fluxo através dessas vias é especifico para cada tecido.
O cérebro utiliza a glicose como seu principal combustível metabólico. Os
músculos podem oxidar uma variedade de combustíveis, mas dependem da
glicólise anaeróbica para o esforço máximo. O tecido adiposo armazena o
excesso de ácidos graxos na forma de triacilgliceróis e mobiliza-os quando
necessário.
O fígado mantém as concentrações dos combustíveis circulantes. A ação da
glicoquinase permite a captação do excesso de glicose pelo fígado,
direcionando-a para diversos destinos metabólicos. O fígado também converte
os ácidos graxos em corpos cetônicos e metaboliza os aminoácidos procedentes
da dieta ou da degradação das proteínas.
Durante o jejum, quando os combustíveis da dieta não estão disponíveis, o
fígado libera a glicose, primeiro pela degradação do glicogênio e depois pela
gliconeogênese, a partir de aminoácidos precursores. Os corpos cetônicos
obtidos pela degradação dos ácidos graxos suprem, por fim, a maior parte das
necessidades energéticas do corpo.
O diabetes melitus causa hiperglicemia e outros distúrbios fisiológicos
resultantes da destruição das células pancreáticas ou da resistência à insulina
(perda de receptores de insulina).
Estudo dirigido
1. Faça um resumo das principais características do metabolismo energético no
cérebro, nos músculos, no tecido adiposo e no fígado.
2. Explique por que o KM alto da glicoquinase é importante para o papel do fígado no
tamponamento da glicose sanguínea.
3. Faça uma previsão do efeito de uma dose excessiva de insulina sobre a função
cerebral em uma pessoa saudável.
4. Por que o metabolismo oxidativo, gerador de ATP, cessa quando o suprimento
celular de ATP está esgotado?
5. Descreva as alterações metabólicas que ocorrem durante o jejum.
6. Corredores experientes sabem que não é recomendável a ingestão de grandes
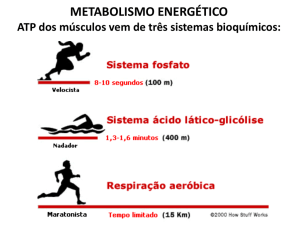
quantidades de glicose imediatamente antes de uma maratona.Qual é a base
metabólica para esse aparente paradoxo?
7. A capacidade do fígado em metabolizar acetil-CoA pelo ciclo do ácido cítrico é
drasticamente reduzida após vários dias de jejum. Justifique a sua resposta.
8. Fazer um resumo dos efeitos do glucagon, adrenalina, e insulina no metabolismo de
carboidratos, lipídios e proteínas no fígado, músculo e adiposo.
9. Relacionar as figuras 22.9 e 22.11 (Bayardo Torres) com a ginástica aeróbica.