Saresp 01
quarta-feira, 13 de agosto de 2014
09:47
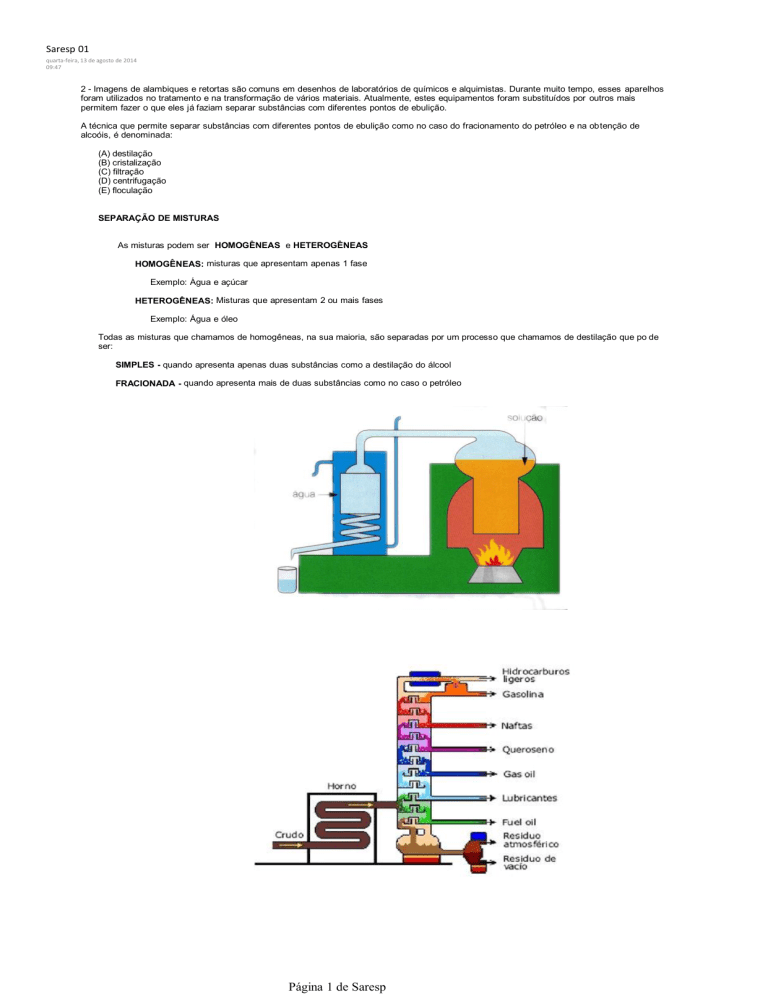
2 - Imagens de alambiques e retortas são comuns em desenhos de laboratórios de químicos e alquimistas. Durante muito tempo, esses aparelhos
foram utilizados no tratamento e na transformação de vários materiais. Atualmente, estes equipamentos foram substituídos por outros mais
permitem fazer o que eles já faziam separar substâncias com diferentes pontos de ebulição.
A técnica que permite separar substâncias com diferentes pontos de ebulição como no caso do fracionamento do petróleo e na obtenção de
alcoóis, é denominada:
(A) destilação
(B) cristalização
(C) filtração
(D) centrifugação
(E) floculação
SEPARAÇÃO DE MISTURAS
As misturas podem ser HOMOGÊNEAS e HETEROGÊNEAS
HOMOGÊNEAS: misturas que apresentam apenas 1 fase
Exemplo: Água e açúcar
HETEROGÊNEAS: Misturas que apresentam 2 ou mais fases
Exemplo: Água e óleo
Todas as misturas que chamamos de homogêneas, na sua maioria, são separadas por um processo que chamamos de destilação que po de
ser:
SIMPLES - quando apresenta apenas duas substâncias como a destilação do álcool
FRACIONADA - quando apresenta mais de duas substâncias como no caso o petróleo
Página 1 de Saresp
Alternativa Correta "A"
3º A Acerto
u 24
aluno
s
3º B Acerto
u 15
aluno
s
Erro
u10
alun
os
Erro
u13
alun
os
9 - Leia o texto a seguir:
" No Brasil, o álcool combustível é produzido a partir da cana-de-açúcar, que pode ser colhida mecanicamente, com o uso de máquinas
colheitadeiras, ou manualmente, queimando-se a palha que envolve a base do vegetal e cortando-se o caule. Este caule de cana é picado e
triturado nas moendas das usinas e libera o caldo que serve de matéria -prima para a produção de etanol. O bagaço que sobra da moagem é
queimado para produzir a eletricidade utilizada pela usina. Após ser filtrado, o caldo é fermentado com uma mistura composta de leite de
levedura, água e ácido sulfúrico. Da fermentação ele é centrifugado e bombeado para colunas de destilação, onde é aquecido at é 90ºC e
transformado em álcool bruto. Novos processos de destilação transformam -no em álcool hidratado ou anidro (puro), a cana-de-açúcar não é a
única matéria prima existente para a produção de álcool combustível. Em outros países, ele é extraído do milho da beterraba e até da madeira,
de onde é feito o metanol. A cana, no entanto, é vegetal mais eficiente para a produção do etanol. No Brasil, ela encontra co ndições ideais de
clima e solo".
Fonte: O ETANOL: "O biocombustível de maior produtividade no mundo" Veja On -line, São Paulo, [2007] Disponível em
<http://veja.abril.com.br/idade/exclusivo/energias_alternativas/contexto2.html > acesso em : 1 agosto de 2008.
Assinale a alternativa que contém duas transformações químcas citadas no texto.
(A) Picar e triturar o caule da cana e filtrar o caldo de cana.
(B) Queimar o bagaço e fermentar o caldo para a formação do álcool
(C) Destilar o álcool bruto e queimar o bagaço
(D) Filtrar o caldo de cana e fermentar o caldo para a formação do álcool.
(E)
Existe dois tipos de transformação, a transformação física e a transformação química
Transformação Física - aquela que apenas muda a aparência externa da substância.
Exemplo: Congelar água
Transformação Química - aquela que muda toda a estrutura da substância obtendo uma substância diferente da inicial, geralmente são
representadas por equação química.
Exemplo: Barra de ferro enferrujando
2 Fe(s) + O2(g) 2 FeO(s)
Alternativa Correta "B"
3º A Acerto
u 04
aluno
s
3º B Acerto
u 11
aluno
s
Erro
u30
alun
os
Erro
u17
alun
os
Página 2 de Saresp
Aula 2
terça-feira, 14 de outubro de 2014
16:32
5. Na construção de residências, são utilizados diversos tipos de materiais que são selecionados devido às suas
várias propriedades físicas.
A sequência que mostra materiais que possuem, respectivamente, durabilidade, bom isolamento térmico e boa
condutibilidade elétrica é:
(A) Cobre, concreto e madeira
(B) Aço, madeira e concreto
(C) madeira, concreto, aço
(D) Concreto, madeira, cobre
(E) Concreto, alumínio, madeira.
Propriedades Físicas dos Materiais: Todos os metais são bom condutores de eletricidade, materiais como madeira,
isopor são bons isoladores de calor, um dos motivos que no sul do pais as casas são de madeiras devido ao frio forte
durante o inverno. O cimento juntamente com areia e pedra forma o concreto que são materiais de grande durabilidade e
bastante resistente mas não são materiais apropriados para regiões onde se tem terremotos já que o concreto e um
material muito duro e com os abalos da terra quebra fácil (rachaduras).
Alternativa correta "D"
7. Segundo o modelo de Dalton, os compostos químicos são agregados de átomos e os produtos de uma
reação química são gerados pela troca, quebra ou união destes agregados. A reação química ocorre quando os
compostos reagentes se encontram dentro do meio reacional e geram os produtos.
O aumento da temperatura do meio reacional aumenta a velocidade da reação porque
(A) aumenta o número de choques entre os reagentes
(B) diminui o número de choques entre os reagentes
(C) diminui a energia cinética dos reagentes
(D) mantém constante a energia cinética dos reagentes
(E) provoca a vaporização de todos os reagentes.
Alternativa correta "A"
10. Nas últimas décadas, o aumento da utilização de aparelhos eletrônicos portáteis aumentou a demanda e a
variedade de pilhas e baterias no mercado. Alguns desses dispositivos utilizam materiais tóxicos,
principalmente metais pesados.
Considerando a composição das pilhas, é possível admitir que.
(A) Não são prejudiciais à saúde humana e ao meio ambiente, quando são descartadas em lixões
(B) não apresentam risco potencial ao meio ambiente e à saúde, quando em sua composição entram o chumbo e o óxido
Página 3 de Saresp
(B) não apresentam risco potencial ao meio ambiente e à saúde, quando em sua composição entram o chumbo e o óxido
de chumbo.
(C) apresentam menor risco ambiental e à saúde, quando funcionam à base de lítio, um metal não pesado.
(D) apresentam menor risco ambiental e à saúde quando em sua composição entram os metais pesados e são
descartadas a céu aberto, com maior oxigenação.
(E) apresentam menor risco à saúde e ao meio ambiente quando são fabricadas à base de chumbo e óxido de chumbo e
são descartadas em meio líquido.
São classificados como metais pesados: mercúrio, cádmio, chumbo e níquel esses metais podem contaminar plantas e
animais os quais o ser humano. Essa denominação Metais Pesados é usada porque geralmente os metais tóxicos são
de maior massa atômica, mas a toxidez dos metais não estão associados a sua massa atômica.
Alternatica correta "C"
11. Segundo a teoria das colisões, uma transformação química ocorre quando duas espécies colidem com
orientação adequada e energia suficiente para que se quebrem as ligações existentes e se formem novas
ligações. Com base nesta teoria, foram feitas as seguintes afirmações sobre a velocidade das transformações
químicas.
I. O aumento da temperatura aumenta a velocidade das transformações, pois aumenta a energia das
moléculas, tornando mais provável a ocorrência de choques com energia suficiente e orientação adequada.
II. O aumento da concentração em geral aumenta a velocidade, pois aumenta a probabilidade de que ocorra um
choque, visto que existem mais moléculas por unidade de volume.
III. O aumento da superfície de contato entre os reagentes diminui a velocidade, pois diminui a probabilidade de
que ocorram choques com a orientação adequada,
É (são) correta (s) apenas a (s) afirmação (ões):
(A) I
(B) II
(C) I e II
(D) II e III
(E) I, II e III
A teoria das colisões, proposta por Max Trautz1 e William Lewis em 1916 e 1918, qualitativamente explica
como reações químicas ocorrem e por que taxas de reação diferem para diferentes reações. Esta teoria é baseada
na ideia que partículas reagentes devem colidir para uma reação ocorrer, mas somente uma certa fração do total de
colisões tem a energia para conectar-se efetivamente e causar a transformaçao dos reagentes em produtos. Isto é
porque somente uma porção das moléculas tem energia suficiente e a orientação adequada (ou ângulo") no
momento do impacto para quebrar quaisquer ligações existentes e formar novas. A quantidade mínima de energia
necessária para isto ocorrer é conhecida como energia de ativação.
Partículas de diferentes elementos reagem com outras por apresentar energia de ativação com que acertam as
outras. Se os elementos reagem com outros, a colisão é chamada de sucesso, mas se a concentração de ao menos
um dos elementos é muito baixa, haverá menos partículas para outros elementos reagirem com aqueles e a reação
irá ocorrer muito mais lentamente. Com a temperatura aumentando, a energia cinética média e velocidade das
moléculas aumenta mas isto é pouco significativo no aumento do número de colisões. A taxa da reação aumenta com
a diminuição da temperatura porque uma maior fração das colisões ultrapassa a energia de ativação.
A teoria das colisões está intimamente relacionada com a cinética química.
Alternativa correta "C"
13. É possível obter oxigênio e hidrogênio a partir da decomposição da água. Essa transformação,
decomposição por eletrólise, ocorre utilizando energia elétrica.
Representando o átomo de Hidrogênio por
e o átomo de Oxigênio por
, identifique entre as equações
esquematizadas abaixo, qual representa a equação balanceada de decomposição da água, de acordo com a
teoria atômica de Dalton.
Equação Química
2 H2O 2 H2 + O2
Página 4 de Saresp
Teoria Atômica de Dalton
1. Toda matéria é formada de partículas fundamentais, os átomos.
2. Os átomos não podem ser criados e nem destruídos, eles são permanentes e indivisíveis.
3. Um composto químico é formado pela combinação de átomos de dois ou mais elementos em uma razão fixa.
4. Os átomos de um mesmo elemento são idênticos em todos os aspectos, já os átomos de diferentes elementos
possuem propriedades diferentes. Os átomos caracterizam os elementos.
5. Quando os átomos se combinam para formar um composto, quando se separam ou quando acontece um rearranjo
são indícios de uma transformação química.
Resumindo: Dalton acreditava que o átomo era uma esfera maciça, homogênea, indestrutível, indivisível e de carga
elétrica neutra. Se fizermos uma comparação, os átomos seriam semelhantes a bolinhas de gude: maciças e esféricas.
Alternatica correta "C"
14. Ácidos em solução aquosa sofrem ionização produzindo o cátion H +; portanto, podemos concluir que, para
ácidos de mesma concentração, quanto maior for a formação de íons H + mais forte é o ácido.
Considere os seguintes ácidos:
Ácidos:
ácido acético, Ka = 2.10 -5
ácido nitroso, Ka = 5,1.10 -4
ácido clorídrico, Ka = muito grande
ácido sulfídrico, Ka = 1,0. 10 -7
Através da constante de ionização, em condições iguais, pode-se identificar como sendo ácido mais fraco o
(A) ácido acético
(B) ácido sulfídrico
(C) ácido clorídrico
(D) ácido nitroso.
A constante de acidez Ka é proporcional a concentração dos ions formados. Portanto, quanto maior o valor de Ka mais
ionizado é o ácido, consequentemente maior a sua força.
Alternativa correta "B"
Página 5 de Saresp
Aula 3
terça-feira, 14 de outubro de 2014
16:32
2. Há pouco tempo, o gás canalizado da cidade do Rio de Janeiro foi trocado de gás manufaturado para gás natural. O gás
manufaturado é basicamente, uma mistura de hidrogênio e óxidos de carbono e é produzido a partir da nafta de petróleo
(hidrocarbonetos líquidos). O gás natural é uma mistura de hidrocarbonetos leves, basicamente metano. Outro tipo de gás,
comercializado em botijões de 13 Kg, é o gás liquefeito de petróleo (GLP), que é uma mistura de hidrocarbonetos
(principalmente propano e butano) provenientes do refino do petróleo. A tabela abaixo mostra o poder calorífico, por metro
cúbico, destes gases.
Fonte <http://www.gasbrsil.com.br/glosario/g.asp>
Gás Poder
Calorí
fico
(kJ/m3
)
Gás 23.400
Manu
fatura
do
Gás 51.100
Natur
al
GLP 77.500
Esses gases são utilizados como combustíveis em aquecimento domésticos. A partir dos dados da tabela, podemos afirmar
que, quando queimado,
(A) o gás natural fornece mais energia que o GLP.
(B) o gás manufaturado fornece mais energia que o GLP.
(C) o gás natural fornece mais energia que o gás manufaturado.
(D) o gás manufaturado fornece mais energia que o gás natural.
(E) o gás natural fornece menos energia que o gás manufaturado.
Primeiramente precisamos saber o que é poder calorífico:
O Poder Calorífico de combustíveis é definido como a quantidade de energia interna contida no combustível, sendo que quanto
mais alto for o poder calorífico, maior será a energia contida. Um combustível é constituído, sobretudo de hidrogênio e carbono,
quanto mais rico em hidrogênio for o combustível maior será o seu poder calorífico.
3
Alternativa Correta _____
6. Durante a Primeira Guerra Mundial, os alemães precisavam produzir amônia para fabricar fertilizantes e explosivos. Haber
Bosch desenvolveu um processo de síntese de amônia, utilizando gás nitrogênio do ar e gás hidrogênio da água, segundo a
reação:
N2(g) + 3 H2(g)
2 NH3(g)
H = 92,2kJ
Esta reação é reversível e deve atingir o equilíbrio a partir de um determinado instante de tempo, no qual sua constante de
equilíbrio assume o valor de 6,09. Para estudar o sistema, foram realizados os seguintes experimentos nos quais as
concentrações dos gases variaram com o tempo.
Expe Tem [N2] [H2] [NH3]
rime po mol. mol. mol.
nto
L-1
L-1
L-1
I
t0 1,000 1,000 0
II
t1 0,874 0,634 0,252
III
t2 0,814 0,442 0,372
IV
t3 0,786 0,358 0,428
V
t4 0,781 0,343 0,438
VI
t5 0,781 0,343 0,438
VII
t6 0,781 0,343 0,438
De acordo com os dados da tabela, o sistema alcança o equilíbrio a partir do tempo:
(A) t1
(B) t2
(C) t3
(D) t4
(E) t5
Um equilíbrio químico é a situação em que a proporção entre os reagentes e produtos de uma reação química se mantém constante ao longo do
tempo. Foi estudado pela primeira vez pelo químico francês Claude Louis Berthollet em seu livro Essai de statique chimique de 1803.
Teoricamente, toda a reação química ocorre nos dois sentidos: de reagentes se transformando em produtos e de produtos se transformando de
volta em reagentes. Contudo, em certas reações, como a de combustão, virtualmente 100% dos reagentes são convertidos em produtos, e não se
observa o contrário ocorrer (ou pelo menos não em escala mensurável); tais reações são chamadas de irreversíveis. Há também uma série de
reações nas quais logo que certa quantidade de produto(s) é formada, este(s) torna(m) a dar origem ao(s) reagente(s); essas reações possuem o
nome de reversíveis. O conceito de equilíbrio químico praticamente restringe-se às reações reversíveis.
Constante de equilíbrio em termos de concentração (Kc)
A constante Kc é denominada constante de equilíbrio em termos de concentração, e é uma grandeza com valor específico para uma
dada reação e temperatura, independente das concentrações iniciais, volume do recipiente ou pressão.
⟺
Para o equilíbrio hipotético:
aA + bB
cC + dD
Onde A, B, C e D representam reagentes e produtos e a, b, c e d os respectivos coeficientes estequiométricos. A expressão da
constante de equilíbrio é:
Página 6 de Saresp
constante de equilíbrio é:
Kc = [C]c . [D]d
[A]a . [B]b
A concentração molar está simbolizada pela fórmula da substância entre colchetes. Exemplo:
Para a reação de formação da amônia temos:
N2(g) + 3 H2(g)
Kc =
2 NH3(g)
[NH3]2 s
[N2] . [H2]3
O fato de os produtos estarem no numerador e os reagentes no denominador, significa que quanto maior o valor do numerador, maior
o valor do Kc e maior tendência de formação dos produtos. Logo, quanto maior for o valor da constante Kc , maior será o rendimento
da reação, ou seja, haverá o favorecimento na formação de produtos e a concentração destes presentes no sistema será maior que a
concentração dos reagentes. E quanto menor o valor do Kc, menor o rendimento da reação, isto é, maior a concentração de
reagentes em relação aos produtos.
Alternativa Correta ________
12. O trecho a seguir foi extraído do livro de Primo Levi, "A Tabela Periódica", tradução Luiz Sergio Henrique - Rio de
Janeiro, Relume Dumará, 1994, p. 63.
" O potássio, como disse, é gêmeo do sódio, mas reage com o ar e a água, até com maior energia: é sabido de todos (eu
também sabia) que em contato com a água não só liberta hidrogênio, mas também se inflama,"
Analise as equações químicas a seguir:
I. P4(s) + H2O P4O(aq) + H2(g) + energia
II. H2(g) + O2(g) H2O2
III. 2 K(s) + 2 H2O 2 KOH(aq) + H2(g) + energia
Pode-se concluir que o texto está corretamente representado, apenas em:
(A) I
(B) II
(C) I e III
(D) I e II
Alternativa Correta _____
15. A equação a seguir representa uma das etapas da formação do ferro gusa
FeO(s) + CO(g) + 19kJ/mol CO2(g) + Fe(s)
Trata-se de um sistema em equilibrio, numa temperatura de 25 ºC e 1 atmosfera de pressão. Reconhecendo a importância da
produção de ferro, qual das seguintes ações favorece a sua produção?
(A) Aumentar a pressão
(B) Aumentar a temperatura
(C) Diminuir a concentração de CO
(D) Aumentar a concentração de CO2
Por não ter os conhecimentos tecnológicos necessários, ele não sabia como obter temperaturas de processamento mais altas, como
controlar a quantidade de carbono no ferro e como fazer o ferro sair líquido do forno. Desse modo, ele só conseguia produzir
pequenas quantidades a cada dia.
Com o tempo e o avanço tecnológico o homem conseguiu aumentar a produtividade, melhorar a qualidade e ampliar a oferta de
produtos fabricados, a partir dos metais ferrosos. E o desenvolvimento do processo de fabricação do ferro-gusa foi essencial para
isso se tornasse realidade. Foi um longo caminho através da História. Vale a pena conhecê-lo.
Do buraco no chão ao alto-forno
Para poder fabricar o ferro fundido e o aço, você precisa do ferro gusa. É um material duro e quebradiço, formado por uma liga de
ferro e carbono, com alto teor, ou seja, uma grande quantidade de carbono e um pouco de silício, manganês, fósforo e enxofre. O
grande problema tecnológico que envolve a fabricação do gusa, é a obtenção das altas temperaturas que favoreçam a absorção do
carbono.
Um povo chamado Hitita foi o primeiro a explorar a “indústria” do ferro, mais ou menos 1.700 anos antes de Cristo, ao sul do
Cáucaso. Para obter o ferro, eles faziam um buraco no chão e, dentro dele, aqueciam uma mistura do minério e carvão vegetal.
Desse modo, formava-se uma massa pastosa que eles batiam, para eliminar as impurezas e, depois, trabalhavam por forjamento.
Com esse processo, fabricavam punhais, espadas e armaduras que “exportavam” para os países vizinhos.
A próxima etapa foi o desenvolvimento de um forno semienterrado onde se colocavam camadas de minério de ferro e carvão e no
qual era soprado ar, por um fole manual, que aumentava a combustão, do mesmo jeito que as labaredas na churrasqueira
aumentam, quando a gente abana as brasas de carvão. Nessas condições, a temperatura podia atingir entre 1.000ºC e 1.200ºC e se
obtinha uma massa pastosa de ferro, da qual o oxigênio do minério havia sido eliminado por redução.
Alternativa Correta ____
1. O petróleo é uma mistura complexa que contém, principalmente substâncias formadas pelos elementos carbono e
hidrogênio. Estas substâncias são classificadas como:
(A) lipídeos
(B) carboidratos
(C) hidrocarbonetos
(D) centrifugação
(E) floculação
O petróleo e praticamente formado por hidrocarbonetos, os hodrocarbonetos são compostos que tem em sua fórmula
molecular apenas carbono e hidrogênio.
Alternativa Correta____
4. O etilenoglicol é uma substância utilizada como anticongelante nos radiadores dos automóveis. Esta substância, apesar
de apresentar sabor doce, não deve ser ingerido porque é venenoso. A toxicidade do etilenoglicol se deve ao ácido oxálico,
substância produzida seguindo a seguinte reação simplificada:
Segundo o que se observa na equação, o processo envolvido na transformação do etilenoglicol em ácido oxálico é
denominado de
Página 7 de Saresp
(A) oxidação
(B) redução
(C) isomerização
(D) tautomerização
(E) polimerização
Definição antiga ou clássica
Antigamente, o termo oxidação significava combinar-se com o oxigênio
Quando adquiriu-se o conhecimento da estrutura dos átomos verificou-se que, quando um elemento ou uma substância combinavase com o oxigênio, esta espécie química perdia elétrons.
Definição atual
Modernamente o termo oxidação significa perder elétrons, ou ainda aumento da reatividade, não necessariamente em presença de
oxigênio (quando um elemento perde elétrons o seu estado de oxidação aumenta. Exemplo: Al0 → Al+3 + 3 e-).
Alternativa Correta____
8. Para que o café expresso tenha um sabor agradável, seu tempo de extração não pode ser superior a 30 segundos.
Quando este limite não é respeitado, certos compostos podem conferir aromas indesejáveis ao café, conforme se pode
observar na tabela:
Composição
2,4decadienal
Etilogujacol
2,4nonadienal
DMTS
Aroma
Rançoso
Fumaça
Rançoso
Enxofre
Segundo as informações da tabela os compostos que podem conferir aroma rançoso ao café pertencem à seguinte função
orgânica:
(A) álcool.
(B) aldeído.
(C) cetona.
(D) éster.
(E) éter.
Neste caso o compostos que dão aroma rançoso é o 2,4-decadienal e o 2,4-nonadienal, lembrando que para dar nome aos
compostos orgânicos segue regra IUPAC que é Prefixo + Infixo + Sufixo, sendo que Prefixo é a quantidade de Carbono, o
Infixo é o tipo de ligação e o sufixo é a função, a terminação do nome do composto neste caso os compostos termina em
"al" e a função em que o composto tem essa terminação é o aldeído.
Alternativa Correta _____
Página 8 de Saresp












