Módulo IV – Propriedades de Substâncias Puras: Relações P-V-T e
Diagramas P-V, P-T e T-V, Título, Propriedades Termodinâmicas, Tabelas
Termodinâmicas, Energia Interna, Entalpia, Calores Espercíficos c v e cp,
Propriedades das Substâncias Puras
Substância pura é aquela que apresenta a mesma composição química
em toda sua extensão, como por exemplo, água, nitrogênio, dióxido de
carbono, etc. As substâncias puras existem em diferentes fases, sólida, líquida
e gasosa. Mesmo dentro de uma fase a substância pode ter diversas
configurações moleculares que as diferencia, exemplo carbono diamante e
grafite. Além disso, várias fases podem coexistir como, por exemplo, gelo
(sólida) e água (líquida) num mesmo recipiente. Também não podemos deixar
de evidenciar a importância da pressão e da temperatura na mudança das
fases, afinal água a 120°C encontra-se no estado de vapor a pressão
ambiente, mas no estado líquido se pressurizada em uma panela de pressão.
Liquido comprimido é o nome que se dá a qualquer líquido que se
encontra a uma determinada pressão e temperatura e que nessas condições
encontra-se em estado líquido.
Liquido saturado é aquele que está numa determinada temperatura e
pressão eminente de iniciar a transformação para o estado vapor.
Após iniciada a ebulição a temperatura não aumenta até que todo líquido
seja transformado em vapor, isto é, durante o processo de mudança de fase a
temperatura permanece constante. Durante o processo de transformação de
fase temos a mistura denominada líquido-vapor saturada.
Quando a última gota de água líquida se vaporiza temos o ponto de
vapor saturado. A partir desse ponto de continuarmos a aquecer o vapor volta a
tem um acréscimo de temperatura e é chamado de vapor superaquecido.
A figura abaixo demostra o processo de vaporização dá água que
inicialmente está em estado de líquido comprimido (a). Quando aquecida chega
ao ponto de líquido saturado onde começa o aparecimento do vapor. A figura
(b) apresenta a mistura líquido-vapor saturado e após toda a transformação de
fase temos o vapor superaquecido (c).
A quantidade de energia absorvida ou liberada durante um processo de
mudança de fase é chamado de calor latente. Este será de fusão se a energia
for liberada durante a solidificação e de vaporização se a energia for absorvida.
Um conceito muito importante na termodinâmica é a temperatura e
pressão de saturação. Sabemos por conhecimento do colégio que a água ferve
a 100°C, mas isso não é uma verdade. A temperatura para a água ferver
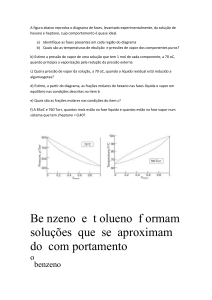
depende da pressão em que se encontra. A curva a seguir mostra isso.
Podemos verificar que para diferentes pressões teremos diferentes pontos em
que o líquido entra em ebulição.
Esse ponto em que o líquido entra em processo de vaporização é
chamado de ponto de saturação e temos a pressão e temperatura de
saturação. Podemos também obter um gráficos que mostre a relação entre
pressão-volume-temperatura que são mostrados a seguir.
O primeiro gráfico mostrado é para a água e à medida que a pressão
aumenta precisamos de mais temperatura para poder iniciar a vaporização.
Quando a pressão atinge aproximadamente 22 MPa não há mais uma linha de
transformação líquido-vapor, mas sim um ponto. Esse ponto é chamado de
ponto crítico e é onde os pontos de líquido saturado e vapor saturado se
encontram.
No segundo gráfico é mostrada a linha de líquido saturado a esquerda,
que separa a região de líquido comprimido da região de transformação líquidovapor. Essa linha de líquido saturado se estende até o ponto crítico, sendo que
depois desse ponto a linha da direita é chamada de vapor saturado. A linha de
vapor saturado separa a região de mistura líquido-vapor da região de vapor
superaquecido.
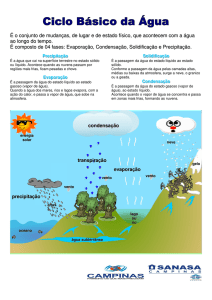
O diagrama completo com as fases sólido, líquido e vapor são
mostrados no diagrama a seguir.
Além desses diagramas bidimensionais, podemos apresentar as
informações de pressão, temperatura e volume em três eixos que constituem
diagramas tridimensionais. Apesar da grande quantidade de informação que se
pode obter de um diagrama tridimensional, para a termodinâmica é
conveniente trabalhar com diagramas bidimensionais.
Tabela de Propriedades
Devido à dificuldade de se expressar as relações termodinâmicas por
meio de equações simples, as propriedades quase sempre são apresentadas
em forma de tabelas. Geralmente qualquer bom livro de termodinâmica traz em
seu apêndice essas tabelas com informações de pressão, temperatura, volume
específica, entalpia específica, energia interna específica e volume específico.
Entalpia
Em estudos na análise de turbinas a vapor e na representação de
propriedades do vapor um termo aparecia com grande importância, a soma da
energia interna com o produto pressão-volume. Para esse termo foi dado o
nome de entalpia.
H = U + pϑ [kJ]
H = u + pv [kJ/kg]
Título
Nas tabelas as propriedades de líquidos comprimidos e vapor
superaquecido são diretamente medidos e listados, mas o que acontece
quando estamos lidando com a região de mudança de fase?
É possível realizar a medida diretamente da propriedade da fase quando
ela se encontra em líquido saturado e vapor saturado, mas região de mistura
(bifásica) precisa levar em consideração a quantidade de líquido e vapor
presentes. Com isso surge o conceito de uma nova propriedade, o título (x),
que é a quantidade de vapor presente na mistura bifásica.
Se pegarmos uma propriedade, como por exemplo, o volume, temos:
(
)
Dividindo toda a equação por
(
)
(
)
Essa análise acima pode ser repetida para a energia interna, a entalpia e
a entropia, resultando nas seguintes expressões:
(
)
(
)
(
)
Não será definido o termo entropia neste momento porque ele está
associado à Segunda Lei da Termodinâmica, que será introduzida em módulos
mais avançados.
Calores Específicos
São propriedades importantes para a termodinâmica, assim com a
entalpia. Para o calor específico a volume constante têm-se:
( )
( )
( )
( )
∫
( )
De modo semelhante é possível desenvolver a expressão para o calor
específico a pressão:
( )
( )
( )
( )
∫
( )
E a relação entre os calores específicos é:
( )
( )
Exemplos
1) Um tanque contém 10 kg de água a 90°C. Se 8 kg de água estiverem na
forma líquida e o restante na forma vapor, determine:
a) A pressão do tanque.
b) O volume do tanque
Resolução:
Para resolver esse problema será necessário o uso de tabelas termodinâmicas
presentes nos livros.
a) Da tabela termodinâmica para T = 90°C, temos:
P = 70,14 kPa
b) Da tabela
(
)
(
)
(
)
2) Um reservatório rígido e fechado de 0,5 m 3 de volume é colocado sobre
uma placa aquecida. Inicialmente o reservatório contém uma mistura
bifásica de água líquida saturada e de vapor d’água saturado a
com título de 0,5. Após o aquecimento a pressão do reservatório é de
. Determine:
a) A temperatura em °C, nos estados 1 e2.
b) A massa de vapor presente nos estados 1 e 2, em kg.
c) Considerando que o aquecimento continua, determine a pressão na qual
o reservatório contém somente vapor saturado.
Resolução:
Para resolver esse problema será necessário o uso de tabelas termodinâmicas
presentes nos livros.
a)
Da tabela para
,
e
Da tabela para
,
e
b)
(
(
)
)
(
)
(
(
(
)
)
)
(
c)
interpolando para
Exercícios Propostos
, temos
)
1) Um tanque rígido de 300 m3 é preenchido com uma mistura saturada de
água líquida e vapor d’água a 200 kPa. Se 25% da massa for líquida e 75%
da massa for vapor, a massa total do tanque é:
a) 451 kg
b) 556 kg
c) 300 kg
d) 331 kg
e) 195 kg
2) Considere uma lata fechada preenchida com refrigerante-134a. O conteúdo
da lata está à temperatura ambiente de 25°C. Um vazamento surge e a
pressão da lata cai à pressão atmosférica local de 90 kPa. A temperatura do
refrigerante na lata deve cair para aproximadamente:
a) 0°C
b) -29°C
c) -16°C
d) 5°C
e) 25°C
3) Um arranjo cilindro-pistão contém 0,8 kg de vapor d’água a 300°C e 1 MPa.
O vapor é resfriado a pressão constante até que a metade da massa
condense.
a) Mostre o processo em um diagrama T-v.
b) Encontre a temperatura final.
c) Determine a variação do volume.
Resposta: 179,88°C, - 0,1282 m3
4) Determine o título de uma mistura bifásica líquido-vapor de:
a) Água a 20°C com um volume específico de 20 m 3/kg.
b) Propano a 15 bar com um volume específico de 0,02997 m 3/kg.
c) Refrigerante 134a a 60°C com um volume específico de 0,001 m 3/kg.
d) Amônia a 1 MPa com um volume específico de 0,1 m 3/kg.
Resposta: 34,6%; 100%; 0,49%; 77,5%
5) Um sistema que consiste de 2 kg de amônia é submetido a um ciclo
composto dos seguintes processos:
Processo 1-2: volume constante de p1 = 10 bar, x1 = 0,6 até vapor saturado.
Processo 2-3: temperatura constante de p3 = p1. Q23 = 228 kJ.
Processo 3-1: pressão constate.
Desprezando os efeitos das energias cinética e potencial, determine o trabalho
líquido relativo ao ciclo e a quantidade de calor trocada para cada processo,
todos em kJ.
Resposta; 35,6 kJ; 844 kJ; 260,6 kJ; - 1036,4 kJ
6) Um galão de leite a 68°F é colocado em um refrigerador. Se a energia for
removida do leite por transferência de calor a uma taxa constante de 0,08
Btu/s quanto tempo levaria, em minutos, para o leite ser resfriado até 40°F?
O calor específico e a massa específica do leite são 0,94 Btu/lbR e 64 lb/ft3,
respectivamente.
Resposta: 47 min