Termodinâmica
Termodinâmica
• (Def.): é a ciência que estuda as
transformações de energia.
• As reacções químicas absorvem ou
libertam energia, geralmente na forma de
calor.
Entalpia, H
• Calor absorvido ou libertado durante uma transformação
a pressão constante.
– O que se mede normalmente é a variação de entalpia
DH = H (produtos) - H(reagentes)
• Processo endotérmico absorve calor: + DH
• Processo exotérmico liberta calor: - DH
• Unidades de energia: SI é o joule (J); 1cal = 4,18 J
Determinação da energia reticular
• Ex: NaCl
• Energia Reticular: é a quantidade de energia libertada
quando um cristal é formado a partir das suas partículas
componentes na fase gasosa; geralmente é expressa
por mole de substância; é a força com que estão unidas
as partículas de um sólido.
• Cálculo de Born – Haber
Líquidos
•
O líquido pode ser formado
1. Fundindo um sólido: a energia é absorvida de
modo a superar as forças de atracção entre as
partículas no retículo cristalino;
2. Condensando um gás: a energia é retirada
quando as forças de atracção são estabelecidas.
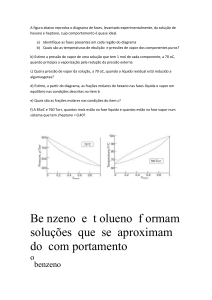
Evaporação e pressão de vapor
Curva (a) Indica que a maioria das moléculas possui energia cinética
baixa, a temperatura baixa
Curva (b) Indica que a maioria das moléculas possui energia cinética alta,
a temperatura alta
Pressão de vapor
•
É a pressão exercida por um gás em equilíbrio com o seu líquido
•
Depende da tendência que as moléculas têm de escapar da fase
líquida; quando as forças intermoleculares são fracas, as moléculas
tendem a escapar com facilidade e a pressão de vapor em equilíbrio
torna-se alta.
• As curvas têm a mesma
forma
• A pressão de vapor
aumenta com a temperatura
• Ponto de ebulição de um
líquido: é a temperatura na
qual a pressão de vapor do
líquido é igual à pressão
atmosférica
Equação de Clausius – Clapeyron
(Exercícios)
• Serve para determinar o Calor de Vaporização (DHvap)
de um líquido a partir de dados de pressão de vapor;
usando gráficos pressão de vapor vs temperatura;
• Determinar o Calor de Vaporização (DHvap) quando a
pressão de vapor for conhecida a duas temperaturas;
• Determinar a pressão de vapor a uma dada temperatura
se o DHvap e a pressão de vapor for conhecida a uma
outra temperatura.
Entalpia de formação padrão (DHfº)
•
(Def.): é a variação de entalpia quando se forma uma mole de um composto
a partir dos seus elementos à pressão de 1atm. Embora o estado padrão
Usaremos sempre valores de DHfº
não especifique uma temperatura.
medidos a 25ºC.
•
aA + bB → cC + dD
•
DHreacçãoº = [cDHfº(C) + dDHfº(D)] - [aDHfº(A) + bDHfº(B)]
•
DHreacçãoº = ΣnDHfº(produtos) - ΣmDHfº(reagentes)
•
n, m são coeficientes estequiométricos
•
Ex: Na (s) +
Cl2(g)----> NaCl (s)
DHºf = - 412,1 kJmol-1
1º Primeira Lei da Termodinâmica
• Baseia-se no Principio da conservação de energia. Esta Lei diz que
a energia pode ser convertida de uma forma noutra, mas não pode
ser criada ou destruída.
• Diferenças de energia DE podem ser atribuídas ou a
– Calor adicionado:
q = D E = E2 - E1
ou a
– Trabalho executado
- W= D E = E2 - E1
por ex.: trabalho de expansão contra uma pressão externa
W = Pext D V
Lei de Hess
•
Estabelece que a variação da entalpia para qualquer reacção
depende somente da natureza dos reagentes e dos produtos e
não depende do número de etapas ou do caminho que conduz
dos reagentes aos produtos (recorremos a essa lei quando
determinamos a energia reticular)