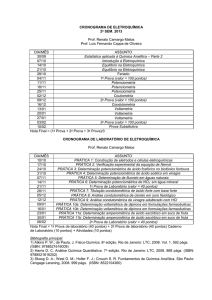
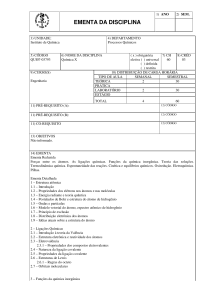
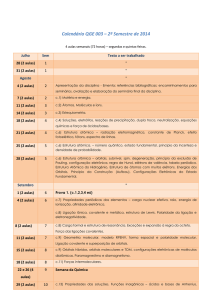
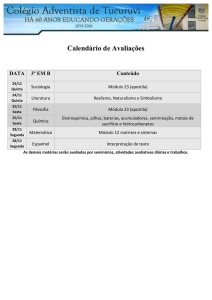
CQ049 : FQ IV - Eletroquímica
CQ049 – FQ
Eletroquímica
prof. Dr. Marcio Vidotti
LEAP – Laboratório de Eletroquímica e Polímeros
www.quimica.ufpr.br/mvidotti
[email protected]
CQ049 : FQ IV - Eletroquímica
O que será oferecido no curso:
Apresentar os princípios básicos em Eletroquímica como soluções eletrolíticas, condutividade
e cinética; aplicações tecnológicas envolvendo reações redox e as principais visões modernas
e perspectivas futuras no emprego desta área da Química.
Forma de avaliação:
Serão aplicadas duas provas teóricas e eventualmente exercícios de fixação ao final das aulas.
Referências Bibliográficas:
(1) Atkins, P. W. Physical chemistry, Oxford, 5ª ed. (2) Bard, A.; Faulkner, L.R. Electrochemical Methods
John Wiley & sons.2nd ed. (3) Atkins, P.W.; Jones, L. General Chemistry, Freeman Co. 3rd ed. (4) Castellan,
G. W. Fundamentos de Físico-Química, LTC, vol. 1 (5) Moore, W. J. Físico-Química, Edgard Blücher, tradução
da 4ª ed. americana, vol. 1 e 2 (6) Maron, S. H. & Prutton, C. F. Principles of physical chemistry, Collier
McMillan, 4ª edição (7) Antropov, L. I. Theoretical eletrochemistry, Editora MIR, Moscow, 1972. (8)
Damaskin, B. B. & Petri, O. A. Fundamentos de la electroquímica teórica, Ed. MIR, Moscow, 1980. (9)
Levine, I. N. Physical chemistry, McGraw-Hill, 3ª ou 4ª edição.
CQ049 : FQ IV - Eletroquímica
F.E.M.
cinética de transferência de carga
fenômenos de
interface
balanço de cargas
soluções eletrolíticas
CQ049 : FQ IV - Eletroquímica
PRINCÍPIOS BÁSICOS DE FQ
GASES
TERMODINÂMICA
ELETROQUÍMICA
propriedades da matéria
CQ049 : FQ IV - Eletroquímica
propriedades da matéria
CQ049 : FQ IV - Eletroquímica
interações moleculares
criação de modelos
CQ049 : FQ IV - Eletroquímica
Modelos são criados para explicar os fenômenos da natureza, a partir de hipóteses
simplificadas que podem ser continuamente melhoradas até a reprodução do
fenômeno investigado, criando uma lei.
observação da
natureza
criação de
modelos
experimentos
criação de modelos
CQ049 : FQ IV - Eletroquímica
Iniciaremos os estudos em FQ com os gases;
Criação de modelos (gás perfeito): interações intermoleculares
Em um gás perfeito (ou ideal) não há
nenhum tipo de interação entre as
moléculas / átomos; nem forças
atrativas / repulsivas (EP = 0)
A única contribuição energética de um
gás perfeito é sua VELOCIDADE (Energia
Cinética) que está diretamente
relacionada com a TEMPERATURA
criação de modelos
CQ049 : FQ IV - Eletroquímica
Criação de modelos (gás perfeito): volume
Um gás perfeito possui massa, mas seu volume pode ser considerado
desprezível, podendo ser considerado um ponto puntiforme
Partimos de duas situações extremamente simples na criação do modelo:
1 – Ausência de interações intermoleculares;
2 – O gás possui massa, mas desprezaremos seu volume;
o experimento de Boyle
CQ049 : FQ IV - Eletroquímica
P=F/A
Pressão de um gás: choque das
moléculas na superfície do recipiente
Pgás = Patm + Pcol = Patm + mgh
o experimento de Boyle
CQ049 : FQ IV - Eletroquímica
A uma temperatura constante, o volume ocupado por uma massa definida de um gás
é inversamente proporcional à pressão
o experimento de Boyle
CQ049 : FQ IV - Eletroquímica
o experimento de Boyle
CQ049 : FQ IV - Eletroquímica
Cálculos empregando a lei de Boyle
Uma amostra de gás ocupa 12 L sobre uma pressão de 1,2 atm. Qual seria seu
volume se a pressão for elevada a 2,4 atm?
a lei de Charles
CQ049 : FQ IV - Eletroquímica
nitrogênio líquido
Explique em termos moleculares o que você entende pelo experimento acima
a lei de Charles
CQ049 : FQ IV - Eletroquímica
Em seus estudos envolvendo gases, Robert Boyle
percebeu que aquecendo-se uma amostra de um
gás, seu volume aumentava, mas ele não seguiu
adiante com essa observação. Em meados de
1800 dois cientistas franceses, Jacques Charles e
Joseph Gay-Lussac iniciaram os estudos
envolvendo a expansão de gases com o aumento
da temperatura.
a lei de Charles
CQ049 : FQ IV - Eletroquímica
a lei de Charles
CQ049 : FQ IV - Eletroquímica
diferentes pressões
Perguntas:
(i) Admitindo este experimento, como foi possível variar as pressões?
(ii) Qual a explicação para o comportamento em “D”?
o experimento de Boyle
CQ049 : FQ IV - Eletroquímica
leis combinadas
CQ049 : FQ IV - Eletroquímica
postulado de Avogadro
CQ049 : FQ IV - Eletroquímica
Em 1811, Amadeo Avogadro postulou que:
o experimento de Boyle
CQ049 : FQ IV - Eletroquímica
equação dos gases ideais
CQ049 : FQ IV - Eletroquímica
exemplo
CQ049 : FQ IV - Eletroquímica
a lei de Dalton
CQ049 : FQ IV - Eletroquímica
a lei de Dalton
CQ049 : FQ IV - Eletroquímica
CQ049 : FQ IV - Eletroquímica
energia potencial
gases reais
gás ideal
gás ideal
0
distância
entre as
moléculas
gás real
gás real
gases reais
CQ049 : FQ IV - Eletroquímica
Na criação do modelo dos gases ideais, adotamos como hipóteses iniciais:
Não há nenhum tipo de interação entre as moléculas do gás;
O gás possui uma massa m, mas não um volume;
Partindo de pV = nRT
Podemos “ajustar” o modelo para que as medidas reais se aproximem aos valores
calculados:
Equação de van der Waals
gases reais
CQ049 : FQ IV - Eletroquímica
Coeficientes do virial
Nas isotermas mostradas abaixo, podemos claramente perceber os efeitos das interações
moleculares no comportamento do gás real, nos volumes molares grandes e nas altas
temperaturas, as isotermas reais diferem pouco das isotermas dos gases perfeitos. Essas
pequenas diferenças podem ser ajustadas segundo:
pVM = RT (1 + B’p + C’p2 + ...)
Ou convenientemente, a expansão pode ser feita:
pVM = RT (1 + B/VM + C/VM2 + ....)
Essas duas expressões são versões da
equação do estado do virial. Os coeficientes
B, C, etc. são os coeficientes do virial
CQ049 : FQ IV - Eletroquímica
Conceitos básicos
CQ049 : FQ IV - Eletroquímica
O universo se divide em duas partes:
Sistema: é a parte do universo que estamos
observando e estudando, pode ser o vaso de uma
reação, uma pilha eletroquímica ou uma célula
biológica, etc.
Vizinhanças: parte do universo vizinha do sistema e
de onde fazemos as observações e medidas.
Fronteira: separação entre o sistema e suas
vizinhanças
Conceitos básicos
CQ049 : FQ IV - Eletroquímica
A fronteira diatérmica é
permeável à passagem de
energia na forma de calor;
O sistema pode ser:
Aberto: troca matéria e
energia com as vizinhanças;
Fechado: troca apenas energia
com as vizinhanças;
Isolado: não permite a troca
nem de matéria nem energia
A fronteira adiabática não
é permeável à passagem
de energia na forma de
calor, mesmo que haja
uma
diferença
de
temperatura
entre
o
sistema e as vizinhanças;
Conceitos básicos
CQ049 : FQ IV - Eletroquímica
A unidade física fundamental da termodinâmica é o trabalho (W), há trabalho
quando um corpo é deslocado contra uma força que se opõe ao deslocamento.
CO2(s) → CO2(g)
Energia - trabalho
CQ049 : FQ IV - Eletroquímica
A energia de um sistema é sua capacidade de efetuar trabalho. Quando se faz
trabalho sobre um sistema, a capacidade do mesmo de efetuar trabalho aumenta,
então, a energia do sistema aumenta. O contrário também é valido. A energia não
pode ser aleatoriamente criada, apenas convertida ou transformada.
W
E1
E2
E2 = E1 + W
Na produção de energia nuclear há uma
reação de fissão auto-sustentada, que
ocorre em um reator, normalmente
imerso num tanque com uma substância
moderadora e refrigerante - água. A água
é aquecida e vaporizada pelo reator,
passando em seguida por turbinas que
acionam geradores, para assim produzir
energia elétrica.
CQ049 : FQ IV - Eletroquímica
Energia - calor
A energia de um sistema é também pode ser alterada pela variação de temperatura, ou
transporte de calor (q). Um processo que cede energia na forma de calor são chamados
de exotérmicos, e aqueles que consomem energia, na forma de calor, são chamados de
endotérmicos.
aquecimento
E1
q
E2 = E1 + q
E2
CQ049 : FQ IV - Eletroquímica
1ª lei da termodinâmica
W
aquecimento
E1
q
E2
E1
E2
E2 = E1 + q
E2 = E1 + W
A energia interna de um sistema (U) só pode ser alterada mediante trocas de calor
(q) ou na realização de trabalho (W)
UF – UI = DU = q + W
dU = dq + dW
Trabalho de expansão
CQ049 : FQ IV - Eletroquímica
O trabalho de expansão de um gás confinado em um pistão móvel é dado pela
seguinte expressão:
dW = - F dz
O sinal negativo significa que o deslocamento está sendo
efetuado contra uma força no sentido oposto, e o sistema está
gastando energia, realizando trabalho;
dW = - p x A dh
O trabalho será diretamente relacionado pela variação de
volume, A dh = dV:
dW = - pext x dz
CQ049 : FQ IV - Eletroquímica
Função de estado
Uma função de estado é aquela em que sua variação depende APENAS dos seus
estados inicial e final, onde qualquer tipo de ganho / perda de calor / trabalho
ENTRE esses dois estados não são levados em consideração.
H2O(g)
H2O(l)
H2O(s)
Estado final (UF)
pico
DU = UF - UI
Estado inicial (UI)
Independe de quaisquer
estados intermediários
base
Ciclo de Born-Haber
CQ049 : FQ IV - Eletroquímica
Calcular a energia do retículo de um cristal de NaCl, que é definido como o calor liberado
quando um mol de cristal de NaCl é formado a partir de um mol de íons gasosos sódio e
cloreto;
Como H é uma função de estado, se
somar os processos do ciclo,
chegaremos a HF = HI, desta forma, DH
= 0;
DH1 + DH2 + ... +DHN = 0 (CICLO)
Lei de Hess
CQ049 : FQ IV - Eletroquímica
Entalpia (H)
Entalpia
(H)
CQ049 : FQ IV - Eletroquímica
A definição de entalpia (H):
A variação da energia interna não é igual ao calor recebido pelo sistema quando o volume não for
constante. Nessa situação, parte da energia fornecida como calor volta para as vizinhanças na forma
de um trabalho de expansão, desta forma dU < q. Neste caso, o calor fornecido a pressão constante
é igual a variação de outra propriedade termodinâmica, a entalpia (H).
A entalpia se define por:
H = U + pV
Quando trabalhamos em situações onde a pressão é
constante, podemos convenientemente dizer que:
dH = dq (quando p é constante)
E em uma variação finita:
DH = qp
CQ049 : FQ IV - Eletroquímica
Termoquímica
Entalpias de transições de fase
A variação de entalpia padrão que acompanha uma mudança de estado físico é a entalpia
padrão da transição, representado por DtrsHϴ.
sólido
gasoso
líquido
DfusHϴ
DvapHϴ
DsolHϴ
DconHϴ
Termoquímica
CQ049 : FQ IV - Eletroquímica
A entalpia é uma função de estado, desta
forma a variação depende apenas dos
estados inicial e final
Termoquímica
CQ049 : FQ IV - Eletroquímica
Entalpias padrão de formação
A entalpia padrão de formação, DfHϴ, de uma substância é a entalpia padrão da reação de
formação do composto a partir dos respectivos elementos, cada qual no seu estado de
referência, ou seja, sua forma mais estável em determinada temperatura e a pressão de 1 bar.
Termoquímica
CQ049 : FQ IV - Eletroquímica
Lei de Hess
A lei de Hess diz que: “a mudança de entalpia de uma reação é a mesma, independente dela
ocorrer em uma ou mais etapas”.... Ou seja, entalpia é uma função de estado.
Considere a seguinte reação:
O DRH desta reação não pode ser medido diretamente, porém indiretamente podemos obter a variação da
entalpia através das seguintes reações:
Rearranjando-as de maneira adequada:
Termoquímica
CQ049 : FQ IV - Eletroquímica
Energia de ligação:
Em qualquer reação química, ligações são rompidas e formadas. Podemos utilizar esses
conceitos básicos no estudo da termoquímica, onde a energia de ligação (EL) é a
quantidade de energia necessária para quebrar um mol de ligações em uma substância
covalente gasosa para formar os produtos, considerando p e T constantes. Quanto maior
for a EL, mais difícil será quebrá-la.
Termoquímica
CQ049 : FQ IV - Eletroquímica
Energia de ligação:
somente para gases
Termoquímica
Energia de ligação:
CQ049 : FQ IV - Eletroquímica
CQ049 : FQ IV - Eletroquímica
2ª lei da termodinâmica
Espontaneidade
Algumas coisas acontecem, outras não .... A segunda lei da termodinâmica trata da
espontaneidade de processos. Até agora, vimos pela termoquímica que processos
espontâneos liberam energia e processos não-espontâneos absorvem energia. Agora porém,
vamos introduzir um outro parâmetro termodinâmico chamado entropia (S).
A entropia está diretamente relacionada com a dispersão de energia do sistema, ou de forma
mais geral, na desordem de um sistema. Um processo entropicamente espontâneo é aquele
onde há um aumento na desordem do sistema, como visto abaixo:
SI
SF
DS = SF – SI
Se o processo é espontâneo, DS > 0
2ª lei da termodinâmica
CQ049 : FQ IV - Eletroquímica
Variação da entropia com a temperatura:
O aumento da temperatura irá provocar um aumento na desordem do sistema. Se
imaginamos um sistema que é aquecido, sob pressão constante (como a atmosférica),
podemos calcular quanto vale o dS, como mostrado abaixo:
Como a mudança é feita sob pressão constante, dH = dq
Assim, chegamos a dqrev = CP dT, substituindo na equação anterior:
2ª lei da termodinâmica
CQ049 : FQ IV - Eletroquímica
Variação da entropia com a temperatura:
Dependendo do sistema, ao aquecer uma amostra, ela poderá sofrer mudança de fase, desta
forma, o cálculo da variação de entropia para uma transição de fase, pode ser calculado
como:
Durante uma transição de fase, T é constante e se estamos admitindo
um aquecimento a pressão constante, podemos dizer que qtrs = DtrsH ,
assim:
A variação de entropia durante um aquecimento, levando em
consideração as possíveis transições de fase (como mostrado nos
gráficos ao lado), pode ser calculada como:
Gibbs
CQ049 : FQ IV - Eletroquímica
A energia de Gibbs
Vimos que o conceito de espontaneidade está diretamente relacionado com:
Fatores Entalpicos (DH) – relacionado com o calor liberado / consumido em uma reação;
Sabemos que se DH > 0 a reação absorve calor, ou seja não-espontâneo
se DH < 0 a reação liberta calor, sendo considerado espontâneo
Fatores Entrópicos (DS) – relacionado com a dispersão de energia de um processo, ou seja, a desordem
do sistema;
Sabemos que se DS > 0, a desordem do sistema aumenta, ou seja, é um processo espontâneo
se DS < 0, ocorre uma aumento na ordem do sistema, em um processo não-espontâneo
Como vimos que tanto a entalpia quanto a entropia são funções de estado, o conceito de
espontaneidade será agora relacionado a uma outra função termodinâmica, que abrange
tanto os fatores entálpicos quanto os entrópicos, a energia livre de Gibbs (G), que é válida
em situações onde a pressão e a temperatura são constantes. A função de Gibbs é dada por:
G = H – TS
dG = dH - TdS
CQ049 : FQ IV - Eletroquímica
Gibbs
dG = dH – dTS
DG = DH – TDS
O DG determina se um processo é espontâneo ou não:
Energia livre de Gibbs
soluto + solvente → solução
GPRO > GREA ; DrG > 0 : NÃO Espontânea
GPRO < GREA ; DrG < 0 : Espontânea
Avanço da reação
Gibbs
CQ049 : FQ IV - Eletroquímica
Energia Livre de Gibbs (G)
Relaciona as mudanças entalpicas e entropicas de um sistema, em uma situação
onde tanto a pressão quanto a temperatura são constantes; em mudanças
espontâneas DG < 0.
DG = DH - TDS
Gibbs
CQ049 : FQ IV - Eletroquímica
Sulfeto de mercúrio II (HgS) é um mineral de coloração vermelha,
como mostrado ao lado. Mercúrio líquido pode ser obtido pelo
aquecimento do sólido na presença de oxigênio, como mostrado
na equação abaixo.
Estime qual temperatura esta reação é favorecida:
Como DH0 < 0 e DS0 > 0 , a reação será
favorecida em todas as temperaturas
Gibbs
CQ049 : FQ IV - Eletroquímica
Estime qual temperatura
favorecida:
esta
reação mostrada
abaixo
é