UNIVERSIDADE FEDERAL DE SANTA MARIA
CENTRO DE CIÊNCIAS NATURAIS E EXATAS
PROGRAMA DE PÓS-GRADUAÇÃO EM AGROBIOLOGIA
INTERAÇÕES DE COBRE E FÓSFORO EM
ACESSOS DE Pfaffia glomerata (SPRENG.)
PEDERSEN: EFEITO NO CRESCIMENTO E
RENDIMENTO DE β-ECDISONA
DISSERTAÇÃO DE MESTRADO
Franciele Antonia Neis
Santa Maria, RS, Brasil
2013
2
INTERAÇÕES DE COBRE E FÓSFORO EM ACESSOS DE
Pfaffia glomerata (SPRENG.) PEDERSEN: EFEITO NO
CRESCIMENTO E RENDIMENTO DE β-ECDISONA
Franciele Antonia Neis
Dissertação apresentada ao Programa de Pós-Graduação em
Agrobiologia, da Universidade Federal de Santa Maria (UFSM, RS),
como requisito parcial para obtenção do grau de Mestre em
Agrobiologia
Orientador: Prof. Fernando Teixeira Nicoloso
Santa Maria, RS, Brasil
2013
3
Universidade Federal de Santa Maria
Centro de Ciências Naturais e Exatas
Programa de Pós-Graduação em Agrobiologia
A Comissão Examinadora, abaixo assinada,
aprova a Dissertação de Mestrado
INTERAÇÕES DE COBRE E FÓSFORO EM ACESSOS DE Pfaffia
glomerata (SPRENG.) PEDERSEN: EFEITO NO CRESCIMENTO E
RENDIMENTO DE β-ECDISONA
Elaborada por
Franciele Antonia Neis
como requisito parcial para obtenção do grau de
Mestre em Agrobiologia
Comissão Examinadora:
__________________________________________
Fernando Teixeira Nicoloso, Dr.
(Presidente/Orientador)
___________________________________________
Arthur Germano Fett-Neto, PhD. (UFRGS)
____________________________________________
Eduardo Girotto, Dr. (IFRS)
Santa Maria, 14 de março de 2013
4
DEDICATÓRIA
A Miguel e Maria Gessi, meus pais queridos,
em gratidão à dádiva da vida, exemplos de força e dedicação.
À Andressa e Andrei, meus irmãos, motivos de orgulho e alegria.
Ao meu noivo Neimar, parte de mim, pelo apoio, companheirismo e amor...
Sem vocês eu não conseguiria ter dado tantos passos importantes em minha vida.
5
AGRADECIMENTOS
Agradeço primeiramente a Deus por estar sempre guiando meu caminho.
Aos meus pais, Miguel Neis e Maria Gessi Neis, pela educação, amor, esforço e
dedicação, Amo vocês!
Em especial a meu noivo Neimar F. da Rosa pela compreensão, amor, carinho,
incentivo e confiança nos momentos de ausência, que foram essenciais para vencer
todos os obstáculos. Para todo sempre!
Ao professor Fernando T. Nicoloso, exemplo de profissional, agradeço pela
oportunidade que me foi confiada, pela amizade, pelos ensinamentos oferecidos e
por toda a atenção dispensada.
Aos meus irmãos, Andressa Neis e Andrei Neis por todo nosso amor, a meus
cunhados (as) Suzana F. da Rosa, Marcos P. Ludwig, Denise F. Da Rosa e Tiago
Cassol, pela presença agradável, pelo apoio e incentivo.
A minha amiga e muitas vezes mãe Hilda H. Soriane (Pós- doutoranda), obrigada
pelo carinho, ensinamentos e conselhos, sem você não teria conseguido suportar
tantas coisas. Obrigada minha querida!
Ao Pós-doutorando Paulo Ferreira Avelar pela ajuda na execução deste trabalho,
pelos conhecimentos compartilhados e principalmente por uma amizade que vou
levar para vida toda.
Ao professor Sidinei J. Lopes, pela amizade, pelas sugestões, pelos conselhos,
pelos constantes incentivos e pela colaboração fundamental na realização deste
trabalho.
A professora Denise Cargnelutti, por ter acreditado em mim.
A professora Luciane A. Tabaldi, incentivo e ensinamentos que contribuíram para a
realização deste trabalho.
As minhas amigas e companheiras de mestrado Suzi C. Uliana e Darlene Sausen as
―mosqueteiras‖ inseparáveis.
A doutora Júlia G. Farias, pelo apoio, carinho e ensinamentos, nunca vou esquecer
o quanto você fez por mim.
Às doutorandas Liana V. Rossato e Bibiana S. Morais pelo convívio, auxílio e
conhecimento compartilhado ao longo desse período.
6
Ao mestrando Gabriel Schaich pela amizade, apoio e incentivo.
Aos bolsistas de iniciação científica Marcos, Leonardo, Pedro, Sibila, Victória,
Gessieli, Andrieli, Jover, Heloisa, Raíssa, Bianca e Jussiane pelo auxílio na
execução deste trabalho.
Aos colegas de pós-graduação pela amizade, companheirismo e apoio prestados ao
longo deste curso.
As minhas amigas Raquel Binotto, Mariana Durigon, Tatiane Bertuzzi, Daniele
Grigoletto e Ana Paula Cassol, pela força e companheirismo.
Aos amigos que de uma forma ou outra contribuíram para esta conquista.
Ao laboratório de química da UFSM, em especial ao Matheus e ao professor Valderi,
pela ajuda nas análises de tecido.
Ao laboratório de fertilidade do solo da UFSM, em especial ao Tadeu L. Tiecher pela
atenção, ensinamentos, paciência e compreensão de minhas dificuldades.
A Universidade Federal de Santa Maria e ao Programa de Pós-Graduação em
Agrobiologia, pela oportunidade de realização do curso de mestrado.
À PIONEER pela concessão da bolsa de mestrado, a qual torna possível a
realização de projetos como este aqui apresentado.
E a todos aqueles que torceram, incentivaram e contribuíram de alguma
forma para a realização deste trabalho.
7
EPIGRAFE
Apesar dos nossos defeitos,
precisamos enxergar que somos pérolas únicas no teatro da vida
e entender que não existem pessoas de sucesso ou pessoas fracassadas
o que existe são pessoas que lutam pelos seus sonhos ou desistem deles.”
Por isso...
Nunca desista dos seus sonhos!
Augusto Cury
8
LISTA DE FIGURAS
Figura 1 – Aspectos visuais de plantas de dois acessos de Pfaffia
glomerata (acesso BRA e JB), cultivados em Argissolo Vermelho
distrófico típico com doses de 80 mg kg-1 de Cu na presença de
10 (A e B) e 120 mg kg-1 de P (C e D). (NEIS, F.A).........................
Figura 2 – Produção de matéria seca das folhas e hastes de plantas de
Pfaffia glomerata (acesso JB e BRA) submetidas ao cultivo em
Argissolo Vermelho distrófico típico com concentrações
crescentes de Cu e P (mg kg-1)........................................................
Figura 3 – Produção de matéria seca de raiz e matéria seca total de
plantas de Pfaffia glomerata (acesso JB e BRA) submetidas ao
cultivo em Argissolo Vermelho distrófico típico com concentrações
crescentes de Cu e P (mg kg-1)........................................................
Figura 4 – Aspectos visuais de raízes do acesso BRA, cultivado em
Argissolo vermelho distrófico típico com concentrações
crescentes de Cu e P (mg kg-1). Barra correspondente a 10 cm.
(NEIS, F.A).......................................................................................
Figura 5 – Aspectos visuais de raízes do acesso JB cultivado em Argissolo
vermelho distrófico típico com concentrações crescentes de Cu e
P (mg kg-1). Barra correspondente a 10 cm. (NEIS, F.A).................
29
30
31
33
34
9
LISTA DE TABELAS
Tabela 1 – Propriedades químicas e físicas do solo Argissolo vermelho
distrófico típico com aplicação de diferentes doses de cobre e
fósforo...........................................................................................
Tabela 2 – Concentração de Cu (mg kg-1) na parte aérea e raízes de
Pfaffia glomerata cultivadas em Argissolo Vermelho distrófico
típico com aplicação de diferentes doses de cobre e
fósforo...........................................................................................
Tabela 3 – Concentração de P (g kg-1) na parte aérea e raízes de Pfaffia
glomerata cultivada em Argissolo Vermelho distrófico típico com
aplicação
de
diferentes
doses
de
cobre
e
fósforo...........................................................................................
Tabela 4 – Índice de translocação de Cu para parte aérea de dois acessos
de Pfaffia glomerata (JB e BRA) cultivados em Argissolo
Vermelho distrófico típico com aplicação de diferentes doses de
cobre e fósforo (mg kg-1)...............................................................
Tabela 5 – Índice de acumulação nas raízes dois acessos de Pfaffia
glomerata (JB e BRA) cultivados em Argissolo Vermelho
distrófico típico com aplicação de diferentes doses de cobre e
fósforo (mg kg-1)............................................................................
Tabela 6 – Coeficiente de correlação de Pearson (ρ) entre Cu dosado nos
tecidos (folhas, hastes e raízes) e os nutrientes P, Ca, Mg, Fe,
K, Mn e Zn, presentes nos respectivos tecidos de dois acessos
Pfaffia glomerata (JB e BRA) cultivados em Argissolo Vermelho
distrófico típico com aplicação de diferentes doses de cobre e
fósforo...........................................................................................
Tabela 7 – Teor de β-ecdisona (µg g-1 de matéria seca) em raízes de dois
acessos de P. glomerata (JB e BRA) cultivada em Argissolo
Vermelho distrófico típico com aplicação de diferentes doses de
cobre e fósforo..............................................................................
Tabela 8 – Conteúdo de β-ecdisona (g raiz-1) em raízes de dois acessos
de P. glomerata (JB e BRA) cultivada em Argissolo Vermelho
distrófico típico com aplicação de diferentes doses de cobre e
fósforo...........................................................................................
24
36
38
40
41
42
43
44
10
LISTA DE APÊNDICES
Apêndice A – Curva analítica do padrão de β-ecdisona.................................
Apêndice B –Propriedades químicas e físicas do solo Argissolo vermelho
distrófico típico ao final do experimento........................................
Apêndice C – Concentração de Fe (mg kg-1) na parte aérea e raízes de
Pfaffia glomerata cultivada em Argissolo Vermelho distrófico
típico com aplicação de diferentes doses de cobre e fósforo......
64
65
66
11
SUMÁRIO
INTRODUÇÃO.................................................................................................
1 INTERAÇÕES DE COBRE E FÓSFORO EM ACESSOS DE
Pfaffia Glomerata (SPRENG.) PEDERSEN: EFEITO NO
CRESCIMENTO E RENDIMENTO DE Β-ECDISONA....................
Resumo………………………………………………………………………………...
Abstract………………………………………………………………………………...
Introdução...........................................................................................................
Material e Métodos.............................................................................................
Resultados..........................................................................................................
Discussão............................................................................................................
Conclusão...........................................................................................................
Referências.........................................................................................................
REFERÊNCIAS BIBLIOGRÁFICAS..........................................................
APÊNDICES.....................................................................................................
11
17
17
18
19
21
28
44
49
50
58
64
12
INTRODUÇÃO GERAL
O uso de plantas medicinais na terapêutica ou como suplementos dietéticos
remota além da história gravada, mas tem aumentado substancialmente nas últimas
décadas (KHAN et al., 2001). Exemplos do uso destes recursos naturais são
encontrados intensamente na história do desenvolvimento das civilizações Oriental e
Ocidental, merecendo destaque a medicina tradicional Chinesa, a qual se
desenvolveu com tal eficiência, que ainda hoje muitas espécies de plantas
medicinais são estudadas em busca do entendimento de seu mecanismo de ação e
isolamento dos princípios ativos (SCHENKEL et al., 2002; SIANI, 2003; VIEGAS
JÚNIOR et al., 2006).
A terapêutica moderna não teria atingido o grau de desenvolvimento atual
sem ajuda dos produtos naturais, especialmente dos vegetais superiores (SIANI,
2003). Esse fato se explica em razão das plantas se constituírem em fontes
importantes de metabólitos secundários biologicamente ativos, sendo estes muito
utilizados na indústria farmacêutica na produção de medicamentos fitoterápicos,
além de servirem de modelos para a síntese de um grande número de fármacos
(GUERRA; NODARI, 2002; SIANI, 2003).
No Brasil, várias espécies do gênero Pfaffia são utilizadas em substituição ao
ginseng coreano (Panax ginseng C. A. Meyer – Araliaceae) como uma panacéia.
Entre estas espécies pode-se citar a Pfaffia glomerata (Spreng.) Pedersen, a Pfaffia
iresinoides Sprengel e a Pfaffia paniculata (Mart.) Kuntze (OLIVEIRA, 1986;
SHIOBARA et al., 1992). Estas plantas são popularmente conhecidas como ginseng
brasileiro por apresentarem efeitos adaptógenos ou antiestresse semelhantes à
espécie típica de ginseng, sendo o termo adaptógeno usado para descrever a ação
de substâncias no aumento da resistência não específica do organismo às
influências externas (MAGALHÃES, 2000; SCHENKEL et al., 2002).
A P. glomerata caracteriza-se por ser uma erva perene relativamente alta,
apresenta caules retos, delgados e ocos, raiz fusiforme e inflorescência muito
ramificada composta por flores polígamo-monóicas (VIGO et al., 2004b); sendo as
raízes de formas variadas, destacando-se as típicas formas humanóides, das quais
deriva o nome ―ginseng‖ que significa ―imagem do homem‖, em chinês (SCHENKEL
13
et al., 2002). Ocorre normalmente em locais de clima tropical ou subtropical úmido. É
comum encontrar Pfaffia em beira de rios e nas orlas das matas de galerias, onde
pode receber bastante luz (MAGALHÃES, 2000).
A P. glomerata destaca-se como uma espécie de grande importância
medicinal e comercial (VIGO et al., 2004a; ZIMMER et al., 2006), em razão de
apresentar efeitos como tônico e afrodisíaco, além de serem utilizadas para o
tratamento do diabetes, reumatismo (MAGALHÃES, 2000), esgotamento físico e
mental, falta de memória, irregularidades circulatórias e estresse (RATES;
GOSMANN, 2002).
Em extratos de P. glomerata, estudados por Shiobara et al. (1993), foram
identificadas várias substâncias, tais como: β-ecdisona, rubrosterona, ácido
oleanólico, β-glucopiranosil oleanolato, ácido glomérico e ácido pfamérico (dois
nortriterpenóides).
A
ação
adaptógena
desta
espécie
está
relacionada,
principalmente, à presença do ecdisteróide β-ecdisona (VIGO et al., 2003), que é
utilizado como marcador químico da qualidade dessa planta, que é usada como
matéria-prima
para
produção
de
fitoterápicos
e
suplementos
alimentares
(MAGALHÃES, 2000; ZIMMER et al., 2006).
Os
metabólitos
secundários
são
derivados
biossinteticamente
de
intermediários do metabolismo primário, portanto estas rotas apresentam uma
estreita relação. A produção desses compostos é, em geral, baixa (menos que 1%
da biomassa seca) (OKSMAN-CALDENTE; INZÉ, 2004), sendo resultado dos
processos de biossíntese, transporte, degradação e armazenamento, os quais são
afetados pelo genótipo, estádio ontogenético e por fatores ambientais (TAIZ;
ZEIGER, 2012). A maioria dos compostos é armazenada nos vacúolos de células
que fazem parte de tecidos específicos da planta (OKSMAN-CALDENTEY; INZÉ,
2004). Atualmente, as técnicas cromatográficas e espectroscópicas têm permitido
um avanço na separação e elucidação estrutural de diferentes compostos nos mais
diversos grupos de plantas (GIL et al., 2005).
Dentre os compostos químicos presentes nas raízes de diferentes espécies
de Pfaffia destacam-se as saponinas triterpênicas e os ecdisteróides (SHIOBARA et
al., 1992). As saponinas são glicosídeos de esteróides ou de terpenos policíclicos.
Esse tipo de estrutura, que possui uma parte com característica lipofílica (triterpeno
ou esteróide) e outra parte hidrofílica (açúcares), determina a propriedade de
14
redução da tensão superficial da água e suas ações detergente e emulsificante
(SIMÕES et al, 2002).
As saponinas são substâncias de elevada massa molecular (600 a 2000 Da)
e, de modo geral, ocorrem em misturas complexas devido à presença concomitante
de estruturas com um número variado de açúcares ou ainda devido à presença de
diversas agliconas. Por essas razões, o isolamento e elucidação estrutural de
saponinas podem se tornar muito difíceis. É por isso, também, que o conhecimento
sobre a química e propriedades biológicas das saponinas desenvolveu-se somente
nas últimas décadas, paralelamente à evolução das técnicas cromatográficas e
espectroscópicas. As saponinas possuem várias propriedades físico-químicas e
biológicas, podendo-se citar: a elevada solubilidade em água e outros solventes
polares, a ação sobre membranas das células sanguíneas (ação hemolítica) ou das
células das brânquias de peixes (ação ictiotóxica) e a complexação com esteróides;
sendo
esta
última,
a
razão
pela
qual
apresentam
ação
antifúngica
e
hipocolesterolemiante (SCHENKEL et al., 2002).
As saponinas triterpênicas e os ecdisteróides presentes no sistema radicular
da P. glomerata são considerados os responsáveis pela sua ação farmacológica
(VIGO et al., 2004b), porém poucos estudos têm explorado sua atividade biológica
(NETO et al., 2004). Pesquisas mostraram que os extratos de P. glomerata têm
propriedades
tranquilizantes;
anti-reumáticas;
antidiarréicas;
antiinflamatórias;
febrífugas; cicatrizantes internas e externas; anti-hemorróidicas; melhoradoras da
visão e da memória e para o tratamento de distúrbios gástricos, artrite, artrose,
anemia, astenia e dores (SILVA JÚNIOR; OSAIDA, 2005). No entanto, como
acontece com outras plantas medicinais (SARASAN et al., 2011), a sobreexploração e insustentável colheita tem causado uma diminuição drástica nas
populações naturais e está levando à erosão genética da espécie.
Além destas propriedades, todas as espécies de Pfaffia já estudadas
forneceram quantidades relativas de ecdisona e seus análogos (ecdisteróides). A
ecdisterona é um hormônio esteroidal precursor da β-ecdisona, hormônio indutor das
mudas nos insetos (ecdises) (DINAN, 2001). Rações compostas à base de
P. glomerata foram administradas em criações de bichos-da-seda, no Japão,
prolongando seu estágio larval, a fim de obter maior rendimento na sericultura
(NINAGI; MARUYAMA, 1996).
Também é atribuído a esse fitoecdisteróide, um
15
papel importante na defesa da planta contra insetos não adaptados e aos
nematóides (SAVCHENKO et al., 1998; DINAN, 2001). Estudos realizados com
raízes de P. glomerata de diferentes acessos mostraram teores de β-ecdisona
variando de 0,15 a 0,75%, indicando que a espécie apresenta grande variação em
relação ao acúmulo deste composto (MONTANARI JÚNIOR et al., 1999;
FIGUEIREDO et al., 2004; FREITAS et al., 2004; ZIMMER et al., 2006). De acordo
com Figueiredo et al. (2004), estas variações no conteúdo de β-ecdisona podem ser
devido à variabilidade genética existente entre os acessos, a fatores ambientais e
condições de cultivo, além de diferenças na metodologia de extração e doseamento
do metabólito.
Muitas plantas sofrem com as adaptações a estresses hídricos, temperatura,
radiação ultravioleta, a salinidade, a deficiência nutricional, exposição aos metais
pesados, ataques de insetos e patógenos, os quais podem envolver mudanças
bioquímicas e fisiológicas tanto no metabolismo primário quanto no secundário, o
que pode acarretar maior produção de metabólitos secundários (MARCHESE,
1999).
O modo como o teor dos metabólitos secundários é alterado devido ao
estresse causado pelos metais pesados no solo é bem caracterizado em muitas
espécies
de
plantas
(FACCHINI,
2001;
MEMELINKET
et
al.,
2001;
SHÜTZENDÜBEL; POLLE, 2002). O efeito varia com a espécie, o tempo e a
intensidade da condição estressante. Os metais pesados são encontrados
naturalmente no solo, em baixas concentrações, como resultado do intemperismo e
de outros processos pedogenéticos. Entretanto, as concentrações naturais podem
ser modificadas por processos biogeoquímicos e, principalmente, pela ação
antrópica. Alguns desses elementos são essenciais para várias funções fisiológicas
nos seres vivos, como Fe, Zn, Cu e Mn, enquanto outros, como Cd, Pb e Hg, não
tem funções biológicas conhecidas. Quando em excesso no solo, esses elementos
podem inibir o crescimento das plantas e causar alterações fisiológicas nos vegetais
(BAKER et al., 1994), alterando também sua produção de metabólitos secundários
(FACCHINI, 2001; MEMELINKET et al., 2001; SHÜTZENDÜBEL; POLLE, 2002 ).
O cobre é um micronutriente para as plantas, desempenhando um papel
insubstituível em função de um grande número de enzimas que catalisam as
reações de oxidação em uma variedade de vias metabólicas (LOLKEMA; VOOIJS,
16
1986; QUARTACCI et al., 2000; MARSCHNER, 2011). É um metal de transição que
tem dois estados de oxidação sob condições fisiológicas. Como resultado, o Cu é o
cofator de enzimas envolvidas em numerosas reações de transferência de elétrons.
Encontra-se envolvido em processos biológicos essenciais, tais como a fotossíntese,
respiração, dismutação do superóxido, detecção de etileno, metabolismo da parede
celular e lignificação (BURKHEAD et al., 2009; MARSCHNER, 2011). Em nível
celular, o Cu exerce papel essencial de sinalizador de transcrição, transportes de
proteínas, fosforilação oxidativa e na mobilização do ferro (YRUELA, 2005).
O excesso de Cu é altamente tóxico porque catalisa reações de Fenton, que
geram radicais hidroxil que causam danos aos lipídios, proteínas e ácidos nucléicos
(DRAZKIEWICZ et al., 2007). Este aumento de espécies reativas de oxigênio (ROS)
conduz a alterações na atividade de muitas enzimas envolvidas nas vias
antioxidantes (MOCQUOT et al., 1996; CHAOUI et al., 1997; ZHANG et al., 2010).
Uma redução de biomassa de plantas, inibição do crescimento da raiz, clorose e
necrose são normalmente relatadas como sintomas de excesso de Cu (MENCH;
BES, 2009; MARSCHNER, 2011).
Uma das estratégias que vem sendo utilizadas, para atenuar os efeitos
causados pelo excesso de metais como Cu, consiste em alterações nos teores de
fosfato no solo (MA et al., 1994; COTTER-HOWELLS; CAPORN, 1996; LAPERCHE
et al., 1997; HETTIARACHCHI et al., 2000). Cao et al. (2003) demonstraram que a
adição de fosfato em solos com excesso de Cu, além de aumentar a disponibilidade
de fósforo também pode precipitar o Cu, tornando-o menos disponível às plantas e a
outros organismos do solo, diminuindo consideravelmente a fitointoxicação. Estudos
anteriores demonstraram que a adição de fosfato em vários solos contaminados
podem reduzir a mobilidade e fitodisponibilidade de Cd, Zn, Pb, e Cu, promovendo o
crescimento de plantas (MENCH et al., 1987; MENCH; BES, 2009), pois diminui o
transporte de metais pesados para parte aérea de plantas (LEE; GEORGE, 2005),
devido à formação de compostos menos solúveis (BROWN et al., 1995).
O fosfato atua também na biossíntese dos fitoecdisteróides formando
compostos para atuar na síntese dos terpenóides (CROTEAU et al., 2000; KLEIN,
2004; TAIZ; ZEIGER, 2012). Além disso, aparece conjugado a ecdiesteróides como
componente endógeno de muitas espécies de plantas (LAFONT; HORN, 1989). Este
intermediário endógeno conhecido como ecdisona-P, em Spinacea oleracea inibiu a
17
biossíntese dos fitoesteróis e dos fitoecdisteróides (GREBENOK et. al., 1994).
Enquanto em Zea mays (DEVARENNE et al., 1995) o fosfato conjugado com a
ecdisona, parece ter sido importante no transporte dos ecdisteróides, bem como na
regulação do metabolismo destes compostos.
Diante do exposto, pode-se notar que o estresse causado sobre as plantas ou
uma nutrição adequada de fósforo pode alterar a produção de metabólitos
secundários. No entanto, é vago o conhecimento sobre os efeitos estressantes dos
metais pesados sobre a produção de β-ecdisona. Portanto, o objetivo deste trabalho
foi avaliar o efeito do cobre e do fósforo sobre a produção de β-ecdisona em P.
glomerata.
18
INTERAÇÕES DE COBRE E FÓSFORO EM ACESSOS DE Pfaffia glomerata
(SPRENG.) PEDERSEN: EFEITO NO CRESCIMENTO E RENDIMENTO DE
β-ECDISONA
RESUMO
A Pfaffia glomerata (Spregen.) Pedersen destaca-se como uma espécie de grande
importância medicinal e comercial devido a seu principal metabólito secundário, a
β-ecdisona, que pode sofrer variações em seus teores nas raízes por condições
adversas, dentre elas o estresse nutricional. O objetivo deste trabalho foi avaliar os
efeitos das concentrações crescentes de Cu e P no solo sobre a produção de
β-ecdisona de dois acessos de P. glomerata (JB e BRA). As plantas utilizadas foram
obtidas através de micropropagação in vitro e posteriormente foram aclimatizadas
em hidroponia, sendo então transplantadas e cultivadas em vasos contendo 4 kg de
um Argissolo Vermelho distrófico típico em casa de vegetação. Foram avaliados 12
tratamentos em um esquema bifatorial completo (4x3), representados pela
combinação de quatro níveis de Cu (0, 20, 40 e 80 mg kg-1) e três níveis de P (10, 60
e 120 mg kg -1). Após 100 dias, a plantas foram colhidas e avaliou-se o crescimento,
os teores de nutrientes e a produção de β-ecdisona nas raízes. A máxima produção
de massa seca de plantas para ambos os acessos (JB e BRA) ocorreu nas doses de
40 mg kg-1 de Cu e 10 mg kg-1 de P, sendo que a massa seca do sistema radicular
do acesso JB foi significativamente maior quando comparada ao acesso BRA. A
dose de 60 mg kg-1 de P influenciou o crescimento do sistema radicular das plantas
do acesso JB na maior dose de Cu, além disso, as raízes deste acesso atuaram
como uma barreira reduzindo a transferência do metal para a parte aérea. As
plantas de ambos os acessos na dose elevada de Cu e na presença de 10 e 120 mg
kg-1 de P apresentaram acentuada inibição do crescimento, no entanto a dose de 60
mg kg-1 de P favoreceu o crescimento das plantas em condições de excesso de
metal na solução do solo. As concentrações de β-ecdisona detectadas nas raízes de
P. glomerata do acesso JB foram maiores quando comparadas ao acesso BRA.
Altos teores de Cu no solo não afetaram a produção de β-ecdisona. No entanto, a
adição de P (120 mg kg-1) ao solo reduziu a produção de β-ecdisona.
Palavras-chave: Pfaffia glomerata, fosfato, metais pesados, β-ecdisona, cobre.
19
ABSTRACT
Pfaffia glomerata (Spregen.) Pedersen stands out as a species of great medical and
commercial importance due to its major secondary metabolite β-ecdysone, which
content can vary in roots under adverse conditions as nutritional stress. The aim of
this study was to evaluate the effects of increasing concentrations of Cu and P in soil
on the production of β-ecdysone of two accessions of P. glomerata (JB and BRA).
The plants used were obtained through in vitro micropropagation and were
subsequently acclimatized in hydroponics and then transplanted and grown in pots
containing 4 kg of a Paleudalf soil, under glasshouse conditions. Twelve treatments
were evaluated in a full factorial scheme (4x3), represented by the combination of
four Cu levels (0, 20, 40 and 80 mg kg-1) and three P levels (10, 60 and 120 mg kg-1).
After 100 days, the plants were harvested for evaluation of growth, nutrient content
and root production of β-ecdysone. The maximum dry matter production of plants for
both accesses (JB and BRA) occurred at doses of 40 mg kg-1 Cu and 10 mg kg-1 of
P, and root dry matter of JB access was significantly higher when compared to BRA
access. The dose of 60 mg kg-1 P influenced root growth of JB accessions at higher
Cu, moreover, access roots acted as a barrier reducing the transference of the metal
to the shoot. Plants of both accesses in high dose of Cu and in the presence of 10
and 120 mg kg-1 P exhibited marked growth inhibition, however the dose of 60 mg kg1
P favored the growth of plants under conditions of metal excess in soil solution.The
concentrations of β-ecdysone detected in roots of P. glomerata JB access were
higher when compared to BRA access. High levels of Cu in the soil did not affect the
production of β-ecdysone. However, the addition of P (120 mg kg-1) to soil reduced
production of β-ecdysone.
Keywords: Pfaffia glomerata, phosphate, heavy metals, β-ecdisona, copper.
20
1 INTRODUÇÃO
A utilização de plantas como fonte de medicamento, na terapêutica ou como
suplementos dietéticos remonta além da história registrada, mas tem aumentado
substancialmente nas últimas décadas (KHAN et al., 2001). Exemplos do uso destes
recursos naturais são encontrados intensamente na história do desenvolvimento das
civilizações Oriental e Ocidental, merecendo destaque a medicina tradicional
Chinesa, a qual se desenvolveu com tal eficiência que ainda hoje muitas espécies
de plantas medicinais são estudadas em busca do entendimento de seu mecanismo
de ação e isolamento dos princípios ativos (SCHENKEL et al., 2002; SIANI, 2003;
VIEGAS JÚNIOR et al., 2006).
Entre as plantas medicinais brasileiras de relevância comercial estabelecida
encontra-se a Pfaffia glomerata (Spreng.) Pedersen pertencente à família
Amaranthaceae, sendo conhecida como ginseng brasileiro ou ginseng do pantanal,
podendo
substituir
o
ginseng
verdadeiro
(Panax
ginseng
C.A.
Meyer)
(NASCIMENTO et al., 2007). A sua importância medicinal e comercial (VIGO et al.,
2004a; ZIMMER et al., 2006) se deve ao fato de apresentar efeitos adaptógeno,
tônico e afrodisíaco (MAGALHÃES, 2000). As suas raízes e folhas têm propriedades
tranquilizantes;
anti-reumáticas;
antidiarréicas;
antiinflamatórias;
febrífugas;
cicatrizantes internas e externas; anti-hemorróidicas; melhoradoras da visão e da
memória e para o tratamento de distúrbios gástricos, artrite, artrose, anemia, astenia
e dores (SILVA JÚNIOR; OSAIDA, 2005).
A ação adaptógena da Pfaffia está relacionada, principalmente, à presença do
ecdisteróide β-ecdisona (VIGO et al., 2003), que é utilizado como marcador químico
da qualidade da planta, as quais são usadas como matéria-prima para produção de
fitoterápicos (MAGALHÃES, 2000; ZIMMER et al., 2006). Esta espécie é conhecida
por acumular o fitoecdisteróide 20-hidroxiecdisona (20E), um composto que foi
incluído em muitas preparações comerciais de anabólicos para atletas (LAFONT;
DINAN, 2003). O fitoecdisteróide é o principal grupo isolado de Pfaffia e 20E é o
mais frequente e amplamente distribuído fitoecdisteróide neste gênero (BAKRIM et
al., 2008). É possível que o 20-hidroxiecdisona atue como um mecanismo de defesa
para proteger as plantas contra insetos fitófagos (DINAN et al., 2009). Além disso, é
21
atribuído um efeito antioxidante, o qual confere mais este uso medicinal para
espécies de ginseng brasileiro (DANIEL et al., 2006).
Muitas plantas sofrem com as adaptações a estresses hídricos, temperatura,
radiação ultravioleta, a salinidade, a deficiência nutricional, a exposição aos metais
pesados, ataques de insetos e patógenos, os quais podem envolver mudanças
bioquímicas e fisiológicas tanto no metabolismo primário quanto no secundário, o
que pode acarretar maior produção de metabólitos secundários (MARCHESE,
1999).
O modo como o teor dos metabólitos secundários é alterado devido ao
estresse causado pelos metais pesados no solo é bem caracterizado em muitas
espécies de plantas (FACCHINI, 2001; MEMELINK et al., 2001; SHÜTZENDÜBEL;
POLLE, 2002). O efeito varia com a espécie, o tempo e a intensidade da condição
estressante. Os metais pesados são encontrados naturalmente no solo, em baixas
concentrações,
como
resultado
do
intemperismo
e
de
outros
processos
pedogenéticos. Entretanto, as concentrações naturais podem ser modificadas por
processos biogeoquímicos e, principalmente, pela ação antrópica. Alguns desses
elementos são essenciais para varias funções fisiológicas nos seres vivos, como Fe,
Zn, Cu e Mn, enquanto outros, como Cd, Pb e Hg, não tem funções biológicas
conhecidas. Quando em excesso no solo, esses elementos podem inibir o
crescimento das plantas e causar alterações fisiológicas nos vegetais (BAKER et al.,
1994), alterando também sua produção de metabólitos secundários (FACCHINI,
2001; MEMELINK et al., 2001; SHÜTZENDÜBEL; POLLE, 2002).
Pesquisas realizadas em nosso grupo de pesquisa sugerem que plantas de P.
glomerata apresentam tolerância intermediária a alta concentração de Al, Hg, Cd, Pb
(MALDANER, 2008; SKREBSKY et al., 2008; CALGAROTO, 2009).
Algumas medidas utilizadas para diminuir a solubilidade e a biodisponibilidade
de metais pesados no solo têm sido propostas como forma de diminuir os impactos
desta contaminação sobre o desenvolvimento das plantas. Alguns autores (CHEN et
al., 1997; MA; RAO, 1997; CAO et al.; 2003) têm mostrado que a remediação de
solos contaminados por metais através da adição de fosfatos é eficiente em função
dos metais pesados adquirirem formas químicas menos solúveis.
O fosfato atua também na biossíntese dos fitoecdisteróides, formando
compostos para atuar na síntese dos terpenóides (CROTEAU et al., 2000; KLEIN,
22
2004; TAIZ ZEIGER, 2012). Além disso, aparece conjugado a ecdiesteróides como
componente endógeno de muitas espécies de plantas (LAFONT; HORN, 1989). Este
intermediário endógeno conhecido como ecdisona-P, em Spinacea oleracea inibiu a
biossíntese dos fitoesteróis e dos fitoecdisteróides (GREBENOK, et. al., 1994). Em
Zea mays (DEVARENNE et al., 1995) o fosfato conjugado com a ecdisona parece
ter sido importante no transporte dos ecdisteróides, bem como na regulação do
metabolismo destes compostos.
Diante do exposto, pode-se notar que o estresse causado sobre as plantas ou
uma nutrição adequada de fósforo pode alterar a produção de metabolitos
secundários. Além disso, detalhes significativos das respostas fisiológicas e
metabólicas das plantas em ambientes contaminados com metais pesados são
conhecidos, mas o efeito estressante dos metais pesados sobre a produção de
β-ecdisona não é relatado na literatura. Portanto, o objetivo deste trabalho foi avaliar
o efeito do cobre e do fósforo sobre a produção de β-ecdisona em dois acessos de
P. glomerata.
2 MATERIAL E MÉTODOS
2.1 Material vegetal e condições de crescimento
O experimento foi desenvolvido junto ao grupo de pesquisa Fisiologia de
Plantas de Interesse Agrobiológico da Universidade Federal de Santa Maria, no
período de março a junho de 2012. A planta estudada foi
Pfaffia glomerata
(Spreng.) Pedersen, oriunda de dois locais e identificada como BRA e JB, sendo que
cada acesso constituiu um experimento. O acesso BRA foi coletado no município de
Querência do Norte (PR) e faz parte do Banco de Germoplasma da Embrapa
Recursos Genéticos e Biotecnologia (Cenargen), Brasília, DF. O acesso JB faz parte
do acervo do Jardim Botânico da Universidade Federal de Santa Maria (UFSM),
Santa Maria, RS. O solo foi coletado na camada de 0-20 cm de profundidade na
23
cidade de Santa Maria, classificado como Argissolo Vermelho distrófico típico
(EMBRAPA, 2006).
O delineamento experimental foi inteiramente casualizado em esquema
fatorial 4 x 3, com seis repetições. Os tratamentos foram constituídos de quatro
níveis de Cu (0, 20, 40 e 80 mg Cu kg-1) adicionados no solo na forma de sulfato de
Cu, sendo a dose zero constituída pelo teor natural (3,2 mg kg-1). Dentro de cada
nível de Cu foram ainda adicionados níveis de P na forma de superfosfato triplo,
resultando em: 10, 60 e 120 mg P kg-1 de solo, o que resultou na combinação de
doze tratamentos, com quatro doses de cobre e
três doses de fósforo
respectivamente na ordem 0-10; 20-10; 40-10; 80-10; 0-60; 20-60; 40-60; 80-60; 0120; 20-120; 40-120; 80-120. Fez-se adição de sulfato de potássio (K) na dose de 40
mg kg-1 com base nos resultados da análise do solo e de acordo com CQFS -RS/SC.
Aos 30 dias adicionou-se nitrogênio (N) na concentração de 60 mg kg-1 na forma de
nitrato de amônio.
As plantas utilizadas foram obtidas de segmentos nodais com 1,0 cm de
comprimento e sem folhas, os quais foram retirados da porção mediana de plantas
matrizes micropagadas in vitro em meio MS (MURASHIGE; SKOOG, 1962),
suplementado com 30 g L-1 de sacarose, 6 g L-1 de agar, 0,1 g L-1 de mio-inositol e
na ausência de fitorreguladores (NICOLOSO et al., 2001). Os tubos de ensaio
contendo os explantes foram mantidos em sala de crescimento durante 20 dias, sob
temperatura de 25 2C, fotoperíodo de 16h com densidade luminosa de 35 µmol
m-2 s-1 fornecida por lâmpadas fluorescentes brancas frias, e umidade relativa do ar
entre 50 e 60%. As plantas foram então selecionadas a fim de compor uma
população homogênea e aclimatizadas em bandejas plásticas contendo 20 kg de
areia. As plantas foram crescidas em casa de vegetação parcialmente climatizada
sob condições de cultivo em hidroponia com solução nutritiva completa de acordo
com ANDRIOLO (2006) através de três irrigações diárias pelo período de 14 dias. A
fim de minimizar o estresse causado pela radiação solar, as bandejas foram
protegidas sob uma tela de sombreamento com 50% de interferência na radiação
nos cinco primeiros dias.
Com o término da aclimatização os acessos foram transplantados para os
vasos com 4 kg de solo (capacidade de 5 kg), sendo plantada uma muda por vaso.
Os vasos foram forrados internamente com plásticos para evitar a perda de água e
24
de nutrientes pela drenagem. Ao longo do cultivo, conduzido em estufa, a reposição
da água evapotranspirada foi realizada através de irrigação, com água deionizada,
sobre a superfície ou através de canos de PVC perfurados e introduzidos no solo
entre 60 e 80% da capacidade de campo, sempre por meio de aferições diárias por
pesagem.
Após o período de três meses depois do transplantio as plantas foram
coletadas e separadas em folhas, hastes e raízes para as posteriores análises.
2.2 Análise do solo
A distribuição do tamanho de partículas dos constituintes do solo foi analisada
de acordo com o método de pipeta (EMBRAPA, 1997). A determinação do pH foi
realizada com água em uma proporção de 1:1 de acordo com a metodologia
proposta por Tedesco et al. (1995). O teor de matéria orgânica do solo (MO) foi
analisado mediante oxidação úmida usando dicromato de potássio em meio de ácido
sulfúrico (0,4 N), e a determinação de MO foi feita por titulação com 0,1 N de sulfato
de amônio ferroso de acordo com a Embrapa (EMBRAPA, 1997).
Para a extração do Cu disponível para as plantas, foi utilizada a metodologia
descrita por Chaignon e Hinsinger (2003), onde amostras de 0,25g de solo seco
foram adicionadas em tubos de Falcon de 15 mL de capacidade e agitadas por 2 h
com 10 mL da solução contendo EDTA dissódico 0,01 mol L -1 e NH4CH3COO 1,0
mol L-1, com pH ajustado para 7,0. Após a agitação a suspensão foi centrifugada e o
teor de Cu determinado em Espectrometria de Absorção Atômica (EAA).
No procedimento para extração do P e do K disponível às plantas, foi pesado
1 g de solo seco, adicionado a tubos falcon com capacidade de 15 mL, agitado por 5
minutos com 10 mL do extrator Mehlich-1 e repouso de 16 h depois da agitação
(TEDESCO et al., 1995). Após a extração o P foi determinado por análise
colorimétrica (MURPHY; RILEY 1962). A concentração de K trocável foi determinada
por espectroscopia de emissão de chama. Os cátions permutáveis (Ca 2+, Mg2+ e
Al3+) foram extraídos com uma solução de KCl (1,0 mol L-1) (EMBRAPA, 1997). A
concentração de Al3+ foi determinada por uma titulação ácido-base com uma solução
25
NaOH (0,0125 mol L-1), e as concentrações de Ca e de Mg foram determinadas por
espectroscopia de absorção atômica (AAS) (TEDESCO et al., 1995). As
características químicas iniciais de cada tratamento encontram-se na tabela 1, e os
atributos químicos finais do solo para cada acesso encontram-se no apêndice-A.
Tabela 1. Atributos químicos e físicos do solo Argissolo Vermelho distrófico típico
com aplicação de diferentes doses de cobre e fósforo.
Cu (mg kg-1) - P (mg kg-1)
Cu (mg kg-1)
-1
P (mg kg )
0-10
20-10
40-10 80-10 0-60
20-60
40-60
80-60
0-120 20-120
40-120
80-120
3,6
21,8
42,7
82,4
2,89
21,9
41,2
83,5
3,1
23,8
42,2
87,1
7,1
5,9
6,7
6,7
59,0
58,4
60,0
57,5
111
117
114
115
-1
3,9
4,2
3,7
3,9
3,7
3,2
3,0
3,0
3,2
3,1
3,0
3,2
-1
Mg (cmolc kg )
2,1
2,0
2,3
2,,3
2,1
2,1
2,1
2,1
2,1
2,7
2,1
2,3
Al
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
K (mg kg-1)
78,2
78,6
81,8
83,4
74,0
73,0
46,2
76,2
72,8
80,6
74,2
74,0
% MO
1,5
1,4
1,3
1,3
1,6
1,4
1,5
1,3
1,5
1,4
1,4
1,4
pH
5,7
5,5
5,6
5,6
5,7
5,7
5,6
5,6
5,7
5,6
5,7
5,7
Ca (cmolc kg )
2.3 Biomassa, determinação da concentração de Cu e de nutrientes minerais
Ao fim do experimento, as plantas foram coletadas e separadas em folhas,
hastes e raízes. Posteriormente, as plantas foram lavadas suavemente com água
destilada, seguindo-se sua secagem em estufa com sistema de ar forçado de
circulação a 65°C, até atingir massa constante para a determinação da massa seca
dos órgãos, bem como para concentração de macronutrientes e micronutrientes. As
amostras foram submetidas a um procedimento de digestão ácida em sistema
aberto com bloco digestor Modelo DK (Velp Scientifica, Itália). As amostras foram
previamente pesadas e transferidas para os frascos de decomposição (tubo de
vidro). A cada tubo de vidro contendo amostra foram adicionados 5 mL de HNO 3
14 mol L-1. Os tubos foram tampados com tampas de polipropileno e mantidos a
140°C durante 2 h. Após a etapa de digestão, as amostras foram transferidas para
26
frascos de polipropileno e volume foi completado até 25 mL com água destilada. A
determinações de Cu, bem como o Ca, K, Mg, P, Fe, Mn e Zn foram feitas por
espectrometria de emissão óptica com plasma indutivamente acoplado (ICP OES)
num espectrômetro da Perkin Elmer 4300 DV (Optima, EUA) equipado com
nebulizador Gencone®, câmara de nebulização do tipo ciclônica e tocha de quartzo
com injetor de alumina de 2,0 mm de diâmetro interno.
2.4 Índice de translocação
A translocação de Cu pelas plantas foi mensurada pelo índice de
translocação (IT), que é definido pela concentração do elemento na parte aérea em
relação à concentração total do elemento nas raízes.
IT = [Metal] parte aérea / [Metal] raízes
2.5 Índice de acumulação nas raízes
O Índice de acumulação (IAR) nas raízes para o Cu foi definido pelo conteúdo
do elemento nas raízes em relação ao conteúdo total da planta.
IAR = [Conteúdo] raízes / [Conteúdo] total
2.6 Análise do conteúdo de β-ecdisona
2.6.1 Preparo das amostras
27
As raízes das plantas de P. glomerata de ambos os acessos (BRA e JB)
foram separadas, cortadas em pequenos pedaços e secas em estufa a 45°C durante
o período de uma semana (FIGUEIREDO et. al., 2004). Posteriormente, as raízes
foram moídas em um moinho de forma a obter uma amostra com tamanho de
partículas inferior a 300 µm.
2.6.2 Extração das amostras
As amostras (1,0 g) foram submetidas ao processo de extração com 125 mL
de metanol, grau HPLC, em soxhlet, durante o período de 4 horas (MAGALHÃES,
2000). Os extratos foram concentrados até 100 ml e uma alíquota (10 ml) de cada
amostra foi tratada com carvão ativo (20 mg) durante cerca de três horas e depois
filtrada duas vezes em holder com membrana de 14 µm. Posteriormente, as
soluções foram novamente filtradas empregando-se uma membrana de 0,45 µm
(Milipore, Bedford, USA) e injetadas no sistema cromatográfico.
2.6.3 Reagente e solvente utilizados no sistema cromatográfico
O padrão de β-ecdisona e o metanol, grau HPLC, foi obtido da Sigma-Aldrich
(São Paulo, Brasil). O metanol foi degaseificado em banho de ultra-som antes de ser
utilizado no sistema cromatográfico.
2.6.4 Condições cromatográficas
As condições cromatográficas utilizadas neste estudo foram adaptadas da
metodologia proposta por Magalhães (2000) e Figueiredo et al. (2004). As análises
foram realizadas em cromatografia líquida de alta eficiência (CLAE-DAP) (Shimadzu,
28
Kyoto, Japão), com auto amostrador Prominence (SIL-20A), equipado com bombas
alternadas Shimadzu LC-20 AT, conectadas a um desgaseificador DGU 20A5,
integrador CBM 20A, detector UV–VIS, DAD SPD-M20A, Software LC solution 1,22
SP1 e coluna Phenomenex C-18 (250 mm x 4,6 mm), empacotada com partículas de
5 μm de diâmetro.
A fase móvel utilizada foi metanol (100%), grau HPLC, com eluição isocrática,
fluxo de 1,0 mL min e volume de injeção de 20 μL. O tempo de retenção do padrão
foi 2,7 minutos. Os picos da amostra foram identificados em comparação com o
tempo de retenção e o espectro de absorção da solução do padrão, no comprimento
de onda de 245 nm.
2.6.5 Preparo do padrão de β-ecdisona
Soluções do padrão de β-ecdisona foram preparadas a partir da diluição da
amostra original (1,0 mg em 10 mL de metanol, grau HPLC), obtendo-se uma
solução estoque com concentração inicial de 100 µg mL -1. A partir desta solução
foram realizadas diluições sucessivas para a obtenção de soluções de trabalho
contendo 20, 40, 60, 80 e 100 µg mL-1 de β-ecdisona, conforme proposto por Ribani
et al. (2004) e Zimmer et al. (2006).
2.6.6 Curva analítica e quantificação
A curva analítica foi construída através de um gráfico de regressão que
relaciona a área dos picos com as concentrações do padrão de β-ecdisona
(Magalhães, 2000; Figueiredo et al., 2004; Ribani et al., 2004; Zimmer et al., 2006).
A linearidade do método foi verificada através do coeficiente de determinação (R²)
da curva obtida na análise de regressão (Ribani et al., 2004) (Apêndice-B).
Considerou-se a média de três injeções em cada concentração (Zimmer et al.,
2006). A quantificação foi realizada pelo método do padrão externo, onde a área do
29
pico correspondente à β-ecdisona presente na amostra é calculada a partir da
equação da reta da curva analítica construída com concentrações conhecidas do
padrão (Ribani et al., 2004). A identificação do analito nas amostras foi baseada no
tempo de retenção e na co-cromatografia das amostras com padrão de β-ecdisona e
espectro UV.
2.7 Análise estatística dos dados
Os dados foram testados quanto à normalidade dos erros através do teste de
Anderson-Darling e homogeneidade das variâncias através dos testes de Levene e
Bartlet (ESTATCAMP, 2012). Quando atendidos a estes pressupostos, procedeu-se
a análise de variância com base apropriada do teste-F. As equações de regressão
foram determinadas por meio do uso do programa estatístico SISVAR (FERREIRA,
2000). As correlações de Pearson entre o Cu e os nutrientes foram realizadas por
meio do software SigmaPlot versão 12.3 (teste F; P≤0,05). Quando os dados não
atenderam aos pressupostos, foram transformados pelo procedimento Box-Cox,
sendo novamente testados os pressupostos (ESTATCAMP, 2012).
3 RESULTADOS
3.1 Produção de Biomassa
Quanto à produção de matéria seca da parte aérea e de raízes, os acessos
de Pfaffia glomerata avaliados diferiram entre si após 100 dias de plantio (Figura 2 e
3). Para os dois acessos estudados as doses de 10 mg kg-1 de P e 40 mg kg-1 de Cu
aumentaram a produção de matéria seca de folhas, com incrementos médios que
atingiram 57 e 49%, respectivamente para os acessos BRA e JB, em relação aos
tratamentos com 120 mg kg-1 de P. Ambos os acessos apresentaram uma
30
diminuição na produção de matéria seca de folhas na dose de 80 mg kg-1 de Cu, e
na presença de 10 mg kg-1 de P (Figura 1 e 2). Para o acesso JB, na dose de 120
mg kg-1 de P, a produção de matéria seca de folhas não diferiu entre as doses de
cobre, sendo a média de produção de 2,6 g planta -1. Na dose de 120 mg kg-1 de P a
produção de matéria seca de folhas do acesso BRA foi maior na dose de 0 mg kg-1
de Cu, aproximadamente 3,9 g planta-1, enquanto que para as demais doses de Cu
não houve diferença significativa (p>0.05) (Figura 2).
A
B
C
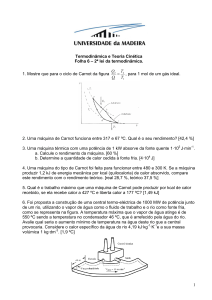
D
Figura 1. Aspectos visuais de plantas de dois acessos de Pfaffia glomerata (acesso
BRA e JB), cultivados em Argissolo Vermelho distrófico típico com doses de 80 mg
kg-1 de Cu na presença de 10 (A e B) e 120 mg kg-1 de P (C e D). (NEIS, F.A).
Os resultados evidenciaram que também ocorreu efeitos dos tratamentos na
produção de matéria seca de hastes entre os acessos, sendo que a produção de
31
matéria seca para o acesso BRA foi 65% maior em relação ao acesso JB. Nas
doses de 40 mg kg-1 de Cu e 10 mg kg-1 de P, a produção de matéria seca de hastes
para as plantas do acesso BRA foi de 7,17 g planta -1, enquanto que para o acesso
JB as plantas apresentaram menores incrementos de matéria seca de hastes, 5,19 g
planta-1 nestas mesmas doses. O incremento na produção de matéria seca de
hastes, para ambos os acessos, na presença de 10 mg kg-1 de P ocorreu até a dose
de 40 mg kg-1 de Cu, seguido de uma redução na dose de 80 mg kg-1 de Cu. Os
acessos BRA e JB na presença de 60 mg kg-1 de P, não apresentaram diferenças
significativas entre as doses de Cu, obtendo uma produção de matéria seca de
hastes estimada em torno de 5,08 e 4,25 g planta-1, respectivamente (Figura 2).
8
JB
BRA
y= 3.34 + 0.07x -0.001x² R² =0.95
y=4.43 +0.05x -0.0006x² R²=0.81
8
Matéria seca de folhas (g planta )
Não significativo
-1
Não significativo
-1
Matéria seca de folhas (g planta )
Não significativo
6
4
2
0
20
40
6
5
4
3
2
1
0
80
y= 4 + 0.04x -0.001x² R² =0.80
y=4.71 + 0.03x R²=0.81
7
y=4.40 + 0.06x - 0.001x² R²=0.99
5
4
3
2
1
0
40
80
Não significativo
Não significativo
-1
6
20
y=5.89 +0.06x -0.001x² R²=0.88
10
Matéria seca de haste (g planta )
-1
y=3.72 -0.04x -0.0002x² R²=0.52
0
0
Matéria seca de haste (g planta )
7
8
6
4
2
0
0
20
40
80
0
20
40
80
Doses de Cu (mg kg-1)
10 mg kg-1 P
60 mg kg-1 P
120 mg kg-1 P
Figura 2. Produção de matéria seca das folhas e hastes de plantas de Pfaffia
glomerata (acesso JB e BRA) submetidas ao cultivo em Argissolo Vermelho
distrófico típico com concentrações crescentes de Cu e P (mg kg-1).
32
A produção de matéria seca de raízes foi significativamente diferente entre os
acessos BRA e JB, com este último apresentando um incremento de 45% em
relação ao acesso BRA (Figuras 3, 4 e 5). A maior produção de matéria seca de
raízes evidenciada no acesso JB ocorreu na dose de 80 mg kg -1 de Cu, na presença
de 60 mg kg-1 de P, sendo em média 7,40 g planta-1. As plantas do acesso BRA
tiveram sua maior produção de matéria seca de raízes (2,32 g planta-1) na presença
de 10 mg kg-1 de P e 40 mg kg-1 de Cu. Já na dose de 80 mg kg-1 de Cu com 10 mg
kg-1 de P, ocorreu uma redução de 23,3% em relação às doses que favoreceram a
máxima produção. Para o acesso JB, a dose de 120 mg kg-1 de P proporcionou
maior produção de matéria seca de raiz na dose de 0 mg kg-1 de Cu, em média 5,03
g planta-1, enquanto que na dose de 80 mg kg-1 de Cu e 120 mg kg-1 de P houve uma
redução de 85% em relação a mesma dose de Cu, na presença de 60 mg kg -1 de P
(Figura 3).
JB
y= 4.11 + 0.05x -0.001x² R² =0.83
8
-1
Matéria seca de raiz (g planta )
Não significativo
y=4.22 - 0.04x R²=0.90
-1
Matéria seca de raiz (g planta )
10
BRA
6
4
2
0
20
40
Não significativo
Não significativo
2,4
2,2
2,0
1,8
1,6
1,4
1,2
80
0
22,5
y= 11.46 + 0.17x -0.003x² R² =0.86
20
20,0
Não significativo
y= 10.22 + 0.07x -0.002x² R² =0.98
18
17,5
15,0
12,5
10,0
7,5
5,0
2,5
0,0
20
40
80
y=12.77 +0.11x -0.001x² R²=0.88
Não significativo
Não significativo
-1
Matéria seca total (g vaso )
-1
y=2.13 +0.01x -0.0002x² R²=0.99
2,6
1,0
0
Matéria seca total (g vaso )
2,8
16
14
12
10
8
6
0
20
40
80
0
20
40
80
Doses de Cu (mg kg -1)
10 mg kg-1 P
60 mg kg-1 P
120 mg kg-1 P
Figura 3. Produção de matéria seca de raiz e matéria seca total de plantas de
Pfaffia glomerata (acesso JB e BRA) submetidas ao cultivo em Argissolo Vermelho
distrófico típico com concentrações crescentes de Cu e P (mg kg-1).
33
A produção de massa seca total das plantas do acesso JB, na dose de 40 mg
-1
kg de Cu e de 10 mg kg-1 de P, foi de 14,9 g planta-1, seguida de uma redução na
dose 80 mg kg-1 de Cu. Não houve diferenças significativas entre as doses de Cu
estudadas na presença de 60 mg kg-1 de P, as quais apresentaram produção média
de 12,73 g planta-1. As doses de 80 mg kg-1 de Cu e 60 mg kg-1 de P,
proporcionaram um incremento de 82% na matéria seca total em relação as doses
de 10 e 120 mg kg-1 de P na presença de 80 mg kg-1 de Cu. Em relação à produção
de matéria seca total na presença de 120 mg kg-1 de P, as plantas do acesso JB não
apresentaram diferenças significativas até a dose de 40 mg kg-1 de Cu, em média
10,32 g planta-1, por outro lado a dose de 80 mg kg-1 de Cu apresentou uma redução
de 77% em relação a dose inicial de Cu, com produção de matéria seca de 2,44 g
planta-1 (Figura 3).
Quanto à produção de massa seca total das plantas do acesso BRA, também
se observou resposta de máxima produção na dose de 40 mg kg -1 de Cu associada
a 10 mg kg-1 de P, em média 15,09 g planta-1. Já na dose combinada de 80 mg kg-1
de Cu e 10 mg kg-1 de P houve uma redução de 30% em relação às doses que
proporcionaram a máxima produção. Com o aumento na dose de P (60 mg kg-1), nas
diferentes doses de Cu, não houve diferenças na produção de matéria seca total
(média de 11,71 g planta-1). Já na presença de 120 mg kg-1 de P, ocorreram
diferenças entre as doses de Cu, sendo que a máxima produção ocorreu na menor
dose de Cu e a mínima em 20 mg kg-1 de Cu. No entanto não houve diferenças em
relação às doses citadas e as maiores doses de Cu (40 e 80 mg kg-1 de Cu) (Figura
3).
34
Figura 4. Aspectos visuais de raízes do acesso BRA, cultivado em Argissolo
Vermelho distrófico típico com concentrações crescentes de Cu e P (mg kg-1). Barra
correspondente a 10 cm. (NEIS, F.A).
35
Figura 5. Aspectos visuais de raízes do acesso JB, cultivado em Argissolo Vermelho
distrófico típico com concentrações crescentes de Cu e P (mg kg-1). Barra
correspondente a 10 cm. (NEIS, F.A).
36
3.1.2 Concentração de Cu e P nos tecidos
Os teores de Cu e P nas folhas, hastes e raízes variaram nos dois acessos
com a adição das diferentes quantidades de Cu e P adicionados ao solo (Tabela 2).
Os teores de Cu nas folhas do acesso JB, expostos a 10 mg kg-1 de P nas
diferentes doses de Cu, apresentaram uma relação quadrática. A concentração
máxima de Cu nestes tecidos foi em média 32,5 mg kg-1 sob a exposição de 40 e 80
mg kg-1 de Cu, diferindo das doses de 0 e 20 mg kg-1 de Cu, as quais ocasionaram
menor concentração de Cu nos tecidos, em média 19,52 mg kg -1 de Cu. O acesso
BRA nestas mesmas condições descritas apresentou resposta linear à adição de
Cu. As concentrações de Cu variaram em média de 18,77 mg kg-1 nas doses de 0 e
20 mg kg-1 de Cu a 28,20 mg kg-1 nas doses de 40 e 80 mg kg-1 de Cu. O maior teor
de Cu encontrado nas folhas do acesso JB foi de 42,1 mg kg-1, na dose de 0 mg kg-1
de Cu e na presença de 60 mg kg-1 de P no acesso JB. Enquanto que para o acesso
BRA, a presença de 60 mg kg-1 de P junto as diferentes doses de Cu não afetou às
concentrações de Cu nos tecidos foliares, ficando em torno de 23,50 mg kg-1. Em
contrapartida, este último acesso respondeu quadraticamente às doses de Cu
associadas a 120 mg kg-1 de P, alcançando a sua máxima concentração (28,5 mg
kg-1) na dose de 40 mg kg-1 de Cu (Tabela 2).
O teor de Cu nas hastes do acesso BRA foi 9% maior em relação ao acesso
JB, na média de todos os tratamentos. O acesso BRA, nas doses de 80 mg kg -1 de
Cu associadas a 10 e 120 mg kg-1 de P, apresentaram teores de Cu na faixa de
24,15 e 23,55 mg kg-1, respectivamente. Na presença de 60 mg kg-1 de P, as doses
40 e 80 mg kg-1 de Cu, não diferiram no teor de Cu, sendo a média de concentração
de ambas as doses em torno de 20,6 mg kg-1.
No acesso JB, as maiores concentrações de Cu nas hastes foram observadas
na presença de 0 mg kg-1 de Cu e 60 mg kg-1 de P, cerca de 27,7 mg kg-1, com o
aumento do P (120 mg kg-1) e do Cu (80 mg kg-1) houve um aumento linear na
concentração de Cu neste tecido, atingindo 26,6 mg kg-1. Já na presença de 10 mg
kg-1 de P a maior concentração de Cu foi verificada na dose de 80 mg kg-1 de Cu
(20,9 mg kg-1) (Tabela 2).
37
Tabela 2. Concentração de Cu (mg kg-1) na parte aérea e raízes de Pfaffia
glomerata cultivadas em Argissolo Vermelho distrófico típico com aplicação de
diferentes doses de cobre e fósforo.
Doses de Cu mg kg
-1
Acesso JB – Folhas
Doses de P mg kg
-1
2
0
20
40
80
Regressão
R
10
18,00
21,00
35,00
29,95
Y=16,24+0,547x-0,004x²
0,79*
60
42,10
31,70
36,65
22,40
Y=40,79-0,21x
0,79*
120
31,85
26,60
31,80
29,70
Não significativo
Acesso JB – Haste
10
10,60
13,80
18,90
20,90
Y=10,22+0,26x-0,001x²
0,98*
60
27,70
18,00
15,40
16,80
Y=27,34+0,50x +0,004 x²
0,98*
120
12,65
12,20
22,05
26,60
Y=11,56+0,19x
0,89*
Acesso JB – Raiz
10
17,95
27,60
54,30
56,15
Y=15,14+1,15x-0,007x²
0,87*
60
50,20
29,65
37,95
29,50
Y=43,7-0,19x
0,49*
120
28,80
23,00
46,85
60,35
Y=23,78+0,45x
0,84*
0,54*
Acesso BRA – Folhas
10
20,35
17,20
28,70
27,65
Y=19,30+0,11x
60
24,50
22,25
25,00
22,40
Não significativo
120
18,50
17,25
28,25
24,20
Y=16,83-0,29x-0,002x²
0,55*
Acesso BRA – Haste
10
10,20
17,15
22,15
24,15
Y=16,78+0,09x
0,87*
60
15,75
18,00
21,50
19,70
Y=15,41+0,21x-0,002x²
0,93*
120
15,25
18,40
21,90
23,55
Y=16,18+0,10x
0,90*
Acesso BRA – Raiz
10
8,75
13,25
13,70
14,55
Não significativo
60
19,0
11,90
17,05
30,10
Y=18,07-0,29x+0,005x²
0,95*
120
7,80
10,00
21,80
40,50
Y=4,93+0,43x
0,97*
* Significativo a 5% de acordo com o teste F (P≤0,05),
A maior concentração de Cu nas raízes ocorreu no acesso JB, o qual foi 55%
maior em relação ao acesso BRA, na média de todos os tratamentos, As raízes do
acesso JB na presença de 80 mg kg-1 de Cu e 120 mg kg-1 de P atingiram uma
concentração de 60,35 mg kg-1 de Cu. Nestas mesmas condições, o acesso BRA
concentrou 33% menos de Cu nos tecidos. As diferentes doses de Cu, na presença
de 10 mg kg-1 de P, não provocaram alterações nas concentrações de Cu nas raízes
38
do acesso BRA. Por outro lado, as raízes das plantas do acesso JB cultivado nas
doses de 40 e 80 mg kg-1 de Cu na presença de 10 mg kg-1 de P apresentaram em
média 55,25 mg kg-1 de Cu nas raízes, valor este 58% maior do que encontrado nas
doses de 0 e 20 mg kg-1 de Cu. Além disso, ao considerarmos apenas a
concentração de Cu das raízes do acesso JB cultivado nas doses de 80 mg kg-1 de
Cu na presença de 10 mg kg-1 de P, em relação à concentração das raízes do
acesso BRA, nestas mesmas condições de cultivo, a concentração de Cu das raízes
deste último acesso foi 75% menor em relação às raízes do acesso JB. No entanto,
na presença de 60 mg kg-1 de P, as raízes das plantas do acesso JB apresentaram
teores de Cu em torno de 50,2 mg kg-1 na dose de 0 mg kg-1 de Cu, diferenciando-se
das demais doses de Cu, que proporcionaram concentrações de Cu nos tecidos na
faixa de 32,3 mg kg-1. O acesso BRA, neste mesmo nível de P, apresentou 30,1 mg
kg-1 de Cu nas raízes na dose de 80 mg kg-1 de Cu, valor este 47% maior se
comparado com a média das concentrações de Cu das demais doses (Tabela 2).
Em relação ao teor de fósforo nas folhas, a média do acesso JB foi 15% maior
em relação ao acesso BRA, considerando todos os tratamentos. O acesso JB em
todas as doses de Cu e na presença de 10 mg kg-1 de P não apresentou diferença
nas concentrações de Cu nos tecidos das folhas. Por outro lado o acesso BRA,
nestas condições apresentou maior concentração de P na dose 0 de mg kg-1 de Cu
(5,19 g kg-1). O maior teor de P nas folhas das plantas do acesso JB, na presença de
60 mg kg-1 de P, ocorreu na dose de 40 mg kg-1 de Cu, cerca de 9,33 g kg-1de P. Já
a menor concentração de P nestes tecidos ocorreu quando houve o aumento da
dose de Cu para 80 mg kg-1. Nesta mesma condição de P e independente das doses
de Cu, as folhas das plantas do acesso BRA não apresentaram diferenças nas
concentrações de P, em média 6,34 g kg-1. Com o aumento da dose de P de 60 mg
kg-1 para 120 mg kg-1 de P, as folhas de ambos os acessos responderam
diferentemente para o teor de P. Os teores de P no acesso JB mostrou-se maior na
dose de 40 mg kg-1 de Cu (10,2 g kg-1) na presença de 120 mg kg-1 de P e menor
nas doses de 0 e 80 mg kg-1 de Cu. Em contrapartida, as concentrações de P das
folhas do acesso BRA responderam linearmente, com o maior teor de P (9,64 g kg-1)
na menor dose de Cu e maior dose de P (120 mg kg-1) (Tabela 3).
39
Tabela 3. Concentração de P (g kg-1) na parte aérea e raízes de Pfaffia glomerata
cultivada em Argissolo Vermelho distrófico típico com aplicação de diferentes doses
de cobre e fósforo.
Doses de Cu mg kg
-1
Acesso JB – Folhas
Doses de P mg kg
-1
2
0
20
40
80
Regressão
R
10
1,81
1,86
2,05
2,11
Não significativo
60
9,13
7,97
9,33
6,81
Y=9,17-0,024x
0,86*
120
6,84
8,34
10,21
6,25
Y=6,59+0,16x -0,02x²
0,93*
Acesso JB – Haste
10
2,00
2,36
1,63
1,44
Não significativo
60
7,12
7,67
7,89
6,11
Y=7,09+0,04x + 0,0007 x²
120
8,15
6,86
7,70
7,62
Não significativo
0,99*
Acesso JB – Raiz
10
1,04
1,08
1,13
1,53
Y=0,98 + 0,006x
60
3,01
2,71
4,35
2,82
Não significativo
0,88*
120
3,43
3,48
2,68
2,85
Y=3,41+0,008x
0,79*
0,99*
Acesso BRA - Folhas
10
5,19
2,51
1,63
2,14
Y=5,10-0,14x+0,001x²
60
5,63
6,18
6,78
6,77
Não significativo
120
9,64
4,38
7,07
3,53
Y=8,23+0,05x
0,55*
Acesso BRA – Haste
10
1,46
1,95
1,50
1,50
Não significativo
60
5,01
4,00
4,53
4,26
Y=5,04-0,01x+0,00001x²
120
4,25
4,10
4,51
4,32
Não significativo
0,51
Y=0,75+0,002x
0,96*
Acesso BRA – Raiz
10
0,75
0,69
0,67
0,95*
2
60
2,24
1,72
1,85
1,88
Y=-2,18-0,019+0,0001x
120
1,67
1,52
1,68
1,85
Não significativo
0,70*
* Significativo a 5% de acordo com o teste F (P≤0,05).
As concentrações de P nos tecidos das hastes dos acessos JB e BRA não
variaram na presença de 10 mg kg-1 de P e com as diferentes doses de Cu, sendo
que em média variaram de 1,86 g kg-1 para o acesso JB a 1,60 g kg-1 para o acesso
BRA. Já na dose 120 mg kg-1 de P, que também não apresentou diferenças entre as
doses de Cu para a concentração de P no tecido, foi em média 43% maior no
40
acesso JB comparado ao acesso BRA (Tabela 3). No entanto, quando as doses de
Cu foram associadas a 60 mg kg-1 de P, ambos os acessos apresentaram respostas
quadráticas na concentração de P nas hastes (Tabela 3).
Quanto às concentrações de P nas raízes, o acesso JB concentrou em média
44% mais P do que o acesso BRA. O máximo teor de P encontrado nas raízes do
acesso JB, na presença de 10 mg kg-1 de P, foi observado na dose de 80 mg kg-1 de
Cu, cerca de 1,53 g kg-1 de P. Nesta mesma dose de P, as raízes do acesso BRA
responderam de forma linear, de modo que o aumento na concentração de Cu
reduziu a concentração de P na raízes. As doses de Cu no solo, na presença de 60
mg kg-1 de P para o acesso JB e 120 mg kg-1 de P para o acesso BRA, não
acarretaram diferenças nas concentrações de P nas raízes. No entanto, a menor
dose de Cu associada a 60 mg kg-1 de P proporcionou às raízes do acesso BRA um
incremento no teor de P em relação às demais doses de Cu. Já para o acesso JB,
na dose 120 mg kg-1 de P, houve um decréscimo na concentração desse elemento
nas raízes com o aumento na dose de Cu (Tabela 3).
3.1.3 Índice de translocação
O índice de translocação (IT) para Cu é apresentando na tabela 4. O IT mede
a capacidade da planta em translocar os metais das raízes para a parte aérea
(YOON et al., 2006; MELO et al., 2009).
Os índices de translocação de Cu no acesso BRA foram maiores do que no
acesso JB. A translocação de Cu tanto para as folhas como para as hastes do
acesso JB, na presença de 10, 60 e 120 mg kg-1 de P foram maiores nas doses de 0
mg kg-1 de Cu, enquanto que os menores índices de translocação foram encontrados
na dose de 80 mg kg-1 de Cu. Em relação à translocação de Cu para a parte aérea
no acesso BRA, as respostas foram similares às do acesso JB, sendo que as folhas
e hastes apresentaram a maior translocação de Cu na dose de 0 mg kg-1 de Cu e na
presença de 10 e 120 mg kg-1 de P. Já na presença de 60 mg kg-1 de P, os maiores
índices ocorreram tanto na dose de 0 mg kg-1 de Cu como na dose de 20 mg kg-1 de
Cu (em média 1,87). No entanto, com exceção da dose 10 mg kg -1 de P que
41
apresentou menor IT tanto para folhas como para as hastes na presença de 20 mg
kg-1 de Cu, nas duas outras doses de P, o menor IT, tanto para as folhas como para
as hastes, ocorreu na maior dose de Cu (80 mg kg-1).
Tabela 4. Índice de translocação de Cu para parte aérea de dois acessos de Pfaffia
glomerata (JB e BRA) cultivados em Argissolo Vermelho distrófico típico com
aplicação de diferentes doses de cobre e fósforo (mg kg-1).
Cu
0
20
40
80
0
20
40
80
0
20
40
80
Tratamentos
P
10
10
10
10
60
60
60
60
120
120
120
120
Acesso JB
IT- Folhas
IT- Hastes
1,05 ± 0,24
0,61 ± 0,13
0,76 ± 0,01
0,49 ± 0,05
0,69 ± 0,24
0,37 ± 0,11
0,53 ± 0,02
0,37 ± 0,03
1,07 ± 0,03
0,55 ± 0,01
0,83 ± 0,29
0,60 ± 0,07
0,98 ± 0,11
0,59 ± 0,13
0,78 ± 0,15
0,43 ± 0,14
1,97 ± 1,63
0,59 ± 0,30
1,16 ± 0,09
0,54 ± 0,17
0,67 ± 0,01
0,47 ± 0,04
0,50 ± 0,09
0,45 ± 0,12
Acesso BRA
IT- Folhas
IT- Hastes
2,32 ± 0,21
1,96 ± 0,11
1,29 ± 0,09
1,29 ± 0,04
2,08 ± 0,14
1,63 ± 0,33
1,88 ± 0,25
1,64 ± 0,10
1,86 ± 0,27
1,29 ± 0,78
1,88 ± 0,05
1,64 ± 0,53
1,48 ± 0,26
1,27 ± 0,13
0,77 ± 0,16
0,66 ± 0,08
2,37 ± 0,13
1,95 ± 0,34
1,75 ± 0,44
1,84 ± 0,03
1,29 ± 0,08
1,00 ± 0,05
0,65 ± 0,21
0,62 ± 0,16
3.1.4 Índice de acumulação nas raízes
O Índice de acumulação nas raízes (IAR) para o Cu é apresentado na tabela
5. O IAR mede o quanto do Cu que foi absorvido ficou acumulado nas raízes,
verificando-se que este índice variou com o acesso, onde os maiores índices foram
observados no acesso JB, em todos os tratamentos, variando de 1,6 a 2,8.
42
Tabela 5. Índice de acumulação nas raízes dois acessos de Pfaffia glomerata (JB e
BRA) cultivados em Argissolo Vermelho distrófico típico com aplicação de diferentes
doses de cobre e fósforo (mg kg-1).
Cu
0
20
40
80
0
20
40
80
0
20
40
80
Tratamentos
P
10
10
10
10
60
60
60
60
120
120
120
120
Acesso JB
Acesso BRA
2,21 ± 0,02
2,39 ± 0,09
2,38 ± 0,01
1,66 ± 0,11
2,22 ± 0,09
1,75 ± 0,10
1,91 ± 0,08
1,56 ± 0,11
2,84 ± 0,10
1,79 ± 0,11
1,68 ± 0,10
2,23 ± 0,09
0,09 ± 0,05
0,14 ± 0,01
0,09 ± 0,02
0,11 ± 0,02
0,18 ± 0,01
0,10 ± 0,03
0,12 ± 0,01
0,21 ± 0,02
0,09 ± 0,04
0,14 ± 0,01
0,17 ± 0,02
0,28 ± 0,02
3.1.5 Concentrações de nutrientes
As concentrações dos nutrientes nas plantas do acesso BRA foi mais afetada
pelo Cu do que o acesso JB (Tabela 6). A análise das correlações entre o Cu e os
nutrientes nas raízes do acesso JB foi positiva e forte (ρ acima de 0,70) para o Mn,
enquanto que para o Zn e o Fe se manteve moderada, com ρ = 0,44 e ρ = 0,68,
respectivamente. Nas hastes do acesso JB, os teores de Cu também se
correlacionaram positivamente com o Mn e com o K, os quais apresentaram
coeficientes de correlação de 0,59 e 0,48, respectivamente. No entanto, para as
folhas do acesso JB, a correlação apesar de positiva para Mn e Zn, apresentou-se
pequena ρ = 0,35 e ρ = 0,28, respectivamente (Tabela 6).
Para o acesso BRA, ocorreu correlação positiva forte com o Mn nas hastes, a
qual apresentou coeficiente de 0,72. Já nas raízes, ocorreram correlações
moderadas com o Ca, o Fe e o Mn, enquanto nas folhas estas correlações foram
observadas com o Zn e o P (Tabela 6). Para o Fe não houve correlação significativa
com o Cu nas folhas, no entanto as plantas de ambos os acessos apresentaram
43
deficiência induzida de Fe (Figura 3) (Apêndice – C). Para os demais nutrientes não
foi observado teores abaixo da faixa nutricional adequada, para ambos os acessos.
Tabela 6. Coeficiente de correlação de Pearson (ρ) entre Cu dosado nos tecidos
(folhas, hastes e raízes) e os nutrientes P, Ca, Mg, Fe, K, Mn e Zn, presentes nos
respectivos tecidos de dois acessos Pfaffia glomerata (JB e BRA) cultivados em
Argissolo Vermelho distrófico típico com aplicação de diferentes doses de cobre e
fósforo.
-1
Elementos
P
Ca
Mg
Fe
K
Mn
Zn
Doses de Cu (mg kg )
Folhas
NS
-0,18
NS
-0,06
NS
-0,02
NS
0,20
NS
0,18
0,35*
0,28*
Acesso JB
Haste
NS
-0,25
0,26*
0,26*
NS
-0,13
0,48*
0,59*
NS
0,20
Raiz
0,38*
0,28*
0,25*
0,68*
NS
0,20
0,84*
0,44*
Folhas
0,48*
0,32*
NS
- 0,03
NS
0,002
NS
0,082
0,33*
0,66*
Acesso BRA
Haste
0,26*
0,35*
0,26*
NS
0,09
0,49*
0,72*
NS
-0,16
Raiz
NS
0,01
0,58*
0,52*
NS
0,04
0,29*
0,53*
0,27*
Significativo ao nível de * P <0,05 nível
NS
Não significativo
3.1.6 Produção de β-ecdisona
Os acessos de P. glomerata diferiram entre si em relação à concentração de
β-ecdisona nas raízes, sendo que o acesso JB apresentou um maior teor desse
metabólito quando comparado ao acesso BRA. O maior teor de β-ecdisona nas
raízes do acesso JB ocorreu nas doses de 0 mg kg-1 de Cu e 10 mg kg-1 de P,
enquanto que nas plantas do acesso BRA a maior concentração foi encontrada no
tratamento com 40 mg kg-1 de Cu e 10 mg kg-1 de P. Houve uma diminuição
significativa no teor de β-ecdisona nas raízes das plantas do acesso JB nos
tratamentos que continham 120 mg kg-1 de P, enquanto que as plantas do acesso
BRA, apresentaram esta mesma diminuição significativa apenas na dose de 80 mg
kg-1 de Cu com 120 mg kg-1 de P (Tabela 7).
44
Tabela 7. Teor de β-ecdisona (µg g-1 de matéria seca) em raízes de dois acessos de
P. glomerata (JB e BRA) cultivada em Argissolo Vermelho distrófico típico com
aplicação de diferentes doses de cobre e fósforo.
Doses de Cu mg kg
-1
Acesso JB
Doses de P mg kg
10
60
120
10
60
120
-1
0
20
40
66 ± 0,18 Aa*
56 ± 0,95 Ba
46 ± 0,38 Cb
62 ± 4,51 Ab
63 ± 0,17 Ab
54 ± 0,13 Bb
60 ± 0,35 Ab
51 ± 0,63 Ca
51 ± 0,15 Ba
Acesso BRA
52 ± 3,45 Ab
51 ± 3,35 Aab
51 ± 1,32 Ab
50 ± 4,20 Ab
49 ± 0,22 Ab
47 ± 0,11 Ab
60 ± 0,40 Aa
59 ± 0,13 Aa
55 ± 3,45 Aa
80
52 ± 0,15 Ac
51 ± 0,45 Ab
46 ± 0,45 Bb
50 ± 2,65 ABb
56 ± 3,01 Aa
48 ± 0,56 Bb
* Médias seguidas de letras minúsculas na linha diferem significativamente entre as doses de Cu ao
nível 5% de probabilidade pelo teste F (P≤0,05). Médias seguidas de letras maiúsculas na coluna
diferem significativamente entre as doses de P ao nível 5% de probabilidade pelo teste F (P≤0,05).
Diferenças na massa seca das raízes de ambos os acessos de P. glomerata
influenciaram na quantidade total do princípio ativo. Os resultados obtidos em
relação ao conteúdo de β-ecdisona nas raízes demonstram que, para ambos os
acessos, a maior produção de β-ecdisona ocorreu na dose de 40 mg kg-1 de Cu e na
presença de 10 e 120 mg kg-1 de P. Já na presença de 60 mg kg-1 de P, o conteúdo
de β-ecdisona foi maior na dose de 80 mg kg-1 de Cu, para ambos os acessos
(tabela 8).
45
Tabela 8. Conteúdo de β-ecdisona (g raiz-1) em raízes de dois acessos de P.
glomerata (JB e BRA) cultivada em Argissolo Vermelho distrófico típico com
aplicação de diferentes doses de cobre e fósforo.
Doses de Cu mg kg
-1
Acesso JB
Doses de P mg kg
10
60
120
10
60
120
-1
0
0,29 ± 0,06 Ab*
0,24 ± 0,12 Ac
0,20 ± 0,04 Ab
0,11 ± 0,01 Ab
0,09 ± 0,06 Bab
0,10 ± 0,01 ABb
20
40
80
0,19 ± 0,11 Bab
0,32 ± 0,04 Aa
0,29 ± 0,06 Aab 0,31 ± 0,07 Aab
0,28 ± 0,05 Aab
0,29 ± 0,04 Aa
Acesso BRA
0,06 ± 0,05 Bc
0,38 ± 0,13 Aa
0,03 ± 0,02 Bc
0,11 ± 0,01 Ab
0,08 ± 0,02 Bc
0,09 ± 0,01 Bb
0,09 ± 0,01 Bc
0,11 ± 0,04 Aa
0,09 ± 0,02 Bb
0,14 ± 0,04 Aa
0,10 ± 0,03 Ba
0,11 ± 0,01 Ba
* Médias seguidas de letras minúsculas na linha diferem significativamente entre as doses de Cu ao
nível 5% de probabilidade pelo teste F (P≤0,05). Médias seguidas de letras maiúsculas na coluna
diferem significativamente entre as doses de P ao nível 5% de probabilidade pelo teste F (P≤0,05).
4 DISCUSSÃO
No presente estudo observou-se que a produção de matéria seca das plantas
variou entre os dois acessos, em função da quantidade de cobre e fósforo disponível
no solo. As plantas de ambos os acessos, JB e BRA, exposto aos tratamentos de Cu
e P no solo apresentaram aumento na produção de matéria seca de folhas, de
hastes e de raízes nas doses de 40 mg kg-1 de Cu e 10 mg kg-1 de P, enquanto que
quando expostas à dose mais elevada de Cu, junto à menor e maior dose de fósforo,
mostraram acentuada redução no crescimento da parte aérea e raízes, com o
aparecimento de necrose nas folhas (Figura 3). Apesar do Cu ser um elemento
essencial para o crescimento das plantas e ter funções importantes em muitos
processos fisiológicos, como a fotossíntese, a respiração, a distribuição de
carboidratos, a redução do N, e o metabolismo de proteínas (YRUELA, 2005), o
excesso desse nutriente pode se tornar tóxico para as plantas (MICHAUD et al.,
2007; MICHAUD et al., 2008; BRAVIN et al., 2010).
Entretanto, o aumento da
concentração da dose P para 60 mg kg-1 no solo, retardou visualmente o
aparecimento desses sintomas, indicando um possível efeito protetor do P sobre a
toxidez de Cu nas plantas, favorecendo seu desenvolvimento. O P aumenta a
46
adsorção do cobre no solo (SARIOGLU et al., 2005) diminuindo, assim, a
disponibilidade de cobre na solução do solo (LIU et al., 2007). Para Girotto et al.
(2010) a biodisponibilidade e a mobilidade de elementos químicos, como o cobre e o
fósforo, são dependentes da sua concentração na solução, da natureza da
associação com outras espécies iônicas solúveis e da habilidade do solo em
fornecê-los para a solução.
A interação entre P e Cu, nos solos onde foram
cultivadas as plantas de P. glomerata, pode ter diminuído a toxicidade de Cu, tal
como observado para Cd (NAIDU et al., 1994; BOLAN et al., 1999) e para o Cu
(PÉREZ-NOVO et al., 2009), em estudos sobre solos onde a adição de fosfato
aumentou a adsorção desses metais.
Após a adição de 120 mg kg-1 de P no solo, na menor concentração de Cu,
houve um aumento na quantidade de P disponível, o que promoveu incrementos na
produção de matéria seca para ambos os acessos, evidenciando uma resposta
positiva da aplicação desse nutriente no crescimento dessa espécie. Além disso, na
dose de 80 mg kg-1 de Cu e 120 mg kg-1 de P houve uma redução nos teores de P
na parte aérea das plantas, o qual manteve-se acima do limite estabelecido como
concentração ideal de 2,0 g kg-1 de P (0,2%) na matéria seca (NOVAIS et al., 2007).
Este comportamento pode estar relacionado com o efeito de concentração do
nutriente, uma vez que houve redução no crescimento das plantas com o aumento
das doses de Cu no solo. Em adição, o Cu interage com muitos nutrientes no solo
alterando sua disponibilidade na solução do solo, sendo com o fósforo uma das mais
importantes (ABREU et al., 2001). A interação do íon fosfato pode interferir na
solubilidade dos elementos metálicos, formando precipitados pouco solúveis e
diminuindo a concentração do íon em solução (CAMARGO et al., 2001).
A maior produção de matéria seca das raízes do acesso JB, em relação à
baixa aplicação de P está em concordância com as observações de SKREBSKY et
al. (2008), que verificaram que no baixo teor de fósforo no solo houve pouca redução
na biomassa radicular de P. glomerata. Esses autores sugerem que na baixa
disponibilidade de P, esta espécie redireciona a distribuição de fotoassimilados. Uma
das explicações para isto é que as raízes, estando mais próximas da fonte de
suprimento, usam do limitado influxo destes nutrientes para as próprias
necessidades de manutenção e crescimento (FERNANDES, 2007).
47
As concentrações de P encontradas nos tecidos das plantas do acesso JB,
quando comparadas ao acesso BRA foram significativamente maiores. Verificou-se,
de maneira geral, que o aumento das doses de Cu reduziu os teores de P na
matéria seca da parte aérea. Alguns autores (MA; RAO, 1997; CHEN et al., 1997;
CAO et al.; 2003) têm mostrado que a remediação de solos contaminados por
metais, através da adição de fosfatos é eficiente em função dos metais pesados
adquirirem formas químicas menos solúveis, e, como consequência uma menor
absorção de fósforo pelo sistema radicular. Os teores de P na parte aérea do acesso
JB, aumentaram de acordo com o aumento de P no solo, enquanto que os teores de
Cu na parte aérea diminuíram significativamente. Possivelmente o fósforo esteja
limitando a translocação de Cu das raízes para a parte aérea, pela formação de
compostos insolúveis capazes de reduzir o transporte do Cu (SOARES et al., 2006).
A maior concentração de Cu nas raízes em relação às folhas e às hastes no
acesso JB não resultaram num alto grau de toxicidade, ao contrário do que foi visto
por outros autores quando estudaram os efeitos de outros metais (CARNEIRO et al.,
2002; LIMA et al., 2006;. MISHRA et al., 2006). O suprimento adequado de P
possibilita também o aumento da retenção de metais pesados nas raízes das
plantas por meio da formação de compostos insolúveis, restringindo, assim, o
transporte desses elementos para a parte aérea (VAN STEVENINCK et al., 1994;
BROWN et al., 1995; SOARES et al., 2006).
A retenção de Cu nos tecidos das raízes pode ser devido à imobilização do
Cu na parede celular, exclusão ou restrição da absorção, compartimentalização no
vacúolo com complexos solúveis, formação de quelatos na interface parede celularmembrana e fitoquelatinas, que quelatam metais pesados nas células, evitando
danos intracelulares (MARSCHNER, 2011). Além disso, o maior teor de Cu nas
raízes do acesso JB pode estar relacionado com a baixa translocação do Cu das
raízes para parte aérea. Isto pode ser observado em resultados de muitos estudos
em que a concentração de Cu nas raízes é maior que na parte aérea (CHAIGNON e
Hinsiger, 2003; KOPITTKE; MENZIES, 2006; MICHAUD et al., 2007; MICHAUD et
al., 2008). A retenção de Cu nas raízes é um mecanismo de tolerância ao excesso
do metal, ocorrendo, por exemplo, a imobilização do metal na parede celular por
carboidratos extracelulares, e consequentemente, a reduzida presença de íons livres
para transporte até a parte aérea (LASAT, 2002).
48
As raízes do acesso JB atuaram como uma barreira natural ao excesso de Cu
reduzindo a transferência do metal para o restante da planta. Por outro lado, quando
esses índices de translocação apresentaram valores maiores que 1, há uma
indicação da elevada taxa de absorção do elemento e sua translocação e acúmulo
na parte aérea (BAKER; WHITING, 2002; MCGRATH; ZHAO, 2003). Os resultados
encontrados por meio do índice de translocação para o acesso BRA revelam que
este acesso tem uma elevada concentração de Cu na parte aérea, sugerindo a
existência de mecanismos específicos relacionados à absorção, transporte e
acúmulo, que permitem e facilitam a permanência de valores altos de Cu nos tecidos
foliares.
Os teores de Cu nas raízes do acesso BRA foram menores e foram
influenciadas pelo aumento das doses de Cu no solo, além disso, verificou-se uma
redução acentuada na produção de matéria seca das raízes, quando comparado ao
acesso JB. Este fato também foi visto em estudo com Arabidopsis thaliana a qual
mostrou uma evidente redução no peso de raízes sob altos níveis de Cu em solução
hidropônica (LEQUEUX et al., 2010).
Os resultados das correlações entre as concentrações dos nutrientes e do Cu
nos tecidos apresentaram correlações fracas, moderadas e fortes para os dois
acessos estudados. A correlação positiva nas raízes do acesso JB na absorção do
Ca e do P são relatadas na literatura por desempenhar um papel importante na
integridade das membranas celulares e um desequilíbrio destes nutrientes pode
afetar o processo de absorção, e, por conseguinte, a concentração destes
elementos nas raízes (KABATA-PENDIAS; PENDIAS, 2011). A absorção de Mg2+,
principalmente nas raízes do acesso BRA, as quais acumularam menos Cu, está de
acordo com os resultados obtidos no estudo de Chen et al. (2013) sobre o modelo
de ligante biótico onde a competição entre Mg2+ e Cu2+ sobre os sítios de ligação da
membrana plasmática (isto é, os ligantes bióticos) podem resultar na diminuição da
toxicidade do Cu e na acumulação nas raízes.
As interações entre o Cu-Mn na nutrição das plantas são relatadas na
literatura como sendo tanto sinérgica como antagonista (ADHIKARY; KARKI, 2006).
O Mn atua como cofator de várias enzimas tais como a superóxido-dismutase, Mncatalase, piruvato carboxilase e fosfoenolpiruvato carboxiquinase. A correlação
positiva entre o Cu e o Mn para os orgãos de ambos os acessos, sugerem um
49
possível papel do Mn como um agente antioxidante capaz de atuar na
desintoxicação de espécies reativas de oxigênio (TANAKA et al., 1995; YU et al.,
1998; YU; RENGEL, 1999).
A concentração de Zn na parte aérea no acesso BRA pode estar relacionada
com a maior translocação do Cu para as folhas. Soares et al. (2001) observaram em
Myroxylon peruiferum e Piptadenia gonoacantha que houve uma maior quantidade
de Zn e Cd nas folhas, quando cultivadas em solos contaminados por rejeitos de
indústria de zinco, sugerindo que a maior concentração presente na parte aérea
pode ser devido a eficientes mecanismos de translocação.
A correlação positiva entre o Cu e o Fe nos tecidos das raízes do acesso JB,
pode estar sendo desencadeada pela complexação do Fe com o P presente nas
raízes, deixando o mesmo numa forma indisponível para translocação raiz/parte
aérea (VAN STEVENINCK et al., 1994; BROWN., 1995). Jouvin et al. (2012)
relataram um aumento da concentração de Cu nas raízes das plantas de tomate
com um incremento de Fe, sem incremento na parte aérea, e a resposta oposta em
plantas de trigo em condições idênticas, que foram correlacionadas com a formação
dos fitosideróforos.
As concentrações de β-ecdisona encontradas nas raízes de P. glomerata
diferiram em relação aos acessos e aos tratamentos. Já o conteúdo de β-ecdisona
sofreu influência dos tratamentos e também da massa seca de raízes, variando
entre 0,03 a 0,38 g raiz-1 para o acesso JB e de 0,08 a 0,14 g raiz-1 para o acesso
BRA. Variações no teor de β-ecdisona são frequentemente observadas entre
diferentes acessos de P. glomerata (FIGUEIREDO et al., 2004), o que segundo
Magalhães (2000) e Figueiredo et al. (2004), são decorrentes, principalmente de
fatores genéticos. Estudos conduzidos com P. glomerata demonstraram variações
em relação ao conteúdo de β-ecdisona presente nas raízes da planta (0,15 a 0,75%)
e em amostras comerciais (0,3 a 0,5%) (MAGALHÃES, 2000; FIGUEIREDO et al.,
2004).
A presença de vários compostos ecdiesteróides conjugados em plantas, por
exemplo, fosfatos, sulfatos, acetatos e benzoatos podem ser essenciais para a
regulação da via biossintética nessas espécies (SAATOV et al., 1984; SAATOV et
al., 1987). Neste estudo, as concentrações de Cu não afetaram a produção de βecdisona. Quanto às doses de P, verificou-se diminuição na produção de β-
50
ecdisona. Os menores teores de ecdisterona foram detectados nas amostras
oriundas das doses de 120 mg kg-1 de P. Uma vez que as plantas produzem
principalmente ecdisteróides polifosforilados pode-se esperar que a biossíntese dos
ecdisteróides seja afetada negativamente apresentando baixos níveis destes
produtos, corroborando nossos resultados. Grebenok et al. (1994) observaram que a
formação de intermediários de ecdisona-P em espinafre inibiram a biossíntese dos
fitoesteróis e dos fitoecdisteróides. Estes conjugados de polifosfato parecem atuar
como um feedback negativo nos compostos regulatórios sobre a biossíntese
endógena dos ecdiesteróides.
Alternativamente, estes conjugados de fosfato em outras espécies podem ser
produtos essenciais para o transporte de ecdisteróides dentro da planta, ou como
um meio de evitar os mecanismos de desintoxicação causados por insetos
específicos que se alimentam destas espécies particulares (GREBENOK et al.,
1994; DEVARENNE et al., 1995). Além disso, a presença dos ecdiesteróides
fosfatos é aparentemente importante para o controle geral do fluxo de carbono para
a via dos ecdisteróides. Neste caso, os nossos resultados sugerem que os baixos
níveis de fósforo no solo resultaram numa adequada concentração de P nas raízes,
as quais foram importantes para regulação da biossíntese dos fitoesteróis e
fitoecdisteróides nestas plantas, resultando numa maior produção de β-ecdisona.
Estudos como estes são essênciais quando se trata de plantas de uso
medicinal, já que as mesmas podem vir acumular metais pesados, aumentando o
potencial desses elementos tóxicos na cadeia alimentar.
4 CONCLUSÕES
1. A máxima produção de massa seca de plantas ocorreu para ambos os
acessos (JB e BRA) de Pfaffia glomerata nas doses de 40 mg kg-1 de Cu e 10 mg kg1
de P.
2. O excesso de Cu (80 mg kg-1) reduziu o crescimento das plantas de ambos
os acessos, quando na presença das doses de 10 e 120 mg kg-1 de P.
51
3. A adição de 60 mg kg-1 de P exerceu efeito protetor na toxidez de Cu para
ambos os acessos de Pfaffia glomerata, favorecendo seu desenvolvimento.
4. Alta disponibilidade de P no solo aumentou a fitoxidez causada por excesso
de Cu em P. glomerata.
5. As concentrações de β-ecdisona detectadas nas raízes de P. glomerata do
acesso JB foram maiores quando comparadas ao acesso BRA. As doses de Cu
parecem não ter afetado o metabolismo secundário desta planta para a produção de
β-ecdisona. No entanto, a adição de P (120 mg kg-1) no solo reduziu o teor de βecdisona.
AGRADECIMENTOS
Os autores gostariam de agradecer a PIONEER, ao Conselho Nacional de
Desenvolvimento
Científico
e
Tecnológico
(CNPq),
a
Coordenação
e
Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e a Fundação de Amparo à
Pesquisa de Estado do Rio Grande do Sul (FAPERGS) pelo apoio financeiro.
Referências
ABREU, C. A.; FERREIRA, M. E.; BORKERT, J. C. Disponibilidade e avaliação de
elementos catiônicos: zinco e cobre. In: FERREIRA, M. E. et al. Micronutrientes e
elementos tóxicos na agricultura. Jaboticabal: CNPq/FAPESP/POTATOS, p. 125150, 2001.
ADHIKARY, B. H.; KARKI, K. B. Effect of potassium on potato tuber production in
acid soils of Malepatan, Pokhara. Nepal Agriculture Research Journal, v. 7, p. 4248, 2006.
ANDRIOLO, J. L. Sistema hidropônico fechado com subirrigação para produção
de minitubérculos de batata. In: SIMPÓSIO DE MELHORAMENTO GENÉTICO E
PREVISÃO DE EPIFITIAS EM BATATA, 2006. Anais. Santa Maria: UFSM, CCR,
Departamento de Fitotecnia, p. 26-40, 2006.
52
BAKER, A. J. M. et al. The possibility of in situ heavy metal decontamination of
polluted soils using crops of metal-accumulating plants. Resources, Conservation
and Recycling, v. 11, p. 41-49, 1994.
BAKER, A. J. M.; WHITING, S. N. In search of the Holy grail – a further step in
understanding metal hyperaccumulation. New Phytologist, v. 155, p. 1-7, 2002.
BAKRIM, A. et al. Ecdysteroids in spinach (Spinacia oleracea L.): biosynthesis,
transport and regulation of levels. Plant Physiol Biochem, v. 46, p. 844-854, 2008.
BOLAN, N. S. et al. The effects of anion sorption on sorption and leaching of
cadmium. Australian Journal of Soil Research, v. 37, p. 445-460, 1999.
BRAVIN, M. N. et al. Copper uptake kinetics in hydroponically-grown durum wheat
(Triticum turgidum durum L.) as compared with soil’s ability to supply copper. Plant
and Soil, v. 331, p. 91-104, 2010.
BROWN, S. L. et al. Zinc and cadmium uptake by hyperaccumulator Thlaspi
coerulescens grown in nutrient solution. Soil Science Society of America Journal,
v. 59, p. 125-133, 1995.
CALGAROTO, N.S. Efeitos fisiológicos do mercúrio em plantas de Pfaffia
glomerata (Spreng.) Pedersen. 2009. 108 f. Dissertação (Mestrado em Agronomia)
– Universidade Federal de Santa Maria, Santa Maria, 2009.
CAMARGO, O. A.; ALLEONI, L. R. F.; CASAGRANDE, J. C. Reações dos
micronutrientes e elementos tóxicos no solo. In: FERREIRA, M. E. et al.
Micronutrientes e elementos tóxicos na agricultura.
Jaboticabal:
CNPq/FAPESP/POTATOS, p. 89-117, 2001.
CAO, R.X. et al. Phosphate induced metal immobilization in a contaminated site.
Environmental Pollution, v. 122, p. 19-28, 2003.
CARNEIRO, M. A. C.; SIQUEIRA, J. O.; MOREIRA, F. M. S. Comportamento de
espécies herbáceas em misturas de solo com diferentes graus de contaminação
com metais pesados. Pesquisa Agropecuária Brasileira, v. 37, p. 1629-1638,
2002.
53
CHAIGNON, V.; HINSINGER, P. A biotest for evaluating copper bioavailability to
plants in a contaminated soil. Journal of Environmental Quality, v. 32, p. 824-833,
2003.
CHEN, B-C.; HO, P-C.; JUANG, K-W. Alleviation effects of magnesium on copper
toxicity and accumulation in grapevine roots evaluated with biotic ligand models.
Ecotoxicology, v. 22, p. 174-183, 2013.
CHEN, X. G. et al. Growth of a lettuce crop at low ambient nutrient concentrations: a
strategy designed to limit the potential for eutrophication. Journal of Plant Nutrition,
v. 20, p. 1403-17, 1997.
CROTEAU, R. et al. Natural products (secondary metabolites). In: BUCHANAM,
B.B.; GRUISSEM, W.; JONES, R. (Eds). Biochemistry and molecular biology of
plants. Rockville: Courier Companies, 2000, p. 1250-1318.
DANIEL, J. F. S. et al. Free radical scavenging activity of Pfaffia glomerata (Spreng.)
Pederson (Amaranthaceae). Indian Journal of Pharmacological, v. 37, n. 3, p. 74178, 2006.
DEVARENNE, T. P.; SEM-MICHAEL, B.; ADLER, J. H. Biosynthesis of ecdisteroid in
Zea mays. Phytochemistry, v. 40, p. 1125-1131, 1995.
DINAN, L. et al. Phytoecdysteroids: diversity, biosynthesis and distribution. In:
Smaggbe G (ed) Ecdysone: structures and functions, London, p. 3-10, 2009.
EMBRAPA- Empresa Brasileira de Pesquisa Agropecuária. Manual de métodos de
análise de solo, 2. ed., Rio de Janeiro, 1997.
ESTATCAMP. Portal Action. Disponível em: http://www.portalaction.com.br. Acesso
em: 10 nov. 2012.
FACCHINI, P. J. Alkaloid biosynthesis in plants: biochemistry, cell biology, molecular
regulation, and metabolic engineering applications. Annual Review of Plant
Physiology and Plant Molecular Biology, v. 52, p. 29-66, 2001.
FERNANDES, A. R. et al. Produção de matéria seca e eficiência nutricional para P,
Ca e Mg em leguminosas herbáceas. Acta Amazonica, v. 37, n. 2, p.169-76, 2007.
54
FERREIRA, D. F. Análise estatística por meio do sisvar para Windows versão
4.0. In: REUNIÃO BRASILEIRA DA SOCIEDADE INTERNACIONAL DE
BIOMETRIA, 45, São Carlos, 2000. Programas e Resumos. São Carlos,
Universidade Federal de São Carlos, 2000, p. 235.
FIGUEIREDO, L. S. et al. Comportamento de acessos de Pfaffia glomerata nas
condições de campos de Goytacazez – RJ. Revista Brasileira de Plantas
Medicinais, v. 7, n. 1, p. 67-72, 2004.
GIROTTO, et al. Formas de perdas de cobre e fósforo em água de escoamento
superficial e percolação em solo sob aplicações sucessivas de dejeto líquido de
suínos. Ciência Rural, v.40, n.9, p, 1948-1954, 2010.
GREBENOK, R. J. et al. Biosyntesis of ecdysone and ecdysone phosfhates in
spinach. Phytochemistry, v. 35, p. 1399-1408, 1994.
KABATA-PENDIAS, A. Trace elements in soils and plants. 4rd ed. Boca Raton:
CRC Press, 2011.534 p.
KHAN, I. A. et al. Determination of heavy metals and pesticides in ginseng products.
Journal of AOAC International, v. 84, p. 936-939, 2001.
KLEIN, R. Phytoecdysteroids. Journal of the American herbalist Guild, v.7, p. 1020, 2004.
KOPITTKE, P. M.; MENZIES, N. W. Effect of Cu toxicity on growth of cowpea (Vigna
unguiculata). Plant and Soil, v. 279, p. 287–296, 2006.
JOUVIN, D. et al. Stable isotopes of Cu and Zn in higher plants: evidence for Cu
reduction at the root surface and two conceptual models for isotopic fractionation.
Environmental Science and Technology, v. 46, p. 2652-2660, 2012.
LAFONT, R.; DINAN, L. Practical uses for ecdysteroids in mammals including
humans: an update. Journal of Insect Science, p. 3-7, 2003.
LAFONT, R.; HORN, D. H. S. Ecdysone from chemistry to mode of action
(Koolman, J., ed.), Thieme Medical Publishers, New York, p. 34, 1989.
55
LASAT, M. M. Phytoextraction of toxic metals: a review of biological mechanisms. J.
Journal of Environmental Quality, v. 31, p. 109-120, 2002.
LEQUEUX, H. et al. Response to copper excess in Arabidopsis thaliana: Impact on
the root system architecture, hormone distribution, lignin accumulation and mineral
profile. Plant Physiol. Biochem. v. 48, p. 673-82, 2010.
LIMA, A. I. G. et al. Cadmium detoxification in roots of Pisum sativum seedlings:
relationship between toxicity levels, thiol pool alterations and growth. Environmental
and Experimental Botany, v. 55, p. 149-162, 2006.
LIU, J.; DUAN, C.Q.; ZHU, Y. N. Effect of chemical fertilizers on the fractionation of
Cu, Cr and Ni in contaminated soil. Environmental Geology. n. 52, p. 1601-1606,
2007.
MA, L. Q.; RAO, G. N. Chemical fractionation of cadmium, copper, nickel and zinc in
contaminated soils. Journal of Environmental Quality, v. 26, p. 259-264, 1997.
MAGALHÃES, P. M. de. Agrotecnologia para el cultivo de fáffia o ginseng brasileiro.
In: MARTINEZ, J. V. et al. Fundamentos de agrotecnologia de cultivo de plantas
medicinales iberoamericanas. Santafé de Bogotá: Convênio Andrés Bello/CYTED,
2000. p. 323-332.
MALDANER, R.; 2008. 94 f. Toxidez de alumínio em genótipos de Pfaffia
glomerata (Spreng.) Pedersen e Pfaffia tuberosa (Spreng.) Hicken. Dissertação
(Mestrado em Agronomia) – Universidade Federal de Santa Maria, Santa Maria,
2008.
MARCHESE, J.A. Produção e detecção de artemisinina em plantas de Artemisia
annua L. submetidas a estresses abióticos. 1999, 97 p. (Dissertação de mestrado
em Ciências Biológicas). Instituto de Biologia, UNICAMP, Campinas-SP, 1999.
MARSCHNER, H. Mineral Nutrition of Higher Plants, 3. ed., Academic Press,
London, 2011. 672p.
MCGRATH, S. P.; ZHAO, F. J. Phytoextraction of metals and metalloids from
contaminated soils. Current Opinion in Biotechnology, v. 14, p. 277-282, 2003.
56
MELO, E. E. C. et al. Accumulation of arsenic and nutrients by castor bean plants
gown on an As-enriched nutrient solution. Journal of Hazardous Materials, v. 168,
p. 479-483, 2009.
MEMELINK, J.; VERPOORTE, R.; KIJNE, J. W. Organization of jasmonateresponsive gene expression in alkaloid metabolism. Trends in Plant Science, v. 6,
n. 5, p. 212-218, 2001.
MICHAUD, A. M. et al. Copper uptake and phytotoxicity as assessed in situ for
durum wheat (Triticum turgidum durum L.) cultivated in Cu contaminated, former
vineyard soils. Plant and Soil, v. 298, p.99-111, 2007.
MICHAUD, A. M.; CHAPPELLAZ, C.; HINSINGER, P. Copper phytotoxicity affects
root elongation and iron nutrition in durum wheat (Triticum turgidum durum L.). Plant
and Soil, v. 310, p. 151-165, 2008.
MISHRA, S. et al. Phytochelatin synthesis and response of antioxidants during
cadmium stress in Bacopa monnieri L. Plant Physiology and Biochemistry, v. 44,
p. 25-37, 2006.
MURASHIGE, T.; SKOOG, F. A revised medium for rapid growth and bioassays with
tobacco tissue cultures. Plant Physiology, v. 15, p. 473-97, 1962.
MURPHY, J.; RILEY, J. P. A modified single solution method for the determination of
phosphate in natural waters. Analytica Chimica Acta, v. 27, p. 31-36, 1962.
NAIDU, R. et al. :Ionic-strength and pH effects on the adsorption of cadmium and the
surface charge of soils. European Journal Soil Sciences. v. 45, p. 419-429, 1994.
NASCIMENTO, E. X. et al. Produção de biomassa de Pfaffia glomerata (Spreng.)
Pedersen e Plantago major L. em cultivo solteiro e consorciado. Ciência e
Agrotecnologia, v. 31, n. 3, p. 724-30, 2007.
NOVAIS, R. F.; SMYTH, T. J.; NUNES, F. N. Fósforo. In: NOVAIS, R. F. et al. (Eds.)
Fertilidade do Solo. Viçosa: Sociedade Brasileira de Ciência de Solo p. 471-550,
2007.
PÉREZ-NOVO, C. et al. The effect of phosphate on the sorption of copper by acid
soils. Geoderma, v. 150, p. 166–170, 2009.
57
RIBANI, M. et al. Validação em métodos cromatográficos e eletroforéticos. Química
Nova, v. 27, p. 771-780, 2004.
SAATOV, Z.; ABDULLAEV, N. D.; GOROVITS, M. B. Phytoecdysteroids of plants of
the genusSilene. VI. α-Ecdysone 22-sulfate — A new ecdysteroid from Silene
brahuica, Chemistry of Natural Compounds, v. 20, p. 441-444, 1984.
SAATOV, Z.; GOROVITS, M. B.; ABUBAKIROV, N. K. Phytoecdysteroids of plants of
the Genus silene. XV. 2-Deoxy-α-ecdysone 22-O-benzoate from Silene wallichiana,
Chemistry of Natural Compounds, v. 23, p. 708-711, 1987.
SARIOGLU, M.; ATAY, Ü. A.; CEBECI, Y. Removal of copper from aqueous
solutions by phosphate rock. Desalisation, v. 181, p. 303-311, 2005.
SCHENKEL, E. P.; GOSMANN, G.; PETROVICK, P. R. Produtos de origem vegetal
e o desenvolvimento de medicamentos. In: SIMÕES, M. O. et al. Farmacognosia:
da planta ao medicamento. 4. ed. Porto Alegre/Florianópolis: Ed. UFRGS/UFSC, p.
301-330, 2002.
SCHÜTZEN-DÜBEL, A.; POLLE, A. Plant responses to abiotic stresses: heavy metal
induced oxidative stress and protection by mycorrhization. Journal of Experimental
Botany, v. 53, n. 372, p. 1365, 2002.
SIANI, A. C. Desenvolvimento tecnológico de fitoterápicos: plataforma
metodológica. Rio de Janeiro: Scriptorio, 2003.
SILVA JÚNIOR, A.; OSAIDA, C. C. Ginseng-brasileiro - novo estímulo para o campo
e para o corpo. Agropecuária Catarinense, v.18, n.2, p.41-4, 2005.
SKREBSKY, E. C. et al. Caracterização das exigências nutricionais de mudas de
Pfaffia glomerata em Argissolo Vermelho distrófico arênico pela técnica do nutriente
faltante. Ciência Rural, v. 38, n. 4, p. 989-996. 2008.
SOARES, C. F. S. et al. Acúmulo e distribuição de metais pesados nas raízes, caule
e folhas de mudas de árvores em solo contaminado por rejeitos de indústria de
zinco. Revista Brasileira de Fisiologia Vegetal, v. 13, n. 3, p. 302-315, 2001.
SOARES, C.F.S. et al. Micorriza arbuscular e nutrição fosfática na toxidez de zinco
para Trema [Trema micrantha (L.) Blum.] Revista Brasileira de Ciência do Solo, v.
30, p. 665-675, 2006.
58
TAIZ, L.; ZEIGER, E. Fisiologia Vegetal. 5. ed. Porto Alegre:Artmed, , 2012. 690p.
TANAKA, K.; TAKIO, S.; SATOH, T. Inactivation of the cystolic Cu/Zn superoxide
dismutase induced by copper deficiency in suspension cultured cells of Marchantia
paleacer var. diptera. Journal of Plant Physiology. v. 146, p. 361-365, 1995.
TEDESCO, M. J. et al. Análises de solo, planta e outros materiais. (Soil, plants
and other materials analysis). Porto Alegre, Universidade Federal de Porto Alegre.
1995.
VAN STEVENINCK, R. F. M. et al. The binding of zinc, but not cadmium, by phytic
acid in roots of crop plants. Plant Soil, v. 167, p. 157-164, 1994.
VIEGAS JÚNIOR, C.; BOLZANI, V. da S.; BARREIRO, E. J. Os produtos naturais e a
química medicinal moderna. Química Nova, v. 29, n. 2, p. 326-337, 2006.
VIGO, C. L. S. et al. Caracterização farmacognóstica comparativa de Pfaffia
glomerata (Spreng.) Pedersen e Hebanthe paniculata Martius – Amaranthaceae.
Revista Brasileira de Plantas Medicinais, v. 6, n. 2, p. 7-19, 2004a.
VIGO, C. L. S.; NARITA, E.; MARQUES, L. C. Validação da metodologia de
quantificação espectrofotométrica das saponinas de Pfaffia glomerata (Spreng.)
Pedersen – Amaranthaceae. Revista Brasileira de Farmacognosia, v. 13, n. 2, p.
46-49, 2003.
YOON, J.; CAO, X.; ZHOU, Q.; MA, L. Q. Accumulation of Pb, Cu, and Zn in native
plants growing on a contaminated Florida site. Science of the Total Environment,
v. 368, p. 456-464, 2006.
YRUELA, I. Copper in plants. Brazilian Journal of Plant Physiology, v. 17, n. 2, p.
145-156, 2005.
YU, Q.; OSBORNE, L. D.; RENGEL, Z. Micronutrient deficiency influences plant
growth and activities of superoxide dismutase and ascorbate peroxidase in tobacco
plants. Journal of Plant Nutrition, v. 21, p, 1427-1437, 1998.
YU, Q.; RENGEL, Z. Micronutrient deficiency influences plant growth and activities of
superoxide dismutase and ascorbate peroxidase in narrow leaf lupines. Annals of
Botany, v. 183, p. 175-182, 1999.
59
ZIMMER, A. R. et al. HPLC method for the determination of ecdysterone in extractive
solution from Pfaffia glomerata. Journal of Pharmaceutical and Biomedical
Analysis, v. 40, p. 450-453, 2006.
REFERÊNCIAS BIBLIOGRÁFICAS – INTRODUÇÃO
BAKER, A. J. M. et al. The possibility of in situ heavy metal decontamination of
polluted soils using crops of metal-accumulating plants. Resources, Conservation
and Recycling, v. 11, p. 41-49, 1994.
BROWN, S. L. et al. Zinc and cadmium uptake by hyperccumulator Thlaspi
coerulescens grown in nutrient solution. Soil Science Society of America Journal,
v. 59, p. 125-133, 1995.
BURKHEAD, J. L. et al. Tansley review Copper homeostasis, New Phytologist, v.
182, p. 799-816, 2009.
CAO, R. X. et al. Phosphate induced metal immobilization in a contaminated site,
Environmental Pollution, v. 122, p. 19-28, 2003.
CHAOUI, A. et al. Cadmium and zinc induction of lipid peroxidation and effects on
antioxidant enzyme activities in bean (Phaseolus vulgaris L.). Plant Science, v. 127,
p. 139-147, 1997.
COTTER-HOWELLS, J.; CAPORN, S. Remediation of contaminated land by
formation of heavy metal phosphates. Applied Geochemistry, v. 11, p. 335-342,
1996.
CROTEAU, R. et al. Natural products (secondary metabolites). In: BUCHANAM,
B.B.; GRUISSEM, W.; JONES, R. (Eds). Biochemistry and molecular biology of
plants. Rockville: Courier Companies, 2000, p. 1250-1318.
DEVARENNE, T. P.; SEM-MICHAEL, B.; ADLER, J. H. Biosynthesis of ecdisteroid in
Zea mays. Phytochemistry, v. 40, p. 1125-1131, 1995.
DINAN, L. Phytoecdysteroids: biological aspects. Phytochemistry, v. 57, p. 325339, 2001.
60
DINAN, L. et al. Phytoecdysteroids: diversity, biosynthesis and distribution. In:
Smaggbe G (ed) Ecdysone: structures and functions. Springer, London p. 3-10,
2009.
DRĄŻKIEWICZ, M.; SKÓRZYŃSKA-POLIT, E.; KRUPA, Z. The redox state and
activity of superoxide dismutase classes in Arabidopsis thaliana under cadmium or
copper stress. Chemosphere, v. 67, p. 188-193, 2007.
FACCHINI, P. J. Alkaloid biosynthesis in plants: biochemistry, cell biology, molecular
regulation, and metabolic engineering applications. Annual Review of Plant
Physiology and Plant Molecular Biology, v. 52, p. 29-66, 2001.
FIGUEIREDO, L. S. et al. Comportamento de acessos de Pfaffia glomerata nas
condições de campos de Goytacazez – RJ. Revista Brasileira de Plantas
Medicinais, v. 7, n. 1, p. 67-72, 2004.
FREITAS, C. S. et al. Involvement of nitric oxide in the gastroprotective effects of
aqueous extract of Pfaffia glomerata (Spreng.) Pedersen, Amaranthaceae, in rats.
Life Sciences, v. 74, p. 1167-1179, 2004.
GIL, E. S. et al. Controle físico químico de qualidade de medicamentos. 1. Ed.
Campo Grande: UNIDERP, 438 p, 2005.
GREBENOK, R. J. et al. Biosyntesis of ecdysone and ecdysone phosfhates in
spinach. Phytochemistry, v. 35, p. 1399-1408, 1994.
GUERRA, M. P.; NODARI, R. O. Biodiversidade: aspectos biológicos, geográficos,
legais e éticos. In: SIMÕES, M. O. et al. Farmacognosia: da planta ao
medicamento. 4.ed. Porto Alegre/Florianópolis: Ed. UFRGS/UFSC, p. 13-26, 2002.
HETTIARACHCHI, G. M.; PIERZYNSKI, G. M.; RANSOM, M. D. In situ stabilization
of soil lead using phosphorous and manganese oxide. Environ. Sci. Technol. v. 34,
p. 4614-4619, 2000.
KHAN, I. A. et al. Determination of heavy metals and pesticides in ginseng products.
Journal of AOAC International, v. 84, p. 936-939, 2001.
KLEIN, R. Phytoecdysteroids. Journal of the American Herbalist Guild, v.7, p. 1020, 2004.
61
LAFONT, R.; HORN, D. H. S. Ecdysonefiom chemistry to mode of action (Koolman,
J., ed.), Thieme Medical Publishers, New York, p. 34, 1989.
LAPERCHE, V. et al. Effect of apatite amendments on plant uptake of lead from
contaminated soil. Environ. Sci. Technol. v. 31, p. 2745-2753, 1997.
LEE, Y. J.; GEORGE, E. Contribution of mycorrhizal hyphae to the uptake of metal
cations by cucumber plants at two levels of phosphorus supply. Plant Soil, v. 278,
361-370, 2005.
LOLKEMA, P. C.; VOOIJS. P. Copper tolerance in Silene cucubalus: subcellular
distribution of copper and its effects on chloroplasts and plastocyanin synthesis.
Planta, v. 167, p. 30-36, 1986.
MA, Q. Y. et al. Effects of aqueous Al, Cd, Cu, Fe(II), Ni, and Zn on Pb immobilization
by hydroxyapatite. Environmental Science and Technology, v. 28, p. 1219-1228,
1994.
MAGALHÃES, P. M. de. Agrotecnologia para el cultivo de fáfia o ginseng brasileiro.
In: MARTINEZ, J. V. et al. Fundamentos de agrotecnologia de cultivo de plantas
medicinales iberoamericanas. Santafé de Bogotá: Convênio Andrés Bello/CYTED,
2000. p. 323-332.
MARCHESE, J. A. Produção e detecção de artemisinina em plantas de
Artemisia annua L. submetidas a estresses abióticos. 1999, 97 p. (Dissertação
de mestrado em Ciências Biológicas). Instituto de Biologia, UNICAMP, CampinasSP, 1999.
MARSCHNER, H. Mineral Nutrition of Higher Plants, 3. ed., Academic Press,
London, 2011. 672p.
MENCH, M.; BES, C. Assessment of ecotoxicity of top soils from a wood treatment
site. Pedosphere, v. 19, p. 143-155, 2009.
MENCH, M.; MOREL, J. L.; GUCKERT, A. Action des métaux [Cd, Cu, Pb, Zn] sur la
production d'exsudats racinaires solubles chez le maïs (Zea mays L.). Agronomie, v.
8, p. 237–241, 1987.
62
MEMELINK, J.; VERPOORTE, R.; KIJNE, J. W. Organization of jasmonateresponsive gene expression in alkaloid metabolism. Trends in Plant Science, v. 6,
n. 5, p. 212-218, 2001.
MOCQUOT, B. et al. Copper toxicity in young maize (Zea mays L.) plants: Effects on
growth, mineral and chlorophyll contents, and enzyme activities. Plant and Soil, v.
182, p. 287-300, 1996.
MONTANARI, J. I.; MAGALHÃES, P. M.; QUEIROGA, C. L. Influence of plantation
density and cultivation cycle in root productivity and tenors of beta ecdisone in Pfaffia
glomerata (Spreng.) Pedersen. Acta Horticulturae, v. 3, n. 502, p. 125-129, 1999.
NINAGI, O.; MARUYAHAMA, M. Utilization of 20-hidroxyecdysone extracted from a
plant in sericulture. Japan Agricultural Research Quarterly, v. 30, p. 123-128,
1996.
NETO, A. G. et al. Evaluation of the trypanocidal and leishmanicidal in vitro activity of
the crude hydroalcoholic extract of Pfaffia glomerata (Amaranthaceae) roots.
Phytomedicine, v. 11, p. 662-665, 2004.
OKSMAN-CALDENTEY, K.; INZÉ, D. Plant cell factories in the post-genomic era:
new ways to produce designer secondary metabolites. Trends in Plant Science, v.
9, n. 9, p. 433-440, 2004.
OLIVEIRA, F. Pfaffia paniculata (Martius) Kuntze: o ginseng brasileiro. Revista
Brasileira de Farmacognosia, v. 1, p. 86-92, 1986.
QUARTACCI, M. F. et al. Growth in excess copper induces changes in the lipid
composition and fluidity of PSII-enriched membranes in wheat. Physiologia
Plantarum, v. 108, p. 87-93, 2000.
RATES, S. M. K.; GOSMANN, G. Gênero Pfaffia: aspectos químicos, farmacológicos
e implicações para o seu emprego terapêutico. Revista Brasileira de
Farmacognosia, v. 12, n. 2, p. 85-93, 2002.
SARASAN, V. et al. Applications of phytochemical and in vitro techniques for
reducing overharvesting of medicinal and pesticidal plants and generation income for
the rural poor. Plant Cell Reports, v. 30, p. 1163-1172, 2011.
63
SAVCHENKO, T. et al. Distribution and identity of phytoecdysteroids in Gomphrena
ssp. (Amaranthaceae). Biochemical Systematics and Ecology, v. 26, p. 337-346,
1998.
SCHENKEL, E. P.; GOSMANN, G.; PETROVICK, P. R. Produtos de origem vegetal
e o desenvolvimento de medicamentos. In: SIMÕES, M. O. et al. Farmacognosia:
da planta ao medicamento. 4. ed. Porto Alegre/Florianópolis: Ed. UFRGS/UFSC, p.
301-330, 2002.
SHIOBARA, Y. et al. A nortriterpenoid, triterpenoid and ecdysteroids from Pfaffia
glomerata. Phytochemistry, v. 32, n. 6, p. 1527-1530, 1993.
SHIOBARA, Y.; INOUE, S.; KATO, K. Pfaffane-type nortriterpenoids from Pfaffia
pulverulenta. Phytochemistry, v. 31, p. 1737-1740, 1992.
SCHÜTZEN-DÜBEL, A.; POLLE, A. Plant responses to abiotic stresses: heavy metal
induced oxidative stress and protection by mycorrhization. Journal of Experimental
Botany, v. 53, n. 372, p. 1365, 2002.
SIANI, A. C. Desenvolvimento tecnológico de fitoterápicos: plataforma
metodológica. Rio de Janeiro: Scriptorio, 2003.
SILVA JÚNIOR, A.; OSAIDA, C. C. Ginseng-brasileiro - novo estímulo para o campo
e para o corpo. Agropecuária Catarinense, v.18, n.2, p.41-4, 2005.
SIMÕES, C. M. O. et al. Farmacognosia: da planta ao medicamento.
Florianópolis: UFRGS/UFSC, 2002. 833 p.
TAIZ, L.; ZEIGER, E. Fisiologia Vegetal. 5. ed. Porto Alegre:Artmed, , 2012. 690p.
VIEGAS JÚNIOR, C.; BOLZANI, V. da S.; BARREIRO, E. J. Os produtos naturais e a
química medicinal moderna. Química Nova, v. 29, n. 2, p. 326-337, 2006.
VIGO, C. L. S. et al. Caracterização farmacognóstica comparativa de Pfaffia
glomerata (Spreng.) Pedersen e Hebanthe paniculata Martius – Amaranthaceae.
Revista Brasileira de Plantas Medicinais, v. 6, n. 2, p. 7-19, 2004a.
VIGO, C. L. S.; NARITA, E.; MARQUES, L. C. Influências da variação sazonal e
tipos de secagem nas características da droga vegetal – raízes de Pfaffia glomerata
64
(Spreng.) Pedersen (Amaranthaceae). Revista Brasileira de Farmacognosia, v.
14, n. 2, p. 137-144, 2004b.
VIGO, C. L. S.; NARITA, E.; MARQUES, L. C. Validação da metodologia de
quantificação espectrofotométrica das saponinas de Pfaffia glomerata (Spreng.)
Pedersen – Amaranthaceae. Revista Brasileira de Farmacognosia, v. 13, n. 2, p.
46-49, 2003.
YRUELA, I. Copper in plants. Brazilian Journal of Plant Physiology, v. 17, n. 2, p.
145-156, 2005.
ZHANG, H.; ZHANG. et al. Excess copper induces production of hydrogen peroxide
in the leaves of Elsholtzia haichowensis through apoplastic and symplastic Cu Znsuperoxide dismutase. Journal of Hazardous Materials, v.178, p. 834-843, 2010.
ZIMMER, A. R. et al. HPLC method for the determination of ecdysterone in extractive
solution from Pfaffia glomerata. Journal of Pharmaceutical and Biomedical
Analysis, v. 40, p. 450-453, 2006.
65
APÊNDICE-A Curva analítica do padrão de β-ecdisona
3500000
y = 37.447x - 770.501
R² = 0,9906
Área do pico (mAU)
3000000
2500000
2000000
1500000
1000000
500000
0
0
20
40
60
80
Concentração de β-ecdisona (µg mL)
100
120
66
APÊNDICE-B Propriedades químicas e físicas do solo Argissolo Vermelho
distrófico típico ao final do experimento.
Acesso JB
Cu (mg kg-1) - P (mg kg-1)
Parâmetros
Cu (mg kg-1)
-1
P (mg kg )
0-10
20-10
40-10 80-10 0-60
20-60
40-60
80-60
0-120 20-120
40-120
80-120
3,2
15,2
32,9
69,5
4,5
16,7
32,7
58,6
15,3
15,8
30,8
71,6
5,1
6,0
7,1
7,4
30,8
32,8
33,3
34,5
71,2
82,4
67,6
82,0
-1
2,1
2,2
2,3
2,9
2,7
2,2
2,0
2,7
1,9
2,1
2,3
2,2
-1
Mg (cmolc kg )
1,1
1,0
1,3
1,3
1,1
1,1
1,1
1,1
1,1
1,7
1,1
1,3
Al
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
K (mg kg-1)
38,2
38,6
41,8
43,4
34,0
32,0
36,2
33,2
32,8
40,6
15,2
34,0
% MO
1,5
1,4
1,3
1,3
1,6
1,4
1,5
1,3
1,5
1,4
1,4
1,4
pH
5,7
5,5
5,6
5,7
5,5
5,5
5,6
5,6
5,7
5,7
5,6
5,7
Ca (cmolc kg )
Acesso BRA
Cu (mg kg-1)
-1
P (mg kg )
3,2
14,3
33,0
68,4
4,2
15,2
34,7
66,4
5,2
15,3
34,7
74,3
5,5
10,8
5,8
6,1
30,8
31,7
35,3
32,4
72,6
84,0
75,3
80,2
-1
2,4
2,8
3,0
2,6
2,8
3,2
2,5
2,8
3,2
3,1
2,8
2,8
-1
Mg (cmolc kg )
0,9
1,0
1,0
1,1
0,9
1,0
1,0
1,0
1,1
1,7
1,0
1,0
Al
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
K (mg kg )
34,4
39,2
38,6
40,6
41,6
45,6
34,2
42,2
32,8
34,6
33,2
34,2
% MO
1,4
1,4
1,5
1,4
1,4
1,3
1,5
1,2
1,5
1,4
1,5
1,5
pH
5,6
5,7
5,6
5,6
5,6
5,5
5,5
5,5
5,5
5,6
5,7
5,6
Ca (cmolc kg )
-1
67
APÊNDICE-C Concentração de Fe (mg kg-1) na parte aérea e raízes de Pfaffia
glomerata cultivada em Argissolo Vermelho distrófico típico com aplicação de
diferentes doses de cobre e fósforo.
Doses de Cu mg kg
-1
Acesso JB – Raiz
Doses de P mg kg
-1
0
20
40
80
10
2200 Aa
1650 Ba
1930 Bb
780 Ca
60
1700 Ab
1580 Aa
1420 Aa
1040 Aa
120
710 Ac
970 Ab
1006 Ab
970 Ba
Acesso JB – Haste
10
40 Aa
30 Ab
40 Aa
50 Aa
60
40 Ba
70 Aa
30 Ba
30 Ba
120
40 Aa
30 Ab
40 Aa
60 Aa
Acesso JB – Folhas
10
230 Aa
170 Ba
160 Bb
24,5 Cb
60
160 Bb
200 Ba
250 Aa
190 Ba
120
190 Ab
190 Aa
110 Bb
10,6 Cb
Acesso BRA – Raiz
10
620 Aa
360 Ba
350 Ba
190 Bc
60
420 Ab
380 Aa
440 Ab
590 Ab
120
300 Cb
530 Ba
500 Bb
880 Aa
Acesso BRA – Haste
10
14,55 Aa
15,95 Aa
14,20 Aa
9,05 Bb
60
12,84 Ba
17,35 Ba
16,05 Ba
21,20 Aa
120
15,60 Aa
12,00 Aa
17,10 Aa
12,55 Ab
Acesso BRA – Folhas
10
190 Aa
150 Ab
145 Aa
60
190 Ba
520 Aa
260 Ba
120
220 Aa
290 Ab
190 Aa
38,5 Bb
390 Ba
40,7 Bb
* Médias seguidas de letras minúsculas na linha diferem significativamente entre as doses de Cu ao
nível 5% de probabilidade pelo teste F (P≤0,05). Médias seguidas de letras maiúsculas na coluna
diferem significativamente entre as doses de P ao nível 5% de probabilidade pelo teste F (P≤0,05).