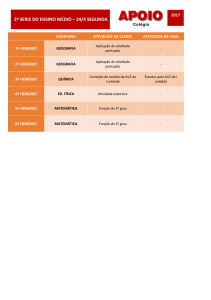
A maioria das enzimas são de natureza proteica e,
relativamente aos outros catalisadores,
têm uma grande especificidade em relação aos substratos e produtos da reacção.
A Comissão de Enzimas da União Internacional de Bioquímica definiu critérios para a
classificação e denominação das enzimas;
os critérios são de tipo funcional: duas enzimas com estruturas diferentes que catalisam
a mesma reacção (isozimas ou isoenzimas) têm o mesmo nome.
1- A palavra “enzima” (do Grego: en, na + zima, levedura) foi inventada em 1878 por Fredrich Kühne.
1- A cada enzima foi atribuído um “número EC” (de Enzyme Comission)
que contém 4 números separados por pontos (EC W.X.Y.Z).
Os números W, X e Y referem-se, respectivamente, à classe, sub-classe e sub-sub-classe
e o número Z é específico de cada enzima.
2- A sua natureza proteica só foi definitivamente aceite na década de 1930.
3- Relativamente aos catalisadores não enzímicos as enzimas são, em geral:
a) mais potentes,
2- No dia 31-10-2006 estavam classificadas 3985 enzimas que podem ser consultadas em
b) actuam em condições “ pouco agressivas “ (pH ≈ 7, temp. < 100°C, etc.),
http://www.expasy.ch/enzyme/
c) têm uma enorme especificidade relativamente aos substratos e produtos, e
3- Em geral uma mesma enzima tem vários nomes e a nomenclatura não é isenta de ambiguidade;
a atribuição de um número EC às enzimas é uma tentativa de resolver essa ambiguidade.
d) a sua actividade pode ser, frequentemente, regulada por substâncias diferentes dos substratos e dos
produtos (as enzimas podem ser sensores do meio ambiente em que estão inseridas...).
Foram definidas 6 classes:
Classe 1: oxi-redútases, Classe 2: transférases, Classe 3: hidrólases
Classe 4: líases,
Classe 5: isomérases, Classe 6: lígases ou sintétases
4- Sendo as enzimas moléculas proteicas o seu tamanho é, geralmente, muito grande relativamente ao
tamanho das moléculas dos substratos.
4- A classificação é de tipo funcional: diferentes proteínas com a mesma actividade catalítica
O “sítio activo” (ou “sítio catalítico”) é um local específico modelado de tal forma que permite a interacção
específica com o substrato (ou substratos) e onde ocorre a reacção química.
(como as isoenzimas) têm o mesmo nome e número EC.
25
As isomérases (EC 5.x.y.z) catalisam a
interconversão de dois isómeros: A↔B
26
Nas reacções catalisadas pelas hidrólases
(EC 3.x.y.z) um dos reagentes é a água e o substrato
rompe-se nas suas partes constituintes:
AB + H2O → A + B
Em geral,
quando à frente do nome de um composto se coloca o
sufixo “ase”
a enzima em questão é uma hidrólase.
Em rigor, as isomérases são as únicas enzimas em que se pode falar do substrato da enzima
no singular.
As hidrólases catalisam
a rotura de ligações sendo a água um dos substratos.
Exemplo:
isomérase das hexoses-fosfato
fosfoglico-mútase
fosfoglicerato-mútase
epimérase das pentose-fosfato
(Glicose-6-P ↔ Frutose-6-P)
(Glicose-1-P ↔ Glicose-6-P)
(3-fosfoglicerato ↔ 2-fosfoglicerato)
(Ribulose-5-P ↔ Xilulose-5-P)
Exemplos de ligações que podem sofrer rotura hidrolítica:
1- éster (produtos = álcool + ácido) ou tioéster (produtos = tiol + ácido)
2- lactona (produtos = álcool + ácido; notar que neste caso, porque a
lactona é “um éster interno”: A + H2O → B)
Em geral,
nas reacções catalisadas pelas isomérases
as Keq têm valores não muito diferentes de 1 (Ù ∆G’º não muito diferente de 0)
e são fisiologicamente reversíveis.
27
3- anidrido (produtos = ácido + ácido)
4- amida (produtos = ácido + amina)
5- osídicas (produtos = semi-acetal + álcool ou semi-acetal + semi-acetal
ou semi-acetal + ácido ou o semi-acetal + amina)
28
As reacções catalisadas pelas enzimas podem, frequentemente, ser conceptualmente
consideradas como o acoplamento de dois processos:
um exergónico (∆G<0) e outro endergónico (∆G>0) ... mas o somatório é exergónico
As fosfátases são hidrólases em que um dos produtos é o fosfato inorgânico (Pi).
As reacções catalisadas pelas fosfátases chamam-se desfosforilações.
Alguns exemplos de fosfátases:
ATPase
(ATP + H2O → ADP + Pi)
pirofosfátase inorgânica
(PPi + H2O → 2 Pi)
fosfátase alcalina,
uma enzima que se pensa estar envolvida
na desfosforilação de proteínas
(proteína-fosfato + H2O → proteína + Pi)
endergónico
(∆G>0)
exergónico
(∆G<0)
NOTA: Embora, teoricamente, as hidrólases catalisem as reacções directa e inversa,
nas reacções de hidrólise a Keq é tão elevada no sentido da hidrólise
que, em geral, não faz sentido falar da reacção inversa.
29
As lígases (ou sintétases) (EC 6.x.y.z) catalisam reacções que podem ser lidas
como sendo o somatório de duas reacções: uma de hidrólise do ATP e outra de
combinação de duas substâncias.
30
As reacções nunca evoluem no sentido em que são endergónicas mas os
processos anabólicos são endergónicos...
H2 O
∆G = + 35 KJ
ATP + A + B ↔ ADP + Pi + AB ou
ATP + A + B ↔ AMP + PPi + AB
glutamato
Nas reacções catalisadas pelas
lígases a energia libertada no
processo de hidrólise do ATP
permite a combinação de dois
reagentes A e B.
Ou, considerando o sentido
inverso, que a energia libertada na
cisão de AB permite a síntese de
ATP.
glutamina
NH4+
∆G = -50 KJ
ADP + Pi
ATP
H2 O
glutamina
sintétase da glutamina
ATP
∆G soma =
-15 KJ
Sintétase do AB
NH4+
glutamato
Quando a rotura do ATP ocorre entre os
resíduos fosfato β e γ forma-se ADP e Pi mas
quando ocorre entre os resíduos fosfato α e β
forma-se AMP e PPi.
endergónico
(∆G= +35 KJ)
exergónico
ADP + Pi
(∆G=-50KJ)
31
As enzimas são as máquinas que acoplando processos endergónicos com exergónicos
possibilitam a ocorrência dos processos endergónicos.
32
A sintétase da glutamina é um exemplo.
Nalgumas lígases o nucleosídeo trifosfato envolvido na reacção não é ATP mas o GTP.
No ciclo de Krebs a reacção catalisada pela sintétase de succinil-CoA (uma das isoenzimas)
evolui no sentido da rotura do succinil-CoA e síntese de GTP:
GDP + Pi + succinil-CoA → succinato + CoA + GTP
Podemos considerar, conceptualmente,
que a sintétase de succinil-CoA faz a acoplagem de duas reacções:
Nas reacções catalisadas pelas transférases (EC 2.x.y.z)
um substrato dador cede um grupo químico ou um resíduo
a um outro substrato (o substrato aceitador) que o aceita:
XT + Y → X + YT
Uma transférase catalisa uma reacção em que um resíduo T é transferido de XT para Y
(ou, tendo em conta a reacção inversa, de YT para X).
São exemplos de transférases:
∆G1<0
Succinil-CoA + H2O → Succinato + CoA (reacção exergónica)
GDP + Pi → GTP + H2O
(reacção endergónica)
∆G2>0
⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯
33
GDP + Pi + Succinil-CoA ↔ GTP + Succinato + CoA
∆G(1,2)=∆G1+∆G2
1- cínases
2- fosforílases
3- pirofosforílases
4- tiólases
(ATP + Aceitador → ADP + Aceitador-P)
(Dador-T + Pi → Dador + T-P)
(Dador-T + PPi → Dador + T-PP)
(Dador-T + CoASH → Dador + T-CoA)
34
Numa reacção enzímica do tipo: ATP + Y ↔ ADP + Y-P
a enzima denominar-se-ia cínase do Y
e a regra mantém-se mesmo quando o aceitador é outra enzima.
As cínases são fosfotransférases que catalisam reacções do tipo:
ATP + Y → ADP + Y-P.
As reacções catalisadas pelas cínases chamam-se fosforilações.
Nas reacções catalisadas por cínases o resíduo transferido é um fosfato e, em geral,
o dador de fosfato é o ATP (ou o GTP) que cede o fosfato γ (o terceiro) a um aceitador.
Os produtos são o ADP (ou o GDP) e o aceitador fosforilado (Aceitador-P).
Exemplo:
a cínase da desidrogénase do piruvato
catalisa a fosforilação da desidrogénase do piruvato pelo ATP
Numa reacção enzímica do tipo: ATP + Y ↔ ADP + Y-P
a enzima denominar-se-ia cínase do Y sendo Y o substrato que aceita o fosfato γ do ATP.
Exemplos de cínases:
cínases de proteínas
Em geral,
35
quando existe uma cínase
que catalisa a fosforilação de um substrato A
existe também uma fosfátase (hidrólase)
que catalisa a desfosforilação do substrato A fosforilado
36
A denominação das cínases
não tem em linha de conta o sentido em que a reacção ocorre nos seres vivos
Alguns fármacos e hormonas exercem os seus efeitos ligando-se a receptores celulares
que têm actividade catalítica intrínseca e que são, portanto, enzimas.
Alguns receptores celulares são enzimas.
mesmo quando
(por razões de índole termodinâmica)
apenas a reacção em que ocorre formação de ATP pode ser observada
ADP + Y-P → Y + ATP
a cínase continua a chamar-se cínase de Y.
O receptor da insulina é uma
cínase que,
quando a insulina está
ligada,
catalisa a fosforilação de
uma proteína citoplasmática
chamada “substrato do
receptor da insulina”.
37
38
As pirofosforílases são enzimas em que o substrato aceitador do resíduo transferido é o
pirofosfato inorgânico (PPi): XT + PPi ↔ X + T-P-P.
As reacções catalisadas pelas fosforílases denominam-se pirofosforólises.
As fosforílases são transférases em que o substrato aceitador
é o fosfato inorgânico (Pi): XT + Pi ↔ X + T-P.
As reacções catalisadas pelas fosforílases denominam-se fosforólises.
Numa reacção do tipo XT + PPi ↔ X + T-P-P
Numa reacção do tipo XT + Pi ↔ X + T-P
a enzima denominar-se-ia pirofosforílase do XT
a enzima denominar-se-ia fosforílase do XT (T é o resíduo transferido)
...e XT sofre pirofosforólise: rompe-se (lise) por acção do pirofosfato inorgânico (PPi).
...e XT sofre uma fosforólise: XT rompe-se (lise) por acção do fosfato inorgânico (Pi).
Exemplo de fosforílase:
A fosforílase do glicogénio
catalisa a fosforólise do glicogénio
Exemplo de pirofosforílase:
Pirofosforílase do UDP-Glicose
Glicose-glicose-glicose...+ Pi →
glicose-glicose...+ Glicose-1-P
39
É interessante notar as semelhanças entre as denominações das enzimas e as reacções catalisadas
pelas fosforílases, pirofosfosforílases e hidrólases.
40 do
No limite as hidrólases poderiam ser consideradas transférases em que o substrato aceitador
resíduo transferido é a água; rompe-se uma ligação mas formam-se outras com a água.
As reacções catalisadas pelas transférases também podem ser conceptualmente
consideradas como o acoplamento de dois processos:
um exergónico e outro endergónico.
glicose + ATP
glicose-6-P + ADP
∆G = -32 KJ
glicose + Pi
glicose-6-P + H2O
∆G = + 18 KJ
ADP + Pi
∆G = -50 KJ
ATP + H2O
cínase da glicose
ATP
glicose-6-P
glicose
endergónico
(∆G= +18 KJ)
ADP
exergónico
(∆G=-50KJ)
A cínase da glicose é uma “máquina química” que acopla um processo endergónico
(a
41
formação de glicose-6-P) com outro exergónico (a hidrólise do ATP).
As oxi-redútases (EC 1.x.y.z)
catalisam reacções de oxiredução
Nas reacções catalisadas pelas
líases (EC 4.x.y.z) um dos
reagentes que contém uma dupla
ligação combina-se com um
segundo reagente de tal maneira
que o produto já não contém a
dupla ligação: A=B + C ↔ ABC
Ou, pensando na reacção inversa:
são líases as enzimas que catalisam reacções
em que um composto se rompe dando
origem a dois produtos sendo que um destes
produtos contém uma dupla ligação que não
existia no composto que lhe deu origem:
ABC ↔A=B + C
Frequentemente o composto C é a
água mas aqui, ao contrário do
caso das hidrólases, a reacção de C
com A=B não resulta na lise de A=B.
42
A palavra síntase (não confundir com sintétase) está popularmente associado a
algumas enzimas e as síntases podem pertencer a diferentes classes.
Algumas vezes o nome que foi
originalmente atribuído a uma
enzima (síntase do composto X),
embora fora da nomenclatura
sistemática, manteve-se o mais
popular ao longo dos anos.
Exemplos de nomes associados a oxi-redútases:
Desidrogénases
Redútases
Oxídases
Oxigénases
Peroxídases
Catálase
Dismútases
1- A síntase do glicogénio
é de facto uma transférase.
dinucleotídeos são substratos
2- Outras síntases foram classificadas na classe das líases. Exemplos:
O2 é o oxidante directo
o H2O2 é reduzido a água...
catalisam reacções de dismutação 43
Síntase do citrato
(acetil-CoA + oxalacetato + H2O →
citrato + CoA)
Síntase da hidroxi-metil-glutaril-CoA
(acetil-CoA + acetoacetil-CoA + H2O → hidroxi-metil-glutaril-CoA + coenzima
A)
44
À rotura hidrolítica das ligações fosfoanidrido do ATP (entre os fosfatos α-β e β-γ) estão
associados valores de ∆G’º “muito” negativos;
por isso se diz na gíria dos bioquímicos que “estas ligações são ricas em energia”.
As ligações em que o ∆G´º que corresponde à sua rotura hidrolítica (em condições
padrão) tem um valor semelhante ou é ainda mais negativo que o que corresponde à
1- Dizemos que a glicose e o etanol
dizem-se “ricas em energia” e costumam representar-se por
“são substâncias energéticas” porque no seu processo de oxidação libertam enormes quantidades de energia:
As ligações “ricas em energia” podem, por exemplo, ser de tipo
a) fosfoanidrido como no ATP
Glicose + 6 O2 → 6 CO2 + 6 H2O
∆G´º = - 2840 KJ/mol
Etanol + 2 O2 → 2 CO2 + 2 H2O
∆G´º = - 168 KJ/mol
2- Quando dizemos que o ATP é “uma substância energética” não estamos a falar da reacção de oxidação do
ATP mas da sua fosfohidrólise.
ATP + H2O → AMP + PPi
~.
∆G´º= - 43KJ
b) fosfamida como na fosfocreatina
(nota: estes ∆G’º não se referem aos seres vivos; ∆G’º refere-se sempre a condições padrão)
ATP + H2O → ADP + Pi
rotura das ligações fosfoanidrido do ATP (- 31 KJ mol-1 ou -46 KJ mol-1)
c) enolfosfato
como no fosfoenolpiruvato.
∆G´º= -62KJ
∆G’º = - 31 KJ/mol
∆G’º = - 46 KJ/mol
∆G´º= -31KJ
∆G´º= -46KJ
Quando dizemos que a fosfocreatina ou o fosfoenolpiruvato “são substâncias energéticas”
também estamos simplesmente a dizer que a sua fosfohidrólise tem um valor de ∆G’º muito
negativo.
45
As substâncias que contém ligações
“ricas em energia” participam no
metabolismo em reacções de
fosfotransferência catalisadas por
cínases.
∆G´º- 49KJ
Fosfocreatina + H2O → Creatina + Pi
Fosfoenolpiruvato + H2O → Piruvato + Pi
∆G’º = - 43 KJ/mol46
∆G’º = - 62 KJ/mol
As reacções enzímicas que in
vivo geram PPi têm um ∆G
(real) muito negativo porque o
produto PPi é rapidamente
hidrolisado pela acção
catalítica de pirofosfátases
que mantém a sua
concentração muito baixa.
No 1,3-bisfosfoglicerato há uma ligação fosfoanidrido...
Como resultado da acção catalítica das
pirofosfátases celulares
⇒ a concentração de PPi na célula é
muito baixa;
não existe um dos substratos para que
a reacção inversa possa ocorrer
A cínase do 3-fosfoglicerato catalisa uma reacção de fosfotransferência que é
47 de
fisiológicamente reversível: síntese de ATP na glicólise (∆G’º=-18KJ) e consumo
ATP na gliconeogénese (∆G’º= +18KJ) .
As reacções em que um dos produtos é o PPi
são reacções exergónicas em todas as condições metabólicas
Ù reacções fisiologicamente irreversíveis.
48