CURSO: ENGENHARIA CIVIL
FÍSICA GERAL E EXPERIMENTAL II
2º Período
Prof.a: Érica Muniz
UNIDADES 2 e 3
Propriedades Moleculares dos Gases
Calorimetria
Estado Gasoso
Dentre os três estados de agregação,
apenas o estado gasosos permite uma
descrição quantitativa simples.
Importância: Entender e aplicar os princípios
fundamentais
da
termodinâmica
estendendo aos sistemas líquidos e
sólidos.
Equação de estado:
A relação matemática baseada nas
propriedades m, v, P, T, suficiente para
descrever o estado do sistema.
Variáveis
• Volume ocupado por um gás –
é a capacidade do recipiente em contê-lo.
No SI:
1 m3 = 1000 L
1 dm3 = 1 L
1 cm3 = 1 mL
Variáveis
• Pressão- força por unidade de área –
decorrente do choque das moléculas
contra as paredes do recipiente que as
contém.
P= F/A SI – Pascal (P = N/m2)
1 atm= 101325 Pa =760 mm Hg = 760 Torr
1 atm = 100000 Pa
1atm = 14,7 psi
• Temperatura- diretamente proporcional
à energia cinética das moléculas do gás.
Tanto a pressão quanto o volume estão
relacionados com a temperatura expresso
em K ou °C.
T (K) = t (°C) + 273,15
• Massa- expressa em gramas ou
quilogramas ou em número de mols.
Na equação de estado, é necessário
incluir alguns parâmetros que
caracterizam o tipo de gás.
Ex: a equação de estado O2 é diferente de
N2.
Pequenas diferenças, pois as interações
são fracas nas distâncias intermoleculares
típicas do estado gasoso.
Modelos dos Gases Ideais
• Sistemas gasosos rarefeitos ou quando não
precisamos de uma grande precisão na
descrição do comportamento dos sistemas
gasosos.
• As
interações
intermoleculares
são
consideradas nulas.
• As
equações
assumem
uma
forma
extremamente simples e independente do tipo
de gás.
• Obs: sistemas de alta pressão, baixas
temperaturas ou, então, quando as interações
moleculares forem elevadas, o modelo de gases
é inadequado.
Equação Geral do Gás Ideal
pressão constante
VT
P1.V1 P2 .V2
T1
T2
volume constante
PT
temperatura constante
1
P
V
Relação Pressão – Volume:
Lei de Boyle - Mariotte
• Lei de Boyle (Isotérmica): volume ocupado por um gás a
uma determinada temperatura varia quando a pressão
sob o gás varia.
PV =K
Obs: todos os gases se aproximam do comportamento da
Lei de Boyle a baixa pressão e altas temperaturas.
• O gás ideal, um gás hipotético que obedece exatamente
a lei de Boyle a todas temperaturas e pressões.
• Isto permite dizer que o comportamento PV de um gás
real (realmente existe) se aproxima de um gás ideal
quando a temperatura é aumentada ou quando a
pressão é reduzida.
Lei de Boyle-Mariotte
Lei de Boyle-Mariotte
Efeitos da Temperatura:
• Lei de Charles ( Isocórica):
Investigou a variação nos volumes de O2,
H2, CO2 e ar causados por variações de
temperatura.
Os gases se expandiram na mesma
quantidade relativa quando aquecidos à
pressão constante.
Transformações IsobáricasLei de Charles e Gay-Lussac
• O volume de uma dada massa gasosa, submetida a
uma transformação isobárica. É função linear da
temperatura.
V = V0 (1 +αt)
Onde α é o coeficiente de dilatação térmica, sob pressão
constante do gás considerado.
O Número de Avogadro
• Mas quantas moléculas existem em uma amostra
macroscópica de uma dada substância? Vamos definir
uma grandeza adequada para lidar com moléculas, é o
mol. Um mol é o número de moléculas que existem em
12g de carbono-12. Experimentalmente se determina
quantas moléculas existem em um mol, e esse é o
chamado número de Avogadro NA ,
NA = 6,02x1023 moléculas
• Desse modo, já podemos relacionar número de moles n
e número de moléculas N, ou seja:
N
n
NA
Gases Ideais
Gases Ideais
Exemplos
1- Um gás ideal é encerrado num aparelho de Boyle , seu
volume é de 247 mL, a pressão é de 625 mmHg. Qual
será o novo volume do gás se a pressão é aumentada
a 825 mmHg?
2- Certa massa de um gás ocupa o volume de 49,2 L sob
pressão de 3 atm e temperatura de 27°C. a constante
universal dos gases perfeitos vale 0,082 atm. L/mol.K.
Determine:
a) o número n de mols do gás;
b) a massa do gás, sendo a massa molar M = 28 g/mol;
c) o volume de um mol ( volume molar) desse gás nas
condições de pressão e temperatura consideradas.
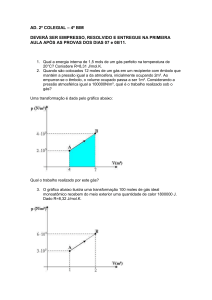
3- O gráfico da figura representa uma
transformação sofrida por uma massa de um
gás ideal. Qual a diferença de temperatura
entre os estados A e C? Considere: VA= 1 m3;
PA= 4 N/m2; VB= 4 m3; PB= 4 N/m2; VC= 4 m3;
PC= 1 N/m2.
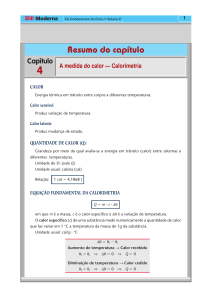
CALOR
Energia térmica em trânsito devido à diferença de
temperatura; flui espontâneamente do sistema de
temperatura mais alta para o de temperatura
mais baixa.
calor
Corpo A
Corpo B
Ta
FIQUE LIGADO:
Tb
Ta > Tb
Pode-se falar em energia térmica de um corpo,
porém jamais em calor de um corpo, pois calor não
pode estar contido num corpo.
Fluxo de calor
Menor temperatura
Maior temperatura
Depois de um certo tempo:
Equilíbrio térmico
Mesma temperatura
EXERCÍCIO
01- É esse calor intenso que destrói o tumor. Nessa frase,
calor é usado como sinônimo de temperatura. No
entanto, para a Física, calor é:
a) energia presente em corpos que apresentam elevadas
temperaturas.
b) energia presente em corpos que apresentam baixas
temperaturas.
c) energia transferida de um sistema para outro em virtude
da diferença de temperatura entre eles.
d) energia transferida de um sistema que apresenta baixa
temperatura para outro de alta temperatura.
e) energia térmica armazenada nos corpos que possuem
temperatura superior a 0 kelvin
Capacidade térmica de um corpo:
Capacidade térmica de um corpo é a
grandeza que expressa a quantidade de calor
que determinado corpo necessita para sofrer
uma unidade de variação de temperatura:
Para calcularmos a capacidade térmica
de um corpo fazemos:
Q
C
Quantidade de calor
dada ou retirada de
um corpo
Variação de
temperatura sofrida
pelo corpo
Se um corpo possui baixa capacidade térmica ele
aquece ou esfria mais rapidamente em
comparação com o outro de maior capacidade
térmica.
VAMOS PENSAR ????
1- Por quê a areia em dia de Sol aquece mais rápido em
comparação com a água do mar ?
R: areia possui menor
capacidade térmica do que a
água do mar.
2- E a noite o que acontece?
R: O corpo que aquece mais
rápido, esfria mais rápido: a
areia está fria,
Enquanto que a água do mar
está “quentinha”.
EX.1
Um bloco metálico recebe 2000 calorias, a temperatura
aumenta de 20°C para 420°C. Determine a capacidade
térmica do bloco.
SABEMOS QUE : C = Q/ΔT
C = 2000 / 400
Temos: C = 5 cal/°C
Isso significa que:
O corpo deve receber 5 calorias para que sua temperatura
aumente de 1°C.
FIQUE LIGADO!!!! CAPACIDADE TÉRMICA : UNIDADE:
SI : J / K
Calor específico sensível
de uma substância
É a quantidade de calor que uma unidade de massa de
uma substância necessita, para sofrer uma unidade de
variação de temperatura.
Calculamos o calor específico sensível de uma
substância, fazendo:
Q
c
m.
Quantidade de
calor
Massa vezes variação
de temperatura
CALOR ESPECÍFICO ( c ) :
É uma característica do material que constitui o corpo:
c = C/m
UNIDADE: S.I. : ( J/kg.K )
O mais usual é : cal/g°C
Veja alguns exemplos:
água: c = 1 cal/g°C
latão: c = 0,092 cal/g°C
prata: c = 0,056 cal/g°C
FIQUE LIGADO!!!!!
CAPACIDADE TÉRMICA ( C )
Depende da massa e da substância
CALOR ESPECÍFICO ( c )
Depende apenas da substância
Mudanças de Fase
CLASSIFICAÇÃO DO CALOR
• Calor Sensível: produz variação de
temperatura.
Ex: uma barra de alumínio sendo aquecida.
• Calor Latente: produz mudança de
estado.
Ex: derretimento de uma barra de gelo,
inicialmente a 0°C
EQUAÇÃO GERAL DA
CALORIMETRIA
Q= m.c.Δθ
Onde:
Q = quantidade de calor
m= massa
c = calor específico sensível
Δθ = variação de temperatura
• Assim, para a equação do calor latente
precisamos apenas da massa do corpo e
da sua substância. Derreter gelo é
diferente de derreter ouro, certo?
• Ficamos com a seguinte fórmula para o
calor Latente:
EX: 2
Um bloco de alumínio com 600g de massa deve ser
aquecido de 10°C para150°C.
Sendo de 0,22 cal/g°C o calor específico do alumínio,
calcule:
a) A quantidade de calor que o bloco deve
receber.
b) A sua capacidade térmica
a) Q = mcΔT
Q = 600 . 0,22 . 140
Q = 18.480 cal
b) C = mc
C = 600 . 0,22
C = 132 cal/°C
Potência Calorífica
Sendo : Pot = potência
Δt = tempo
Pot = Q/Δt
UNIDADE: Pot : S.I. : J/s = W ( Watts )
o mais usual: cal/s
Obs:
W
÷ 4,2
cal/s
Exemplo
TROCAS DE CALOR
• Dois ou mais corpos, com temperaturas
diferentes, quando colocados num
calorímetro, trocam calor entre si até
atingirem o equilíbrio térmico.
LEI GERAL DAS TROCAS DE CALOR
Q 1 + Q2 + Q3 + … = 0
EXEMPLO:
• José, um marido prendado, resolveu servir
café da manhã na cama para sua esposa;
assim, misturou 300ml de café a
temperatura inicial de 800C com 100ml de
leite inicialmente a 200C, podemos
afirmar, antes que José ganhe o prêmio
de maridão do ano, que a temperatura
final da mistura será igual a ?
Dados : ccafé = cleite = 1 cal/g0C
Calorímetro
(Vaso
Adiabático):
Recipiente que
não permite a
troca de calor
com o meio
exterior. É muito
utilizado para
determinação do
calor específico
de corpos.
Exemplo 01
Um corpo A de massa 200 g e de calor
específico cA= 0,2 cal/g.ºC, 60º C é colocado
em contato térmico com um corpo B de 100 g
e cB= 0,6 cal/g.ºC a uma temperatura de 10
ºC. Os corpos são colocados em um recipiente
adiabático.
a) esboce o gráfico Ɵ x t mostrando a evolução
da temperatura da temperatura dos corpos em
função do tempo;
b) Qual a temperatura final do sistema?
Exemplo 02
Em um calorímetro ideal misturamos 220
g de gelo em fusão com 110 g de água a
um a temperatura Ɵ. Determine o valor de
Ɵ para que se tenham massas iguais de
água e gelo.