UNIVERSIDADE DO SAGRADO CORAÇÃO
BRUNA LUÍSA DE PAULA
ANÁLISE HISTOMORFOMÉTRICA DA RESPOSTA
INFLAMATÓRIA E REPARO TECIDUAL FRENTE À
IMPLANTAÇÃO DE MATRIZ COLÁGENA SUÍNA NO
TECIDO SUBCUTÂNEO DE CAMUNDONGOS
BAURU
2017
BRUNA LUÍSA DE PAULA
ANÁLISE HISTOMORFOMÉTRICA DA RESPOSTA
INFLAMATÓRIA E REPARO TECIDUAL FRENTE À
IMPLANTAÇÃO DE MATRIZ COLÁGENA SUÍNA NO
TECIDO SUBCUTÂNEO DE CAMUNDONGOS
Dissertação apresentada à Universidade
do Sagrado Coração, como parte dos
requisitos necessários para obtenção do
título de MESTRE em Biologia Oral,
programa Biologia Oral.
Orientador: Profª. Drª.. Elcia Maria Varize
Silveira
BAURU
2017
Paula, Bruna Luisa de
P3249a
Análise histomorfométrica da resposta inflamatória e reparo
tecidual frente à implantação de matriz colágena suína no tecido
subcutâneo de camundongos / Bruna Luisa de Paula.-- 2017.
65f. : il.
Orientadora: Prof.ª Dra. Elcia Maria Varize Silveira.
Dissertação (Mestrado em Biologia Oral) - Universidade do
Sagrado Coração - Bauru - SP
1. Biomateriais. 2. Inflamação. 3. Enxerto. 4. Colágeno. I.
Silveira, Elcia Maria Varize. II. Título.
BRUNA LUÍSA DE PAULA
ANÁLISE HISTOMORFOMÉTRICA DA RESPOSTA INFLAMATÓRIA E
REPARO TECIDUAL FRENTE À IMPLANTAÇÃO DE MATRIZ
COLÁGENA SUÍNA NO TECIDO SUBCUTÂNEO DE CAMUNDONGOS
Dissertação apresentada à Universidade
do Sagrado Coração, como parte dos
requisitos necessários para obtenção do
título de MESTRE em Biologia Oral,
programa Biologia Oral.
Orientador: Profª. Dra. Elcia Maria Varize
Silveira
Banca examinadora:
Profª. Drª. Carolina Fávaro Francisconi
Faculdade de Odontologia de Bauru (FOB/USP)
Profª. Drª. Angela Mitie Otta Kinoshita
Universidade do Sagrado Coração
Profª. Drª. Elcia Maria Varize Silveira
Universidade do Sagrado Coração
Bauru, 26 de janeiro de 2017.
DEDICATÓRIA
Dedico este trabalho aos meus pais,
pelas raízes de amor e confiança que
sempre me sustentaram e tornaram-me
capaz de concretizar meus sonhos.
AGRADECIMENTOS
Agradeço primeiramente a Deus que até aqui me iluminou e protegeu,
guiando meu caminho e não permitindo que a mim faltasse amor, fé e
sabedoria. Agradeço ainda a Ele, por me presentear com minha família, que
nunca me deixou esquecer quem eu sou e onde quero chegar.
Agradeço eternamente e com todo o amor do mundo, minha mãe Sonia
e meu pai Helton, por apostarem na ‘menininha da promessa’ e me
incentivarem a dar o meu melhor. Agradeço a eles pelo carinho, os mimos e,
principalmente, os exemplos de caráter e bondade a mim ensinados. A eles
devo agradecer também pelo primeiro título que conquistei na vida: irmã mais
velha, título este que irei carregar sempre com muito orgulho. Agradeço a
minha irmã Bianca pelo companheirismo, pelas brigas e risadas e por sua
disposição em me ajudar na confecção deste trabalho juntamente ao meu
cunhado Leonardo, dividindo seu tempo, sua paciência e seus lanchinhos
noturnos comigo.
Ao meu namorado Francisco, agradeço pelo amor, pela dedicação e
pela perseverança em me mostrar que tudo sempre dá e deu certo,
acreditando em mim quando nem eu acreditava. Agradeço a você meu amor
pelas muitas vezes que deixou de ser somente meu parceiro se tornando meu
melhor amigo, cúmplice e anjo da guarda.
Por todas as histórias compartilhadas, pelos trabalhos desenvolvidos e
por permitir que dois anos passassem como minutos, agradeço as minhas
queridas colegas Ana Carolina Gonçalves, Carolina Lourenço, Heloísa
Marques e Yasmin Santos, que transformaram o mestrado em uma experiência
única e enriquecedora. Agradeço em especial minhas amigas de longa data
Beatriz Malaghine, Laura Franciscon, Marina Moraes, Paola Catalano e Poliana
Jacometi juntamente com nossa ‘mascotinha’ Laura, por toda fidelidade e
paciência ao compreender as minhas incontáveis ausências.
À minha querida orientadora, Elcia Silveira, agradeço por toda
generosidade e cuidado em nos acolher, dividindo seu tempo e seus recursos
entre seus alunos, inúmeras vezes recebidos como filhos. Obrigada por seu
exemplo de integridade profissional e pessoal e por compartilhar de maneira
brilhante lições valiosas que extrapolam o presente trabalho se perpetuando ao
longo da vida.
Agradeço a todo corpo docente da Universidade do Sagrado Coração,
em especial às queridas professoras Ana Paula Garlet, Andreia Silva, Dulce
Constantino, Mirela Campos, Pamela dos Santos, Patrícia Saraiva, Rita
Peruquetti, Solange Franzolin e aos funcionários Maira Couto e Wilson Orcini.
À eles e a todos os outros profissionais admiráveis, que tive a honra de
conhecer, deixo o meu obrigada. Ressalto meus
agradecimentos
a
especialmente lembrada professora Sônia, pela qual coleciono respeito e
admiração desde o ensino fundamental I. Agradeço ainda, à toda equipe do
departamento de histologia da Faculdade de Odontologia de Bauru e aos
docentes Gustavo Garlet e Andreia Espíndola, que gentilmente se dispuseram
a me ajudar nesta empreitada.
Agradeço a todos que me acompanharam durante a realização deste
sonho, a vocês o meu muito obrigada.
SUMÁRIO
RESUMO ........................................................................................... 4
ABSTRACT ........................................................................................ 5
REVISÃO DE LITERATURA E JUSTIFICATIVA .............................. 7
PROPOSIÇÃO ................................................................................. 20
MATERIAL E MÉTODOS ................................................................ 21
Animais de Experimentação ................................................... 21
Material de implantação ......................................................... 23
Procedimento cirúrgico ........................................................... 23
Coleta de amostras ................................................................ 24
Processamento histológico e coloração................................. 26
Análise histomorfométrica ...................................................... 27
Análise de Birrefringência ...................................................... 29
Análise Estatística .................................................................. 32
RESULTADOS ................................................................................. 32
Análise histomorfométrica ...................................................... 33
DISCUSSÃO .................................................................................... 43
CONCLUSÕES ................................................................................ 55
REFERÊNCIAS BIBLIOGRÁFICAS ................................................ 56
ANEXOS .......................................................................................... 63
4
RESUMO
Os avanços relacionados a engenharia tecidual levaram à busca por
biomateriais em substituição ao enxerto autógeno de gengiva, que apesar de
ser considerado padrão ouro no reparo de tecidos moles comprometidos possui
restrições em relação a quantidade de tecido doador disponível, limitando o
reparo a pequenas áreas. Além disto, o procedimento de enxerto geralmente
relaciona-se com alta morbidade pós-operatória e dor tanto na porção doadora
como na loja receptora. A compreensão de aspectos inflamatórios envolvidos
após implantação de biomateriais é de suma importância na prática clínica,
uma vez que a dinâmica imunológica atuante no sistema biomaterial/receptor
pode comprometer a eficácia do procedimento. Desse modo, o presente
trabalho avaliou os aspectos da resposta imune e inflamatória desenvolvida
frente à implantação, única e sequencial, de matrizes de colágeno suíno
(Mucograft®) no tecido subcutâneo dorsal de camundongos Balb/c, nos
períodos de 3, 9 e 21 dias. De acordo com análises histomorfométricas em
lâminas coradas com HE e PicrosiriusRed, verificou-se que após 3 dias à
implantação do biomaterial já se observava pontos isolados de reabsorção da
matriz acompanhados de sinais da reação inflamatória, como aumento no
número de células constituindo um pequeno infiltrado ao redor do material
implantado. O processo de degradação da matriz ocorreu de modo bastante
expressivo associado a reações inflamatórias amenas e ao aumento de
fibroblastos, fibras e vasos sanguíneos na região, sendo sua completa
reabsorção após 21 dias. A velocidade da cinética de reabsorção após à
implantação sequencial da matriz (9 dias) não foi significativamente diferente
dos valores encontrados para o mesmo período nos grupos de única
implantação, contudo a reação inflamatória na implantação sequencial se
mostrou maior e com evolução mais rápida quando comparada à implantação
única em todos os períodos.Em análises qualitativas verificou-se que as
matrizes de implantação sequencial apresentaram um maior número de células
inflamatórias compondo o infiltrado, células gigantes, além da presença de uma
cápsula fibrosa mais notável ao redor do biomaterial implantado, ainda que o
número de fibras contabilizadas em PicrosiriusRed fosse menor neste período
5
em relação ao grupo de implantação única. Contudo, tais respostas
imunológicas não são consideradas exacerbadas, salientado a característica
biocompatível do material associado ao sistema receptor.
Palavras-Chave: Biomateriais, Inflamação, Enxerto, Colágeno.
ABSTRACT
The advances related to tissue engineering led to the search for
biomaterials to replace the autogenous gingiva graft, which despite being
considered gold standard in the repair of compromised soft tissues has
restrictions in relation to the amount of available donor tissue, limiting the repair
to small areas. In addition, the graft procedure is usually related to high
postoperative morbidity and pain in both the donor and recipient sites. The
understanding of the inflammatory aspects involved after implantation of
biomaterials is of paramount importance in clinical practice, since the
immunological dynamics in the biomaterial / receptor system may compromise
the efficacy of the procedure. Thus, the present work evaluated the
mechanisms of the immune and inflammatory response developed against the
single and sequential implantation of porcine collagen matrices (Mucograft®) in
the dorsal subcutaneous tissue of Balb / c mice in the periods of 3, 9 and 21
days. According to histomorphometric analysis in blades stained in HE and
PicrosiriusRed, it was verified that after 3 days to implantation of the biomaterial
already isolated points of reabsorption of the matrix were observed
accompanied by signs of the inflammatory reaction, as increase in the number
of cells constituting a small infiltrate surrounding the implanted material. The
degradation process of the matrix occurred in a very expressive way associated
to mild inflammatory reactions and the increase of fibroblasts, fibers and blood
vessels in the region, being its complete reabsorption after 21 days. The rate of
reabsorption kinetics after sequential matrix implantation (9 days) was not
significantly different from the values found for the same period in the single
implantation groups, however, the inflammatory reaction in sequential
implantation was larger and with a faster evolution when compared to the single
6
deployment in all periods. In qualitative analyzes it was verified that the
sequential implantation matrices presented a greater number of inflammatory
cells composing the infiltrate, giant cells, besides the presence of a more
remarkable fibrous capsule around the implanted biomaterial, although the
number of fibers counted in PicrosiriusRed was lower in this period than the
single deployment group. However, such immunological responses are not
considered exacerbated, emphasizing the biocompatible characteristic of the
material associated with the receptor system.
Keywords: Biomaterials, Inflammation, Graft, Collagen.
7
REVISÃO DE LITERATURA E JUSTIFICATIVA
A utilização de substâncias na tentativa de reparar ou substituir funções
perdidas de organismos não é recente e evoluiu juntamente com os avanços
da medicina e da biotecnologia visando à maior qualidade de vida da
população, já que ao longo do tempo estamos sujeitos a fraturas, mutilações e
doenças que podem levar a falha ou a incapacidade funcional de órgãos e
tecidos (MELNIKOV et al., 2009).Há mais de 2000 anos A.C., civilizações
primitivas suturavam feridas para acelerar o processo de cura e utilizavam
ossos
de
animais,
madeira,
entre
outros
materiais
para
substituir
funcionalmente membros perdidos (LYMAN et al., 1974). Tais práticas foram
difundidas e adaptadas ao longo dos séculos e seus resquícios perpetuados no
imaginário popular através de figuras até hoje presentes como a do típico pirata
com sua perna de madeira e olho de vidro, reparando lesões adquiridas em
batalhas.
Atualmente, define-se biomaterial como uma substância produzida a fim
de assumir uma estrutura, que isoladamente ou como parte de um sistema
complexo, direcione o curso de qualquer procedimento terapêutico ou de
diagnóstico, por meio de interações com o sistema do organismo em que foi
implantado (WILLIAMS, 2009). Desta forma, contrariando a primeira definição
de biomaterial baseada na inércia de sua inserção e função estética, espera-se
que a implantação de um dispositivo gere respostas no organismo receptor,
contudo tais respostas não devem ser exacerbadas, sendo sua aplicabilidade
maior que o ônus de sua implantação.
Os biomateriais podem ser classificados de acordo com alguns critérios
relacionados às suas características químicas ou com base nas respostas
biológicas produzidas por suas aplicações. A partir das reações biológicas do
organismo pós-implantação, o biomaterial poderá se classificar como: bioinerte
(não provoca reação de corpo estranho no organismo ainda que esteja em
contato direto com o tecido receptor, contudo promove outras formas de
respostas imunológicas), biotolerado (aquele que induz respostas imunes um
pouco mais acentuadas, sendo geralmente envolto por tecido fibroso pouco
tempo após a implantação), bioativo (promove ligação direta com os tecidos
8
uma vez que libera íons que modulam as ligações químicas de reparo tecidual)
e/ou reabsorvível (apresenta reabsorção lenta e gradual que possibilita que
seja substituído por tecidos ao longo do tempo, em geral apresentando
respostas imunológicas moderadas) (ANDERSON, JM, 2001). Quanto a sua
natureza química, um biomaterial pode ainda ser classificado em: metálico
(aplicado em componentes estruturais que visam à substituição, reforço ou
estabilização de tecidos rígidos que demandam altas cargas de tração e
compressão); cerâmico (geralmente formado por elementos metálicos e não
metálicos unidos por ligações iônicas e/ou covalentes, sendo de baixa
condutividade elétrica e térmica, amplamente empregado como instrumento de
diagnóstico); polimérico (macromoléculas de alta massa molar formadas pela
ligação sequencial de unidades repetitivas ao longo de uma cadeia principal,
podendo assumir desde formas particuladas a filmes e fios empregados no
âmbito hospitalar); compósito (apresenta uma fase contínua e uma fase
dispersa com interfaces distintas, sendo eficazmente empregado na liberação
de fármacos e outras substâncias) e natural (aquele sintetizado a partir de
produtos de origem biológica, podendo assumir formas compósitas ou
poliméricas, como no caso dos biomateriais sintetizados por meio do colágeno
extraído de fonte animal) (SIONKOWSKA, 2011).
Assim,
tendo
em vista que cada
tipo
de
biomaterial
possui
características químicas, mecânicas e biológicas próprias e que essas
características se relacionam a sua aplicabilidade em cada situação, à escolha
de um biomaterial deve ser embasada nos objetivos esperados após sua
implantação, sempre considerando a dinâmica do organismo receptor bem
como a do material empregado (WILLIAMS, 2009).
Em tecidos moles, a reconstrução geralmente é feita por intermédio de
matrizes, as quais devem apresentar características mecânicas similares as
dos tecidos a serem substituídos(WILLIAMS, 2014). Tais matrizes costumam
ser macias, flexíveis e resistentes sendo amplamente atribuídas a medicina e a
odontologia, por exemplo, como substitutos de pele em queimaduras profundas
e enxertos de gengiva, seja por motivos estéticos ou em caso de perda de
tecido decorrente da doença periodontal (MOIOLI et al., 2007).
9
A recessão gengival é uma condição clínica bastante comum, atingindo
mais da metade da população mundial (SUSIN et al., 2004). Trata-se de uma
migração da gengiva marginal livre no sentido apical em relação à junção
amelo-cementária, levando aexposição radicular (KASSAB et al., 2010).
Possuindo etiologia multifatorial, seu desenvolvimento depende de uma série
de fatores, tais como: traumas mecânicos (escovação agressiva, aparelho
ortodôntico, restauração dentária mal adaptada, próteses, placa bacteriana e
uso de piercing) e químicos (tabagismo, etilismo e uso de outras drogas), além
de fatores predisponentes relacionaciodos às características anatômicas da
cavidade
oral
(quantidade
inadequada
de
gengiva
queratinizada,
vestibularização de elementos dentários, deiscência óssea e inserção alta do
freio) (MARINI et al, 2004). A recessão gengival pode causar diversos
problemas ao paciente, sejam eles de cunho estético (harmonização do sorriso,
diferenças de tonalidade entre a raíz exposta e o esmalte dentário) ou
problemas
mais
graves
como
sensibilidade
dentária
(exposição
de
microtúbulos dentinários com comunicação com a polpa), acúmulo de placa
bacteriana (maior prevalência de biofilmes levando à inflamação), abrasão e
erosão (traumas no cemento e dentina por escovação ofensiva) e até mesmo
cáries radiculares (instalalção de microrganismos degradando regiões pouco
mineralizadas) (PATEL et al., 2011).
Classificamos a recessão gengival baseada em sua severidade, sendo a
classificação de Miller (1985), bastante consolidada. Esta classificação busca
englobar os diversos tipos de recessões gengivais em quatro classes,
agrupadas por critérios que analisam a posição da margem gengival em
relação à junção amelocementária e o nível do tecido periodontal interproximal
(MILLER, 1985) (Figura 1).
10
Figura 1. Representação esquemática dos diferentes tipos de recessões gengivais quanto à
classificação de Miller (1985).
Fonte: Elaborada pela autora (adaptado de TAKEI e AZZI, 2004).
Legenda: Classe I, recessões que não se estendem até à linha mucogengival, com ausência
de perda óssea e da porção gengival interdentária.Classe II, recessões que ultrapassam a
linha mucogengival ou se estendem até ela, sem perda do tecido de inserção na área
interdentária. Classe III, recessões que ultrapassam a linha mucogengival ou se estendem até
ela, com perda de tecido de inserção na área interdentária, podendo ocorrer um mau
posicionamento dos dentes. Classe IV se estendem até à linha mucogengival ou a
ultrapassam, com perdas consideráveis de tecido ósseo e de tecido gengival no espaço
interdentário, mau posicionamento severo dos dentes ou até mesmo na perda de alguns
elementos.
Existem várias técnicas cirúrgicas que promovem o recobrimento
radicular em casos de recessão gengival, entretanto tais técnicas só são
eficazes em recessões de classe I e II e em recobrimentos parciais de
recessões de classe III, tendo pouca previsibilidade de sucesso em
recobrimento envolvendo recessões de classe IV (CHAMBRONE et al.,
2008).O enxerto de tecido conjuntivo subepitelial é considerado tratamento de
eleição para recobrimento radicular em razão de sua previsibilidade e
11
resultados
esteticamente
favoráveis.
Contudo,
tal
procedimento
exige
habilidades técnicas apuradas, uma vez que combina tecidos de origem
palatina a retalhos de tecido gengival adjacente à recessão, necessitando, em
alguns casos, de procedimentos adicionais afim de reestabelecer a harmonia
gengival (CHAMBRONE et al, 2010). Outra técnica bastante utilizada é o
enxerto gengival livre, no qual se retira tecido conjuntivo e epitelial de um leito
doador e insere-se no sítio de recessão. Inicialmente a técnica de enxerto
gengival livre foi desenvolvida para ganho de mucosa queratinizada, sendo
posteriormente empregada com sucesso no tratamento de recessões gengivais
(CHAMBRONE et al., 2012). Em ambas as técnicas, o palato é a área doadora
mais comumente utilizada, caracterizando como região doadora a mucosa
adjacente ao segundo pré-molar e primeiro molar (NEVINS et al., 2011).
A retirada de tecido palatino, no entanto, gera limitações à aplicabilidade
destes procedimentos, já que a quantidade de tecido disponível é pequena,
restringindo-se ao recobrimento de moderadas proporções. Além disto, a
morbidade pós-operatória é grande e associa-se a inconvenientes, tais como
maior tempo cirúrgico, dificuldades na dicção, higienização e na alimentação
em decorrência de incomodo doloroso nas regiões de doação e de enxerto
tecidual; além de um possível aumento na utilização medicamentosa, desde
mais áreas interagindo com o anestésico à prevenção de grandes processos
inflamatórios e controle da dor (CAIRO et al., 2008).Dessa forma, pesquisas
com novos biomateriais vêm se desenvolvendo no sentido de garantir a
utilização de materiais que tenham a vantagem de eliminar uma segunda loja
cirúrgica (leito doador) oferecendo maior conforto ao paciente (MENSI et al.,
2016).
Atualmente, a maioria dos biomateriais para recobrimento radicular são
sintetizados na forma de matrizes à base de colágeno, em razão de sua
capacidade de orientar o reparo tecidual, além de sua biodegradação e
compatibilidade bastante favorável (CEN et al., 2008).
A terminologia
‘colágeno’ abrange um subgrupo de 27 proteínas bastante conhecidas,
geralmente encontradas como parte constituinte do tecido conjuntivo e também
presentes em tecido ósseo (YUNG & LIU, 2005). A molécula de colágeno
possui massa molecular de 300.000 daltons e chega a 280 namometros de
12
comprimento, sendo estruturada na forma de unidade tripeptídica (glicina aminoácido x – prolina ou glicina – aminoácido x – hidroxiprolina, onde ‘x’ pode
ser qualquer um dos 20 aminoácidos padrão) estabilizada por pontes de
hidrogênio e ligações intermoleculares (SILVA & PENNA, 2012). Proteínas
colágenas são muito utilizadas em aplicações médicas, sendo o tipo I, seguido
pelo tipo III, os mais frequentes na síntese de biomateriais em decorrência de
fontes naturais abundantes e similaridade com a matriz extracelular humana
(LEEUWEN, 2012). O colágeno pode ser adquirido de várias fontes, porém a
extração por meio de tecidos de origem animal é a mais usual (WEHRHAN et
al., 2010). O pericárdio porcino é um dos tecidos comumente utilizados para a
confeccção de matrizes colágenas em razão de sua fácil obtenção, com alta
disponibilidade, baixo custo e maleabilidade para modificações químicas que
favorecem sua estruturação na forma de matrizes, membranas, géis, filmes e
esponjas (PABST et al., 2014).
Na indústria química, muitos procedimentos são adotados a fim de
conferir durabilidade e conformação estrutural às fibras colágenas que
compõem um dispositivo, uma vez que o colágeno natural é degradado muito
rapidamente nos organismos, levando à perda funcional do material implantado
(VATS et al., 2003). O glutaraldeído, por exemplo, é um composto bastante
utilizado na promoção da estabilidade de membranas colágenas por multiplicar
ligações naturalmente encontradas no arranjo das fibras. Este processo é
denominado de ligação cruzada, sendo muito eficaz no aumento da espessura
das fibras e na força de ligação entre elas, evitando a degradação precoce do
biomaterial pós-implantação (BUNYARATAVEJ & WANG, 2001). Contudo,
tratamentos químicos com glutaraldeído são passíveis à liberação de resíduos,
aumentando
sua
citotoxicidade.
Deste
modo,
ainda
que
efetivo,
o
processamento com glutaraldeído tem deixado de ser empregado em alguns
dispositivos colágenos que preconizam a baixa antigenicidade do material
(SANZ et al., 2009).
O biomaterial empregado neste trabalho, a matriz colágena suína
(Mucograft®) faz parte de uma nova geração de materiais de origem colágena
com estruturação química especialmente elaborada em busca de menores
reações imunogênicas. Nesta matriz, as fibras colágenas do tipo I e III são
13
previamente purificadas e exibem uma organização única, compondo
estruturas tridimensionais estáveis (SCHMITT et al., 2015).Ademais, a
formulação em aspecto de matriz facilita a manipulação nos procedimentos de
recorte e sutura, além de conferir resistência ao material quando comparado às
formas membranosas (HERFORD et al. 2012). Os cuidados com possíveis
reações imunogênicas levam os fabricantes a tomarem precauções desde a
síntese do biomaterial até sua distribuição. Assim, dados de fabricação
ressaltam que a matriz colágena suína (Mucograft®) só chega ao mercado
depois de um duplo processo de esterilização em radiação gama e que todos
os animais utilizados como fonte doadora de colágeno são certificados por
veterinários e criados em ambientes controlados para assegurar a qualidade do
produto final. Tais características tendem contribuir para a diminuição de
reações imunogênicas favorecendo à bicompatibilidade pós-implantação da
matriz (SCHALLHORN et al., 2015).
A literatura relaciona o conceito de biocompatibilidade com respostas
imunológicas amenas e favoráveis à permanência do biomaterial no organismo
receptor (SILVEIRA, 2012). A biocompatibilidade é definida como uma
interação mútua entre biomaterial e receptor, onde material e sistema
fisiológico encontram-se em estado sinérgico, isto é, as reações imunológicas
causadas pela inserção do biomaterial não devem ser desfavoráveis ao
organismo, sendo necessário ainda que o biomaterial promova respostas que
estimulem o reparo tecidual local (WILLIAMS, 2008). Uma vez que se sabe que
todo material é passível de promover respostas no hospedeiro, conceituá-lo
como biocompatível pode causar equívocos, associando erroneamente o termo
bicompatibilidade com inércia na geração de respostas imunológicas. Em razão
disto, Williams (2014) preconiza o emprego da terminologia ‘sistema
biocompatível’, levando em consideração todas as características
do
biomaterial associadas a suas interações fisiológicas com o hospedeiro pósimplantação.
Testar o comportamento dos materiais em meio biológico é fundamental
para assegurar a previsibilidade clínica de sua aplicação. Uma vez expostos
aos fluídos orgânicos do corpo, os biomateriais
promovem a ruptura da
homeostase desencadeando uma série de reações imunológicas imediatas ou
14
tardias, e tais reações podem ocasionar problemas como a reabsorção precoce
do material implantado e infecções graves no receptor (CHUN et al., 2010).
Entretanto tais testes não devem se basear apenas em critérios que aprovem
ou rejeitem um material, mas sim em uma série de avaliações complexas que
permitam esclarecer de maneira eficiente às respostas biológicas promovidas
por sua utilização (GIBBONS, 1975). De modo geral, após a implantação de
um biomaterial verifica-se a interação do material com o fluído sanguíneo
(resultando na formação de um coágulo provisório de revestimento local),
inflamação aguda, posterior inflamação crônica, desenvolvimento de tecido de
granulação, reação de corpo estranho e formação de uma cápsula de tecido
fibroso. Todavia, tais reações poderão variar em decorrência da assepsia
adotada no procedimento, fatores imungênicos do próprio biomaterial
(formulação química, dificuldades de implantação econtaminação bacteriana),
além da capacidade imunológica do organismo receptor (WILLIAMS, 2014).
Desta forma, o emprego de técnicas e ferramentas para a confecção de uma
análise molecular ampla são imprescindíveis para a melhor compreensão dos
aspectos envolvidos na resposta imune e inflamatória pós-implantação de um
biomaterial.
Logo após uma injúria tecidual, como por exemplo, o procedimento de
colocação de um biomaterial, inicia-se um processo inflamatório local com
posteriores alterações sistêmicas denominado processo inflamatório agudo. O
processo inflamatório agudo é caracterizado por respostas rápidas geradas a
partir da primeira linha de defesa imunológica do organismo na tentativa de
restringir danos e infecções ao local lesionado (AARABI et al., 2007). As
respostas inflamatórias são ativadas e coordenadas por mediadores e células
do sistema imune tais como neutrófilos, monócitos e células dendríticas que
por meio de vias inflamatórias levam à migração, proliferação e diferenciação
celular, reparando o tecido degradado e recuperando a homeostasia (ABBAS
AK, 2015).
O processo inflamatório agudo, em geral é caracterizado por sinais
locais tais como: dor, calor, rubor, edema e perda de função (ainda que
temporária). Estes sinais relacionam-se a eventos vasculares que permitem a
migração de células e moléculas pró-inflamatórias para o sítio lesionado
15
(GUYTON, A.C.; HALL, J.E., 2011). Destacam-se neste processo moléculas
vasoativas como a histamina e a bradicinina que auxiliam na formação do
exsudado e do edema, além de expressar citocinas capazes de ativar células
endoteliais na promoção da migração de leucócitos, principalmente os
polimorfonucleares. Uma vez no sítio de inflamação, as células inflamatórias,
como macrófagos residentes no tecido, secretam citocinas responsáveis pela
ativação de células endoteliais, proliferação de fibroblastos e mediadores do
processo de cicatrização, tais como fator de necrose tumoral (TNF-α), fator
transformador
de
crescimento
beta
(TGF-β),
fatores
de
crescimento
plaquetários (PDGF) e fatores de crescimento epidérmico (EGF). Temos ainda
a
presença
acentuada
de
interleucinas
IL-1β
e
IL-6
(aumento
da
permeabilidade vascular, expressão de moléculas de adesão e modulação de
macrófagos) além das quimiocinas CCL2 e CCL3 (recrutamento de macrófagos
e polimorfonucleares para o sitio lesionado) mediadoras pró-inflamatórias,
atuando ativamente durante todo o processo (ABBAS AK., 2015).
O processo inflamatório agudo tende a cessar em um período próximo a
72 horas, sendo a fase de resolução mediada por citocinas anti-inflamatórias
(TGF-β, IL-4 e IL-10) que coordenam a migração celular e o processo de
apoptose. Assim, mononucleares anteriormente recrutados ao sítio lesionado,
liberam citocinas anti-inflamatórias e fagocitam as células danificadas
encerrando o processo (AARABI et al., 2007). Entretanto, vale ressaltar que o
próprio processo inflamatório agudo pode levar a danos teciduais e/ou não ser
totalmente eficaz no processo de cicatrização e reparo tecidual, iniciando-se
posteriormente um processo inflamatório mais longo e complexo, o processo
inflamatório crônico (GUYTON, A.C.; HALL, J.E., 2011).
O processo inflamatório crônico está relacionado às linhas de defesa
imunológicas mais complexas, com respostas específicas e de maior duração,
em geral associadas à atuação pronunciada de macrófagos e linfócitos,
recrutados por estímulos inflamatórios persistentes no local de implantação do
material (FRANZ et al., 2011). Os monócitos circulantes ao chegar ao local da
inflamação sofrem uma alteração fenotípica diferenciando-se em macrófagos.
Os macrófagos, por sua vez, aderem-se ao biomaterial e sofrem um processo
de fusão originando as células gigantes de corpo estranho (Figura 2),
16
responsáveis por atividades fagocitárias e de modulação do material por meio
da degradação da superfície do dispositivo, ou formação de cápsula em tecido
conjuntivo fibroso (reação de corpo estranho) (ANDERSON, JM et al., 2008).
Figura 2. Representação esquemática da fusão de macrófagos em células gigantes
multinucleadas.
Fonte: Elaborada pela autora (adaptado de ABBAS AK., 2012).
Legenda: Macrófago com citocinas moduladoras que estimulam o recrutamento de novas
células e a posterior fusão celular resultando em uma célula gigante multinucleada.
Além disto, as células macrofágicas exercem importante função como
apresentadoras de antígenos aos linfócitos Th (T helper) e liberam uma série
de fatores responsáveis pelo processo de quimiotaxia, ativação e ou
desativação de outros tipos celulares e citocinas no sítio de inflamação
(SCHUTTE et al., 2009).As citocinas secretadas pelos macrófagos atuam na
migração e diferenciação celular, estimulando a proliferação fibroblástica,
surgimento de novos vasos sanguíneos e produção e degradação de fibras
colágenas
(remodulação
do
biomaterial),
auxiliando
no
processo
de
cicatrização e reparo tecidual (SCHMIDT & KAO, 2007).
As variações nas funções exercidas pelos macrófagos relacionam-se
com a via de ativação destas células, sendo identificados dois fenótipos
macrofágicos heterogêneos: macrófago M1 e macrófago M2 (BROWN et al.,
2012) (Figura 3).
17
Figura 3. Representação esquemática dos fenótipos macrofágicos.
Fonte: Elaborada pela autora (adaptado de Brown et al., 2012).
Legenda: Macrófagos do fenótipo M1 e M2 representando extremos de um único espectro
celular, sendo seu fenótipo e função atribuídos de acordo com suas citocinas moduladoras e
aspectos do microambiente em que se encontram.
Em geral, macrófagos M1 (via de ativação clássica- citocinas derivadas
de Th1) atuam no processo inflamatório crônico, associando-se a citocinas próinflamatórias e na reação de corpo estranho, formando a cápsula fibrosa e/ou
degradando o material por fagocitose. Já macrófagos M2 (via de ativação de
cicatrização - citocinas derivadas de Th2) promovem a diminuição de citocinas
pró-inflamatórias que auxiliam no reparo tecidual, finalizando o processo
inflamatório (ANDERSON, JM et al., 2008). Contudo, a classificação dos
macrófagos em apenas dois fenótipos é genérica e minimalista, já que cada
fenótipo é plástico e resultado de microambientes complexos. Células
macrofágicas podem ainda ser ativadas por complexos imunes por meio da via
regulatória, responsáveis pela síntese de citocinas anti-inflamatórias (GORDON
& TAYLOR, 2005). Assim, torna-se mais adequado considerar macrófagos M1
e M2 como extremos de um único espectro celular com funcionalidades
distintas (Figura 4) (BROWN et al., 2012).
18
Figura 4. Representação esquemática das vias de ativação das células macrofágicas.
Fonte: Elaborada pela autora (adaptado de ABBAS AK., 2012).
Legenda: Via de ativação clássica- com citocinas derivadas de linfócitos Th1, atua no processo
inflamatório ativando macrófagos M1. Via de ativação alternativa- com citocinas derivadas de
linfócitos Th2, atua no processo inflamatório ativando macrófagos M2. Via de ativação
regulatória- com complexos imunes e citocinas derivadas de linfócitos Treg, atua no processo
inflamatório ativando macrófagos com fenótipos em transição, responsáveis pela síntese de
citocinas anti-inflamatórias.
Além da modulação dos macrófagos pelos subtipos de linfócitos Thelper,
estas células destacam-se ainda por atuarem direta e/ou indiretamente nas
reações de hipersensibilidade provocadas pela implantação do biomaterial.
Onde uma vez fagocitadas, partículas do material, são reconhecidas como
epítopos e apresentadas aos receptores destes linfócitos, estimulando a
proliferação de outros tipos celulares bem como a síntese de citocinas capazes
de promover a expansão clonal de novos linfócitos efetores e gerir células de
defesa especializadas na memória antigênica. Assim, a presença de linfócitos
compondo o infiltrado inflamatório pode ser associada não apenas à ativação
19
de células fagocitárias, mas a expressividade da resposta imunológica a partir
de uma nova exposição ao antígeno (ABBAS AK., 2015). Sabe-se hoje, que os
mecanismos da resposta imune e inflamatória frente à implantação de
biomateriais estão intimamente ligados a relação de macrófagos e biomateriais,
bem como a de biomateriais e células de corpo estranho, em processos
coordenados por citocinas, quimiocinas e fatores de crescimento (SCHUTTE et
al., 2009). Desta forma, compreender a função desempenhada por estes
mediadores inflamatórios, assim como elucidar o papel exercido por cada tipo
celular auxilia no desenvolvimento de novos materiais e técnicas, além de
aumentar a previsibilidade e atribuir novas aplicabilidades mais seguras aos
dispositivos já existentes.
Por sua inserção recente no mercado, trabalhos relacionados à
efetividade da matriz colágena suína (Mucograft®) têm se expandido
rapidamente, não sendo difícil encontrar suporte literário para questões como
eficácia no reparo tecidual, indicação para o aumento da faixa de gengiva
queratinizada em torno de dentes e implantes, menor impacto cirúrgico quando
comparado a enxertos autógenos, menor sintomatologia dolorosa, menores
dosagens
medicamentosas
pós-procedimento
e
estética
satisfatória
(SCHALLHORN et al., 2015). Todavia, a maior parte destas constatações
foram compiladas através de relatos de casos e estudos clínicos in vitro e in
vivo que não contemplam as relações de biocompatibilidade e imunogenicidade
em aspectos histológicos ou moleculares, assim como as interações celulares
ocorridas no sítio de reparo pós-implantação (FU JH et al., 2012). Tais lacunas
devem ser investigadas aprofundando os conhecimentos sobre a dinâmica
imunológica do receptor frente ao biomaterial implantado, elucidando suas
características na busca de melhorias ao paciente.
20
PROPOSIÇÃO
Avaliar a resposta imune e inflamatória desenvolvida frente a
implantação de uma matriz colágena suína (Mucograft®) no tecido subcutâneo
dorsal de camundongos Balb/c de acordo com parâmetros histomorfométricos.
Detalhadamente, os objetivos são:
Analisar a cinética de resposta e reabsorção da matriz colágena suína
(Mucograft®) nos períodos de 3, 9 e 21 dias em camundongos da linhagem
Balb/c;
Avaliar a intensidade da imunogenicidade da matriz colágena suína
(Mucograft®), de acordo com a cinética de reabsorção e desenvolvimento da
resposta imune e inflamatória, por meio de duas implantações subsequentes
do biomaterial, sendo a resposta à segunda implantação comparada a
implantação única (9 dias) por meio de análises histomorfométricas.
21
MATERIAL E MÉTODOS
Animais de Experimentação
Neste estudo foram utilizados camundongos machos, com idade
aproximada de 8 semanas e peso médio de 22,5g, disponibilizados pelo
biotério do Instituto Lauro de Souza Lima-ILSL/Bauru, São Paulo. Os animais
foram alimentados com ração sólida (Ração Ativada Produtor - Anderson &
Clayton S.A.) e água ad libitum durante todo o experimento e mantidos em
ambiente com controle de umidade, luz, temperatura e higiene. Dessa forma, o
protocolo adotado para a manipulação dos animais envolvidos na pesquisa
visou à preservação de suas condições fisiológicas normais, evitando injúrias
desnecessárias e garantindo a não interferência nos resultados encontrados. O
procedimento de implantação da matriz colágena suína foi realizado no
laboratório de Cirurgia Experimental do Biotério da Universidade do Sagrado
Coração-USC/Bauru
em
camundongos
BALB/c
para
análises
histomorfométricas (quantificação da reabsorção do biomaterial e perfil
inflamatório) nos períodos de 3, 9 e 21 dias. A avaliação da intensidade
imunogênica da matriz colágena suína foi realizada por meio de duas
colocações subsequentes desse biomaterial, sendo a resposta à segunda
implantação
comparada
a
implantação
única
por
meio
de
análise
histomorfométrica no período de 9 dias. A primeira implantação geraria a
sensibilização e após 15 dias, uma segunda implantação do mesmo antígeno
(matriz colágena suína) identificaria a natureza imunogênica desse biomaterial
de acordo com a resposta imunológica secundária. Para as diferentes análises
de cada grupo e cada período foram utilizados 5 animais totalizando 20
animais.
O número de animais de cada grupo experimental, os tempos de
análises e as atividades propostas, estão descritos sistematicamente no
cronograma de execução (Tabela 1), e foram determinados de acordo com
estudos prévios e experimento piloto. As datas que marcam os procedimentos
cirúrgicos
e
eutanásia
representadas (Figura 5).
dos
animais
estão
abaixo
esquematicamente
22
Figura 5. Implantação de matriz colágena suína (única e sequencial) e períodos de eutanásia.
Fonte: Elaborada pela autora.
Legenda: Tempo ‘zero’ representando o primeiro procedimento cirúrgico de inserção da matriz
colágena suína, seguido por eutanásias em 3, 9 e 21 dias após a data inicial de implantação da
matriz (grupos de implantação única). Posteriormente, 15 dias após o primeiro procedimento
cirúrgico realizou-se uma nova implantação da matriz, sendo estes animais eutanasiados 9
dias após a segunda exposição ao biomaterial (grupo implantação sequencial).
O presente trabalho foi aprovado pela Comissão de Ética no Uso de
Animais da Universidade do Sagrado Coração (CEUA/USC) sob o protocolo nº.
3049120216 (ANEXO I).
23
Tabela 1. Relação dos grupos experimentais avaliados frente à implantação de um biomaterial
(Matriz Colágena Suína) de acordo com o número de animais por período e tipo de análise
realizada.
Tipo de análise
Grupos
Períodos
Histomorfometria (HE/PicrosiriusRed)
Total
Matriz de Colágeno (MC)
Implantação única
Implantação
sequencial
3d
5 animais
5
9d
5 animais
5
21d
5 animais
5
9d
5 animais
5
20
Total
Fonte: Elaborada pela autora.
Material de implantação
A matriz colágena porcina, de nome comercial Mucograft® (Geistlich
Pharma AG Bussines Unit Biomaterials Bahnhofstrasse 40CH-6110 Wolhusen
Switzerland, com registro na ANVISA n°80102510884) é constituída por
colágeno do tipo I e III, possuindo características reabsorvíveis e conformação
tridimensional. A matriz apresenta uma estrutura compacta que possibilita a
cicatrização aberta, além de um suporte poroso que favorece a migração
celular local. De acordo com o fabricante, a espessura do biomaterial é de 2,5
mm, porém, um espessímetro digital (World Precision Instruments, Inc., USA)
foi usado para conferir e padronizar a espessura média da matriz. Uma vez que
esse biomaterial não exige processos de pré-hidratação ou tratamento préimplantação, para maior precisão e facilidade na obtenção das peças, utilizouse um punch de 6 mm de diâmetro, sendo as matrizes cortadas
assepticamente em câmara de fluxo.
Procedimento cirúrgico
A matriz de colágeno foi implantada nos animais sob anestesia via
intraperitoneal com aplicação de 100 mg/kg de cloridrato de Cetamina
(Dopalen® Sespo Indústria e Comércio – Divisão Vetbrands Saúde Animal,
24
Paulínia – São Paulo, Brasil) associado a 10 mg/kg de cloridrato de xilazina
(Anasedan® Sespo Indústria e Comércio – Divisão Vetbrands Saúde Animal,
Paulínia – São Paulo, Brasil), sedativo e relaxante muscular de uso animal,
respectivamente. Em seguida, realizou-se a tricotomia do dorso do animal com
auxílio de lâminas de barbear e solução fisiológica. Após o isolamento da área
cirúrgica, por meio de um bisturi com lâmina nº 15foram realizadas duas
incisões contra laterais de 1 cm no tegumento que reveste o dorso do animal,
com posterior divulsão do tecido conjuntivo, formando duas lojas cirúrgicas. Um
disco de matriz de colágeno foi implantado em cada loja cirúrgica, sendo um
lado utilizado para as análises histomorfométricas e outro para análises
moleculares. Os retalhos foram recolocados e suturados com fio vicryl –
poliglactina 910, violeta, trançado, n° 5-0 (Ethicon® - Johnson & Johnson). Os
animais foram mantidos em gaiolas individuais até o momento da realização do
procedimento de eutanásia para coleta das amostras.
Coleta de amostras
Após o término de cada período experimental, a eutanásia dos animais
foi realizada sob dose letal de anestésico (cloridrato de Cetamina 150 mg/kg
associado a cloridrato de xilazina 15mg/kg) via intraperitonial. Para a análise
histomorfométrica de cada período foram utilizadas amostras do tecido
subcutâneo de cada camundongo. Em cada loja cirúrgica de cada animal,
foram coletadas 3 amostras diferentes de tecido, sendo um sítio cirúrgico
destinado às análises histomorfométricas e o outro às análises moleculares,
que futuramente serão executadas.As amostras teciduais de cada loja cirúrgica
foram subdivididas em grupos: Teste, extraído da região tecidual onde a matriz
foi implantada, sujeito às reações inflamatórias locais promovidas pelo
biomaterial; Sham, aquele sujeito a possíveis reações inflamatórias em
decorrência apenas da injúria tecidual local no processo de incisão, divulsão e
sutura do tecido, sem contato direto com o biomaterial; e grupo Controle,
aquele que não sofreu nenhuma injúria tecidual relacionada ao procedimento
cirúrgico ou inserção da matriz (Figura 6).
25
Figura 6. Implantação de matriz colágena suína bilateralmente em camundongos Balb/c.
Fonte: Elaborada pela autora.
Legenda: À direita, amostras teciduais para análises histológicas. Á esquerda, amostras
teciduais destinadas às análises moleculares futuras. Grupo Teste: matriz aderida à região
tecidual; Sham: região sujeita a possíveis reações inflamatórias em decorrência apenas da
injúria tecidual local no processo de incisão, divulsão e sutura do tecido (sem contato direto
com o biomaterial); Controle: região que não sofreu nenhuma injúria tecidual relacionada ao
procedimento cirúrgico ou inserção da matriz.
As amostras destinadas a análise histomorfométrica foram submetidas
ao processo de fixação em formol tamponado a 10% e armazenadas a
temperatura ambiente para posterior processamento histológico.
26
Processamento histológico e coloração
Após a coleta das amostras e fixação, as peças foram submetidas a
procedimentos histológicos padronizados, com desidratação em álcool etílico,
diafanização em xilol e inclusão em Histosec® (parafina associada à resina
sintética – Laboratório Merck®). Um total de 7 cortes semi-seriados de 0,004
mm (4 µm) de espessura e com aproximadamente 0,9 mm de intervalo entre
eles, foram obtidos por meio de um micrótomo (Jung-Leica® RM2045),
abrangendo toda a extensão (6 mm) da matriz de colágeno (Figura 7). A
coloração foi realizada pela técnica de Hematoxilina e Eosina (HE) em todos os
grupos (Teste, Sham e Controle) nos diferentes períodos. Para evidenciar a
cinética de evolução das fibras colágenas, utilizou-se a técnica de coloração
PicrosiriusRed para as amostras do grupo Teste (matriz associada ao tecido)
nos tempos experimentais de 3, 9 e 21 dias.
Figura 7. Esquema da ordem dos cortes semi-seriados abrangendo toda a extensão do disco
da matriz colágena suína.
Fonte: Elaborada pela autora (adaptada de Silveira, 2012).
Legenda: 1) equivalente à porção inicial da matriz; 2 e 3) avançando em direção ao centro; 4)
corte correspondente a maior dimensão da membrana; 5 e 6) mais afastados do terço médio;
7) corte abrangendo a porção final da matriz, totalizando 7 cortes, nos períodos de 3, 9 e 21
dias.
27
Análise histomorfométrica
De acordo com a análise morfológica descritiva dos cortes histológicos
utilizando um microscópico óptico binocular (Olympus CH-2) e objetiva de
imersão de 100x, foi determinada a presença e a intensidade de infiltrado
inflamatório, células mononucleares, células gigantes multinucleadas (CGM),
presença de cápsula de tecido conjuntivo fibroso e sinais de reabsorção da
membrana na área implantada durante seu processo de reabsorção. As
imagens foram capturadas com auxílio do fotomicroscópio (Nikon Eclipse 80i;
Nikon Instruments INC. 1300 Walt Whitman Road, Melville, NY 11747-3064,
USA) e enviadas para o software (Image-Pro® Plus version 5.1.2 for Windows
XP; Media Cybernetics, INC. 8484 Georgia Avenue, Suite 200, Silver Spring,
MD 20910 USA) onde foram tratadas evidenciando a cinética de reabsorção da
matriz em cada período.
Para a análise morfométrica por planimetria, foram capturadas imagens
dos campos histológicos de cada amostra pertencente aos grupos Teste, Sham
e Controle, nos diferentes períodos experimentais com auxílio de uma câmera
(QIMAGING Micropublisher 3.3 Cooled, RTV 19535 56th Avenue, Suite 101
Surrey, BC, Canada) acoplada ao fotomicroscópio (Nikon Eclipse 80i). De cada
amostra foram obtidos 7 cortes semi-seriados de 0,004 mm de espessura e
com 0,9 mm de intervalo entre eles, e para mensurar a área total da matriz
utilizou-se o quarto corte semi-seriado do grupo Teste que contemplava a
totalidade do diâmetro do biomaterial. Desta forma, a área e perímetro da
matriz (mm2/mm) foram determinados pelo sistema de análise de imagem
digitalizada (Image-Pro® Plus version 5.1.2 for Windows XP; Media
Cybernetics, INC. 8484 Georgia Avenue, Suite 200, Silver Spring, MD 20910
USA), composto por um microscópico óptico binocular (Nikon Eclipse 80i),
objetiva com aumento de 4x, câmerae sistema de análise (QIMAGING
Micropublisher 3.3 Cooled) instalado em um computador (Windows XP;
Laboratório de Biologia Molecular/USC Bauru), totalizando 20 cortes analisados
no grupo Teste em relação cinética de reabsorção da matriz.
A análise morfométrica por densidade de volume das estruturas
envolvidas
no
processo
de
reabsorção
da
matriz
foi
caracterizada
quantitativamente nos diferentes períodos de acordo com a presença de fibras,
28
fibroblastos, vasos sanguíneos, células inflamatórias e coágulo na região de
implantação. De cada amostra foram obtidos 7 cortes semi-seriados de 0,004
mm de espessura e com 0,9 mm de intervalo entre eles, sendo escolhido o
quarto corte que contemplava a região central da matriz para a realização das
contagens. Com auxílio de um retículo de integração quadriculado (Opton,
código TA-0262, 10x10mm/100 divisões) com uma malha de 100 intersecções
colocado em uma ocular (Carl West Germany, Kpl 8x), as contagens foram
realizadas em um microscópio (Olympus CH-2) com objetiva de 40x,
circundando todo tecido adjacente à matriz (média de 19 campos analisados
por corte, com um espaço referente a 6 linhas do retículo entre uma contagem
e outra)contabilizando as estruturas sob cada intersecção da malha reticular
previamente estabelecida (10 linhas x 10 colunas). Para contabilizar os campos
a serem analisados nos grupos Sham e Controle, utilizou-se de uma média
aritmética da quantidade de campos observados no grupo Teste nos diferentes
períodos de tempo. Desta forma, os grupos Controle e Sham tiveram 19
campos analisados com espaçamento de 6 linhas reticulares entre uma
contagem e outra (Figura 8). Ao final das análises histomorfométricas por
densidade de volume foram analisados 60 cortes semi-seriados (20 cortes do
grupo Teste, 20 cortes do grupo Sham e 20 cortes do grupo Controle), em um
total médio de 1.900 estruturas teciduais contabilizadas por corte (uma
estrutura sob cada intersecção reticular nos 19 campos analisados, tendo cada
campo 100 intersecções).
29
Figura 8.Esquema de análise histomorfométrica de quantificação de estruturas por meio de
retículo acoplado á ocular.
Fonte: Elaborada pela autora.
Legenda: A direita, na objetiva de 40x é possível observar a área da malha retícular com um
total de cem intersecções previamente estabelecidas (cruzamento de 10 linhas e 10 colunas),
sendo contabilizada cada estrutura encontrada sob as intersecções delimitadas; A esquerda,
esquema mostra o posicionamento reticular adotado sobre o quarto corte semi-seriado
(diâmetro total) da matriz colágena suína.
Análise de Birrefringência
A formação e maturação das fibras colágenas ao redor da matriz após a
colocação do biomaterial (Mucograft®) foi analisada por meio da análise de
birrefringência com PicrosiriusRed e observada sob luz polarizada. De cada
amostra do grupo Teste foram obtidos 7 cortes semi-seriados de 0,004 mm de
espessura e com 0,9 mm de intervalo entre eles, corados pela técnica do
PicrosiriusRed.Utilizou-se o quarto corte semi-seriado que contemplava a
totalidade do diâmetro do biomaterial para observar a intensidade de
birrefringência das fibras colágenas promovidas através de uma lente
polarizada acoplada a um fotomicroscópio binocular (Nikon Eclipse 80i; Nikon
Instruments INC. 1300 Walt Whitman Road, Melville, NY 11747-3064, USA).
Foram capturadas 8 imagens por corte semi-seriado, sendo uma imagem
30
referente ao lado direito, uma do lado esquerdo, 3 imagens da área superior e
finalmente, 3 imagens da área inferior da matriz de modo a abranger quase que
integralmente o corte histológico relacionado ao tecido conjuntivo ao redor do
biomaterial (Figura 9). Em objetiva de 20x foi visualizada mais adequadamente
as fibras colágenas no tecido em reparação ao redor do biomaterial, desde as
mais finas (emitindo birrefringência na tonalidade verde) até as mais espessas
(emitindo birrefringência na tonalidade amarela e vermelha). Uma vez definida
uma quantidade ótima de luz no microscópio óptico para visualização das fibras
e o ângulo da lente polarizada (90 graus em relação a fonte de luz do
microscópio), todas as imagens foram capturadas com os mesmos parâmetros
(formato de cor RGB 24 pixels, tamanho 1024X768 pixels) e salvas em arquivo
de formato TIFF, em alta resolução (300 dots/inch- DPI).
Figura 9. Esquema de áreas analisadas para a quantificação de fibras colágenas em coloração
PicrosiriusRed
Fonte: Elaborado pela autora.
Legenda: Quarto corte semi-seriado com matriz colágena suína (maior diâmetro) e suas
respectivas áreas de captura de imagem a fim de abranger uma área de análise e
quantificação de fibras colágenas coradas com PicrosiriusRed.
A quantificação de intensidade do brilho de birrefringência foi realizada
utilizando o Software Image-Pro® Plus (version 5.1.2 for Windows XP; Media
Cybernetics, INC. 8484 Georgia Avenue, Suite 200, Silver Spring, MD 20910
31
USA). Inicialmente foram definidos os espectros da cor verde, amarela e
vermelha, seguindo valores de RGB (Red, Green e Blue) e estabelecidas suas
respectivas marcações de contraste (amarelo, verde e azul) as quais foram
padronizadas para todas as imagens capturadas. Por se tratar de uma análise
subjetiva foi necessário um treinamento prévio para calibração do examinador
referente à percepção dos espectros de cores e seus respectivos contrastes.
Uma vez capturada a imagem, cada espectro de cor emitido era marcado por
seu contraste, com auxílio de uma ferramenta de seleção manual presente no
software. As fibras mais finas e imaturas emitiam espectro verde e eram
marcadas por contraste amarelo, já as fibras intermediárias emitiam espectro
que variava de amarelo a alaranjado sendo coradas de modo contrastante em
verde, por fim as fibras mais espessas e maduras emitiam espectro vermelho
sendo suas marcações feitas em azul (Figura 10). Uma vez que todas as fibras
eram devidamente marcadas com seus contrastes, o software realizava a
quantificação dos tipos de fibras encontradas bem como o valor total destas
estruturas presente em cada imagem, sendo segregadas de tais quantificações
as fibras constituintes da matriz, uma vez que a área do biomaterial ainda que
capturada nas imagens era delimitada e excluída.
Figura 10. Seleção de espectros e contrastes para análise de birrefringência
32
Fonte: Elaborada pela autora.
Legenda: Quantificação dos diferentes tipos de fibras colágenas a partir da coloração de
contraste aplicada a cada espectro. Em amarelo estão marcadas as fibras colágenas de
birrefringência verde (mais finas e menos maduras). Em verde estão marcadas as fibras
colágenas de birrefringência amarela/alaranjadas (fibras intermediárias).
ANÁLISE ESTATÍSTICA
Após a obtenção dos dados, foram realizadas análises quanto às suas
distribuições. Quando os dados apresentaram distribuição normal, testes
paramétricos foram selecionados. Neste estudo, comparações entre múltiplos
grupos experimentais foram realizadas empregando o teste estatístico one-way
ANOVA complementado pelo teste de Tukey (distribuição Gaussiana) e Dunns
(quando os dados não apresentaram distribuição não normal). Quando análises
entre apenas dois grupos ou amostras se mostraram necessárias, foi utilizado
o teste “t” student. No caso de distribuição não normal dos dados, os testes de
Kruskal-Wallis, seguido pelo teste de Dunns ou Mann-Whitney foram utilizados.
Possíveis correlações foram analisadas através de regressão linear ou do teste
de Pearson. Todos os testes estatísticos foram avaliados ao nível de
significância de 5% (p<0.05) e foram aplicados através dos programas
GraphPad InStat e Prism7 (GraphPad, San Diego, CA).
RESULTADOS
Cinética de resposta e reabsorção da matriz colágena suína
(Mucograft®) em camundongos Balb/c
Durante a fase inicial do experimento, foi realizada implantação da
matriz colágena suína em tecido subcutâneo da região dorsal de camundongos
Balb/c nos períodos experimentais de 3, 9 e 21 dias para posterior análise da
resposta tecidual, tempo de permanência e processo de reabsorção do
biomaterial
implantado.
Na
fase
subsequente,
avaliou-se
a
possível
imunogenicidade da matriz colágena por meio da sua reimplantação no período
experimental de 9 dias após o segundo procedimento cirúrgico. Os resultados
encontrados estão abaixo elucidados.
33
Análise histomorfométrica
De acordo com a análise morfológica descritiva dos cortes histológicos
observa-se que o grupo experimental de 3 dias (Figura 11- A1 e A2) apresenta
uma grande conservação do biomaterial implantado, uma vez que a matriz se
encontra praticamente íntegra, com pequenos e raros pontos de degradação. É
possível verificar ainda a presença de um infiltrado inflamatório, contudo tal
infiltrado é ainda inicial, limitando-se a uma pequena área adjacente a matriz.
Em 9 dias (Figura 11- B1 e B2) nota-se sinais de reabsorção ao longo de toda
extensão do biomaterial, com aumento expressivo do infiltrado inflamatório e
numerosas células polimorfonucleares nas regiões de borda, bem como na
região central, ainda que em menor quantidade. Próximo aos pontos menos
preservados, encontramos células mononucleares além de células gigantes
multinucleadas destacando-se a presença de uma cápsula fibrosa de tecido
conjuntivo circundando a matriz e segregando-a do tecido conjuntivo frouxo da
região. No tempo experimental de 21 dias (Figura 11- C1 e C2) a matriz
encontra-se em estágio mais avançado de degradação com poucos
remanescentes preservados. Neste período observa-se um aumento do
número de células gigantes multinucleadas que se acumulam ao redor dos
esparsos pontos ainda não totalmente degradados, eleva-se a quantidade de
infiltrado inflamatório na região central da matriz, além da presença de
fibroblastos e fibras compondo o tecido conjuntivo ao redor do material
implantado.
34
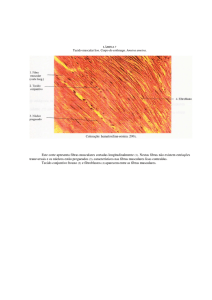
Figura 11. Fotomicrografia de tecido subcutâneo de camundongo Balb/c submetido à
implantação de matriz colágena suína.
Fonte: Elaborada pela autora.
Legenda: A1 e A2) 3 dias, matriz praticamente íntegra com presença de infiltrado inflamatório.
B1 e B2) 9 dias, sinais de reabsorção da matriz, infiltrado inflamatório com células
mononucleares e presença de cápsula de tecido conjuntivo fibroso ao redor do biomaterial. C1
e C2) 21 dias, reabsorção da matriz em fase adiantada, com poucos pontos preservados.
Matriz (*); áreas de reabsorção da matriz (cabeça de seta preta); cápsula de tecido conjuntivo
fibroso (seta vermelha); células gigantes multinucleadas (cabeça de seta vermelha). Objetivas
de 10x e 40x. HE.
No grupo submetido à implantação sequencial da matriz a eutanásia foi
realizada no período de 9 dias posteriores ao processo de reimplantação. De
acordo com a análise histológica descritiva, observou-se a presença de uma
cápsula fibrosa espessa associada a uma quantidade mais expressiva de
infiltrado inflamatório ao redor da matriz. Verificou-se ainda a presença de
35
células gigantes multinucleadas nas áreas de borda mais degradadas do
material, porém, tais células se encontravam em maior número quando
comparadas ao período experimental de 9 dias com implantação única. Notouse também a presença de polimorfonucleares compondo grande parte do
infiltrado (Figura 12- A1 e A2). O biomaterial encontrava-se menos degradado,
com menores áreas de reabsorção situadas principalmente nas bordas. Já sua
porção central manteve a integridade semelhante ao período de 3 dias com
implantação única.
Figura 12. Fotomicrografia de tecido subcutâneo de camundongo Balb/c comparando
implantação única e implantação sequencial da matriz colágena suína no período de 9 dias.
Fonte: Elaborada pela autora.
Legenda: A1 e A2) matriz 9 dias após o segundo procedimento cirúrgico de implantação,
comparação entre as objetivas de10 e 40x, respectivamente. B1) matriz 9 dias após o primeiro
procedimento cirúrgico (implantação única) com objetiva de 40x. B2) matriz 9 dias após o
segundo procedimento cirúrgico (implantação sequencial) com objetiva de 40x, nota-se sinais
de reabsorção associados às áreas de borda, porém observa-se uma maior integridade do
biomaterial quando comparado com o período de 9 dias de implantação única. Destaca-se a
presença de infiltrado inflamatório predominantemente formado por células mononucleares em
9 dias implantação única.Matriz (*); áreas de reabsorção da matriz (cabeça de seta preta);
cápsula de tecido conjuntivo fibroso (seta vermelha); células gigantes multinucleadas (cabeça
de seta vermelha).
36
De acordo com a análise morfométrica por planimetria, a área da matriz
e seu percentual de reabsorção nos períodos de 3, 9 e 21 dias foram
analisados pelo sistema digital de observação de imagens (Image-Pro® Plus
version 5.1.2 for Windows XP; Media Cybernetics, INC. 8484 Georgia Avenue,
Suite 200, Silver Spring, MD 20910 USA). No período inicial de 3 dias, a área
da matriz mostrou-se bastante preservada (área 1469,22 mm2), porém no
decorrer do tempo, 9 dias (área 1158,78 mm2) e 21 dias (área 1073,10 mm2)
houve uma crescente elevação na taxa de reabsorção do biomaterial com uma
consequente diminuição da área (Figura 13).
Figura 13. Cinética de resposta e reabsorção de matriz colágena suína em camundongos
Balb/c.
Fonte: Elaborada pela autora.
Legenda: Avaliação morfométrica (análise por planimetria) dos cortes com diâmetro total da
matriz (quarto corte semi-seriado de cada período experimental) corados pela técnica de HE,
2
quanto à área da matriz (µm ) nos tempos de 3, 9 e 21 dias. Letras diferentes indicam valores
estatisticamente diferentes entre os grupos analisados (p<0.05).
Em análise descritiva, o grupo que recebeu a reimplantação da matriz
apresentou poucos pontos de degradação do biomaterial, sendo sua
integridade de área visualmente semelhante ao período de 3 dias com
implantação
única.
Contudo,
os
valores
assumidos
pela
análise
histomorfométrica demonstram que a cinética de reabsorção da matriz ocorreu
37
de maneira similar tanto para o grupo de implantação única (área 1158,78
mm2) como no de implantação sequencial (área 1446,83 mm2) no período de 9
dias, não havendo, portanto, diferenças significativas entre os grupos em
relação à área reabsorvida,não apresentando um padrão diferenciado na
cinética de reabsorção (Figura 14).
Figura 14. Cinética de resposta e reabsorção de matriz colágena suína em camundongos
Balb/c: implantação única x sequencial.
Fonte: Elaborada pela autora
Legenda: Avaliação morfométrica (análise por planimetria) dos cortes com diâmetro total da
matriz (quarto corte semi-seriado de cada período experimental) corados pela técnica de HE,
2
quanto à área da matriz (µm ) nos tempos 9 dias implantação única e 9 dias implantação
sequencial (após o segundo procedimento cirúrgico). Letras diferentes indicam valores
estatisticamente diferentes entre os grupos analisados (p<0.05).
Por meio da análise histomorfométrica foram avaliadas e quantificadas
as estruturas envolvidas no processo inflamatório tais como vasos sanguíneos,
número
de
coágulo,
(polimorfonucleares,
fibroblastos,
linfócitos
e
fibras
macrófagos)
e
nos
células
inflamatórias
diferentes
períodos
experimentais de 3, 9 e 21 dias. A densidade de volume de coágulo e vasos
sanguíneos não sofreram modificações expressivas em todos os tempos
experimentais, entretanto o número de vasos apresentou um discreto aumento
no período de 21 dias já a quantificação de coágulo teve sua maior
38
representatividade em 3 dias (Figura 15). Quando quantificado o número de
fibroblastos observa-se um aumento deste tipo celular a partir do período de 9
dias, não havendo diferenças significativas com o grupo de 21 dias. Salienta-se
que na quantificação de fibra em coloração por Hematoxilina e Eosina não foi
observada diferença significativa entre o grupo experimental de implantação
única e o grupo de implantação sequencial no período de 9 dias(Figura 15). Em
análise por PicrosiriusRed, nota-se um maior número de fibras nos tempos de
21 e 9 dias, respectivamente, sendo os valores assumidos pelo grupo de
implantação sequencial (9 dias) estatisticamente semelhantes aos encontrados
no grupo de implantação única no período de 3 dias (Figura 17)
O número de coágulo e vasos sanguíneos encontrados foi superior no
grupo de implantação sequencial quando comparado ao período de 9 dias com
o grupo de implantação única, contrapondo o número de fibroblastos, que no
período de 9 dias em implantação única exibiu valores duas vezes maiores que
no mesmo período em implantação sequencial (Figura 15).
39
Figura 15. Densidade de volume (valores absolutos) de vasos, coágulos, fibroblastos e fibras
em camundongos Balb/c.
Fonte: Elaborada pela autora.
Legenda: Implantação de matriz colágena suína nos períodos de 3, 9 e 21 dias, nos cortes
corados pela técnica de HE. Letras diferentes indicam valores estatisticamente diferentes entre
os períodos experimentais analisados (p<0.05).
O número de fibras aumentou gradualmente ao longo dos períodos
experimentais alcançando valores mais expressivos em 21 dias. Tais
resultados foram confirmados por meio da coloração em PicrosiuriusRed, onde
foi possível detectar e mensurar os tipos de fibras colágenas existentes no
tecido ao redor da matriz. Assim, no período de 3 dias observa-se uma menor
quantidade de fibras quando comparadas ao período de 9 e 21 dias,
respectivamente. Verificou-se ainda que o tipo de colágeno e organização
estrutural das fibras sofreu alterações ao longo dos tempos experimentais,
40
onde no período de 3 dias tínhamos uma presença mais acentuada de fibras
imaturas (aquelas coradas pelo espectro verde e contrastadas em amarelo
para permitir a contabilização) quando comparadas ao período de 9 e 21
dias(Figura 16).
Figura 16. Fotomicrografia de tecido subcutâneo de camundongo Balb/c adjacente à matriz
colágena suína.
Fonte: Elaborada pela autora.
Legenda: A1) matriz 3 dias após o procedimento cirúrgico de implantação. A2) matriz 9 dias
após o primeiro procedimento cirúrgico. A3) matriz 21 dias após o primeiro procedimento
cirúrgico A4) matriz 9 dias após o segundo procedimento cirúrgico de implantação. Matriz (*);
Objetiva: 20 x. PicrosiriusRed.
A dinâmica de maturação das fibras colágenas ocorreu de maneira
crescente, onde no período de 21 dias foi observado maior número de fibras
maduras (aquelas coradas pelo espectro vermelho e contrastadas em azul para
permitir a contabilização). As fibras de organização estrutural intermediária
(aquelas coradas em espectro alaranjado e/ou amarelado e contrastadas em
verde para permitir a contabilização) se mantiveram constantes durante todo o
41
processo de reparo tecidual, sendo elas uma ponte entre as fibras imaturas e
fibras com organizações estruturais complexas (Figura 17).
Figura 17. Densidade de volume (valores absolutos) de fibras colágenas ao redor da matriz
colágena suína compondo o tecido subcutâneo de camundongos Balb/c e seus respectivos
perfis de maturação colágena nos diferentes tempos experimentais.
Fonte: Elaborada pela autora.
Legenda: implantação de matriz colágena suína nos períodos de 3, 9 e 21 dias, nos cortes
corados pela técnica de PicrosiriusRed afim de acompanhar a maturação das fibras colágenas
e contabilizar seus valores em cada grupo. As cores verde, amarelo e vermelho representam o
espectro emitido por cada tipo de fibra colágena, sendo as fibras imaturas verdes, as
intermediárias alaranjadas/amareladas e as maduras vermelhas. Letras diferentes indicam
valores estatisticamente diferentes entre os períodos experimentais analisados (p<0.05).
O número de células inflamatórias encontradas foi estatisticamente igual
nos períodos de 3, 9 e 21 dias no grupo de implantação única. Entretanto, no
período de 9 dias com implantação sequencial obtivemos um número superior
de células inflamatórias compondo o infiltrado, indicando um processo
inflamatório mais acentuado na segunda colocação do biomaterial (Figura
42
18).Já o fato dos valores assumidos nos períodos de 3, 9 e 21 de implantação
única serem estatisticamente iguais demonstra a equidade do processo
inflamatório no decorrer do tempo.
Figura 18. Densidade de volume (valores absolutos) de células inflamatórias encontradas em
camundongos Balb/c.
Fonte: Elaborada pela autora
Legenda: implantação de matriz colágena suína nos períodos de 3, 9 e 21 dias, nos cortes
corados pela técnica de HE afim contabilizar a células inflamatórias presentes no infiltrado. Em
preto, valores assumidos pelos diferentes períodos de implantação única. Em cinza, valores
referentes às células inflamatórias encontradas no período de 9 dias de implantação
sequencial. Letras diferentes indicam valores estatisticamente diferentes entre os períodos
experimentais analisados (p<0.05).
Ao analisarmos os valores encontrados para a quantificação de células
inflamatórias nos diferentes grupos (Controle, Sham e Teste) nota-se que o
grupo Teste, ou seja, o tecido que recebeu a matriz, apresenta um maior
número de células inflamatórias contabilizadas quando comparado ao grupo
Sham e Controle em todos os períodos experimentais (Figura 19).Já os valores
encontrados para o grupo Sham, ou seja, o tecido sob influência do
procedimento cirúrgico (incisão/divulsão/sutura), são superiores aos assumidos
pelo grupo Controle nos períodos experimentais de 3 e 9 dias, demonstrando
que independentemente do biomaterial, o procedimento cirúrgico também
desencadeia uma reação inflamatória local, contudo tal reação foi menor que a
provocada pela implantação da matriz.
43
Figura 19. Densidade de volume (valores absolutos) de células inflamatórias encontradas em
camundongos Balb/c nos diferentes grupos experimentais (Teste, Sham e Controle).
Fonte: Elaborada pela autora.
Legenda: implantação de matriz colágena suína nos períodos de 3, 9 e 21 dias, nos diferentes
grupos (Teste, Sham e Controle) em cortes corados pela técnica de HE afim contabilizar a
células inflamatórias presentes no infiltrado. Letras diferentes indicam valores estatisticamente
diferentes entre os grupos experimentais analisados (p<0.05).
DISCUSSÃO
Nos últimos anos, muito se avançou no campo da engenharia tecidual e
da biotecnologia possibilitando a utilização de diversos materiais para reparo
ou mesmo substituição de tecidos e/ou funções perdidas por traumas, doenças
ou em decorrência do processo natural de envelhecimento do organismo
(MIGUEZ-PACHECO et al., 2015). Com o aumento da expectativa de vida da
população, os biomateriais se tornaram importantes ferramentas para
promoção da qualidade de vida, uma vez que se associam desde pequenos
44
reparos estéticos ao reestabelecimento da capacidade funcional de órgãos e
tecidos danificados (BAINO et al., 2015).
Em razão da crescente demanda e do rápido desenvolvimento
tecnológico, todos os dias novos materiais surgem no mercado cabendo a
ciência dos biomateriais elucidar os processos que compõem a resposta
biológica frente à implantação destes dispositivos, bem como sua interação
com o sistema imune do organismo receptor.
O biomaterial aplicado como objeto deste estudo, a matriz colágena
suína (Mucograft®) está disponibilizado comercialmente desde 2009 sendo
amplamente empregado na prática clínica para a reconstrução e fechamento
de alvéolos, recobrimento radicular e ósseo, aumento da mucosa queratinizada
ao redor de dentes e implantes, além de outros procedimentos de reparo
tecidual como substituto a enxertos de tecido conjuntivo autógeno em casos de
recessão gengival (SANZ et al., 2009; FROUM et al., 2015). Entretanto, mesmo
com suas aplicações clínicas bem estabelecidas há na literatura poucos
trabalhos que contemplem aspectos histológicos e moleculares da interação do
sistema biomaterial/hospedeiro pós-implantação da matriz colágena suína. Em
vista disto, essa discussão será conduzida sem o propósito de comparar
diferentes biomateriais, resultados ou metodologias, mas sim, relacionar a
resposta imune e inflamatória frente à implantação da matriz colágena suína
com os resultados obtidos, desde a sua implantação, processo de reabsorção e
reparo dos tecidos e estruturas envolvidas.
Para compreensão do comportamento do organismo pós-implantação do
biomaterial, avaliou-se a resposta imune, inflamatória e os possíveis processos
relacionados a cinética de reabsorção da matriz colágena suína inserida no
tecido subcutâneo dorsal de camundongos Balb/c, avaliando-se parâmetros
histomorfométricos.
Foram utilizados como modelo experimental camundongos adultos (8
semanas) da linhagem Balb/c, sendo esta escolha baseada em critérios como
a
semelhança
tecidual
entre
camundongos
e
humanos;
acelerado
metabolismo, permitindo a observação de resultados em um menor período de
tempo; disponibilidade de obtenção dos animais em biotério confiável próximo
45
à universidade, diminuindo o estresse causado pelo deslocamento até o local
de experimentação e assegurando a sanidade dos animais; além do baixo
custo de manutenção e praticidade no manuseio (OERTELT-PRIGIONE et al.,
2011). Adicionalmente, para garantir à eficácia dos resultados apresentados,
foram selecionados para o estudo apenas camundongos machos uma vez que
as fêmeas possuem um ciclo estral curto (4-5 dias) sofrendo importantes
variações hormonais que podem influenciar direta ou indiretamente nas
respostas imune e inflamatória. Salienta-se a importância de que todos os
animais possuíam idade e peso corpóreo similar, já que tanto a idade como
fatores nutricionais também influenciam na fisiologia do organismo, afetando
nossas variáveis, resposta imune e inflamatória (CHORILLI et al., 2007). Em
associação aos critérios já mencionados é estabelecido que camundongos são
modelos experimentais de utilização bem consolidada na área de imunologia
pela facilidade em realizar manipulações genéticas que determinam a
expressão ou ausência de determinados fatores relacionados aos mecanismos
da resposta imunológica. Desta forma, é possível estabelecer relações de
causa e efeito, suprimir ou aperfeiçoar o sistema imune e avaliar com maior
precisão os processos envolvidos no reparo tecidual em homeostase (KORPI
et al., 2009; TOMOMATSU et al., 2009), aspectos esses, importantes para a
condução de futuros desdobramentos desta pesquisa.
Para melhor avaliação dos processos fisiológicos abordados nesta
discussão é necessário primeiramente definirmos algumas terminologias
relacionadas ao processo de recuperação tecidual. Assim, ressalta-se que o
reparo e a regeneração tecidual são dois processos distintos, porém
igualmente complexos. O reparo tecidual envolve um grande número de células
e mediadores capazes de regular o processo de cicatrização, que na maioria
das
lesões ocorre pela formação de um tecido fibroso, sintetizado
principalmente por fibroblastos e denominado cicatriz (AARABI et al., 2007).
Deste modo, o tecido reparado, é constituído por um tecido conjuntivo
semelhante ao tecido originalmente lesionado em forma e função, ainda que
considerados tecidos diferentes (RUH et al., 2013). Já o processo de
regeneração tecidual, preconiza a substituição de células mortas ou
danificadas por novas células exatamente idênticas às originais, sendo a
46
restituição tecidual total e de idêntica morfologia e funcionalidade ao tecido
anteriormente lesionado (MESCHER & NEFF, 2005). Mesmo sendo atribuído a
quase todos os seres vivos, o processo de regeneração depende da
complexidade tecidual do organismo, sendo que espécies com uma maior
quantidade de tecidos diferenciados têm uma menor capacidade regenerativa
(KNAKIEVICZ, 2007). Nos mamíferos a capacidade de regeneração tecidual é
bastante limitada e quase que exclusiva a alguns tecidos, como por exemplo, o
tecido hepático, que pode se regenerar em até 70% (MESCHER & NEFF,
2005). Portanto, apresentadas as definições e evidenciadas as dificuldades que
envolvem a regeneração tecidual, os processos aqui esclarecidos se
relacionam ao reparo tecidual frente à implantação da matriz colágena suína.
Biomateriais a base de colágeno, atualmente vêm sendo empregados
em inúmeros procedimentos odontológicos. As matrizes (‘scaffolds’) a fim de
recuperar/guiar tecidos perdidos, enquanto as membranas atuam como
barreiras físicas à invasão precoce de tecidos indesejáveis (SCHALLHORN et
al ., 2015; COSTA et al., 2016). Para o reparo de tecidos moles no tratamento
de recessões gengivais e aumento da mucosa queratinizada, o enxerto
autógeno de palato ainda é considerado padrão ouro, contudo essa técnica
apresenta limitações significativas quanto à dimensão da área a ser reparada,
maior área cirúrgica (leito doador/receptor) e maior morbidade pós-operatória
(NEVINS et al., 2011; RAMALINGAM et al., 2016). Assim, a utilização de
biomateriais que atendam tais limitações promove maior conforto ao paciente
proporcionando uma quantidade ilimitada de material, em caso de múltiplas
recessões, e aumentam as chances de sucesso clínico. Analisando ainda os
aspectos biológicos, a utilização das matrizes colágenas é bastante viável, já
que o colágeno exógeno, por se assemelhar aos componentes da matriz
extracelular, é capaz de promover a hemostasia e quimiotaxia de granulócitos,
macrófagos e fibroblastos, sendo esses elementos essenciais para o processo
de cicatrização e reparo tecidual (LEE et al., 2001)
A matriz colágena suína (Mucograft®) é composta por colágeno do tipo I
e III, sendo essas formas comumente empregadas em dispositivos e
aplicações médicas em razão de suas propriedades de biodegradação e
biocompatibilidade (SANZS et al., 2009). O colágeno tipo I é um dos principais
47
constituintes do tecido conjuntivo de mamíferos, representando 30% do total de
proteínas presentes nestes animais (JUNQUEIRA & CARNEIRO, 2013). Na
confecção de biomateriais, o colágeno pode vir de diversas fontes naturais ou
exógenas. Neste estudo, o biomaterial utilizado tem como fonte colágena
fragmentos epiteliais suínos, purificados e tratados sem adição de glutaraldeído
para obtenção de sua forma estrutural ativa. A ausência de glutaraldeído
favorece a baixa antigenicidade do biomaterial, pois, tais tratamentos químicos,
ainda que fortaleçam a conformação estrutural da matriz, geram resíduos
passíveis de provocar alergias e outras reações imunológicas (SPEER et al.,
1979; SPEER et al., 1980; HUC, A. 1985).
Após a implantação da matriz de colágeno suíno (Mucograft®) nos
tempos experimentais de 3, 9 e 21 dias observou-se a resposta tecidual, o
tempo de permanência e o processo de reabsorção deste biomaterial. A
análise histológica descritiva demonstrou resultados inicialmente esperados,
tais como a ocorrência de um processo inflamatório ameno logo após a
implantação da matriz, com infiltrado caracterizado pela presença de
numerosas células mononucleares. No decorrer do tempo, a reabsorção da
matriz transcorreu de maneira gradativa, acompanhada de mudanças na
composição do infiltrado inflamatório. No período de 9 e 21 dias, tal infiltrado
apresentava um grande número de células gigantes multinucleadas associadas
às regiões de borda da matriz, local primariamente povoado por leucócitos.
Além disto, destaca-se a presença de fibroblastos, associados ao aparecimento
progressivo de uma cápsula fibrosa adjacente ao biomaterial. Verificou-se
ainda, que no período experimental de 9 dias, o número de células gigantes
multinucleadas encontradas era superior ao de 21 dias, indicando o pico de
resposta inflamatória neste período. Resultados semelhantes são encontrados
ao analisarmos a implantação de outros biomateriais capazes de formar
sistemas biocompatíveis (ANDERSON, JM et al., 2008). Assim, a reação
provocada pela inserção de tais materiais ocorre de maneira acentuada nos
períodos
iniciais
sendo
posteriormente
caracterizada
por
respostas
imunológicas de baixa magnitude ao longo do processo de reabsorção, sendo
que em geral, tais respostas não têm potencial para causar ônus consideráveis
ao receptor (ANDERSON, JM et al., 2008).
48
A presença da resposta inflamatória, ainda que pouco expressiva,
corrobora com o conceito de que nenhum biomaterial pode ser considerado
inerte uma vez que todos têm a capacidade de induzir respostas advindas do
sistema imune do organismo no
qual ele foi inserido.
Todavia, a
biocompatibilidade do material se relaciona com seu potencial imunogênico, ou
seja, a intensidade das reações inflamatórias causadas por sua implantação
deve ser amena. Além disso, a velocidade com que tais reações ocorrem
devem ser atentamente avaliadas, pois respostas imunológicas exacerbadas
por um grande período de tempo resultam em gasto energético, dano tecidual e
prejuízos ao organismo por romper a homeostasia (WILLIAMS et al ., 2015).
Em análise morfológica quantitativa, o período experimental de 3 dias
pós-implantação da matriz colágena suína, apresentou sinais evidentes da
formação de um processo inflamatório, como aumento no número de células
inflamatórias mononucleares ao redor do biomaterial implantado, proliferação
de células endoteliais e manifestação de polimorfonucleares compondo o
infiltrado, associados a raros pontos de degradação do material (área 1469,22
mm2). Ao longo do tempo verificou-se mudanças no perfil da inflamação
acompanhadas do processo de reabsorção da matriz. O período de 9 dias
(área
1158,78
mm2)apresentava
um
infiltrado
bem
mais
expressivo
estendendo-se por toda dimensão do material, com um grande número de
células mononucleares, presença de células gigantes multinucleadas e
aumento na porcentagem de polimorfonucleares contabilizados. O número de
fibras encontradas foi superior no período de 21 dias (área 1073,10 mm2)
quando comparado aos demais tempos experimentais. Ao analisarmos às
fibras colágenas em PicrosiriusRed, observou-se uma maturação gradativa,
onde o período de 3 dias apresentava um maior número de fibras imaturas, o
de 9 dias fibras intermediárias e finalmente, o período de 21 dias com um
grande número de fibras colágenas maduras, atestando as mudanças na
organização tecidual local. Associado ao crescente número de fibras, tal
período (21 dias) foi marcado por uma redução no infiltrado inflamatório,
localizando-se apenas ao redor dos raros pontos preservados da matriz ou
ainda adjacente a cápsula fibrosa, que nesse período se encontrava bem
menos espessa. As células gigantes multinucleadas, agora em maior número,
49
concentravam-se nas áreas ainda não degradadas do material, sendo
raramente acompanhadas por polimorfonucleares.
O sucesso da implantação da matriz colágena suína está diretamente
associado ao seu tempo de reabsorção, pelo fato de que o processo de reparo
tecidual ocorre de maneira gradativa ao longo do período de cicatrização. A
cinética de reabsorção do biomaterial relaciona-se com os mecanismos imunes
e inflamatórios, pois algumas células inflamatórias e citocinas são responsáveis
por modular a degradação do colágeno. A literatura relata um aumento
relevante no número de macrófagos no decorrer de um processo inflamatório
crônico, sendo essas células de grande importância para liberação e ativação
de citocinas e outros mediadores capazes de modular à resposta imune
causada pela inserção do biomaterial.
As funções exercidas pelos macrófagos vão depender da via de ativação
destas células, onde macrófagos ativados por citocinas derivadas de Th1 (via
clássica) se relacionam à degradação da matriz; macrófagos ativados por
subprodutos de Th2 (via de cicatrização) promovem a diminuição de citocinas
pró-inflamatórias que auxiliam no processo de reparo tecidual; e por fim,
macrófagos ativados por complexos imunes (via regulatória) secretam citocinas
anti-inflamatórias responsáveis por finalizar o processo de reparo e reabsorção,
sendo em geral, as três vias atuantes de modo simultâneo no decorrer do
processo inflamatório (ANDERSON, JM et al., 2008).
Uma vez implantado o material, macrófagos são recrutados para o sítio
implantação e por quimiotaxia ativam e agregam-se a outros macrófagos em
uma fusão resultante em células gigantes multinucleadas, sendo que tais
células se encarregam pela degradação da matriz por meio de processos
fagocitários e estão presentes, ainda que em menor número, até a completa
reabsorção do biomaterial, como visto no período de 21 dias. As células
gigantes são responsáveis também por expressar citocinas que ativam e
modulam a atuação de neutrófilos, o que explicaria a presença de
polimorfonucleares próximos as regiões onde as células gigantes estavam
localizadas, ainda que um processo inflamatório crônico já tivesse sido
instaurado (ABBAS AK., 2012).
50
A reabsorção do biomaterial ocorre em ambiente extracelular e é
mediada por colagenases séricas (elastase, catepsina C e proteinase neutra) e
metaloproteinases, moduladas por citocinas produzidas a partir de células
endoteliais, fibroblastos e células inflamatórias (WILLIAMS et al., 2015).
Portanto, a presença acentuada de fibroblastos e células inflamatórias a partir
do período de 9 dias pode se associar diretamente à evolução no processo de
degradação da matriz. Sabe-se ainda, que as metaloproteinases exercem
papel fundamental na remodulação do colágeno através da hidrólise de
componentes da matriz extracelular, liberando fatores de crescimento e
citocinas que atuam sobre a constituição do biomaterial. Ademais, estudos
demonstram que macrófagos e células gigantes aderidos ao biomaterial são
capazes de sintetizar tais metaloproteinases (MMP-9, MMP-1, MMP-8 e MMP13), sugerindo que o aparecimento das células gigantes multinucleadas
aceleraria o processo de degradação do material (JONES et al., 2008), como
visto a partir do período de 9 dias.
Conhecer os componentes e mecanismos imunológicos que atuam
sobre o biomaterial pós-implantação propiciam ao cirurgião dentista maior
segurança na escolha deste material. Desta forma, o experimento de
reimplantação da matriz colágena suína é fundamental para solucionar
questões do ponto de vista clínico, uma vez que partimos do pressuposto que
uma segunda exposição geraria respostas imunológicas mais rápidas e de
maior expressividade que podem comprometer a previsibilidade do biomaterial.
Na prática clínica, algumas patologias podem exigir múltiplas exposições do
paciente ao material em decorrência de lesões ao longo do tempo, como no
caso da doença periodontal. A doença periodontal é definida como diferentes
processos patológicos que afetam o periodonto de proteção e de sustentação
(PION et al., 2006), podendo ser subdividida em duas entidades principais: a
gengivite, forma mais moderada da doença que acomete apenas o periodonto
de proteção, e a periodontite, forma patológica mais severas que acomete o
ligamento periodontal, cemento e osso alveolar (THE ACADEMY OF
PERIODONTOLOGY, 2001). O Biofilme bacteriano de Porphyromonas
gingivalis e Aggregatibacter actinomycetemcomitans é considerado um dos
fatores etiológicos primários das doenças periodontais, contudo, a severidade
51
da destruição tecidual está intimamente relacionada à resposta imune e
inflamatória do hospedeiro (SHLEZINGER et al., 2016).Assim, em quadros
mais avançados da doença, não é incomum que o paciente seja submetido a
várias colocações do biomaterial como alternativa de reparo tecidual
(SCHMITT et al., 2015).
Tendo em vista o conceito de antigenicidade, um material só pode ser
classificado sendo de natureza não imunogênica a determinado antígeno
quando previamente exposto a uma sensibilização inicial e submetido à uma
segunda exposição subsequente ao mesmo antígeno, não apresentando
respostas imunológicas exacerbadas na segunda exposição (ABBAS AK.,
2012). Desta forma, acreditávamos que o procedimento de reimplantação do
biomaterial geraria respostas inflamatórias mais ávidas, uma vez que o sistema
imune já estava previamente ativado.
Ao comparar o período de 9 dias de única implantação com o mesmo
período de implantação sequencial, nota-se um aumento significativo no
número de células inflamatórias encontradas, sugerindo uma resposta
inflamatória mais acentuada na implantação posterior. Em análise descritiva,
observou-se a presença mais evidente de células gigantes multinucleadas
associadas ás áreas de bordas no período de 9 dias com implantação
sequencial, ratificando a ideia de um processo inflamatório de maiores
proporções gerado pela segunda inserção do material.
A partir de tais
evidências, ao analisarmos a cinética de reabsorção da matriz colágena suína
esperávamos encontrar menores valores de área no grupo que recebeu a
implantação sequencial do biomaterial. Isto porque, o grande número de
células inflamatórias implicaria no aumento da produção de citocinas e outros
mediadores químicos, capazes de promover a degradação da matriz mais
avidamente em razão da prévia ativação do sistema imune na primeira
colocação. Todavia, não identificamos diferenças significativas em relação aos
valores de área obtidos no procedimento de implantação única (área 1158,78
mm2) comparados com de implantação sequencial (área 1446,83 mm2), ambos
no período de 9 dias. Ou seja, ainda que possuísse um processo inflamatório
52
incontestavelmente mais expressivo, o grupo que recebeu a recolocação do
material não demonstrou aumento na velocidade de degradação da matriz.
Em
um
trabalho
semelhante,
Silveira
(2012),
ao
analisar
a
biocompatibilidade de membranas reabsorvíveis de colágeno bovino, também
verificou um aumento no número de células inflamatórias mononucleares e
células gigantes multinucleadas, presentes nos grupos que receberam duas
implantações do material (período de 3 e 9 dias). Contudo, ao analisar a
cinética de reabsorção da membrana, obteve resultados divergentes aos
nossos, já que os valores de áreas encontrados para os grupos de implantação
sequencial foram significativamente menores aos valores assumidos pelos
grupos de implantação única nos mesmos períodos de tempo, sustentando a
ideia de que o processo de implantação sequencial acelera a degradação do
biomaterial.
Discutir essas disparidades de resultados é bastante complexo visto que
na literatura são raros os trabalhos que contemplam aspectos moleculares e
histológicos da reação inflamatória pós-implantação do biomaterial. Entretanto,
nossos resultados também enfatizam que a implantação sequencial gera sim
um aumento na intensidade e velocidade de evolução da resposta imune e
inflamatória ainda que tal aumento não tenha demonstrado influência direta
sobre a degradação da matriz. Cabe ressaltar, que embora ambos os materiais
fossem à base de colágeno, existiam muitas diferenças entre eles. Silveira
(2012) trabalhou com membranas colágenas bovinas utilizadas em substituição
a barreiras não reabsorvíveis, sendo a estruturação na forma de membrana
diferente da matriz aqui empregada. As matrizes colágenas por atuarem como
scaffolds apresentam uma organização estrutural própria, sendo as fibras
colágenas dispostas visando o suporte celular. Além disto, embora as proteínas
colágenas sejam muito semelhantes em animais distintos, podem existir
pequenas alterações entre elas. Deste modo, a comparação entre matrizes de
colágeno suíno e membranas de colágeno bovino pode apresentar resultados
diferentes, uma vez que cada biomaterial possui suas particularidades que irão
influenciar em uma cinética de reabsorção singular.
53
A escolha dos períodos de tempo a serem analisados também parece
ter grande importância na cinética de reabsorção do biomaterial e deve ser
criteriosamente selecionada especificamente para os diferentes tipos de
materiais. Silveira (2012) justifica a escolha do período de 9 dias baseado em
estudos pilotos que determinaram este período como final do processo de
degradação da membrana. Em nosso trabalho, as comparações da
implantação única à sequencial no período de 9 dias também se basearam em
resultados obtidos em estudo piloto. Entretanto, estes resultados indicaram tal
período como crucial no início das mudanças no perfil da resposta inflamatória,
seguido de aumento na taxa de degradação da matriz. Já no período de 21
dias, ainda que a resposta inflamatória tivesse presente, sua expressividade
era menor e o biomaterial aparentava grandes áreas de degradação, sendo
difícil sua identificação e manipulação até mesmo na coleta de tecido,
anteriormente ao processamento histológico. Considerando-se os resultados
aqui apresentados somados a literatura, cabe a estudos futuros estabelecer e
comparar a influência de diferentes períodos experimentais (superior a 9 dias)
na dinâmica de reabsorção da matriz afim de compilar novos dados que
possam ser extrapolados para a prática clínica.
Em síntese, para uma maior compreensão sobre como a matriz
colágena suína é capaz de induzir respostas do sistema imune é preciso nos
atentar para questões muito mais complexas do que as propriedades físicoquímicas do biomaterial e do sítio de sua implantação. Ainda que se tenha
poucas informações na literatura, o envolvimento de padrões moleculares
relacionados a patógenos (PAMPs), padrões moleculares relacionados ao dano
(DAMPs) e endotoxinas podem determinar a intensidade e velocidade das
reações imunológicas, por consequência determinar a cinética de reabsorção
da matriz (ABBAS AK., 2012). Atentos a isto, todo o procedimento de
manipulação e recorte das matrizes foi realizado em câmara de fluxo com
esterilização prévia por raios ultravioletas. O transporte do biomaterial até a
sala de cirurgia e sua posterior inserção nos animais foi realizado com auxílio
de instrumentais estéreis, em ambiente limpo e controlado, na tentativa de
evitar
quaisquer
contaminações
por
microrganismos
que
pudessem
comprometer os resultados da pesquisa. Para mensurar a interferência do
54
próprio procedimento cirúrgico nas respostas imunes
e inflamatórias,
selecionamos em todos os animais uma porção tecidual submetida à incisão,
divulsão e sutura (sem associação do biomaterial), sendo a ela atribuída à
nomenclatura Sham. As análises do grupo Sham nos possibilitaram contabilizar
aspectos inflamatórios (número de células, fibras, vasos sanguíneos,
fibroblastos) relacionados apenas ao dano tecidual. Como parâmetros para
discriminar a origem da reação inflamatória, comparamos nos mesmos animais
áreas teciduais livres de quaisquer injúrias ou associação ao biomaterial
(Grupo Controle), a áreas com a presença do biomaterial (Grupo Teste) e
àquelas referentes ao Grupo Sham. Os resultados nos mostram não haver
diferenças significativas entre o número de células inflamatórias encontradas
no Grupo Teste nos períodos de 3, 9 e 21 dias de implantação única,
confirmando a equidade do processo inflamatório no decorrer do tempo e o
potencial biocompatível do material com o sistema em que ele foi implantado.
Vemos ainda, que o número de células inflamatórias é superior no Grupo Teste
(em todos os tempos experimentais) quando comparado ao Grupo Sham e
Controle, respectivamente. Nos períodos de 3 e 9 dias, o número de células
inflamatórias presentes no Grupo Sham difere significativamente do Grupo
Controle, estando estas células relacionadas ao dano tecidual causado pelo
procedimento cirúrgico e não pela inserção do material. Uma vez que no
período de 21 dias pós-implantação ainda observamos no Grupo Teste um
grande
número
de
células
contabilizadas
(relacionadas
ao
processo
inflamatório causado pelo biomaterial) e redução nos valores de Sham, sendo
este estatisticamente igual ao grupo Controle.
Diante
destas
informações
ressaltamos
a
importância
do
desenvolvimento de estudos moleculares envolvendo não só a aplicação de
biomateriais, mas análises que abordem também as reações provocadas pela
injúria tecidual do procedimento cirúrgico e seus possíveis contaminantes.
Sugerimos ainda, o aperfeiçoamento da literatura já existente por meio da
associação de técnicas que possibilitem elucidar questões como: o impacto
gerado com o tipo de material implantado, intensidade e duração dos
processos inflamatórios e o papel dos mediadores envolvidos na promoção do
55
reparo tecidual, sendo o presente trabalho associado aos futuros resultados
vindos das análises moleculares um pequeno passo nesta direção
CONCLUSÕES
A matriz colágena suína (Mucograft®) implantada em tecido subcutâneo
da região dorsal de camundongos Balb/c apresenta uma cinética de
degradação compatível com o aumento crescente na taxa de reabsorção desse
biomaterial nos diferentes períodos experimentais 3, 9 e 21 dias. O biomaterial
analisado forma um sistema biocompatível com o organismo receptor. Já que,
mesmo induzindo uma reação inflamatória, quando em contato com o tecido,
esta reação é local, transitória e de baixa magnitude. Sendo sua baixa
imunogenicidade, comprovada mesmo após a implantação sequencial, onde as
respostas imunológicas, embora um pouco mais evidentes, ainda são
consideradas amenas.
56
REFERÊNCIAS BIBLIOGRÁFICAS
1.
Aarabi S, Bhatt KA, Shi Y, Paterno J, Chang EI, Loh SA. Mechanical
load initiates hypertrophic scar formation through decreased cellular
apoptosis. FASEB, 21:3250-3261, 2007.
2.
Abbas AK. Imunologia celular e molecular. 7ª. ed. São Paulo:
Elsevier; 2012.
3.
Anderson JM, Rodriguez A, Chang DT. Foreign body reaction to
biomaterials. Semin Immunol, 20(2):86-100, 2008.
4.
Anderson, JM. Biological response to materials. Materials Research,
v. 31, p.81-110, 2001.
5.
Baino F, Novajara G, Vitale-Brovarone C. Bioceramics and scaffolds:
a winning combination for tissue engineering. Bioeng. Biotechnol,
3(202), 2015.
6.
Brown BN, Londono R, Tottey S, Zhang L, Kukla KA, Wolf MT.
Macrophage phenotype as a predictor of constructive remodeling
following the implantation of biologically derived surgical mesh
materials. Acta Biomater, 8(3):978-87, 2012.
7.
Bunyaratavej P, Wang H.L. Collagen membranes: a review. J
Periodontol, 72(2):215-29, 2001.
8.
Cairo F., Pagliaro U., Nieri M.Treatment of gingival recession with
coronally advanced flap procedures: A systematic review. Journal of
Clinical Periodontology, 35(8):136–162, 2008.
9.
Cen L, Liu W, Cui L, Zhang W, Cao Y. Collagen Tissue Engineering:
Development of Novel Biomaterials and Applications. Pediatric
Research, 63(5): 492-495, 2008.
10.
Chambrone L, Chambrone D, Pustiglioni FE, Chambrone LA, Lima
LA. Can subepithelial connective tissue grafts be considered the gold
standard procedure in the treatment of Miller Class I and II recession
type defects? Journal of dentistry, 36(9):659-671, 2008.
11.
Chambrone L., Pannuti C.M., Tu Y. K. & Chambrone L. E. Evidencebased periodontal plastic surgery. II. An individual data meta-analysis
for evaluating factors in achieving complete root coverage. Journal of
Periodontology, 83: 477–490, 2012.
57
12.
Chambrone L., Sukekava F., Araujo M. G., Pustiglioni F. E.,
Chambrone L. E. & Lima, L. A. Root-coverage procedures for the
treatment of localized recession- type defects: a cochrane systematic
review. Journal of Periodontology, 81:452–478, 2010.
13.
Chorilli M, Michelin, D.C, Salgado, H.R.N. Animais de laboratório: o
camundongo. Rev. Ciênci. Farm. Básica Apl, 28(1):11-23, 2007.
14.
Chun K.H, Seong S.Y. CD14 but not MD2 transmit signals from
DAMP. Int Immunopharmacol, 10(1):98-106, 2010.
15.
Costa Z.B.J, Silva F, Dultra A.C, Souza F.L, Santos E.N.MC. O uso
de membranas biológicas para regeneração óssea guiada em
implantodontia. Revista Bahiana de odontologia, 7(1):751, 2016.
16.
Franz S, Rammelt S, Scharnweber D, Simon JC. Immune responses
to implants- a review of the implications for the design of
immunomodulatory
biomaterials.
Biomaterials,
32(28):6692-709,
2011.
17.
Froum SJ, Khouly I, Tarnow DP, Froum S, Rosenberg E, Corby P, et
al. The use of a xenogeneic collagen matrix at the time of implant
placement to increase the volume of buccal soft tissue. The
International journal of periodontics & restorative dentistry. 2015 MarApr;35(2):179-89. PubMed PMID: 25738338.
18.
Fu JH, Su CY, Wang HL. Esthetic soft tissue management for teeth
and implants. The journal of evidence-based dental practice. 2012
Sep;12(3 Suppl):129-42. PubMed PMID: 23040344.
19.
Gibbons D.F. Biomedical materials. Biophisics and Bioengineering,
4:367-375, 1975.
20.
Gordon S, Taylor PR. Monocyte and macrophage heterogeneity. Nat
Rev Immunol. 5(12):953-61, 2005.
21.
Guyton A.C, Hall J.E. Tratado de Fisiologia Médica. 12ª ed. Rio de
Janeiro, Elsevier Ed., 2011.
22.
Herford AS, Lu M, Akin L, Cicciu M. Evaluation of a porcine matrix
with and without platelet-derived growth factor for bone graft coverage
in pigs. The International journal of oral & maxillofacial implants. 2012
Nov-Dec;27(6):1351-8. PubMed PMID: 23189284.
58
23.
Huc, A. Collagen biomaterials characteristics and applications. J
Amer. Leath. Chem. Assoc. 80(2):195-212, 1985.
24.
Jones, J.A. et al. Matrix metalloproteinases and their inhibitors in the
foreign body reaction on biomaterials. J Biomed Mater Res A,
84(1):158-66, 2008.
25.
Junqueira L.C, Carneiro J. Histologia básica. 12ed. Rio de Janeiro:
Guanabara Koogan. Cap 18, 2013.
26.
Kassab
M,
Badawi
H,
Dentino
A.
Treatment
of
Gengival
Recession.The Journal of the American Dental Association, 133:
1499-1506, 2010.
27.
Knakievicz T. Caracterização da biologia de populações de planárias
do gênero Giardia nativas do Rio Grande do Sul. Programa de PósGraduação em Biologia Celular e Molecular. 2007
28.
Korpi JT, Astrom P, Lehtonen N, Tjaderhane L, Kallio-Pulkkinen S,
Siponen M, Sorsa T, Pirilã E, Salo T. Healing of extraction sockets in
collagenase-2 (matrix metalloproteinase-8)- deficient mice. Eur J Oral
Sci, 117(3):248-254, 2009.
29.
Lee C.H, Singla A, Lee Y. Biomedical applications of collagen.
Internation. J. Pharmac, 221(2):1-22, 2001.
30.
Lyman, D.J., Seare, Jr, W.J. Biomedical materials in surgery.
Materials Science, v.4, p.415-433, 1974.
31.
Marini MG, Greghi SLA, Passanezi E, Santana ACP. Gingival
recession: prevalence, extension and severity in adults. J Appl Oral
Sci, 12(3):250-255, 2004.
32.
Melnikov P, Zanoni LZ, Poppi NR. Copper and ceruloplasmin in
children undergoing heart surgery with cardiopulmonary bypass.
Biological trace element research. 2009 Summer;129(1-3):99-106.
PubMed PMID: 19183869.
33.
Mescher A.L, Neff A.W. Regenerative capacity and the developing
immune system. Adv. Biochem. Eng. Biotechnol., 93:39-66, 2005.
34.
Miguez-Pacheco V, Hench LL, Boccaccini AR. Bioactive glasses
beyond bone and teeth: emerging applications in contact with soft
tissues. Acta biomaterials. 2015 Feb;13:1-15. PubMed PMID:
25462853.
59
35.
Miller Jr. PD. A classification of marginal tissue recession. Int J.
Periodont. Rest. Dent, 5(2): 8-13, 1985.
36.
Moioli EK, Clark PA, Xin X, Lal S, Mao JJ. Matrices and scaffolds for
drug delivery in dental, oral and craniofacial tissue engineering.
Advanced drug delivery reviews. 2007 May 30;59(4-5):308-24.
PubMed PMID: 17499385. Pubmed Central PMCID: 4035021.
37.
Nevins M, Nevins ML, Kim SW, Schupbach P, Kim DM. The use of
mucograft collagen matrix to augment the zone of keratinized tissue
around teeth: a pilot study. The International journal of periodontics &
restorative dentistry. 2011 Jul-Aug;31(4):367-73. PubMed PMID:
21837302.
38.
Oertelt-Prigione S. Immunology and the menstrual cycle. Autoimmun
Rev, 2011.
39.
Pabst AM, Lehmann KM, Walter C, Kruger M, Stratul SI, Kasaj A.
Influence of porcine-derived collagen matrix on endothelial progenitor
cells: an in vitro study. Odontology / the Society of the Nippon Dental
University. 2014 Dec 9. PubMed PMID: 25487653.
40.
Patel M, Nixon P, Chan M. Gingival recession: Part I. A etiology and
non-surgical management. British Dental Journal, 211:251-254, 2011.
41.
PION, F. L. B. et al. Condição periodontal de um subgrupo
populacional do município de Guarulhos, SP. Revista Brasileira de
Epidemiologia, v. 9, n. 3, p. 335-345, 2006.
42.
Ramalingam S, Basudan A, Babay N, Al-Rasheed A, Nooh N,
Nagshbandi J, Aldahmash A, Atteya M, Al-Hezaimi K. Efficacy of
Mucograft vc Conventional resorbable collagen membranes in guided
bone regeneration around standardized calvarial defects in rats: A
histologic and biomechanical assessment. Into J Periodontics
Restorative Dent, 36:99-107, 2016.
43.
Ruh C.A, Fernandes D, Artoni F.R, Marino G. Inflamação: entre a
regeneração e a cicatrização. Biol. Saúde, 19(1):11-19, 2013.
44.
Sanz M, Lorenzo R, Aranda JJ, Martin C, Orsini M. Clinical evaluation
of a new collagen matrix (Mucograft prototype) to enhance the width
of keratinized tissue in patients with fixed prosthetic restorations: a
60
randomized prospective clinical trial. J Clin Periodontol, 36(10):86876, 2009.
45.
Schallhorn RA, McClain PK, Charles A, Clem D, Newman MG.
Evaluation of a porcine collagen matrix used to augment keratinized
tissue and increase soft tissue thickness around existing dental
implants. The International journal of periodontics & restorative
dentistry. 2015 Jan-Feb;35(1):99-103. PubMed PMID: 25734712.
46.
Schmidt DR, Kao WJ. The interrelated role of fibronectin and
interleukin-1
in
biomaterial-modulated
macrophage
function.
Biomaterials, 28(3):371-82, 2007.
47.
Schmitt CM, Moest T, Lutz R, Wehrhan F, Neukam FW, Schlegel KA.
Long-term outcomes after vestibuloplasty with a porcine collagen
matrix (Mucograft ) versus the free gingival graft: a comparative
prospective clinical trial. Clinical oral implants research. 2015 Feb 27.
PubMed PMID: 25720794.
48.
Schutte RJ, Xie L, Klitzman B, Reichert WM. In vivo cytokineassociated responses to biomaterials. Biomaterials, 30(2):160-8,
2009.
49.
Shlezinger M, Houri-Haddad Y, Coppenhagen-Glazer, Resch G, Que
Ya, Beyth S, Dorfman E, Hazan R, Beyth N. Phage therapy: A new
horizon in the antibacterial treatment of oral pathogens. Curr Top Med
Chem, 2016.
50.
Silva TF, Penna ALB. Colágeno: características químicas e
propriedades funcionais. Rev. Inst. Adolfo Lutz, São Paulo 71(3):5309, 2012.
51.
Silveira, EM. Mechanisms involved in immune and inflammatory
response to implantation of bovine bone cortical membrane in
subcutaneous tissue of mice: characterization histomorphometric,
imunoenzimatic and molecular. Tese. 2012. Bauru. LILACS ID:lil673687
52.
Sionkowska, A. Current research on the blends of natural and
synthetic polymers as new biomaterials: review. Prog. Polym. Sci. 36,
1254-1276, 2011.
61
53.
Speer D.P. et al. Biological effects of residual glutaraldehyde in
glutaraldehydetanned collagen biomaterials. J Biomed Mater Res
14(6):753-64, 1980.
54.
Speer D.P. et al. Enhancement of healing in osteochondral defects by
collagen sponge implants. Clin Orthop Relat Res, 144:326-25, 1979.
55.
Susin C, Haas A.N, Oppermann R. V, Haugejorden O, Albandar J.M.
Gingival
recession:
epidemiology
and
risk
indicators
in
a
representative urban Brazilian population. J. Periodontol. 75(10):
1377-1386, 2004
56.
Takei HH, Azzi R. Cirurgia plastic e estética periodontal In: Carranza
FA, Newman MG, Takei HH. Periodontia clínica. Rio de Janeiro:
Guanabara Koogan; p. 759-80, 2004.
57.
THE AMERICAN ACADEMY OF PERIODONTOLOGY. Glossary of
Periodontal Terms. 4.ed.Chicago, 2001.
58.
Tomomatsu N, Aoki K, Alles N, Soysa NS, Hussain A, Nakachi H.
LPS-induced inhibition of osteogenesis is TNF-alpha dependent in a
murine tooth extraction model. J Bone Miner Res, 24:1770-1781,
2009.
59.
Van Leeuwen A. C. Guided bone regeneration in rat mandibular
defects using resorbable poly (trimethylene carbonate) barrier
membranes. Acta Biomater. 8(4):1422-9, 2012.
60.
Vats A, Tolley NS, Polak JM, Gough JE. Scaffolds and biomaterials
for tissue engineering: a review of clinical applications. Clin
Otolaryngol 28(3):165-172, 2003.
61.
Wehrhan F, Nkenke E, Melnychenko I, Amann K, Schlegel KA,
Goerlach C, et al. Skin repair using a porcine collagen I/III membrane-vascularization and epithelization properties. Dermatologic surgery :
official publication for American Society for Dermatologic Surgery [et
al]. 2010 Jun;36(6):919-30. PubMed PMID: 20618373.
62.
Williams D.F. The same but different: regulation of tissue engineering
and regenerative medicine in the context of regional and international
standards and expectations. Tissue Eng. Part A, 21(23):2781-2,
2015.
62
63.
Williams DF. On the mechanisms of biocompatibility. Biomaterials.
2008 Jul;29(20):2941-53. PubMed PMID: 18440630.
64.
Williams DF. On the nature of biomaterials. Biomaterials. 2009
Oct;30(30):5897-909. PubMed PMID: 19651435.
65.
Williams
DF.
Regulatory
biocompatibility
requirements
for
biomaterials used in regenerative medicine. Journal of materials
science Materials in medicine. 2015 Feb;26(2):89. PubMed PMID:
25649511.
66.
Williams DF. The biomaterials conundrum in tissue engineering.
Tissue engineering Part A. 2014 Apr;20(7-8):1129-31. PubMed PMID:
24417599.
67.
Williams DF. There is no such thing as a biocompatible material.
Biomaterials. 2014 Dec;35(38):10009-14. PubMed PMID: 25263686.
68.
Yung, K. L.; Deng, C. L. Comparison of physical-chemical properties
of
type
I collagen
from different
Taiwan(99):244-251, 2005.
species. Food chemistry,
63
ANEXOS
64