Mestrado integrado em Engenharia do Ambiente
Licenciatura Bolonha em Engenharia de Materiais
2º Teste de Química Orgânica
21/05/2013
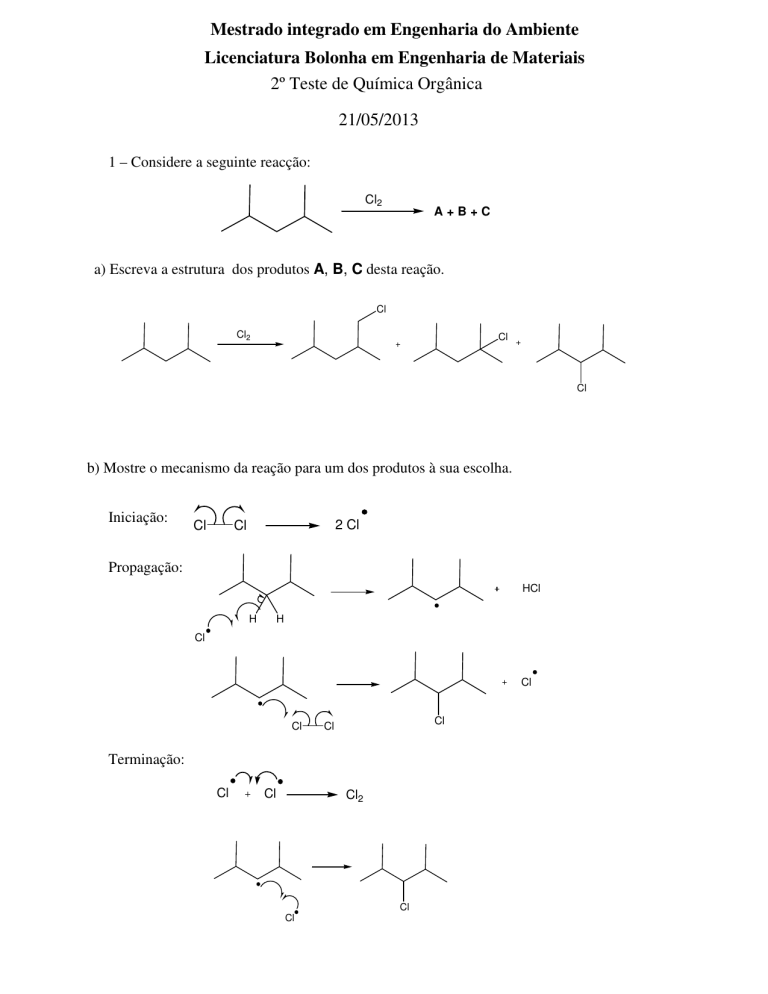
1 – Considere a seguinte reacção:
Cl2
A+B+C
a) Escreva a estrutura dos produtos A, B, C desta reação.
Cl
Cl2
Cl
Cl
b) Mostre o mecanismo da reação para um dos produtos à sua escolha.
Iniciação:
Cl
2 Cl
Cl
Propagação:
HCl
H
H
Cl
Cl
Cl
Cl
Cl
Terminação:
Cl
Cl
Cl2
Cl
Cl
c) Calcule as percentagens formadas de cada produto, sabendo que a velocidade relativa da
cloração é: 5.1 (H terciário), 4.0 (H secundário), 1.0 (H primário).
1ários
3ário
1ários
1ários
CH3
CH3
H
H
H3C
3ário
CH3
H
1ários
H
2ários
12H x 1 = 12.0
40%
2H x 4 =
8.0
26%
2H x 5.1 = 10.2
34%
30.2
100%
Cl
Cl
Cl
40%
34%
26%
2 – Considere as seguintes reacções:
a) Mostre o mecanismo e o produto D da reacção com HBr e a estereoquímica (quando
aplicável).
OCH3
OCH3
OCH3
H
H
H
OCH3
Br
H
Br
H
Br
H
Br
H
OCH3
H
b) Escreva somente a estrutura dos produtos E e F.
OCH3
OCH3
OCH3
H
Br
H
HBr
ROOR
H
OCH3
H
H
H
H2
H
Pd
E
3 – Indique se os seguintes compostos são aromáticos ou não aromáticos. Justifique.
Um composto para ser aromático tem que respeitar as seguintes 3 regras:
⇒
Ter 4n + 2 e Π, com n=0, 1, 2… (regra de Hückel).
⇒ Ser plano.
⇒ Os eletrões estarem deslocalizados num sistema fechado
F
O
O
N
G
Carbono sp3
N
O
O
Tem 4 eletrões Π no anel, não respeita a regra de Hückel.
Há 1 átomo de carbono do anel que é hibridado sp3, logo não é plano.
Os eletrões Π não estão deslocalizados num sistema fechado, como
mostram as estruturas de ressonância
G não é aromático
⇒
N
N
N
O
⇒
⇒
⇒
H
O
N
N
O
N
N
N
N
O
N
N
O
O
N
N
O
O
Há 6 eletrões Π, respeita a regra de Hückel (4n + 2 e Π, com n=1).
Todos os átomos do anel estão hibridados sp2. É plano.
Os eletrões Π estão deslocalizados num sistema fechado, como
mostram as estruturas de ressonância
H é aromático.
⇒
⇒
⇒
⇒
4 – Considere as seguintes reacções:
a) Mostre o mecanismo da reação de I e o(s) produto(s) formados com H2SO4 e HNO3.
O
O
H
O
HO
S
O H
HO
N
HO
O
O
O
O
O
N
H2O
H
O
N
O
COCH3
O
I
O
O
COCH3
COCH3
COCH3
COCH3
S
-H
N
NO2
NO2
NO2
NO2
O
H
H
H
HSO4
b) Qual o efeito na velocidade da mesma reação se em vez de I
OCH3
fizesse a reação com J? Justifique e mostre somente o(s)
J
produto(s) que se formariam.
⇒
Com J, a velocidade aumentava porque passávamos
de um grupo desativante (COCH3, -R) para um
ativante (OCH3, +R), sendo agora orientador orto
para, já que o carbocatião fica mais estável (há mais
uma estrutura de ressonância devido ao facto do
grupo poder dar eletrões, estabilizando o
carbocatião).
OCH3
OCH3
NO2
NO2
c) Mostre o mecanismo da reação de I com -CN e em seguida meio ácido.
O
O
CH3
CN
HO
∗
H
CH3
CN
CH3
Mistura racémica
CN
5 – Preveja o(s) produto(s) da seguinte reação, mostrando o mecanismo e a estereoquímica
(quando aplicável).
a)
O
H
H
O
HO
CH3
O
OCH3
HO
H
OH2
OH
OH
OH
CH3OH
H2O
H
O
O
-H
OCH3
OCH3
b)
H
CH3
H
CH3
H
CH3
H
H
CH3
H
CH3
H
CH3
CH3
H
CH2
H3C
CH3
CH3
CH2
H3C
H 3C
H
CH3
CH3
H 3C
H3C
CH3
CH3
H3C
H 3C
H
CH3
CH3
CH2
CH2
CH3
CH3
n
CH3
6 - O Nomex é um polímero sintético, resistente à chama, usado por exemplo no vestuário dos
bombeiros e militares. Este polímero é preparado a partir dos regentes L e M.
a) Quais os grupos funcionais presentes em L e M?
Anilina (amina aromática)
Cloreto de ácido
O
O
H2N
Cl
NH2
Cl
b) Escreva a fórmula de estrutura do polímero Nomex.
O
H2N
N
H
O
O
N
H
O
N
H
Cl
n
c) Qual o grupo funcional presente no polímero?
⇒
d) Qual o nome pelo qual são conhecidos estes polímeros?
Amida
⇒
Poliamidas