HISTÓRIA, SINTOMAS E TRATAMENTOS DA FEBRE CHIKUNGUNYA
HISTORY, SYMPTOMS AND TREATMENT OF FEVER CHIKUNGUNYA
Caio Farias¹
Caio Swame²
Sérgio Rocha
Tatianny Silva
Débora Zanforlim
¹Graduando do 1º período de Farmácia na UNIFAVIP/Devry, e-mail: [email protected]
²Graduando
do
1º
período
de
Farmácia
na
UNIFAVIP/Devry,
e-mail:
[email protected]
Professor de Anatomia na UNIFAVIP/Devry, e-mail: [email protected]
Professora na UNIFAVIP/Devry, e-mail: [email protected]
Professora de Bioquimica, Citologia/Histologia/Embriologia e Fundamentos da saúde humana
na UNIFAVIP/Devry, e-mail: [email protected]
RESUMO: Este estudo é um artigo de revisão literária, que trata sobre a chikungunya,
doença que entrou no Brasil e está se estabelecendo cada vez mais e com capacidade de
causar grandes problemas. O estudo trata especialmente das questões históricas, apresentação
clínica, tratamentos e medidas disponíveis, no intuito de colaborar para a elaboração de novos
programas sociais, projetos, medidas e estudos com finalidade de controlar a arbovirose.
PALAVRAS-CHAVE: Chikungunya. Sintomas. Tratamento.
1
ABSTRACT: This study is a literature review article, which talks about the chikungunya, a
disease that entered Brazil and is establishing itself increasingly and ability to cause major
problems. The study especially speaks of historical, clinical presentation, treatment and
measures available, in order to contribute to the development of new social programs,
projects, measures and studies in order to control arbovirus.
KEYWORDS: Chikungunya. Symptoms. Treatment.
2
INTRODUÇÃO
O CHIKV é um arbovírus, transmitido por mosquitos do gênero Aedes, responsável
pela febre chikungunya, uma doença responsável por grandes surtos, que ganharam grande
notoriedade especialmente a partir de 2005. É um alfavírus da família thogaviridae. O CHIKV
foi isolado pela primeira vez no início da década de 1950 na região onde hoje é a Tanzânia e
recebeu o nome chikungunya devido à postura que o portador do vírus fica devido às dores,
que na língua de origem do nome, o makonde, significa algo como “Aquele que é
contorcido”. É enzoótico e endêmico, primitivamente de regiões da África, Ásia e Oceano
índico onde se mantêm em ciclos silvestres e urbanos (Tauil, P.L. 2014). Nos casos de ciclos
silvestres, os principais vetores, são: (Ae. furcifer, Ae. taylori, Ae. luteocephalus, Ae.
africanusand e Ae. Neoafricanus (McIntosh et al., 1977; Jupp and McIntosh, 1988; Diallo et
al., 1999 apud Powers, A. M. and Logue, C.H. 2007). E o vírus circula entre primatas,
pequenos mamíferos e mosquitos; já nos ciclos urbanos os vetores principais são o Ae.
aegypti e o Ae. albopíctus; sendo as duas espécies “invasoras” e cosmopolitas, sendo a
primeira antropofílica, habitando casas em locais de aglomerados urbanos ; e a segunda
peridomiciliar (Honório, N. A. et al. 2015). Estudos indicam que o vírus tem origens africanas
e depois foi levado para outras regiões como a Ásia e Oceano Índico, que hoje são áreas
endêmicas (Volk, S. M., et al). O CHIKV apresenta três genótipos distintos circulando pelo
mundo, variando de região para região e variando os sintomas, devido as diferenças
biológicas; podendo mais de um genótipo diferente circular por uma mesma região (Powers,
Ann M., et al, 2000); os três genótipos são o África Ocidental, o Leste/Central/Sul da África
(ECSA) e Asiático (Honório, N. A et al., 2015).
Após uma mutação foi possibilitado um novo vetor, o que ocasionou um aumento na
área suscetível a epidemias e ocasionou novas grandes epidemias e reemergências a partir de
2004 (Tsetsarkin, K. A., and Weaver, S. C., 2011). Não há vacina ou tratamento antiviral
específico e eficaz em circulação para a doença (Mishra, Priyadarsee, et al, 2016). Na
ausência de um tratamento específico até então é feito o uso de medidas profiláticas e
paliativas, para evitar a propagação da doença e atenuar os sintomas até que a doença seja
sanada pelo organismo.
O vírus é sintomático em aproximadamente 75% dos casos (com essa taxa variando
entre 65 e 90% entre os artigos) e seu período de incubação pode durar de 2 a 12 dias e o
3
período de viremia de 12 dias; 2 dias antes e 10 dias depois da febre e o período de incubação
no mosquito é bem menor (DonalisioI, M. R., & FreitasII, A. R. R). Os sintomas apresentados
em todos os surtos até então são febre alta de início súbito, erupção cutânea e o sintoma mais
característico da doença, a poliartralgia, normalmente simétrica e bastante intensa,
principalmente nas pequenas articulações, as mais periféricas (Membrillo de Novales, F. J.,
2015). Além desses sintomas, vários outros foram relatados mas uma minoria apenas em
alguns surtos e variando bastante em frequência e intensidade (Oliveira, C. S., &
Vasconcelos, P. F. 2014). Os sintomas principais e alguns que podem se manifestar ou não,
em casos sintomáticos, se assemelham com os de vários outros alfavírus e de outros
arbovírus, como a dengue, que possui os mesmos vetores.
Um dos problemas causados com o aumento da área afetada pelo vírus é que essas
áreas não haviam tido contato prévio com a doença, não havendo defesas no organismo contra
a doença. O que pode ser outro problema é a área já ser endêmica de outras doenças de
sintomas semelhantes como a dengue (caso de Cuba, Brasil e várias outras regiões) (Pérez
Sánchez, G et al., 2014). Outro problema é a ausência de um kit específico para a doença e de
alta eficácia em circulação, principalmente em locais onde não há estudo na sociedade local
(Núcleo, I. P. Ê. Et al 2015).
OBJETIVO
Este estudo tem a finalidade de realizar uma revisão da literatura sobre a história,
sintomas e tratamento da Febre Chikungunya, com o intuito de evidenciar fatores de
desenvolvimento endêmico e vetorial, sintomatologia em diferentes fases clínicas e
perspectiva de tratamentos farmacológicos fisioterapêuticos e imunológicos, colaborando na
compreensão do que é a doença e sua gravidade, de forma a ajudar e estimular na elaboração
de programas e medidas que beneficiem a sociedade.
MÉTODOS UTILIZADOS
Foi realizada uma revisão da literatura entre os meses de fevereiro e abril de 2016,
sobre o tema: História, Sintomas e Tratamentos da Febre Chikungunya. Foram coletados
artigos científicos nas bases de dados google acadêmico, Scielo e Capes. Tendo como
limitantes: artigos nos idiomas português, inglês e espanhol, publicados no período de 2000 a
2016 e palavras-chave: Arbovírus, Chikungunya, Sintomas, Diagnóstico e Evolução.
4
RESULTADOS
A HISTÓRIA
O vírus CHIKV foi isolado pela primeira vez no início da década de 1950, e após isso
há relatos de que alguns casos reportados antes como surtos de dengue foram declarados
assim de forma errônea (Casals & Whitman, 1957; Spence & Thomas, 1959 apud Powers, A.
M., & Logue, C. H. (2007)). O relato mais antigo encontrado, do qual se especula ter sido um
caso de surto de chikungunya, devido aos sintomas reportados (dores intensas e persistentes
nas articulações), reportado como um surto de algum tipo de dengue é datado de 1779, na
Betavia; região hoje conhecida como Jacarta, na Indonésia. Outros casos foram os de 1920 na
Índia e na África, que afetou um terço da população afetada. Outras duas em Calcutá em 1853
e 1871, afetando 75% da população (Lg, L. C. & Hapuarachchi apud Acosta-Reyes, J., &
Navarro Lechuga, E. 2015; Powers, Ann M., & Logue, C. H. 2007).
Acredita-se que ele teve um ancestral comum com o vírus o’nyong-nyong que
divergiram a milhares de anos, apresentando hoje aproximadamente divergência de 28% dos
nucleotídeos totais e 13% dos aminoácidos totais. Estudos da árvore filogenética do vírus
indica que o vírus tem raízes africanas e foi posteriormente introduzido na Ásia. (Powers, Ann
M. et al, 2000).
Após a isolação do vírus, foram documentados vários casos esporádicos e outros
grandes surtos com variações na manifestação, frequência e intensidade dos sintomas
apresentados além da poliartralgia. Por muitas vezes o vírus foi isolado novamente entre 1960
e 1990, na África. Em 1960 houve um grande surto em Bangkok, na Tailândia, importante
para a observação de diferenciação da dengue e da chikungunya; entre 1963 e 1973 houve
outra grande epidemia em Barsi, na Índia. Havendo muitos outros casos de surtos
documentados entre os anos 1952 e 2016, havendo relatos em todos os continentes, exceto na
Antártida. Porém os casos a partir de 2005 merecem um pouco mais de atenção e estudo, pois
em alguns grandes surtos datados desde então, como o surto da Ilha de Reunião, houve uma
presença de sintomas até então não relatados, incluindo morte e transmissão vertical.
Estudos confirmam que os aparecimentos dos sintomas foram devido a mutações,
como a que causou uma mudança no envelope viral possibilitando o Ae. albopictus tornar-se
vetor, expandindo assim as regiões receptivas ao vírus e a velocidade de propagação, por
aumentar a densidade populacional de vetores, desde 2004. A mutação responsável pelo
5
aumento na área suscetível à doença foi uma mudança no aminoácido, A226V, da
glicoproteína do envelope viral (E1), o que ocorreu próximo de 2005. Estudos posteriores, no
qual foi testada, demonstram uma mudança adicional no envelope viral, na glicoproteína E2,
L210Q, mesma mudança encontrada em amostra coletadas em Kerala, na ìndia em 2009,
aumentando bastante a possibilidade de o vírus ser transportado pelo Ae. albopictus. Esses
estudos mostraram que um novo passo de adaptação como ocorrido no A226V pode ocorrer
na natureza e trazer outro problemas (Tsetsarkin, Konstantin A., and Scott C. Weaver. 2011).
Por o Brasil ter uma grande receptividade e vulnerabilidade ao vírus, considerando que
é um país com várias áreas endêmicas de dengue e na qual a grande maioria da população não
havia tido contato prévio, mesmo em gerações anteriores, para desenvolver resistência ao
vírus, o vírus entrou no país em setembro de 2014 em Oiapoque no Amapá, e atingiu outras
áreas posteriormente, havendo notificação de 3657 casos no mesmo ano, onde 2772 foram
confirmados; 140 em exames laboratoriais e 2632 através da análise clinica-epidemiológica.
Só no início de 2015, 3431 casos foram confirmados (Oliveira Chaves, M. R. et al, 20152016).
Um estudo feito com 242 pessoas possivelmente infectadas, na Vila Mallela,
localizada no distrito de Kadapa (Andhra Pradesh, Índia), entre 1 de Dezembro de 2005 e 29
de março 2006, dos quais 55% tiveram análise de sangue, e desses 143 pacientes 67%
confirmou positivo para IgM específicos de chikungunya. Dos 242, 96%, com uma média de
idade de 39 anos e a razão entre homens por mulheres de 0,7, apresentaram sintomas da fase
aguda apenas, sendo a duração da fase aguda e crônica nos casos, respectivamente 10 e 19
dias. E cada caso causou cerca de 0,027 DALYs (anos de vida útil perdidos por
incapacidade). No total a perca na vila, foi de 6,6 DALYs, no qual a fase aguda foi
responsável por 97% do total. Aproximadamente 2200 dias de trabalho foram perdidos em
Mallela (8,9 dias por caso). O estudo também indicou cerca de 6040 casos situados no distrito
de Kadapa, o que em estimativa causou aproximadamente 160 DALYs. A febre CHIKV a
nível estadual, em Andhra Pradesh, na Índia, de janeiro a dezembro de 2006, estima-se ter
causado aproximadamente 6600 DALYs em 257.034 casos. No geral a perda em dólares por
região foi de 9.100 dólares (37,5 por caso) em Mallela; 290 000 dólares no distrito de Kadapa;
e 12 400 000 para o estado de Andhra Pradesh. Porém considerando que o país é alvo de
muitos investimentos comerciais, devido ao baixo custo da mão de obra, empresas evitam
investir em regiões com doenças incapacitantes de alta propagação, esse tipo de doença causa
dano diretamente à economia com os gastos do governo no tratamento e indiretamente com
6
menos pessoas trabalhando e perda de investimento no local além de menor valorização; e se
considerarmos outras áreas que invistam mais em saúde (até mesmo dentro da própria índia,
onde os gastos com saúde são geridos pelo estado, com um custo maior por paciente e regiões
onde os pacientes têm um lucro maior, os gastos e perdas de ganho, podem ser maiores.
(Seyler, T. et al., 2010).
No Brasil, a introdução da doença acabou causando um alerta de emergência e a
expedição de medidas provisórias de movimentação de verba com a finalidade de treinar os
profissionais para estarem aptos a tratarem a doença, a elaboração de manuais, divulgação da
necessidade de prevenção e até a utilização de militares para conscientizar e verificar
residências, podendo entrar forçadamente em casas quando achar necessário. Um dos
problemas em relação à vigilância é a quantidade de domicílios desocupados encontrados,
chegando a aproximadamente 2,5 milhões de possíveis criadouros de mosquito (Souza, M. G.,
2016 ; Macedo, M. R., 2016).
A MUTAÇÃO
A mutação do vírus para ser adaptado ao vetor Ae. Albopictus foi identificada em
2005, e para testar se uma segunda etapa da mutação evolutiva ocorreria em natureza, no
CHIKV ou outro arbovírus, foram realizados testes, adicionando um envelope glicoproteico
adicional com mutações nos aminoácidos como as encontradas em kelara, na Índia em 2009;
nas mudanças feitas em E2-L210Q foram observadas mudanças apenas na potencialização do
Ae. Albopictus como vetor (Tsetsarkin, K. A. & Weaver, S. C., 2011). Estudos também
indicam que o motivo da mutação potencializar o Ae. albopictus como vetor é devido à
dependência de colesterol, que aumenta a aptidão do mosquito citado, como vetor (Tsetsarkin,
Konstantin A., et al 2007). Apesar disso, houve relatos de casos mais graves e sintomas
diferentes dos até então relatados; como: transmissão vertical, hemorragia, e até morte.
Estudos com mosquitos dos dois principais gêneros de maior importância urbana
foram isolados e alimentados com sangue com e sem vírus dependo do grupo em que
estivessem. Após isso, os ovos foram retirados e cultivados; alimentados, até a nona geração,
com sangue humano não infectado. Os descendentes do gênero Ae. aegypti apresentaram o
vírus até a 5ª geração, enquanto a do Ae. albopictus até a 6ª geração, comprovando a
possibilidade de transmissão vertical entre os mosquitos. Os estudos foram feitas com vírus de
uma linhagem do Oceano Índico com a mutação E1-A226V, e os mosquitos do grupo de
controle não apresentaram qualquer problema.
7
SINTOMAS
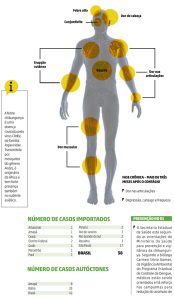
Os casos de chikungunya são em maioria sintomáticos, apresentando uma taxa de
casos assintomáticos de em média 25%. O período de incubação da doença pode variar entre
dois e doze dias e o período de viremia pode ser de até 12 dias, onde são distribuídos
normalmente dois dias antes e dez dias depois do início da febre. Os sintomas da doença
variam bastante, sendo os principais e mais frequentes, presente em todos os surtos relatados
nos artigos: febre alta, erupções cutâneas e, o mais característico da doença, dores intensas nas
articulações, que podem chegar a durar por anos em casos graves. A febre tem um início
súbito entre 38,5ºC e 40ºC, sendo este o primeiro sintoma detectado, e que acaba em
aproximadamente 10 dias, como a maioria dos outros sintomas, com a exceção da artralgia. A
erupção cutânea normalmente é maculopapular, não coça e apresenta eritemas; torna-se
visível entre o segundo e o quinto dia após a infeção; localizado com mais frequência no
tronco. A poliartralgia, normalmente intensa e simétrica; com potencial incapacitante, que
normalmente afeta com mais intensidade as pequenas articulações, não sendo raro afetar de
forma intensa as grandes articulações; as articulações mais citadas como mais atingidas
foram: dedos, joelhos, punhos, tornozelos e cotovelos. A artralgia pode durar por meses e
chegarem a durar anos em alguns casos, havendo indicações de que em cerca de 12% dos
casos desenvolve-se um estado crônico, que muito raramente pode resultar na destruição da
articulação. É comum a parestesia no tecido acima das articulações afetadas, indica a
possibilidade de sequelas neurológicas. A doença pode manifestar vários outros sintomas,
variando em frequência/presença e intensidade de surto para surto e, mais restritamente, de
casos para caso, devido à diferença do genótipo manifestante na região e fatores de
resistência. A manifestação é dividida em fases: fase aguda/febril, subaguda e crônica. A fase
aguda inicia-se com o início súbito da febre, acompanhada de alguns dos sintomas seguintes,
variando em frequência e intensidade: poliartralgia (sempre frequente), dor nas costas, dor de
cabeça, cansaço, calafrios, dor atrás dos olhos, náusea, vontade de vomitar, vômito, diarreia,
dor abdominal, inchaço (associado a tenossinovite) e aparecimento das erupções cutâneas. A
fase subaguda caracteriza-se pelo fim da febre, persistência e possível agravamento da
artralgia, principalmente em regiões distais como punhos e tornozelos, prurido generalizado,
exantema maculopapular, cansaço e sintomas depressivos. A fase crônica consiste na
persistência dos sintomas da fase subaguda, podendo, ainda, desenvolver inchaços,
deformidades, limitação de movimento, ausência de eritemas, dor de cabeça, alopecia, bursite,
tenossinovite, disestesias, distúrbios do sono, conjuntivite, faringite, linfadenopatia, entre
8
outras manisfetações. (de Oliveira Chaves, M. R. et al., 2016 ; Powers, Ann M., &
Christopher H. Logue 2007). As manifestações mais graves são de pessoas acima de 65 anos,
com a presença de alguma doença crônica anterior, e crianças estão dentro da zona de risco
para desenvolver os sintomas de forma mais intensa e sintomas mais graves e atípicos. Dentre
os sintomas atípicos os principais são: meningoencefalite, encefalopatia, convulsão
(principalmente em pacientes jovens), síndrome de Guillain-Barré, síndrome cerebelar,
paresias, paralisias, neuropatias, neurite óptica, iridociclite, uveíte, epsclerite, retinite,
miocardite, insuficiência cardíaca, renal e respiratória, pericardite, arritmia, instabilidade
hemodinâmica, hiperpigmentação da pele por fotosenssibilidade, dermatoses vesiculobolhosa,
ulcerações aftosas, nefrite, discrasia sanguínea, pneumonia, hepatite, pancreatite, síndrome da
secreção inapropriada do hormônio antidiurético e insuficiência adrenal (Oliveira Chaves, M.
C. et al 2015-2016).
Os casos de morte que foram relatados são extremamente raros e são tratados de certa
forma, esperados, devido ao alto número de infectados, porém eles não são relacionados
diretamente como causados pela chikungunya, sendo especificado no máximo provocado por
complicações devido as condições coexistentes. (Simon, F et al., 2015).
O CHIKV pode ser passado da mãe ao filho, no momento intraparto, fazendo o recémnascido desenvolver os sintomas dentro de aproximadamente quatro dias, incluindo
descamação da pele e com maior probabilidade de desenvolver os sintomas mais graves.
DIAGNÓSTICO
Para diagnosticar a doença, há testes que podem relatar a doença com especificidade,
como o PCR em tempo real para CHIKV, pode ser feito entre o 1º e o 8º dia do início da
doença, porém, com um custo próximo de mil reais e um tempo de espera de
aproximadamente quatro dias pelo resultado, não é tão viável o seu uso. Outro teste é o
sorológico, usando a técnica ELISA; mais barato, porém, esse é feito a partir do 4º dia após a
manifestação dos sintomas e os resultados saem apenas com 18 dias (Aguiar, R. 2014). Kits
para rápido diagnóstico e com alta especificidade, estão sendo desenvolvidos. Um dos
problemas para fazer isso em alguns países, como o Brasil, é a falta de um banco de dados
com os efeitos e características dos isolados na população local, o que já não é um problema,
devido aos surtos que vêm acontecendo no país.
9
TRATAMENTO
Não há uma vacina ou tratamento específico para o CHIKV, assim as medidas que
ficam são as profiláticas, para evitar novos casos e tratar os infectados, com remédios
específicos para cada sintoma que se manifestar até que o organismo crie defesas contra o
vírus, ficando como medida mais eficaz a contenção do mosquito com vigilância frequente
(Weaver, S. C., 2014), normalmente são utilizados analgésicos e anti-inflamatórios não
hormonais como tratamentos paliativos, devido também a possível necessidade de um
tratamento prolongado (de Oliveira Chaves, M. R. et al., 2016). A aspirina, mesmo
considerando que ela atue nos principais problemas, foi deixada de lado nos tratamentos após
os relatos de possibilidade de sintomas hemorrágicos, sendo substituída pelos remédios acima
citados e acetaminofeno e ibuprofeno principalmente. Repousar e ingerir líquidos podem ser
medidas a serem tomadas para auxiliar na recuperação da doença; além da prática da
fisioterapia para combater os casos persistentes de artralgia. Outros medicamentos bastante
usados são: paracetamol, ribavirina, polissacarídeos sulfatados e fosfato de cloriquina, que
tem mostrado bons resultados no tratamento de pacientes com alguma resistência aos outros
anti-inflamatórios. (Powers, Ann M., 2007).
Vacinas foram testadas anteriormente, sendo a de maior eficácia uma feita através de
uma estripe encontrada em pacientes na Tailândia (estirpe 15561), cultivada em células dos
rins de macacos verdes (GMKC), gerando anticorpos dentro de 42 dias. Uma segunda geração
da vacina foi desenvolvida (CHIK 181/clone 25), resultante de uma serie de 18 passagens
placa-a-placa, do vírus inicial, em células MRC-5, que já havia passado onze vezes em uma
cultura de GMKC. O projeto não foi mais à frente devido à verba, recursos e potencial
comercial limitante, ainda que gerasse imunidade por aproximadamente um ano e não
houvesse relatos de efeitos adversos nos testes em voluntários (Powers, Ann M., 2007). Hoje
vacinas estão sendo desenvolvidas no Brasil e no EUA e apontam pra um futuro de alta
eficácia e imunidade por aproximadamente nove meses.
10
DISCURSSÃO
Nota-se que é consenso entre os artigos que a chikungunya tem uma alta taxa
de propagação e alto potencial para se estabelecer em novas regiões, principalmente
regiões endêmicas de outras doenças que têm os mosquitos do gênero Aedes como
vetor. Também é consenso que surtos dessa doença podem causar problemas além dos
sintomas breves e passageiros, e da artralgia, causando grandes sequelas na economia
e na qualidade de vida dos habitantes locais. O maior ponto de divergência foi entre o
ano específico em que o vírus foi isolado pela primeira vez, variando entre 1950 e
1953 entre os artigos, sendo citado como isolado em 1950 em apenas três artigos;
outros especificam 1952 ou 1953.
Os casos de morte em nenhum dos artigos foram tidos como causado pelo
vírus, tendo participação no máximo como coexistente nos casos de morte, sem
indicações de que estivesse ligado diretamente com mortes.
CONSIDERAÇÕES FINAIS
O vírus está sendo notavelmente subestimado, devido à falta de medidas para o
controle do vetor que pode ser observada nos municípios, na ausência de agentes de
saúde e monitoramento intenso. Sendo uma das maiores ações de contenção no Brasil,
uma medida provisória, com duração de apenas três meses. Também é encontrado nos
dados dos artigos lidos, que a maioria dos casos confirmados no país são através de
critérios clinico-epidemiológicos, método de pouca eficiência, o que é um desafio no
combate aos vetores, dificultando o isolamento de pacientes infectados com o vírus,
além de promover tratamentos não indicados para a doença e não colaborar com dados
mais precisos para estudos.
Essas dificuldades podem também ser estímulo para o desenvolvimento de
vacinas e tratamentos além da compreensão da doença, do vírus, da genética e possível
utilização benéfica do vírus no tratamento e combates de outros arbovírus.
11
REFERÊNCIAS BIBLIOGRÁFICAS
Acosta-Reyes, Jorge, and Edgar Navarro Lechuga. "Enfermedad por el virus del
Chikungunya: historia y epidemiología." Revista Científica Salud Uninorte31.3
(2015).
http://rcientificas.uninorte.edu.co/index.php/salud/article/view/7486/8191
Aguiar, R. (2014). Conheça melhor a doença que está chegando ao Brasil e pode
causar uma epidemia pelo país. Ciência e Cultura, 66(4), 10-11.
http://medicalsuite.einstein.br/praticamedica/Documentos%20Doencas%20Epidemicas/febre-do-chikungunya.pdf
Chompoosri, Jakkrawarn, et al. "Vertical transmission of Indian Ocean Lineage of
chikungunya virus in Aedes aegypti and Aedes albopictus mosquitoes." Parasites &
vectors 9.1 (2016): 1.
https://parasitesandvectors.biomedcentral.com/articles/10.1186/s13071-016-1505-6
DonalisioI, Maria Rita, and André Ricardo Ribas FreitasII. "Chikungunya no Brasil:
um desafio emergente." REV BRAS EPIDEMIOL 18.1 (2015): 283-5.
http://www.scielosp.org/pdf/rbepid/v18n1/1415-790X-rbepid-18-01-00283.pdf
Honório, N. A., Câmara, D. C. P., Calvet, G. A., & Brasil, P. (2015). Chikungunya:
uma arbovirose em estabelecimento e expansão no Brasil.
http://www.scielosp.org/scielo.php?pid=S0102311X2015000500003&script=sci_arttext
Macedo, Marcelo de Rezende. "Análise da adequação orçamentária e financeira da
Medida Provisória nº 709, de 30 de dezembro de 2015." (2016).
http://www2.senado.leg.br/bdsf/handle/id/518145
12
Membrillo de Novales, F. J., et al. "A propósito de un caso de Fiebre de Chikungunya
importada de América." Sanidad Militar 71.3 (2015): 183-185.
http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S188785712015000300005&lang=pt
Mishra, Priyadarsee, et al. "Inhibition of Chikungunya Virus Replication by 1-[(2Methylbenzimidazol-1-yl)
Methyl]-2-Oxo-Indolin-3-ylidene]
Amino]
Thiourea
(MBZM-N-IBT)." Scientific reports 6 (2016).
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4740769/
Oliveira Chaves, M. R. et al., Quadra, R. U. Dengue, Chikungunya e Zika: a nova
realidade brasileira Dengue, Chikungunya and Zika: new brazilian reality. (20152016)
http://www.newslab.com.br/newslab/revista_digital/132/artigos/artigo1.pdf
Oliveira, C. S., and P. F. Vasconcelos. "Chikungunya risk for Brazil." Revista de
saude publica 49 (2014): 58-58.
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S003489102015000100509&lang=pt#B26
Pérez Sánchez, Glenda, et al. "Fiebre de Chikungunya: enfermedad infrecuente como
emergencia médica en Cuba." Medisan 18.6 (2014): 848-856.
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S102930192014000600015&lng=es&nrm=iso
13
Powers, Ann M., et al. "Re-emergence of Chikungunya and O’nyong-nyong viruses:
evidence
for
distinct
geographical
lineages
and
distant
evolutionary
relationships." Journal of General Virology 81.2 (2000): 471-479.
http://jgv.microbiologyresearch.org/content/journal/jgv/10.1099/0022-1317-81-2-471
Powers, Ann M., and Christopher H. Logue. "Changing patterns of chikungunya virus:
re-emergence of a zoonotic arbovirus." Journal of General Virology 88.9 (2007):
2363-2377.
http://jgv.microbiologyresearch.org/content/journal/jgv/10.1099/vir.0.82858-0#tab2
Sampaio, M. G. Evidências de transmissão vertical de arbovírus. (2016)
http://residenciapediatrica.com.br/exportar-pdf/188/v6n1a04.pdf
Seyler, T., et al. "Estimating the burden of disease and the economic cost attributable
to chikungunya, Andhra Pradesh, India, 2005–2006."Transactions of the Royal Society
of Tropical Medicine and Hygiene 104.2 (2010): 133-138.
http://library.tephinet.org/system/files/costanalysis_burden_chik_transactions.pdf
Simon, Fabrice, Emilie Javelle, and Philippe Gasque. "Chikungunya Virus
Infections." The New England journal of medicine 373.1 (2015): 93-95.
http://www.nejm.org/doi/pdf/10.1056/NEJMc1505501
Souza, Mario Luis Gurgel de. "Análise da adequação orçamentária e financeira da
Medida Provisória nº 712, de 29 de janeiro de 2016." (2016).
http://www2.senado.leg.br/bdsf/bitstream/handle/id/518580/MP%20712-2016%20%20Nota%20T%C3%A9cnica%20n%C2%BA%2010-2016.pdf?sequence=1
14
Tsetsarkin, Konstantin A., and Scott C. Weaver. "Sequential adaptive mutations
enhance efficient vector switching by chikungunya virus and its epidemic
emergence." PLoS Pathog 7.12 (2011): e1002412.
http://journals.plos.org/plospathogens/article?id=10.1371%2Fjournal.ppat.1002412
Tauil,
Pedro
Luiz.
"Condições
para
a
transmissão
da
febre
do
vírus
chikungunya." Epidemiologia e Serviços de Saúde 23.4 (2014): 773-774.
http://www.scielo.br/pdf/ress/v23n4/2237-9622-ress-23-04-00773.pdf
Tsetsarkin, Konstantin A., et al. "A single mutation in chikungunya virus affects
vector specificity and epidemic potential." PLOS pathog 3.12 (2007): e201.
http://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.0030201
Weaver, Scott C. "Arrival of chikungunya virus in the new world: prospects for spread
and impact on public health." PLoS Negl Trop Dis 8.6 (2014): e2921.
http://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0002921
Volk, Sara M., et al. "Genome-scale phylogenetic analyses of chikungunya virus
reveal independent emergences of recent epidemics and various evolutionary
rates." Journal of virology 84.13 (2010): 6497-6504.
http://jvi.asm.org/content/84/13/6497.short
15