ATUALIZAÇÃO
EM ORTOPEDIA E
TRAUMATOLOGIA
DO ESPORTE
As lesões da cartilagem articular
Dr. Cristiano Frota de Souza Laurino
Mestre pelo Departamento de Ortopedia e Traumatologia da Unifesp.
Especialista em Cirurgia do Joelho e Artroscopia. Diretor Científico do Comitê
de Traumatologia Desportiva da SBOT. Diretor Médico da Confederação
Brasileira de Atletismo e Médico do Clube de Atletismo BM&F/Bovespa.
CRM-SP 77341.
2
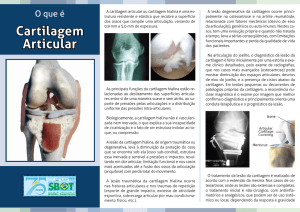
As lesões da cartilagem articular
Apoio
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
3
As lesões da cartilagem
articular
Dr. Cristiano Frota de Souza Laurino
Mestre pelo Departamento de Ortopedia e Traumatologia da Unifesp. Especialista em
Cirurgia do Joelho e Artroscopia. Diretor Científico do Comitê de Traumatologia Desportiva
da SBOT. Diretor Médico da Confederação Brasileira de Atletismo e Médico do Clube de
Atletismo BM&F/Bovespa. CRM-SP 77341.
ANATOMIA DA CARTILAGEM ARTICULAR
A
cartilagem se origina do mesênquima, onde algumas de suas células se
agregam para formar o bastema na 5a semana de vida gestacional. As
células do blastema começam a secretar matriz de cartilagem, e são
então chamadas de condroblastos. Com o desenvolvimento, a matriz extracelular é produzida gradualmente e separa as células umas das outras, até serem
chamadas de condrócitos.
A cartilagem articular normal é do tipo hialina e não apresenta vascularização,
inervação e rede linfática. Tais características anatômicas justificam em parte o
ambiente desfavorável para as condições de reparo de lesões na sua estrutura.
A água representa 65% a 80% do peso da cartilagem hialina e também contribui para a lubrificação articular e transporte de nutrientes para os condrócitos.
O pH é 7.4 e sua mudança pode facilmente romper a infraestrutura da matriz.
A cartilagem articular é composta de células mergulhadas dentro de uma
complexa matriz extracelular de colágeno e proteoglicanos. Os condrócitos são
os únicos tipos de células no interior da matriz e representam os únicos elementos vivos ocupando aproximadamente 1 a 2% do volume total da cartilagem
4
As lesões da cartilagem articular
adulta normal e 5% do peso seco, declinando
sua densidade com a evolução da idade. Estão
presentes em lacunas e são responsáveis pela
homeostase entre a síntese e a degradação do
complexo macromolecular proteico (fig. 1).
Os condrócitos produzem a matriz colágena,
proteoglicanos, proteínas não colágenas e enzimas responsáveis pela degradação da cartilagem
normal. Este processo é influenciado por muitos
fatores, incluindo a composição ao redor da matriz, o carregamento mecânico, os hormônios,
os fatores de crescimento locais, as citocinas, a
idade e as lesões.
Figura 1. Corte histológico
A matriz extracelular representa 99% da estruda cartilagem articular.
tura biológica e corresponde a 50% do peso seco
da cartilagem articular madura. As funções da matriz são: proteger os condrócitos do carregamento mecânico, estoque de citocinas e fatores de crescimento,
determinar o tipo, concentração e taxa de difusão de nutrientes nos condrócitos
e atuar como um transdutor de sinais para as células. A matriz desempenha um
papel importante no registro histórico do carregamento da cartilagem articular
e sua deformação produz sinais químicos, elétricos e mecânicos que afetam
as funções dos condrócitos.
O colágeno predominante da cartilagem articular madura é do tipo II, e em
mínima proporção são também encontradas fibras de colágeno tipos I (fibrocartilagem), IX, XI. As fibras colágenas apresentam uma configuração em tripla
hélice que confere resistência tênsil, forma e integridade mecânica à cartilagem.
Os proteoglicanos são macromoléculas de polissacarídeo e proteína, produzidos dentro dos condrócitos e secretados para a matriz. Ocupam os interstícios
das fibras colágenas, constituem aproximadamente 12% do peso total (30%
do peso seco) da cartilagem articular e conferem resistência à compressão. Há
duas grandes classes de proteoglicanos encontrados na cartilagem articular,
os agrecans e os proteoglicanos menores (decorin, biglycan e fibromodulina).
As subunidades de proteoglicanos são chamadas de glicosaminoglicanos
(GAGs) e representam moléculas dissacarídicas de dois tipos predominantes,
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
5
o condroitim sulfato e o queratan sulfato. Os GAGs se ligam ao centro proteico
através de uma molécula de agrecan. Ligações proteicas estabilizam esta cadeia
com uma cadeia central de ácido hialurônico, formando a intrincada estrutura
de uma molécula de GAG.
Os proteoglicanos mantêm o balanço de fluidos e eletrólitos na cartilagem
articular. Estas macromoléculas são carregadas negativamente, as quais atraem
somente moléculas de cargas positivas e repelem moléculas de cargas negativas. Tal propriedade aumenta a concentração de íons inorgânicos (sódio) dentro
da matriz, aumentando a osmolaridade da cartilagem articular.
A ultraestrutura da cartilagem hialina pode ser dividida em 4 zonas, cada
qual com uma morfologia celular e de fibras colágenas específica.
1. Zona superficial: a mais fina das camadas, composta por células elipsoides dispostas paralelamente à superfície articular. Coberta por um filme de
líquido sinovial, chamado lamina splendens, responsável pela lubrificação
da cartilagem. Os condrócitos nesta zona sintetizam altas concentrações
de colágeno e baixas concentrações de proteoglicanos. A disposição
paralela das fibrilas promove a maior capacidade de resistir às forças de
tensão e cisalhamento. Esta camada funciona como um filtro de grandes
macromoléculas, protegendo a cartilagem do sistema imune do tecido
sinovial.
2. Zona de transição: a densidade celular desta camada é baixa. As células são predominantemente esferoidais, envoltas por uma matriz celular
abundante. As fibras colágenas de maior diâmetro são aleatoriamente
dispostas nesta zona e a concentração de proteoglicanos é a mais alta.
3. Zona profunda: as células são dispostas perpendicularmente à superfície
e são esferoidais na forma. Esta camada contém as fibrilas colágenas
de maior diâmetro e a maior concentração de proteoglicanos, embora a
densidade celular seja a menor de todas as camadas.
4. Zona calcificada: esta camada mineralizada contém um pequeno volume
de células distribuídas dentro de uma matriz calcificada com atividade
metabólica baixa. Os condrócitos desta camada sintetizam colágeno tipo
X, responsável por promover importante integridade estrutural e absorção
de choque ao longo do osso subcondral.
A densidade celular da cartilagem articular é mais alta na camada superficial
6
As lesões da cartilagem articular
e diminui progressivamente através das camadas intermediária e profunda, a
aproximadamente 1/3 da camada superficial.
Devido ao fato de a cartilagem articular ser avascular, os condrócitos recebem
tanto oxigênio e nutrição por difusão simples do líquido sinovial. A tensão de
oxigênio na cartilagem varia entre 1 e 3% e se mantém baixa por toda a vida,
enquanto a pressão de oxigênio na atmosfera é de 21%. Portanto, a cartilagem desenvolve-se num ambiente hipóxico e, de fato, a proximidade com o
suprimento sanguíneo parece ser um fator determinante da formação de osso
sobre a cartilagem.
Os condrócitos desenvolveram mecanismos específicos de promover a função
tecidual em resposta à hipóxia crônica, como por exemplo o aumento da expressão dos componentes da matriz e a inibição da angiogênese. Uma das respostas
dos condrócitos articulares ao ambiente hipóxico é a geração de energia celular
(ATP) através da glicólise anaeróbica e o baixo consumo de oxigênio.
Os condrócitos se conectam à matriz extracelular por meio das integrinas de
superfície e respondem às forças mecânicas. As integrinas de superfície também
se conectam com uma variedade de fatores de crescimento e citocinas, que regulam as atividades anabólicas e catabólicas dos condrócitos. Os elementos da
matriz são, portanto, regulados pelos condrócitos dentro de uma homeostase.
Dentre os fatores de crescimento, o TGF-ß é um dos mais importantes na
cartilagem articular, pois se liga a receptores de superfície do condrócito, que
ativam sinais bioquímicos, que regulam a expressão de genes específicos.
Pesquisas em ratos transgênicos evidenciaram que a ausência do fator de
crescimento TGF-ß na cartilagem, devido a um defeito do receptor de superfície,
desenvolve artrite precoce. Outros estudos evidenciaram o efeito condroprotetor do TGF-ß, pois foi demonstrado um aumento na síntese de colágeno e de
proteoglicanos, inibindo a degradação da matriz extracelular.
Outros fatores de crescimento também apresentam uma função anabólica
sobre a cartilagem articular. O IGF-1 é produzido por condrócitos articulares
e aumenta ambas as sínteses de colágeno e de proteoglicanos, um efeito
sinérgico à estimulação mecânica. O IGF-1 também desempenha um papel
no desenvolvimento da osteoartrite, quando há uma diminuição da expressão
deste fator de crescimento, causando uma menor biodisponibilidade e uma
aceleração do catabolismo. Condrócitos de pacientes com idade avançada
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
7
produzem baixos níveis de IGF-1, resultando na diminuição dos componentes
da matriz. De forma semelhante, duas BMPs, a BMP-2 e BMP-7, aumentam a
síntese de proteoglicanos e mantêm o fenótipo articular.
Muitas citocinas possuem uma atividade catabólica e estimulam a expressão de metaloproteinases da matriz (MMPs) e outras enzimas catabólicas. As
citocinas mais estudadas na cartilagem articular são a interleucina 1 (IL-1) e o
fator de necrose tumoral alfa (TNF-α), que inibem a síntese de proteoglicanos
(colágeno) e estimulam a produção de MMPs (enzimas de degradação da matriz).
O tecido cartilaginoso pode suportar um grande número de estresses repetitivos durante a vida. A complexidade da interação entre células, matriz e
outros fatores faz com que a reprodução !"#$!%&' da cartilagem articular seja
extremamente difícil.
PROPRIEDADES DA CARTILAGEM
A cartilagem articular é um tecido de propriedades viscoelásticas, capaz de
suportar cargas variadas, com consequente redução das forças diretas sobre
o osso subcondral.
Em particular, a cartilagem articular adulta apresenta uma função primordial
de revestimento das articulações sinoviais, mantendo a eficiência mecânica do
movimento. Devido a sua sofisticada composição, seu alto teor de água e sua
capacidade de suportar pressão hidrostática, a cartilagem é capaz de transferir
forças de grandes magnitudes de uma superfície de osso subcondral a outra.
Nas condições fisiológicas, a cartilagem também promove uma superfície de
deslizamento de baixa fricção, conferindo um baixo coeficiente de atrito entre
as superfícies deslizantes.
Em 1743, William Hunter afirmou que “Desde Hipócrates até o presente, é
universalmente aceito que a destruição da cartilagem nunca mais se repara”. O
potencial de reparo fisiológico da cartilagem articular madura é limitado. Decorre
do número insuficiente de células multipotentes e da limitada capacidade dos
condrócitos maduros para migrar, proliferar e produzir matriz cartilaginosa para
revestir a área lesionada. Com o envelhecimento, ocorre uma diminuição dos
proteoglicanos da matriz, diminuindo ainda mais a capacidade regenerativa
das lesões.
8
As lesões da cartilagem articular
A cartilagem articular possui uma distribuição morfológica e propriedades
biomecânicas únicas. Estas propriedades são até o momento incomparáveis a
qualquer material artificial, apesar dos consideráveis esforços dos engenheiros
e biólogos.
OS EFEITOS DO EXERCÍCIO SOBRE A CARTILAGEM ARTICULAR
Poucos estudos abordando a cartilagem articular in vivo foram realizados,
observando a variabilidade morfológica da cartilagem normal entre indivíduos
e os fatores que determinam suas modificações. Também pouco se conhece
a respeito do comportamento de deformação da cartilagem articular hialina
durante o carregamento in vivo.
A cartilagem articular possui uma propriedade mecanoadaptativa, e diferentemente de outros tecidos, a sua morfologia (sua espessura), é determinada
relativamente tarde na vida pós-natal, durante a adolescência, quando a ossificação endocondral foi terminada.
A literatura desconhece quais fatores específicos impedem que a calcificação
avance para a superfície articular e também aqueles que permitem preservar a
superfície de cartilagem articular. Devido ao número limitado de genes disponíveis
para guiar a emergência e manter a morfologia de vários tecidos e sistemas
funcionais em geral, uma hipótese seria que os fatores ambientais, particularmente os mecânicos, teriam um papel central neste processo.
A habilidade dos tecidos manterem suas estruturas, em concordância com
ambientes específicos, tem sido designada “adaptação funcional”. Os processos
de adaptação funcional são descritos durante o desenvolvimento do sistema
nervoso central (córtex visual), órgãos internos (rins) e nos tecidos com funções
mecânicas primárias, como os músculos e os ossos.
O exercício físico tem demonstrado ser capaz de aumentar as massas óssea
e muscular, enquanto os estados de inatividade e de microgravidade têm sido
associados à atrofia destes tecidos.
Nos ossos, a adaptação funcional ao carregamento mecânico tem sido
caracterizada como um processo mediado por células, nos quais osteócitos
atuam como sensores e orquestram a ação de outras células capazes de realizar
a osteogênese e a osteoclasia, mediante sinais bioquímicos.
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
9
A atividade biossintética dos condrócitos tem sido evidenciada experimentalmente por ser regulada por estímulos mecânicos. Baseados nesta premissa,
estudos in vitro apresentaram modelos experimentais, que explicam a variação
de espessuras da cartilagem articular entre as articulações, baseadas nas
diferenças de magnitude do carregamento mecânico. Entretanto, há pouca
evidência experimental que comprove esta teoria em nível sistêmico.
Embora as propriedades mecânicas da cartilagem articular tenham sido
estudadas amplamente in vitro, até recentemente poucos estudos revelam
informações sobre a deformação da cartilagem das articulações intactas sobre
condições de carregamento in vivo. As informações in vitro não podem ser
extrapoladas para as condições in vivo, pois a magnitude do carregamento
articular durante a participação em atividades esportivas ainda é desconhecida.
Os efeitos das condições articulares, como a incongruência entre as superfícies e a composição bioquímica do líquido sinovial, também interferem sobre
a cartilagem, embora apresentem limitações de avaliação.
O conhecimento da magnitude de deformação da cartilagem articular in vivo
está relacionado com a magnitude da estimulação mecânica recebida pelos
condrócitos, o que afeta a sua atividade biossintética.
O conhecimento da deformação da cartilagem in vivo pode servir como
um guia de orientação de como células podem ser estimuladas em tecidos
de cultura, para geração de transplantes futuros, e como utilizar sinais para
estimular a cartilagem in situ.
Eckstein e colaboradores realizaram estudos para avaliar o comportamento
de deformação da cartilagem articular após exercícios físicos. Foram estudados voluntários saudáveis, que realizaram 50 flexões do joelho e analisados
os volumes da cartilagem articular após 3 a 7 minutos e 1 hora da realização
do exercício. Os resultados revelaram uma redução do volume da cartilagem
articular da patela entre 2,4 e 8,6% (média: 6,0%). A deformação média da cartilagem não apresentou homogeneidade em toda a superfície patelar, havendo
áreas com pequenas e outras com grandes deformações. Após a realização
de 100 flexões, o nível de deformação foi de 2,4% a 8,5% (média: 5,0%) e não
foi significantemente diferente da avaliação com 50 flexões.
O tempo de recuperação da cartilagem sob condições de repouso sem
carga também foi avaliado por Eckstein e colaboradores, onde um intervalo de
10
As lesões da cartilagem articular
45 minutos tinha sido necessário para compensar aproximadamente 50% da
deformação observada após as flexões do joelho, e um intervalo de 90 minutos
para atingir o volume pré-exercício. Múltiplas séries de 50 flexões, com intervalos de 15 minutos de descanso entre cada série, mantiveram as medidas de
deformação medidas após a primeira série (5 a 6%), mas não geraram mais
deformação da cartilagem.
A literatura comparou as deformações da cartilagem articular da patela após
alguns exercícios físicos, tais como: 30 movimentos de flexão total do joelho,
carregamento estático, caminhada normal no plano por 5 minutos após corrida
de 200 m, caminhada (sobe e desce com 54 passos durante 4 minutos) e ciclismo por 10 minutos com frequências de pedaladas de 80 Hz. As deformações
de cartilagem da patela encontradas foram: 5.9 ± 2,1% após 30 movimentos
de flexão total do joelho, 2,8 ± 0,8% após caminhada, 5,0 ± 1,3% após corrida
e 4,5 ± 1,6% após o ciclismo (P<0,01).
Durante as atividades diárias normais (caminhadas), a cartilagem patelar
sofre uma compressão média de 2 a 3%, quando comparada a situações de
repouso sem carga. Exercício intenso pode acrescentar 2 a 3% na média de
compressão aos valores encontrados durante as atividades físicas normais.
Waterson e colaboradores estudaram voluntários pela manhã e ao fim do
dia após atividades predominantemente realizadas em posição ortostática. Os
resultados constataram não haver modificações no volume e espessura da
cartilagem femoral. Foram observados o aumento na espessura de zonas de
cartilagem da tróclea e dos côndilos, não supostamente envolvidas em carregamento durante as atividades em posição ortostática. Uma das hipóteses
apresentadas foi a migração dos fluidos intersticiais das zonas de maior carregamento mecânico para as áreas de menor carregamento.
A deformação da cartilagem femorotibial após a realização de exercícios
intensos foi avaliada por Eckstein e colaboradores, onde voluntários saudáveis
realizaram 12 movimentos de flexão do joelho com apoio unipodálico, 2 minutos
de carregamento estático da articulação femorotibial em 15 graus de flexão e
10 saltos a partir de uma cadeira (40 cm de altura) e aterrissagem unipodálica. Os resultados revelaram não haver mudanças significativas no volume da
cartilagem articular femorotibial após os movimentos bipodálicos de flexão dos
joelhos (exceto para a superfície lateral da tíbia) ou nas flexões unipodálicas.
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
11
Modificações significativas foram encontradas nas superfícies de cartilagem
medial e lateral da tíbia após impactos gerados nos saltos (40 cm de altura), o
que não se observou nos côndilos femorais medial e lateral.
Modificações fisiológicas dos conteúdos de água da cartilagem articular
ocorrem concomitantemente à composição macromolecular após o exercício.
Kunz e colaboradores avaliaram sete maratonistas do sexo feminino, após
completarem a maratona de Boston durante condições de competição, e não
observaram deformações significativas na cartilagem femorotibial e patelofemoral, após 90 minutos de corrida. Estes achados demonstraram que deformações
não se prolongam após atividades muito intensas, mesmo envolvendo alguns
milhares de ciclos de carregamento. Entretanto, houve modificações encontradas 1 dia, 1 semana e 6 semanas após a corrida, indicando que pode haver
uma perda de glicosaminoglicanos (GAGs) após atividades físicas intensas e
que pode provocar uma resposta biológica, que eleva o metabolismo celular e
a produção de GAGs.
A deformação da cartilagem articular in vivo é um evento complexo, determinado pela aplicação e distribuição de cargas durante uma atividade específica
e pelas propriedades mecânicas da cartilagem local. O volume de cartilagem
depende da espessura e da superfície de área. Somente nas condições onde
a superfície de cartilagem é constante, o volume ou a espessura se modificam
com o tempo.
Numerosos estudos descrevem a grande variabilidade nos volumes de
cartilagem encontrados nas articulações entre diferentes sexos, idades, pesos,
alturas e volumes ósseos.
Hudelmaier e colaboradores avaliaram indivíduos com idades entre 50 e
75 anos, não portadores de osteoartrite e encontraram um menor grau de
deformação da cartilagem patelar, quando comparados aos indivíduos de 20
a 30 anos de idade. Uma explicação provável para a reduzida deformação nos
indivíduos de maior idade são as diferentes estratégias motoras utilizadas para
reduzir os estresses sobre a cartilagem articular do joelho durante a flexão. Outro
fator descrito é a consequência da não glicosilação enzimática, promovendo
o aumento da formação de pontes cruzadas de colágeno, com o avanço da
idade tanto em humanos quanto em animais, tornando a matriz cartilaginosa
mais rígida do que nos indivíduos jovens.
12
As lesões da cartilagem articular
Karvonen e colaboradores concluíram, a partir de medições locais nas
imagens de ressonância magnética, que a idade contribui para um significante
decréscimo linear da espessura da cartilagem, tanto na ausência quanto na
presença de osteoartrite. Os achados foram restritos às áreas de contato femorotibial mais frequentes, mas não se aplicaram à patela, à tíbia e aos côndilos
posteriores do fêmur.
Hudelmaier e colaboradores observaram uma diminuição da espessura da
cartilagem articular do joelho de aproximadamente 4% por década para ambos
os sexos, com exceção para a cartilagem patelar.
Os estímulos mecânicos representam potentes reguladores da massa óssea
e muscular. Estudos em animais constataram que a espessura de cartilagem
diminui durante as imobilizações, mas as investigações em animais submetidos a níveis elevados de exercícios apresentaram resultados inconclusivos e
contraditórios.
Vanwanseele e colaboradores examinaram os joelhos de pacientes paraplégicos no período de seis, 12 e 24 meses após a lesão e encontraram uma
redução significativa na espessura da cartilagem articular, quando comparados
a indivíduos saudáveis do mesmo sexo. A redução anual da espessura da cartilagem foi de > 10% em todos os compartimentos do joelho.
Hinterwimmer e colaboradores observaram que a redução da carga, observada durante 7 semanas de apoio parcial, após uma cirurgia no tornozelo
homolateral, causou uma redução média da secção transversa do músculo
quadríceps de 11% e uma significativa redução da espessura de cartilagem.
Eckstein e colaboradores investigaram triatletas adultos, submetidos a
treinamento de 10 horas/semana durante 3 anos e observaram não haver
diferenças na espessura de cartilagem quando comparados com indivíduos
sedentários.
A cartilagem articular humana adapta-se ao exercício aumentando o conteúdo de glicosaminoglicanos. Embora a cartilagem articular hialina apresente
modificações atróficas durante períodos sem carregamento mecânico, e
modificações na composição de glicosaminoglicanos durante o exercício, a
cartilagem difere dos outros tecidos musculoesqueléticos durante as situações de carga, por não apresentar aumento da massa como resultado de
estimulação mecânica.
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
13
INCIDÊNCIA
A real incidência das lesões osteocondrais nas articulações humanas
durante o esporte é desconhecida, em função de grande parte delas serem
assintomáticas.
Aroen e colaboradores revisaram 993 artroscopias, utilizando o sistema de
classificação ICRS, e registraram 66% de patologias da cartilagem articular, com
11% de lesões condrais de espessura total. Curl e colaboradores revisaram
31.516 artroscopias e observaram 53.569 lesões condrais em 19.827 pacientes.
Os processos degenerativos articulares apresentam uma íntima relação com
as lesões de cartilagem e suas implicações na função articular.
FISIOPATOLOGIA
A cartilagem articular sofre degradação, em resposta a um número de estímulos metabólicos, genéticos, vasculares e traumatismos.
As lesões mecânicas podem ocorrer em decorrência de um único carregamento excessivo de grande magnitude, ou através de carregamento articular
prolongado e de pequena magnitude. Tais estresses causam lesões de basicamente três tipos distintos, baseados na espessura:
Microlesão: resultado de traumatismo sobre os condrócitos e matriz, sem
que haja lesão visível da superfície da cartilagem articular. Uma das respostas
iniciais ao impacto envolve a perda de condrócitos na região do trauma. D’Lima
e colaboradores estudaram modelos de lesão condral em coelhos e demonstraram que 34% dos condrócitos da área acometida sofreram apoptose (morte
celular programada). As alterações da matriz observadas são: a degradação
do colágeno e a perda de proteoglicanos. Estresses crônicos sobre o osso
subcondral e a região da cartilagem calcificada resultam em avanço da calcificação e consequente afilamento da cartilagem articular, achados observados
nos estágios iniciais da osteoartrite.
Fratura condral: lesão de espessuras variáveis até a camada calcificada,
mas sem penetrar o osso subcondral. O sistema vascular não está envolvido
e, portanto, não há reação inflamatória. A cartilagem articular não apresenta
células-tronco mesenquimais indiferenciadas e os condrócitos no local da lesão
14
As lesões da cartilagem articular
sofrem necrose e apoptose, porém as células ao redor da lesão promovem
uma resposta proliferativa na tentativa de reparar a lesão. Ocorre um aumento
da síntese de colágeno tipo II e das macromoléculas da matriz. Os condrócitos proliferados não migram para o defeito de cartilagem, o que impede que
os bordos da lesão se fundam. A lesão inicial se propaga gradualmente com
perda progressiva da superfície de cartilagem e desenvolvimento de sintomas
que incluem inchaço, dor, crepitação, bloqueio e deterioração progressiva da
articulação.
Fratura osteocondral: a mais grave das lesões de cartilagem, resulta
acometimento de toda a espessura da cartilagem e perfuração do osso
subcondral. A resposta inflamatória se faz presente, gerando a migração de
células e formação de coágulo no local da lesão, que desenvolverá um tecido
de reparação do tipo fibrocartilagem. As células-tronco mesenquimais originadas do tecido ósseo ao redor proliferam e se diferenciam em condrócitos,
que sintetizam matriz contendo colágeno tipo I, II e proteoglicanos. Por volta
de 6 a 8 semanas, o tecido de reparo apresenta uma elevada proporção de
condrócitos e as células da camada profunda sofrem ossificação endocondral para reparar o defeito ósseo subcondral. Entretanto, a composição da
cartilagem de reparo raramente replica a estrutura da cartilagem articular
normal e a degeneração da matriz cartilaginosa ocorre, com substituição por
uma grande proporção de fibras de colágeno tipo I. As alterações degenerativas se iniciam com fibrilação da superfície, seguida de perda da matriz de
proteoglicanos, morte de condrócitos e fissuras na superfície da cartilagem.
Por volta de 12 meses, as células remanescentes assumem tipicamente a
aparência de fibroblastos, com matriz densamente formada por colágeno
tipo I. Frequentemente algumas áreas de tecido se desintegram dentro de 1
ano, deixando áreas de osso subcondral exposto.
Cada tipo de lesão apresenta diferentes potenciais de reparação e prognóstico e a extensão da lesão é o maior determinante destes. O tamanho e a
localização são fatores importantes; entretanto, também são influenciados por
variáveis como a idade, o nível de atividade, a obesidade e o alinhamento do
membro.
O prognóstico das lesões condrais depende da integridade dos seus elementos constituintes (condrócitos e da matriz), e das características da lesão
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
15
(tamanho, profundidade e localização). Lesões restritas à espessura de cartilagem, sem comprometerem o osso subcondral, evidenciam pequeno potencial
de reparo espontâneo. As lesões condrais profundas promovem uma redução
das propriedades viscoelásticas, e consequentemente, as forças aplicadas
sobrecarregam o osso subcondral, tornando-o espesso e rígido.
As lesões com exposição do osso subcondral propiciam a comunicação
de canais vasculares com a área exposta, permitindo a migração de células
inflamatórias e mediadores químicos. Um novo tecido de reparo é formado com
predomínio de fibras colágenas do tipo I e com propriedades biomecânicas
diferentes da cartilagem hialina. Esta fibrocartilagem geralmente começa a degenerar após um ano de sua formação devido às propriedades biomecânicas
anormais.
DIAGNÓSTICO CLÍNICO
O diagnóstico clínico pode ser dificultado muitas vezes em decorrência da
pobre sintomatologia. Grande parte dos pacientes com lesões da cartilagem
articular não apresenta sintomas ou significante incapacidade.
Definir se a lesão é aguda ou crônica, pesquisando-se os possíveis mecanismos envolvidos, é de fundamental importância na história clínica. As histórias de
dor aguda mais frequentes são provocadas por movimentos torsionais traumáticos, gerando lesões ligamentares e meniscais associadas e nos traumatismos
diretos entre a patela e a tróclea. Alguns pacientes, no entanto, não apresentam
história pregressa de traumatismo definido.
As queixas mais frequentes são: o inchaço, a dor, o falseio, o bloqueio e a
crepitação. Os sintomas apresentam caráter insidioso, com dor de localização
difusa ou específica, por exemplo na interlinha articular e na região anterior no
joelho.
A dor pode ser decorrente de alguns fatores: 1. exposição óssea subcondral nas lesões condrais profundas durante o suporte de carga, 2. derrame
articular, proveniente do processo inflamatório da membrana sinovial (sinovite),
que distende a cápsula e provoca um desconforto com limitação funcional,
3. estimulação de nervos localizados no osso subcondral em decorrência da
congestão vascular.
16
As lesões da cartilagem articular
O corpo livre intra-articular é a manifestação clínica de uma lesão condral completa
com um fragmento solto na cavidade articular
(fig. 2). Os sintomas podem variar desde a dor,
derrame até o bloqueio articular.
DIAGNÓSTICO POR IMAGEM
Os métodos utilizados para o diagnóstico
por imagem abrangem geralmente as radioFigura 2. Fragmento osteocondral
grafias simples em duas ou mais incidências e
da patela.
a ressonância nuclear magnética. A medicina
nuclear permite a avaliação da atividade metabólica do osso subcondral nas
lesões osteocondrais.
Radiografias simples
As radiografias simples informam sobre o alinhamento do membro, as deformidades, a presença de corpos livres, fragmentos osteocondrais, as avulsões
ósseas, os sinais de osteoartrite e as características de posição óssea (altura
da patela, desalinhamentos). No joelho, podem ser realizadas radiografias nas
incidências ântero-posterior (AP) com e sem carga,
perfil a 30º, axial da patela a 30o e 45º, oblíquas e
póstero-anterior a 45º de flexão com carga (fig. 3).
Tomografia computadorizada
As imagens de tomografia computadorizada
permitem avaliar características de alinhamento
articular e avaliação das dimensões dos fragmentos osteocondrais (fig. 4).
Figura 3. Osteocondrite de
patela. Radiografia de perfil
do joelho.
Ressonância magnética
A ressonância magnética (RM) é o método de
imagem não-invasivo de preferência para o estudo
da cartilagem articular. A ressonância magnética
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
17
tem a propriedade de diagnosticar os tipos
de lesões condrais, classificá-las segundo
a extensão e localizá-las espacialmente,
importantes informações na determinação
do tratamento a ser seguido (fig. 5). Permite
também avaliar a evolução da lesão após um
procedimento cirúrgico.
A cartilagem articular apresenta uma espessura média de 1,3 a 2,5, podendo atingir
espessuras de 5 mm especificamente em
Figura 4. Osteocondrite de patela.
algumas regiões da patela no joelho humano.
Tomografia computadorizada do
Desta forma, uma alta resolução espacial se
joelho.
faz necessária para que um número suficiente
de pontos de imagem (pixels) estejam disponíveis para caracterizar a espessura
do tecido, incluindo áreas de pequena espessura de cobertura.
Embora não haja consenso sobre a resolução ideal para a avaliação da
morfologia da cartilagem, a espessura de 1,5 mm/0,3 mm tem sido frequentemente utilizada nos dispositivos de RM. Os aparelhos de última geração de
3.0 T permitem uma melhor avaliação qualitativa e quantitativa da cartilagem
articular. O gadolínio também tem sido empregado em sequências de imagens
de RM para a cartilagem articular.
!
"
Figura 5. Osteocondrite de patela (A). Ressonância magnética do joelho (B).
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
21
ções cirúrgicas para estas lesões. Permanece incerto, entretanto, quais lesões
manifestarão sintomas dolorosos a curto e a longo prazo.
Muitas são as opções cirúrgicas para o tratamento das lesões da cartilagem
do joelho. Podemos dividi-las em procedimentos primários e secundários,
conforme a tabela 5.
As técnicas primárias promovem a formação de fibrocartilagem nos locais
da lesão. A fibrocartilagem apresenta propriedades biomecânicas diferentes da
Tabela 4. Indicações gerais para o tratamento das lesões de cartilagem
1.
Lesões traumáticas agudas ≥ 1 cm de diâmetro
2.
Lesões não degenerativas focais e nos casos sem história de gota, artrite reumatóide, sepse ou doença sistêmica
3.
Lesões no côndilo femoral distal
4.
Lesões sintomáticas grau IV e lesões de osteocondrite dissecante graus II, III e IV (classificação da ICRS)
5.
Lesões assintomáticas em pacientes ativos que serão submetidos concomitantemente a reconstrução do
ligamento cruzado anterior, osteotomia tibial alta ou transplante meniscal homólogo
6.
Pacientes sintomáticos após um procedimento falho de reparo da cartilagem
7.
Joelho estável alinhado e com meniscos intactos
8.
Índice de massa corpórea (peso/altura em m2) < 25-30
9.
Paciente de acordo com a fisioterapia pós-operatória
Tabela 5. Procedimentos cirúrgicos primários e secundários
Primários
• Lavagem e desbridamento artroscópico
• Abrasão
• Técnicas de fixação
• Técnicas de estimulação da medula óssea – perfurações, microfraturas
Secundários
• Transplante osteocondral autólogo (mosaicoplastia)
• Transplante osteocondral homólogo
• Enxerto pericondral e periosteal
• Implante autólogo de condrócitos (IAC)
• Implante autólogo de condrócitos assistido por matriz (MACI)
• Engenharia genética
• Realinhamento ósseo – osteotomia
• Realinhamento de partes moles – (luxação recidivante de patela)
• Artroplastia
18
As lesões da cartilagem articular
Uma das grandes vantagens da ressonância magnética, quando comparada a histologia, é a capacidade de fazer cortes contíguos e espacialmente
alinhados, desta maneira permitindo a avaliação tridimensional, que caracteriza
a morfologia articular propriamente.
Alguns parâmetros são avaliados na RM, como o volume da cartilagem, a
espessura (média, máximo e desvio padrão), a área de superfície, a área de
interface com o osso subcondral, as medidas de tamanho do osso e as curvaturas da superfície de cartilagem (congruência articular), dentre outros.
DIAGNÓSTICO ARTROSCÓPICO
A artroscopia é o método mais completo no diagnóstico das lesões da
cartilagem articular, propiciando classificar, localizar e palpar as lesões através
da utilização de instrumental.
CLASSIFICAÇÃO
A graduação das lesões da superfície articular tem se baseado tradicionalmente em técnicas de análise visual. Os sistemas de classificação citados na
literatura incluem aqueles descritos por Outerbridge (tabela 1), Insall, Bauer e
Jackson e Noyes e ICRS (tabela 2).
Mais recentemente, a ICRS (International Cartilage Repair Society) desenvolveu uma padronização da avaliação diagnóstica das lesões de cartilagem
baseada em 12 variáveis: 1. etiologia: lesão aguda (evento traumático) ou crônica (lesões repetitivas), 2. profundidade, 3. tamanho, 4. limites, 5. localização,
Tabela 1. Classificação de Outerbridge modificada
Grau 0: cartilagem normal
Grau 1: cartilagem amolecida e edemaciada
Grau 2: fissuras na cartilagem não atingindo o osso subcondral
Grau 3: fissuras na cartilagem atingindo o osso subcondral
Grau 4: exposição do osso subcondral
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
19
6. avaliação ligamentar, 7. avaliação meniscal, 8. alinhamento femorotibial e
femoropatelar, 9. tratamento prévio, 10. avaliação radiográfica, 11. ressonância
magnética e 12. história clínica.
A ICRS propôs um sistema de graduação no interesse de aprimorar o mapeamento preciso e a descrição das lesões de cartilagem do tipo osteocondrite
dissecante do joelho, promovendo uma linguagem universal sobre as patologias
da cartilagem (tabela 3).
TRATAMENTO
A abordagem das lesões sintomáticas da cartilagem do joelho permanece
um dos maiores desafios da terapêutica moderna. A crescente participação nos
esportes competitivos, e sobretudo a ênfase mundial para a prática da atividade
física, vêm corroborar a necessidade de formas de tratamento eficazes e que
permitam o retorno à prática esportiva.
Tabela 2. Sistema de graduação das lesões da cartilagem articular (ICRS)
Grau 0
Normal
Grau I
Próximo do normal. Lesões superficiais. Indentações com amolecimento (A) e/ou fissuras superficiais e
rachaduras (B)
Grau II
Anormal. Lesões estendendo-se até 50% da espessura da cartilagem.
Grau III
Severamente anormal. Lesões estendendo-se a > 50% da espessura da cartilagem (A) ou até a camada
calcificada (B) ou até o osso subcondral mas sem exposição do mesmo (C)
Grau IV
Severamente anormal. Exposição óssea subcondral
Tabela 3. Osteocondrite dissecante do joelho. Classificação da ICRS
(International Cartilage Research Society)
I
Estável, contínua com área amolecida coberta por cartilagem intacta
II
Descontinuidade parcial, estável à palpação artroscópica
III
Descontinuidade completa, fragmento in situ não deslocado
IV
Fragmento deslocado sobre o leito ou defeito vazio
Lesão < 10 mm de espessura
Lesão > 10 mm de espessura
20
As lesões da cartilagem articular
Tratamento clínico
Os fundamentos do tratamento clínico consistem na redução dos sintomas
dolorosos e a melhora da impotência funcional.
A informação do paciente sobre a lesão é de fundamental importância para
a programação do tratamento. As atividades físicas devem ser modificadas
durante o quadro sintomático e programas de fisioterapia devem ser iniciados.
O uso de analgésicos e anti-inflamatórios não-esteroides, assim como as
infiltrações articulares com corticosteroides promovem uma melhora provisória
dos sintomas, embora não ocorram modificações nas características das lesões.
Os corticosteroides inibem a proliferação dos condrócitos e diminuem a síntese de matriz, incluindo a expressão de colágeno e a síntese de proteoglicanos.
Numerosos estudos têm investigado o papel de agentes condroprotetores
da cartilagem (diacereína, sulfato de glucosamina e o sulfato de condroitina) no
reparo da cartilagem articular e na desaceleração no processo degenerativo, embora os mecanismos de ação ainda não sejam completamente compreendidos.
A glucosamina é uma molécula de amino-açúcar, enquanto a condroitina
é um polissacarídeo composto de resíduos de ácido glicurônico e N-acetilglicosamina, e ambos são componentes dos proteoglicanos encontrados na
cartilagem. Estudos em culturas de células constataram que ambos aumentam
a síntese de proteoglicanos nos condrócitos articulares.
Tratamento cirúrgico
Lesões da cartilagem articular representam um desafio ao ortopedista, em
parte devido à estrutura complexa e às propriedades distintas da cartilagem
hialina. Os objetivos primordiais a serem considerados no tratamento cirúrgico
abrangem a realização de um método que restabeleça a superfície da cartilagem
hialina através de uma abordagem minimamente invasiva, preferencialmente
artroscópica e associada a mínima morbidade, não somente pós-operatória
imediata, como a longo prazo. As indicações amplas para o tratamento cirúrgico
das lesões de cartilagem são descritas na tabela 4.
O tratamento não-cirúrgico das lesões osteocondrais do joelho manifestase eficiente para muitos pacientes, particularmente em curto prazo; entretanto,
recentes avanços na abordagem cirúrgica, assim como os melhores conhecimentos da história natural destas lesões, aumentaram o interesse nas solu-
22
As lesões da cartilagem articular
cartilagem hialina, o que justifica a deterioração dos resultados pós-operatórios.
Fazem parte deste grupo a abrasão, a lavagem, o desbridamento artroscópico,
as perfurações (“drilling”) e as microfraturas.
O algoritmo de tratamento das lesões cartilagem segue na tabela 6.
Lavagem e desbridamento artroscópico
A lavagem e o desbridamento artroscópicos baseiam-se na remoção de
fragmentos de cartilagem articular degenerada, enzimas proteolíticas e mediadores inflamatórios e promovem um alívio temporário dos sintomas.
As indicações do desbridamento e lavagem artroscópica são: tamanho entre
0,5 e 2,0 cm2, lesões graus II e III, delaminação de lesões grau IV, pacientes
de baixa demanda funcional, melhorar a congruência articular e reduzir os
mediadores químicos inflamatórios. As técnicas devem minimizar a remoção
de fragmentos, exclusivamente aqueles em situações que se enquadram nas
indicações.
Tabela 6. Algoritmo clínico de tratamento da lesão de cartilagem
Indicações gerais: sintomático, unipolar, não artrítico, alinhado, estável (sem frouxidão ligamentar), > 2/3 menisco
intacto, idade < 55 anos, IMC < 30 (Scaglione N. Sports Med Arthr Rev 2003;11(3):912-201).
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
23
Os instrumentais utilizados são o shaver e remoção direta dos fragmentos
livres. A utilização de instrumentos térmicos pode provocar lesões adicionais
sobre a cartilagem intacta.
As técnicas são geralmente simples, rápidas e custo-efetivas, embora
possam provocar lesões perimetrais inadvertidas por manuseio inadequado
do instrumental. Os resultados satisfatórios a curto prazo estão associados a
pacientes com sintomas inferiores a 1 ano, história de trauma específico, com
mínimo desalinhamento articular e baixo índice de massa corpórea.
Abrasão artroscópica
A abrasão superficial cortical cria uma resposta vascular de reparo através
do sangramento, removendo o tecido desvitalizado e esclerótico exposto e
preservando a cartilagem articular degenerativa intacta ao redor, com a utilização
de instrumental motorizado ou cureta.
Reparo
A fixação permanece o tratamento de escolha nas fraturas condrais e osteocondrais, com tamanho entre 1 a 2 cm2, ou maiores, nas quais o fragmento
permanece viável, não deformado e redutível.
A fixação na osteocondrite dissecante do joelho está indicada nas lesões
instáveis, parcial ou totalmente destacadas, sobre o leito ou formando corpos
livres (fig. 6).
!
"
Figura 6 A/B.
Fragmento
ósseo da tíbia
proximal,
utilizado na
confecção
de “palitos”
ósseos,
utilizados na
fixação dos
fragmentos de
osteocondrite
dissecante.
24
As lesões da cartilagem articular
As vantagens da técnica são decorrentes do fato do tecido nativo ser superior
a outros tecidos, possibilidade de gerar alto potencial de cicatrização e a realização por meio de artroscopia. As desvantagens são o real desconhecimento
sobre a viabilidade do tecido e a perda óssea concomitante.
Microfraturas
A técnica de microfraturas idealizada por Steadman, uma modificação do
método de perfuração (“drilling”) idealizado por Pridie, utiliza-se de um instrumental com formato semelhante a de um “quebra-gelo” que penetra 3 a
4 mm de profundidade perpendicularmente à superfície, completando 3 a 4
perfurações por cm2.
Dentre as vantagens da técnica estão a formação de canais de acesso às
células mesenquimais multipotentes (“stem cells”), a produção de uma superfície
rugosa no osso subcondral para adesão do coágulo sanguíneo e a menor reação
de necrose térmica dos tecidos adjacentes, quando comparada à técnica de
perfurações e a mobilização precoce.
As microfraturas são a primeira linha de tratamento cirúrgico para as lesões
de cartilagem em pacientes jovens. As indicações abrangem as lesões focais
traumáticas, grau IV (Outerbridge), as lesões graus IIIB, IIIC, IIID e IV (ICRS),
tamanho em torno de 2 cm2, lesões de espessura total instáveis, perda óssea
< 4-6 mm, pacientes com idade entre 35 e 50 anos, em todos os compartimentos do joelho e pode ter valor em certas lesões degenerativas focais associadas
à correção dos desalinhamentos.
As contraindicações para a técnica estão nos desalinhamentos axiais (> 5o
de varo/valgo nas radiografias com incidência de Rosemberg), perdas ósseas
≥ 5 -10 mm, leito necrótico ou avascular, pacientes não colaboradores com a
limitação de carga pós-operatória, lesões de espessura parcial e nos indivíduos
com idade superior a 65 anos.
As vantagens da microfratura são: artroscópica, facilidade técnica, procedimento único, custo baixo, mínima morbidade, pode ser eficiente em algumas
lesões degenerativas, resultados comparáveis a outras técnicas de maior custo.
As desvantagens da microfratura são: violação do osso subcondral, pode
comprometer ou postergar a realização de futuros procedimentos (IAC), formação de fibrocartilagem (propriedades biomecânicas inferiores), a durabilidade
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
25
do reparo tecidual sobre o carregamento mecânico é desconhecida ao longo
do tempo, resultados inferiores nos pacientes com idade > 50 anos, lesões
crônicas, tamanho > 2 cm2, bipolar e desalinhamento articular.
As perfurações ósseas idealizadas por Pridie em 1959 são realizadas com fios
de Kirchner de 2,0 mm, com cerca de 2 a 3 mm de profundidade e espaçados
entre 3 e 4 mm, de maneira que o osso subcondral seja penetrado.
As técnicas cirúrgicas secundárias baseiam-se no transplante ou na indução
à formação de cartilagem hialina nos locais de lesão. São representadas pelo
transplante osteocondral autólogo (mosaicoplastia), transplante ostecondral
homólogo, transplante de periósteo, transplante de pericôndrio, cultura de
condrócitos, engenharia de tecidos e a terapia genética.
Transplante osteocondral autólogo
O transplante osteocondral autólogo baseia-se no transplante de múltiplos
fragmentos osteocondrais autólogos ou homólogos de pequeno tamanho,
com um formato cilíndrico, fixados por compressão contra as paredes da área
receptora. Em ambos os casos, tanto a cartilagem articular hialina (colágeno
tipo II), quanto o osso subcondral são extraídos conjuntamente da área doadora. Os enxertos são transplantados para o defeito previamente preparado
por meio de instrumental específico e as técnicas podem ser realizadas por
via aberta ou artroscópica, dependendo do tamanho, localização da lesão e
preferência do cirurgião.
As indicações ideais dos transplantes osteocondrais autólogos são: lesões
focais isoladas de tamanho < 2-3 cm2 (< 4 a 5 enxertos), localizadas nos côndilos, tróclea, patela e platô tibial, osteocondrite dissecante (OCD), extremidade
alinhada e nos indivíduos com idade inferior a 50 anos.
As regiões doadoras do “plugue osteocondral” apresentam algumas particularidades: 1. todas as localizações demonstram algum contato, o que de fato
gera alguma morbidade para a zona doadora, 2. a espessura da cartilagem e
a curvatura variam conforme a zona doadora e receptora, 3. a acurácia e precisão no cálculo, remoção do plugue e enxertia comprometem a vitalidade do
enxerto, 4. a técnica de inserção deve ser perpendicular à superfície receptora,
5. os enxertos são maiores do que a área receptora.
Os diâmetros ideais dos “plugues osteocondrais” são: 6 a 8 mm de diâme-
26
As lesões da cartilagem articular
Figura 7. Técnica de transplante osteocondral
autólogo (mosaicoplastia). Fragmento
osteocondral.
tro e 15 a 20 mm de comprimento
(fig. 7). As zonas doadoras de enxerto
são descritas abaixo conforme seus
autores:
• Tróclea súpero-medial (Staubli,
Garretson)
• Tróclea medial distal (Ahmad)
• Tróclea súpero-lateral melhor do
que o da zona intercondilar
• Intercôndilo para lesões da tróclea
central (Ahmad)
Implante autólogo de condrócitos
A técnica de implante autólogo de condrócitos (IAC) foi primeiramente descrita em 1984 por Peterson e colaboradores em modelos animais. A técnica se
baseia em dois procedimentos cirúrgicos (artrotomias), sendo a primeira para
a coleta de células viáveis, seguida de tempo de cultura e nova cirurgia para
implante do produto final (condrócitos) no local da lesão.
A técnica original se baseia na coleta da fragmentos de cartilagem viável,
os condrócitos são enzimaticamente isolados sob condições assépticas e
cultivados em meio de cultura especial no laboratório. As células crescem in
vitro sob condições ideais, para criar milhões de condrócitos ativos. Após 2 a
3 semanas, a articulação é aberta e o defeito condral coberto com lâmina de
periósteo da superfície da tíbia.
As indicações ideais são: pacientes ativos, lesões focais de 2 a 8 cm, ausência de osteoartrite e geralmente casos refratários a tratamentos cirúrgicos
anteriores.
Knutsen e colaboradores constataram, ao realizar estudo randomizado
comparando o IAC e microfratura, não haver correlação entre a histologia e
a evolução clínica de ambos os grupos aos 2 anos de seguimento após a
cirurgia. Após 5 anos, os mesmos grupos apresentaram uma taxa de sucesso
comparável de 77%.
Saris e colaboradores realizaram estudo randomizado comparando o IAC
com a microfratura e observaram melhores resultados no grupo de defeitos
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
27
condrais tratados com condrócitos autólogos, revelando melhor estrutura de
reparo registrada por histomorfometria e avaliação histológica geral. Ambos os
grupos apresentaram escores comparáveis, embora o tecido regenerado tenha
sido superior no IAC.
Os “scaffolds” são matrizes biocompatíveis, estruturalmente e biomecanicamente estáveis, que devem suportar cargas compatíveis com a viabilidade e o
crescimento celular no seu interior, além de fornecer moléculas bioativas capazes
de promover a ligação celular em sua estrutura. Devem ser biodegradáveis e
promover um suporte temporário às células (fig. 8).
As matrizes podem ser divididas em biomateriais naturais (colágeno, alginato, cola de fibrina, hialuronato, agarose, chitosan) e biomateriais sintéticos
(ácido poliglicólico (PGA), ácido polilático (PLA) e polidioxanona). Entretanto, a
utilização clínica destes materiais tem sido limitada, devido ao risco inerente de
transmissão de doenças e reação imunológica.
A técnica de MACI compreende um sistema de engenharia de tecidos, onde
o princípio do implante autólogo de células é preservado, além de desenvolver
uma matriz de dupla camada de colágeno tipo I-III. Células são removidas do
paciente e processadas in vitro e uma vez desenvolvidos, os condrócitos são
semeados entre as camadas de colágeno na sala de cirurgia, antes do implante
ser realizado. A membrana de MACI pode ser diretamente colocada sobre o
defeito e fixada com cola de fibrina.
Alguns estudos in vitro e in vivo têm demonstrado que as matrizes tridimensionais com multicamadas são
um excelente meio para a adesão
celular e a manutenção do fenótipo
dos condrócitos.
Magnussen e colaboradores realizaram revisão sistemática de estudos
com níveis de evidência I e II para
responder questões clínicas referentes às evoluções pós-operatórias do
implante autólogo de condrócitos,
Figura 8. Matriz para implante autólogo de
condrócitos.
transplante osteocondral autóloNakamura (2007).
go, MACI (implante autólogo de
28
As lesões da cartilagem articular
condrócitos assistido por matriz) e microfratura. O seguimento mínimo foi de
1 ano (média de 1,7 anos) e nenhuma das técnicas apresentou resultados
consistentemente melhores quando comparadas entre si. Todos os estudos
registraram melhora nos critérios clínicos, quando comparados aos resultados
pré-operatórios, embora grupos controle (não-cirúrgicos) não tenham sido
utilizados em muitos dos estudos.
Estudos recentes sobre o IAC revelam uma viabilidade de mais de 11 anos,
evidenciando o potencial da terapia celular na regeneração da cartilagem hialina. Várias modificações diferentes da técnica original estão sendo testadas,
focando-se especialmente as técnicas cirúrgicas minimamente invasivas e a
combinação dos IAC com matrizes tridimensionais (MACI), fatores de crescimento e engenharia genética.
Engenharia genética
A habilidade das células-tronco mesenquimais de se diferenciarem em
condrócitos (in vitro e in vivo) e de se expandirem nos meios de cultura sem
perderem a pluripotencialidade tem feito delas candidatos atrativos para o reparo
da cartilagem articular baseado em células.
Estudos recentes registraram que a hipóxia estimula a diferenciação condrogênica das células-tronco mesenquimais, quando comparadas às culturas
de controle nos ambientes com elevadas tensões de oxigênio.
A combinação dos fatores de crescimento com a engenharia genética parece
ser o método mais promissor no futuro do tratamento das lesões de cartilagem.
Alguns conceitos importantes no tratamento cirúrgico das lesões de cartilagem não devem ser esquecidos:
• Nem toda patologia da cartilagem causará sintomas significantes
• Estabelecer correlação entre a lesão e os sintomas é de fundamental
importância
• Pacientes jovens apresentam melhores evoluções
• Conheça os objetivos do paciente, sua realidade e comportamento
• Opte por procedimentos de custo acessível, único estágio e minimamente
invasivos
• O estado do osso subcondral tem importância fundamental no tratamento
das lesões de cartilagem
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
29
• O alinhamento articular é fundamental: “A biomecânica inadequada destrói
a biologia adequada”
• Defeitos focais traumáticos decorrentes da osteocondrite dissecante
diferem das lesões da osteoartrite, são patologias diferentes
• O tratamento de lesões grandes e complexas requer uma abordagem
mais ampla e experiente
• Procedimentos coadjuvantes são críticos para o sucesso do tratamento
• A osteoartrite promove uma dor difusa, decorrente de uma doença
articular. As técnicas de microfraturas, transplantes osteocondrais e
implante autólogo de condrócitos são bem indicadas nos pacientes sem
osteoartrite
REFERÊNCIAS BIBLIOGRÁFICAS
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
Al Ali D, Graichen H, Faber S et al. Quantitative cartilage imaging of the human hind foot: precision
and intersubject variability. J Orthop Res 2002;20:249–256.
Antoniades L, Spector TD, MacGregor AJ. The genetic contribution to hip joint morphometry and
relationship to hip cartilage thickness. Osteoarthritis Cartilage 2001;9:593–595.
Burstein D, Bashir A, Gray ML. MRI techniques in early stages of cartilage disease. Invest Radiol
2000;35:622–638.
Burstein D, Gray M. New MRI techniques for imaging cartilage. J Bone Joint Surg Am 2003;85
(Supplement 2):70-77.
Carter DR, Wong M, Orr TE. Musculoskeletal ontogeny,phylogeny, and functional adaptation. J Biomech 1991;24(Suppl. 1):3–16.
Chen AC, Temple MM, Ng DM et al. Induction of advanced glycation end products and alterations
of the tensile properties of articular cartilage. Arthritis Rheum 2002;46:3212–3217.
Cicuttini F, Forbes A, Asbeutah A, Morris K, Stuckey S. Comparison and reproducibility of fast and
conventional spoiled gradient-echo magnetic resonance sequences in the determination of knee
cartilage volume. J Orthop Res 2000;18:580–584.
Cicuttini FM, Wluka AE, Wang Y et al. Compartment differences in knee cartilage volume in healthy
adults. J Rheumatol 2002;29:554–556.
Cicuttini FM, Wluka AE, Forbes A, Wolfe R. Comparison of tibial cartilage volume and radiologic grade
of the tibiofemoral joint. Arthritis Rheum 2003;48:682–688.
Cohen ZA, Roglic H, Grelsamer RP et al. Patellofemoral stresses during open and closed kinetic chain
exercises. An analysis using computer simulation. Am J Sports Med 2001;29: 480–487.
Eckstein F, Schnier M, Haubner M et al. Accuracy of cartilage volume and thickness measurements
with magnetic resonance imaging. Clin Orthop 1998a;352:137–148.
Eckstein F, Tieschky M, Faber SC et al. Effect of physical exercise on cartilage volume and thickness
in vivo: MR imaging study. Radiology 1998b;207:243–248.
Eckstein F, Lemberger B, Stammberger T, Englmeier KH, Reiser M. Patellar cartilage deformation in
vivo after static versus dynamic loading. J Biomech 2000a;33:819–825.
Eckstein F, Lemberger B, Stammberger T, Englmeier KH, Reiser M. Patellar cartilage deformation in
vivo after static versus dynamic loading. J Biomech 2000b;33:819–825.
30
As lesões da cartilagem articular
15. Eckstein F, Charles HC, Buck RJ et al. Accuracy and precision of quantitative assessment of cartilage
morphology by magnetic resonance imaging at 3.0T. Arthritis Rheum 2005a;52:3132–3136.
16. Eckstein F, Lemberger B, Gratzke C et al. In vivo cartilage deformation after different types of activity
and its dependence on physical training status. Ann Rheum Dis 2005c;64:291–295.
17. Faber SC, Eckstein F, Lukasz S et al. Gender differences in knee joint cartilage thickness, volume and
articular surface areas: assessment with quantitative three-dimensional MR imaging. Skeletal Radiol
2001;30:144–150.
18. Gray ML, Eckstein F, Peterfy C et al. Toward imaging biomarkers for osteoarthritis. Clin Orthop
2004;427:S175–S181.
19. Haapala J, Arokoski JP, Hyttinen MM et al. Remobilization does not fully restore immobilization induced
articular cartilage atrophy. Clin Orthop 1999;00:218–229.
20. Hinterwimmer S, Krammer M, Krotz M et al. Cartilage atrophy in the knees of patients after seven
weeks of partial load bearing. Arthritis Rheum 2004;50:2516–2520.
21. Hudelmaier M, Glaser C, Hohe J et al. Age-related changes in the morphology and deformational
behavior of knee joint cartilage. Arthritis Rheum 2001;44:2556–2561.
22. Huiskes R, Ruimerman R, Van Lenthe GH, Janssen JD. Effects of mechanical forces on maintenance
and adaptation of form in trabecular bone. Nature 2000;405:704–706.
23. Hunziker EB, Quinn TM, Hauselmann HJ. Quantitative structural organization of normal adult human
articular cartilage. Osteoarthritis Cartilage 2002;10, 564–572.
24. Kim YJ, Bonassar LJ, Grodzinsky AJ. The role of cartilage streaming potential, fluid flow and
pressure in the stimulation of chondrocyte biosynthesis during dynamic compression. J Biomech
1995;28:1055–1066.
25. Kiviranta I, Tammi M, Jurvelin J et al. Articular cartilage thickness and glycosaminoglycan distribution in
the young canine knee joint after remobilization of the immobilized limb. J Orthop Res 1994;12:161–167.
26. Kornaat PR, Reeder SB, Koo S et al. MR imaging of articular cartilage at 1.5T and 3.0T: comparison
of SPGR and SSFP sequences. Osteoarthritis Cartilage 2005;13:338–344.
27. Krishnan R, Park S, Eckstein F, Ateshian GA. Inhomogeneous cartilage properties enhance superficial
interstitial fluid support and frictional properties, but do not provide a homogeneous state of stress.
J Biomech Eng 2003;125:569–577.
28. Papa E, Cappozzo A. Sit-to-stand motor strategies investigated in able-bodied young and elderly
subjects. J Biomech 2000;33:1113–1122.
29. Raynauld JP, Kauffmann C, Beaudoin G et al. Reliability of a quantification imaging system using
magnetic resonance images to measure cartilage thickness and volume in human normal and osteoarthritic knees. Osteoarthritis Cartilage 2003;11:351–360.
30. Roos EM, Dahlberg L. Positive effects of moderate exercise on glycosaminoglycan content in knee
cartilage: a fourmonth, randomized, controlled trial in patients at risk of osteoarthritis. Arthritis Rheum
2005;52:3507–3514.
31. Tiderius CJ, Olsson LE, Leander P, Ekberg O, Dahlberg L. Delayed gadolinium-enhanced MRI of
cartilage (dGEMRIC) in early knee osteoarthritis. Magn Reson Med 2003;49:488– 492.
32. Vanwanseele B, Eckstein F, Knecht H, Stussi E, Spaepen A. Knee cartilage of spinal cord-injured
patients displays progressive thinning in the absence of normal joint loading and movement. Arthritis
Rheum 2002a;46:2073–2078.
33. Vanwanseele B, Lucchinietti E, Stussi E. The effects of immobilization on the characteristics of articular
cartilage: current concepts and future directions. Osteoarthritis Cartilage 2002b;10:408–419.
34. Vanwanseele B, Eckstein F, Knecht H, Spaepen A, Stussi E. Longitudinal analysis of cartilage atrophy
in the knees of patients with spinal cord injury. Arthritis Rheum 2003;48:3377–3381.
35. Verzijl N, Degroot J, Ben ZC et al. Crosslinking by advanced glycation end products increases the
stiffness of the collagen network in human articular cartilage: a possible mechanism through which
age is a risk factor for osteoarthritis. Arthritis Rheum 2002;46:114–123.
36. Waldman SD, Spiteri CG, Grynpas MD, Pilliar RM, Kandel RA. Long-term intermittent shear deformation
improves the quality of cartilaginous tissue formed in vitro. J Orthop Res 2003; 21:590–596.
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
31
37. Williams A, Gillis A, McKenzie C et al. Glycosaminoglycan distribution in cartilage as determined by
delayed gadolinium-enhanced MRI of cartilage (dGEMRIC): potential clinical applications. AJR Am J
Roentgenol 2004;182,167–172.
38. Curl WW, Krome J, Gordon ES, Rushing J, Smith BP, Poehling GG. Cartilage injuries. A review of
31,516 knee arthroscopies. Arthroscopy 1997;13:456-460.
39. Mandelbaum BR, Browne JE, Fu F et al. Articular cartilage lesions of the knee. Am J Sports Med
1998;26:853-861.
40. Minas T, Hehrer S. Current concepts in the treatment of articular cartilage defects. Orthopedics
1997;20:525-538.
41. Outerbridge RE. The etiology of chondromalacia patellae. J Bone Joint Surg Br 1961;43:752-757.
42. Setnikar I: Antireactive properties of “chondroprotective” drugs. Int J Tissue React 1992;14:253-261.
43. Mankin JH. The response of articular cartilage to mechanical injury. J Bone Joint Surg 1982;64A:460466.
44. Hangody L, Kish G, Karpati Z et al. Autologous osteochondral graft technique for relacing knee
cartilage defects in dogs. Orthopedics 1997;5:175-181.
45. Hangody L, Kish G, Karpati Z, Udvarhelyi I, Szigeti I, Bely M. Mosaicoplasty for the treatment of
articular cartilage defects: application in clinical practice. Orthopedics 1998;21:751-756.
46. Sgaglione NA, Miniaci A, Gillogly SD, Carter TR. Update on advanced surgical techniques in the
treatment of traumatic focal articular cartilage lesions in the knee. Arthroscopy 2002;18(2 february,
suppl 1):9-32.
47. Alford JW, Cole B. Cartilage Restoration, Part 1: Basic science, historical perspective, patient evaluation
and treatment options. Am J Sports Med 2005;33 (2):295-306.
48. Buckwalter J. Integration of Science into Orthopaedic Practice: Implications for Solving the Problem
of Articular Cartilage Repair. J Bone Joint Surg 2003;85A (suppI2) 1-7.
49. Guettler J, Demetropoulos C, Yang K et al. Osteochondral Defects in the Human Knee: Influence of
Defect Size on Cartilage Rim Stress and Load Redistribution to Surrounding Cartilage. AJSM 2004;
32:1451-1458.
50. Hambly K, Griva K. IKDC or KOOS? Which Measures Symptoms and Disabilities Most Important to
Postoperative Articular Cartilage Repair Patients? Am J Sports Med 2008;36 (9):1695 -1704.
51. Henderson I, Lavigne P, Valenzuela H et. aI. Autologous Chondrocyte Implantation: Superior Biologic
Properties of Hyaline Cartilage Repairs. Clin Orthop 2007;455:253-61.
52. Jakobsen R, Engebretsen L, Slauterbeck J. An Analysis of the Quality of Cartilage Repair Studies. J
Bone Joint Surg 2005;87(A10):2232-2239.
53. Knutsen G, Drogset J, Engebretsen L et.al. A Randomized Trial Comparing Autologous Chondrocyte
Implantation with Microfracture: Findings at Five Years. J Bone Joint Surg 2007;89(10):2105-12.
54. Kuikka P, Kiuru B, Niva M. Sensitivity of Routine 1.0 - Tesla MRI versus Arthroscopy as Gold Standard in Fresh Traumatic Chondral Defects ofthe Knee in Young Adults. Arthroscopy 2006;22(10):
1033-39.
55. Potter H, Foo L. Magnetic Resonance Imaging of Articular Imaging: Trauma, Degeneration and Repair.
Am J Sports Med 2006;34(4):661-77.
56. Sgaglione, N. A.: Biologic Approaches to Articular Cartilage: Future Trends. Orthopedic Clinics of
North America 2005;36;October,485-95.
57. Sgaglione N. Decision - Making and Approach to Articular Cartilage Surgery. Sports Med Arthr Rev
2003;(11) 3:192-201.
58. Sgaglione N. The Future of Cartilage Restoration. J Knee Surg 2004;17(4):235-243.
59. Shelbourne KD, Kari S, Gray T. Outcome of Untreated Traumatic Articular Defects in the Knee. J Bone
Joint Surg 2003;85A:Suppl. 8-16.
60. Ahmad C, Cohen Z, Levine W et aI. Biomechanical and Topographical Considerations for Autologous
Osteochondral Grafting in the Knee. Am J Sports Med 2001;29:201-206.
61. Barber Fa, Herbert M, McGarry J et al. Insertion Force of Articular Cartilage Transplantation Systems.
Journal Knee Surg 2008;21(3):200-4.
32
As lesões da cartilagem articular
62. Barber FA, Iwasko N. Treatment-of Grade lV Femoral Chondral Lesions: Mechanical Chondroplasty
Versus Monopolar Radiofrequency Probe. Arthroscopy 2006;22(12):1312-17.
63. Barber FA, Chow J. Arthroscopic Chondral Osseous Autograft Transplantation (COR Procedure) for
Femoral Defects. Arthroscopy 2006;22(1):10-16.
64. Bartz R, Kamaric E, Noble P et. aI. Topographic Matching of Selected Donor and Recipient Sites
for Osteochondral Autografting of the Articular Surface of the Femoral Condyles. Am J Sports Med
2001;29:207-212.
65. Bentley G, Biant L, Carrington R, Akmal M, Goldberg A, Williams A, Skinner J, Pringle J. Autologous
Chondrocyte Implantation was Superior to Mosaicplasty for Repair of Articular Cartilage Defects in
the Knee. J Bone Joint Surg Br 2003;85:223-230.
66. Borazjani B, Chen A, Bae W et al. Effect of Impact on Chondrocyte Viability During Insertion of Human
Osteochondral Grafts. J Bone Joint Surgery 2006;88A(9):1934-43.
67. Chow JC, Hantes M, Houle JB et aI. Arthroscopic Autogenous Osteochondral Transplantation for
Treating Knee Cartilage Defects: A 2 to 5 Year Follow -up Study. Arthroscopy 2004;20:681-690.
68. Dervin G, Stiell I, Rody K et al. Effect of Arthroscopic Debridement for Osteoarthritis ofthe Knee on
Health - Related Quality of Life. J Bone Joint Surg 2003;85A:10-19.
69. Frisbie D, Morisset, Ho, C et aI. Effects of Calcified Cartilage on Healing of Chondral Defects Treated
with Microfracture in Horses. Am J Sports Med 2006;34:1824-1831.
70. Garretson R, Katolik L, Verma N et al. Contact Pressures at Osteochondral Donor Sites in the Patellofemoral Joint. Am J Sports Med 2004;32:967-974.
71. Gudas R, Kalesinskas R, Kimtys V et aI. A Prospective Randomized Clinical study ofMosaic Osteochondral Autologous Transplantation Versus Microfracture for the Treatment of Osteochondral Defects
in the Knee Joint in Young Athletes. Arthroscopy 2005;21(9):1066-75.
72. Guettler J, Demetropoulos C, Yang K et al. Osteochondral Defects in the Human Knee: Influence of
Defect Size on Cartilage Rim Stress and Load Redistribution to Surrounding Cartilage. Am J Sports
Med 2004;32:1451-1458.
73. Hangody L, Rathonyi G, Vasarhelyi G et aI. Autologous Osteochondral Mosaicplasty. J Bone Joint
Surg 2004;86A suppl 1:65-72.
74. Harwin S. Arthroscopic Debridement for Osteoarthritis ofthe Knee: Predictors of Patient Satisfaction.
Arthroscopy 1999;15:142-142.
75. Horas U, Pelinkovic D, Aigner T et aI. Autologous Chondrocyte Implantation and Osteochondral Cylinder Transplantation in Cartilage Repair ofthe Knee Joint: A Prospective Comparative Trial. J Bone
Joint Surg 2003;85A;2:185-192.
76. Hubbard M. Articular Debridement Versus Washout for Degeneration ofthe Medial Femoral Condyle.
J Bone Joint Surg 1996;78B(5):217-219.
77. Iwasaki N, Kato H, Kamishima T. Donor site Evaluation After Autologous Osteochondral Mosaicplasty
for Cartilaginous Lesions of the Elbow Joint. Am J Sports Med 2007;35(12):2096-2100.
78. Kobayashi T, Fujikawa K, Oohashi M. Surgical Fixation of Massive Osteochondritis Dissecans Lesion
Using Cylindrical Osteochondral Plugs. Arthroscopy 2004;20:981-986.
79. Kocher M, Tucker R, Ganley, T, et. aI. Management of Osteochondritis Dissecans of the Knee Current
Concepts Review: Am J Sports Med 2006;34(7):1181-1191.
80. Koh J, Wirsing K, Lautenschlager E, et. aI. The Effect of Graft Height Mismatch on Contact Pressure
Following Osteochondral Grafting. Am J Sports Med 2004;32:317-320.
81. Koh J, Kowalski A, Lautenschlager E. The Effect of Angled Osteochondral Grafting on Contact Pressure. Am J Sports Med 2006;34(1):116-19.
82. Knutsen G, Drogset J, Engebretsen L et al. A Randomized Trial Comparing Autologous Chondrocyte
Implantation with Microfracture: Findings at Five Years. J Bone Joint Surg 2007;89(10):2105-12.
83. Koutsen G, Engebretsen L, Ludvigsen T et al. Autologous Chondrocyte Implantation Compared with
Microfracture in the Knee: A Randomized Trial. J Bone Joint Surg 2004;86A (3):455-464.
84. Kreuz P, Erggelet C, Steinwachs M et al. Is Microfracture of Chondral Defects in the Knee Associated
with Different results in Patients Aged 40 Years or Younger? Arthroscopy 2006;22(11):1180-86.
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
33
85. Lane J, Massie J, Ball S et. aI. Follow- up of Osteochondral Plug Transfers in a Goat Model. Am J
Sports Med 2004;32:1440-1450.
86. LaPrade R, Botker J. Donor - Site Morbidity After Osteochondral Autograft Transfer Procedures.
Arthroscopy 2004;20(7):e69-72.
87. Marcacci M, Kon E, Delcogliano M, et. aI. Arthroscopic Autologous Osteochondral Grafting for Cartilage Defects of the Knee: Propective Study Results at a Minimum 7 -yr Follow - up. Am J Sports
Med 2007;35(12):2014-21.
88. Marder R, Timmerman L. Arthroscopic Microfracture of Chondral Defects of the Knee: A Comparison
of Two Postoperative Treatments. Arthroscopy 2005;21:152-158.
89. Merchan E, Galindo E. Arthroscope - Guided Surgery Versus Nonoperative Treatment for Limited
Degenerative Arthritis ofthe Femorotibial Joint in Patients Over 50 Years of Age: A Prospective Comparative Study Arthroscopy 1993;9:663-667.
90. Miniaci A, Tytherleigh - Strong G. Fixation of Unstable Osteochondritits Dissecans Lesions ofthe Knee
Using Arthroscopic Autogenous Osteochondral Grafting (Mosaicplasty). Arthroscopy 2007;23(8):845-51.
91. Mithoefer K, Williams R, Warren R et aI. High Impact Athletics After Knee Articular Cartilage Repair.
Am J Sports Med 2006;34(9):1413-18.
92. Mithoefer K, Williams R, Warren R et aI. The Microfracture Technique for the Treatment of Articular
Cartilage Lesions in the Knee A Prospective Cohort Study. J Bone Joint Surg 2005;87A(9):1911- 20.
93. Mosely B, O’Malley, Petersen N et aI. A Controlled Trial of Arthroscopic Surgery For Osteoarthritis of
the Knee. NEJM 2002;347:81-88.
94. Patil S, Butcher W, D’Lima D et aI. Effect of Osteochondral Graft Insertion Forces on Chondrocyte
Viability. Am J sports Med 2008;36(9):1726-32.
95. Pearce S, Hurtig M, Clarnette R et al. An Investigation of Two Techniques for Optimizing Joint Surface
Congruency Using Multiple Cylindrical Osteochondral Autografts. Arthroscopy 2001;17:50-55.
96. Potter H, Foo L. Magnetic Resonance Imaging of Articular Imaging: Trauma, Degeneration and Repair.
Am J Sports Med 2006;34(4):661-77.
97. Reddy S, Pedowitz D, Parekh S et aI. The Morbidity Associated with OC Harvest from Asymptomatic
Knees for the Treatment of OC Lesions of the Talus. Am J Sports Med 2007; 35(1):80-5, 2007.
98. Sgaglione N, Abruytn D. Update on the Management of Osteochondral Fractures and Osteochondritits
Dissecans of the Knee. Sports Med Arthr Rev 2003;(11)4:222 -235.
99. Sgaglione N, Miniaci A, Gillogly S, Carter T. Update on Advanced Surgical Techniques in the Treatment
of Traumatic Focal Articular Cartilage Lesions of the Knee. Arthroscopy 2002;18:2:9-32.
100. Sgaglione N. The Future of Cartilage Restoration. J Knee Surg 2004;17(4):235-243.
101. Spahn G, Muckly T, Kahl E et aI. Factors Affecting the Outcome of Arthroscopy in Medial Compartment
Osteoarthritis of the Knee. Arthroscopy 2006;22(11):1233-40.
102. Steadman J R, Briggs K, Rodrigo J et al. Outcomes of Microfracture for Traumatic Chondral Defects
of the Knee: Average 11 - Year Follow - up. Arthroscopy 2003;19:477-484.
103. Stuart M, Lubowitz J. What if Any, Are the Indications for Arthroscopic Debridement of the Osteoarthritic Knee? Arthroscopy 2006;22(3):238-9.
104. Williams S, Amiel D, Ball S, et. aI. Prolonged Storage effects on the Articular Cartilage of Fresh Human
Osteochondral Allografts. J Bone Joint Surg 2003;85A(11):211-20.
105. Peterson L, Brittberg M, Kiviranta I, Akerlund EL, Lindahl A. Autologous chondrocyte transplantation.
Biomechanics and long-term durability. Am J Sports Med 2002;30:2-12.
106. Chu CR, Convery FR, Akeson WH, Meyers M, Amiel D. Articular cartilage transplantation. Clinical
results in the knee. Clin Orthop Relat Res 1999(360):159-68.
107. Gõrtz S, Bugbee WD. Allografts in articular cartilage repair. J Bone Joint Surg Am 2006;88(6):1374-84.
108. Czitrom AA, Keating S, Gross AE. The viability of articular cartilage in fresh osteochondral allografts
after clinical transplantation. J Bone Joint Surg Am 1990;72(4):574-81.
109. McCulloch PC, Kang RW, Sobhy MH, Hayden JK, Cole BJ. Prospective evaluation of prolonged
fresh osteochondral allograft transplantation of the femoral condyle: minimum 2-year follow-up. Am
J Sports Med 2007;35(3):411-20.
34
As lesões da cartilagem articular
110. Ghazavi MT, Pritzker KP,Davis AM, Gross AE. Fresh osteochondral allografts for post-traumatic
osteochondral defects of the knee. J Bone Joint Surg Br 1997;79(6):1008-13.
111. Torga Spak R,Teitge RA. Fresh osteochondral allografts for patellofemoral arthritis: long-term followup.
Clin Orthop Relat Res 2006;444:193-200.
112. Emmerson BC,Gortz S,Jamali AA, Chung C, Amiel D, Bugbee WD. Fresh Osteochondral Allografting
in the Treatment of Osteochondritis Dissecans of the Femoral Condyle. Am J Sports Med 2007.
113. Allen RT, Robertson CM, Pennock AT et aI. Analysis of stored osteochondral allografts at the time of
surgical implantation. Am J Sports Med 2005;33(10):1479-84.
114. Noyes FR, Stabler CL. A system for grading articular cartilage lesions at arthroscopy. Am J Sports
Med. 1989;17:505–513.
115. Outerbridge RE. The etiology of chondromalacia patellae. J Bone Joint Surg Br 1961;43:752–757.
116. Robertson CM, Allen RT, Pennock AT, Bugbee WD, Amiel D. Upregulation of apoptotic and matrix-related gene expression during fresh osteochondral allograft storage. Clin Orthop Relat Res
2006;442:260-6.
117. Enneking WF, Mindell ER. Observations on massive retrieved human allografts. J Bone Joint Surg
Am 1991;73(8):1123-42.
118. Aroen LS, Heir S, Alvik E, Ekeland A, Granlund OG, Engebretsen L. Articular cartilage lesions in 993
consecutive knee arthroscopies. Am J Sports Med 2004;32:211–215.
119. Knutsen G, Engebretsen L, Ludvigsen TC et al. Autologous chondrocyte implantation compared with
microfracture in the knee. A randomized trial. J Bone Joint Surg Am 2004; 86-A,455–464.
120. Knutsen G, Drogset J, Engebretsen L et al. A randomised trial comparing autologous chondrocyte
implantation with microfracture - findings at five years. J Bone Joint Surg Am 2007;89:2105–2112.
121. Saris DB, Vanlauwe J, Victor J et al. Characterised chondrocytes implantation results in better structural repair when treating symptomatic cartilage defects of the knee in a randomized controlled trial
versus microfracture. Am J Sports Med 2008;36:233–234.
122. Magnussen RA, Dunn WR, Carey JL, Spindler KP. Treatment of Focal Articular Cartilage Defects in
the Knee.A Systematic Review. Clin Orthop Relat Res 2008;466:952–962.
123. Iwasa J, Engebretsen L, Shima Y, Ochi M. Clinical application of scaffolds for cartilage tissue engineering. Knee Surg Sports Traumatol Arthrosc 2009;17:561–577.
124. Pelttari K, Steck E, Richter W. The use of mesenchymal stem cells for chondrogenesis. Injury. 2008
Apr;39 Suppl 1:S58-65.
125. Blunk T, Sieminski AL, Gooch KJ et al. Differential effects of growth factors on tissue-engineered
cartilage. Tissue Eng 2002;8:73-84.
Esta é uma publicação patrocinada pela Farmoquímica S/A, produzida pela Office Editora e Publicidade Ltda. Diretor Responsável: Nelson dos
Santos Jr. - Diretor de Arte: Roberto E. A. Issa - Diretora Executiva: Waléria Barnabá - Publicidade: Adriana Pimentel Cruz e Rodolfo B. Faustino - Jornalista Responsável: Cynthia de Oliveira Araujo (MTb 23.684) - Redação: Luciana Rodriguez, Flávia Lo Bello e Vivian Ortiz - Gerente de
Produção Gráfica: Roberto Barnabá. Toda correspondência deverá ser enviada - Rua General Eloy Alfaro, 239 - Chácara Inglesa - CEP 04139-060
- São Paulo - SP - Brasil - Tels.: (11) 5594-5455/5594-1770 - e-mail: [email protected]. Todos os artigos publicados têm seus direitos
resguardados pela editora. É proibida a reprodução total ou parcial dos artigos sem autorização dos autores e da editora. Os pontos de vista aqui
expressos refletem a experiência e as opiniões dos autores. Antes de prescrever qualquer medicamento eventualmente citado nesta publicação,
deve ser consultada a bula emitida pelo fabricante. Os conceitos aqui emitidos são de responsabilidade do autor e não refletem necessariamente
a opinião deste laboratório. (00910R)
ATUALIZAÇÃO EM ORTOPEDIA E TRAUMATOLOGIA DO ESPORTE
35
!"#$%&'()#*+!"#$%&'()('*+&",-"%(.('*"-"$%&/(,/*+&",-"$($%&0-'1*2/('*34")",%$(-$,%$./01&.$(*($2,*3*'1$45"6(
5&62/(6(,&."/-7-.+(,&."8"960*%*:-6"$&'+-',&";<"$&62/(6(,&."/-7-.+(,&.4""7'8&.$49*36(=&%*6('">%-)!"
,-.+('*8.-"*&"+/*+*6-'+&",*",&/",-"&/(:-6"6?.$@%&8-.A@-%B+($*C"2/('$(2*%6-'+-"A@*',&"*$&62*'D*,*",-"
$&'+/*+@/*"6@.$@%*/4":"'1,$;&'8&.$49*36(E'+-$-,-'+-.",-"*.6*"&@"0/&'$&-.2*.6&C"2F%(2&."'*.*(.C"/-*GH-."
*%B/:($*."&@"@/+($I/(*"&$*.(&'*,&."2-%*"*,6('(.+/*GJ&",-"I$(,&"*$-+(%.*%($K%($&"#*.2(/('*3"&@"&@+/&."*'+(('L*6*8
+F/(&."'J&"-.+-/F(,-.4"=-7(,&"M"2/-.-'G*",-"$($%&0-'1*2/('*C"*"*,6('(.+/*GJ&",&"2/&,@+&"B"$&'+/*8(',($*,*"
,@/*'+-"&"+/*+*6-'+&"$&6"6-,($*6-'+&."('(0(,&/-.",*"6&'&*6('&"&)(,*.-"#NOEP3"*+B"Q".-6*'*."*2F.".@*"
[email protected]'.J&"-"'&."A@*,/&.",-"('R*/+&"*:@,&",&"6(&$I/,(&"/-$-'+-C"('.@S$(T'$(*"$*/,K*$*C"*//(+6(*.C"0%&A@-(&"
,-"/*6&"&@"+/*'.+&/'&.",*"$&',@GJ&C"0-6"$&6&"'&"D(2-/+(/-&(,(.6&4"U*60B6"-.+I"$&'+/*8(',($*,&",@/*'+-"
*":/*7(,-1"-"*"%*$+*GJ&C"-6"2*$(-'+-."*0*()&",-";<"*'&.C"&@"*(',*"-6"$*.&",-"D(2-/.-'.(0(%(,*,-"*"A@*%A@-/"
@6",&."$&62&'-'+-.",*"RF/6@%*4"<8=*,1/'.&$36(,-7(,&"M"2/-.-'G*",-"$($%&0-'1*2/('*C"2&,-"&$&//-/"*@6-'+&"
,&."-R-(+&.",&"I%$&&%C"0*/0(+?/($&."&@"&@+/&.",-2/-..&/-.",&"VW54"P"6-,($*6-'+&",-7-".-/"*,6('(.+/*,&"
$&6"$*@+-%*"*"2*$(-'+-."$&6"*'+-$-,-'+-.",-":*.+/(+-"&@"?%$-/*",&"-.+X6*:&"&@",@&,-'&C"-"MA@-%-."-6"
+/*+*6-'+&"$&6"*'+($&*:@%*'+-.4"96"2*$(-'+-."$&6"2-/[email protected]&"/-'*%",(6('@K,*C"*"*,6('(.+/*GJ&",-.+-."RI/8
6*$&."2&,-"2/-$(2(+*/"@6*",-.$&62-'.*GJ&",*"R@'GJ&"/-'*%C":-/*%6-'+-"/-7-/.K7-%"$&6"*"('+-//@2GJ&",&"
+/*+*6-'+&4"Y6"-R-(+&"A@-"2&,-".-/"&0.-/7*,&"&$*.(&'*%6-'+-",@/*'+-"&"+/*+*6-'+&"$&6"&."*'+(('L*6*+F/(&."
'J&"-.+-/F(,-."-"A@-"+*60B6"B"6-'$(&'*,&",@/*'+-"&"+/*+*6-'+&"$&6"$%&'()('*+&",-"%(.('*C"B"*"-%-7*GJ&",&."
'K7-(."2%*.6I+($&.",*."+/*'.*6('*.-."&@",-"&@+/&."2*/Z6-+/&.",*"R@'GJ&"D-2I+($*4"W*"6*(&/(*",&."$*.&.C"
&"*@6-'+&"-6"/-%*GJ&"*&."'K7-(."'&/6*(."B"2-A@-'&"-"+/*'.(+F/(&4"=-7(,&"M"2/-.-'G*",-"$($%&0-'1*2/('*C"
A@(6($*6-'+-"/-%*$(&'*,*"$&6"&."*'+(,-2/-..(7&."+/($K$%($&."-"&."2*/*..(62*+($&%K+($&.C",-7-8.-"+-/"$*@+-%*"
'&."$*.&.",-"/-+-'GJ&"@/('I/(*"-":%*@$&6*",-"Z':@%&"-.+/-(+&4"E"$($%&0-'1*2/('*"2&,-",(6('@(/"*"$*2*$(,*,-"
6-'+*%"&@"RK.($*"'-$-..I/(*"2*/*"/-*%(1*/"+*/-R*."*//(.$*,*."#&2-/*/"6IA@('*.C",(/(:(/"7-K$@%&.C"-+$434"=&%*6('"
>%-)!"2&,-"*@6-'+*/"&."'K7-(."2%*.6I+($&.",-"%K+(&4"E"$&'$-'+/*GJ&"2%*.6I+($*",-"%K+(&",-7-".-/"$&'+/&%*,*"*&"
.-"('($(*/C"6&,(S$*/"&@"[email protected]',-/".@*"*,6('(.+/*GJ&4"V-"&$&//-/-6"/-*GH-."*%B/:($*."'*"2-%-"-[&@"6@$&.*."
&@".('+&6*.",-"?%$-/*"2B2+($*"&@",-"D-6&//*:(*":*.+/&('+-.+('*%C"&"+/*+*6-'+&"$&6"=&%*6('">%-)!",-7-/I"
.-/"[email protected]'.&4"7'1*,$49*3(%*8&.$%*'1"3$36(P"@.&"$&'$&6(+*'+-"$&6"*'+($&*:@%*'+-."&/*(.C"+($%&2(,('*C"
D-2*/('*"#*,6('(.+/*GJ&".(.+T6($*3"-"+/&60&%K+($&."*@6-'+*"&"/(.$&",-"D-6&//*:(*4"P."*'+(('L*6*+F/(&."'J&"
-.+-/F(,-."-6":-/*%"*@6-'+*6"&."'K7-(."2%*.6I+($&.",-"%K+(&4"P"+/*+*6-'+&".(6@%+Z'-&"$&6"6-+&+/-)*+-"-"
*'+(('L*6*+F/(&."'J&"-.+-/F(,-."2&,-"*@6-'+*/"*"+&)($(,*,-"D-6*+&%F:($*",-"6-+&+/-)*+-4"P"@.&"$&'$&6(+*'+-"
$&6"&@+/&."*'+(('L*6*+F/(&."'J&"-.+-/F(,-.C"('$%@(',&"&"I$(,&"*$-+(%.*%($K%($&"-6",&.-."*%+*.C"2&,-"*@6-'+*/"
&"/(.$&",-"?%$-/*",&"-.+X6*:&C",&",@&,-'&"-"D-6&//*:(*.4(96"2*$(-'+-.",-.(,/*+*,&.C"&"+/*+*6-'+&"$&6"
*'+(('L*6*+F/(&."'J&"-.+-/F(,-."*@6-'+*"&"/(.$&"2&+-'$(*%",-"('.@S$(T'$(*"/-'*%"*:@,*4"96"$*.&",-"+/*+*8
6-'+&"$&'$&6(+*'+-"$&6"$%&'()('*+&",-"%(.('*"-",(@/B+($&.C",-7-8.-"D(,/*+*/"*,-A@*,*6-'+-"&."2*$(-'+-."-"
$&'+/&%*/"*"R@'GJ&"/-'*%"*'+-.",-"$&6-G*/"&"+/*+*6-'+&4(P"+/*+*6-'+&".(6@%+Z'-&"$&6"*'+(('L*6*+F/(&."'J&"
-.+-/F(,-."-"*'+(8D(2-/+-'.(7&."#-)\"0-+*0%&A@-*,&/-.C"('(0(,&/-.",*"95EC"7*.&,(%*+*,&/-.C",(@/B+($&.3"$*@.*"
,(6('@(GJ&",*"-S$I$(*"*'+(8D(2-/+-'.(7*"2&/"('(0(GJ&",*."2/&.+*:%*',('*."7*.&,(%*+*,&/*.4(=-7(,&"M"2/-.-'G*"
,-"$($%&0-'1*2/('*C"*"('+-/*GJ&"$&6"6-,($*6-'+&."('(0(,&/-.",*"-'1(6*"6&'&*6('&&)(,*.-"#NOEP.3"2&,-"
&$*.(&'*/"$/(.-",-"D(2-/+-/6(*C"$&'7@%.H-."-"-7&%@GJ&"R*+*%4"P"-R-(+&"*'+(8D(2-/+-'.(7&",*":@*'-+(,('*"-",-"
.-@."$&':T'-/-."2&,-".-/"0%&A@-*,&"A@*',&"*,6('(.+/*,&."$&'$&6(+*'+-6-'+-"$&6"=&%*6('">%-)!4">*$49*3(
$8=*,3$36(96",&.-."+-/*2T@+($*.C"=&%*6('">%-)!"B"@6"6-,($*6-'+&"0-6"+&%-/*,&4"9)$-2$(&'*%6-'+-C"-6"
2*/+($@%*/"A@*',&"B"*,6('(.+/*,&"*"(',(7K,@&."2/-,(.2&.+&.C"2&,-"&$&//-/":*.+/(+-4"=-7(,&"M"*..&$(*GJ&"$&6"
$($%&0-'1*2/('*C"2&,-6"&$&//-/".&'&%T'$(*C"0&$*".-$*"-"'[email protected]*.4"P.".('+&6*."6*(."$&6@'.".J&\"*.+-'(*C"
'[email protected]*.C"$&'.+(2*GJ&"('+-.+('*%C",(.2-2.(*C"*%+-/*GJ&",&"2*%*,*/C"7(.J&"+@/7*C"$-R*%B(*C"'-/7&.(.6&4"?"3"#";
@&$6(U&6*/"@6"$&62/(6(,&"+/T."7-1-."*&",(*"-6"('+-/7*%&."/-:@%*/-.C".-',&"*.",&.-."*]@.+*,*.",-"*$&/,&"
$&6"*"('+-'.(,*,-",*",&/4E",&.-"6I)(6*",(I/(*"B",-".-(."$&62/(6(,&.4WJ&"B"/-$&6-',*,*"*"*,6('(.+/*GJ&"
$&'+('@*,*"2&/"6*(.",-",@*."&@"+/T.".-6*'*.4"AB6";4^_`^4^;ab4"CDE!<(BFG(?>DB:>7HIF(AJ!7:<K(
VE5"^c^^8Q<^;;^4"d*/*"7-/"&"+-)+&",-"0@%*"'*"K'+-:/*C"*$-..-"&".(+-"eee4RA64$&640/"4
O*+-/(*%",-.+('*,&"-)$%@.(7*6-'+-"M"$%*..-"6B,($*
fevereiro 2010
503154 - fevereiro 2010