Ensino Médio – Unidade Parque Atheneu
Professor:
Aluno (a):
Leandro George
Série: 3ª
Data: ____/ ____/ 2014.
LISTA DE QUÍMICA II
1) (UFC CE) Metano (CH4) é o gás produzido a partir da biomassa, e a sua queima na indústria, para
obtenção de energia térmica, corresponde à seguinte reação: CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l)
Se a velocidade de consumo do metano é 0,01 mol min–1, assinale a alternativa que corretamente expressa o
número de moles de CO2 produzido durante uma hora de reação.
2) (UEPG PR) Considere a equação a seguir que representa a síntese da amônia.
N2(g) + 3 H2(g) → 2 NH3(g)
Verificou-se em um experimento, que em 5 minutos foram consumidos 0,20 mol de N2. Com base
nessas informações, calcule a velocidade de consumo de H2.
3) (UDESC SC) Um bico de Bunsen está consumindo 2,24 litros/minuto de butano, C4H10 (medido nas
CNTP). A combustão é completa, de modo a produzir dióxido de carbono e água. Pode-se afirmar que a
velocidade de formação do dióxido de carbono é de?
4) (CEFET PR) O cloreto de prata sofre a seguinte reação de decomposição:
AgCl(s) → Ag(s) + Cl2(g).
Considerando a variação de concentração do cloreto de prata em função do tempo mostrada na tabela a
seguir, calcule a velocidade média da decomposição do cloreto de prata no intervalo entre 2,0 e 8,0 minutos.
Tempo (min) [H 2 O 2 ] mol / L
0
1,40
2,0
4,0
1,00
0,70
6,0
0,50
8,0
0,40
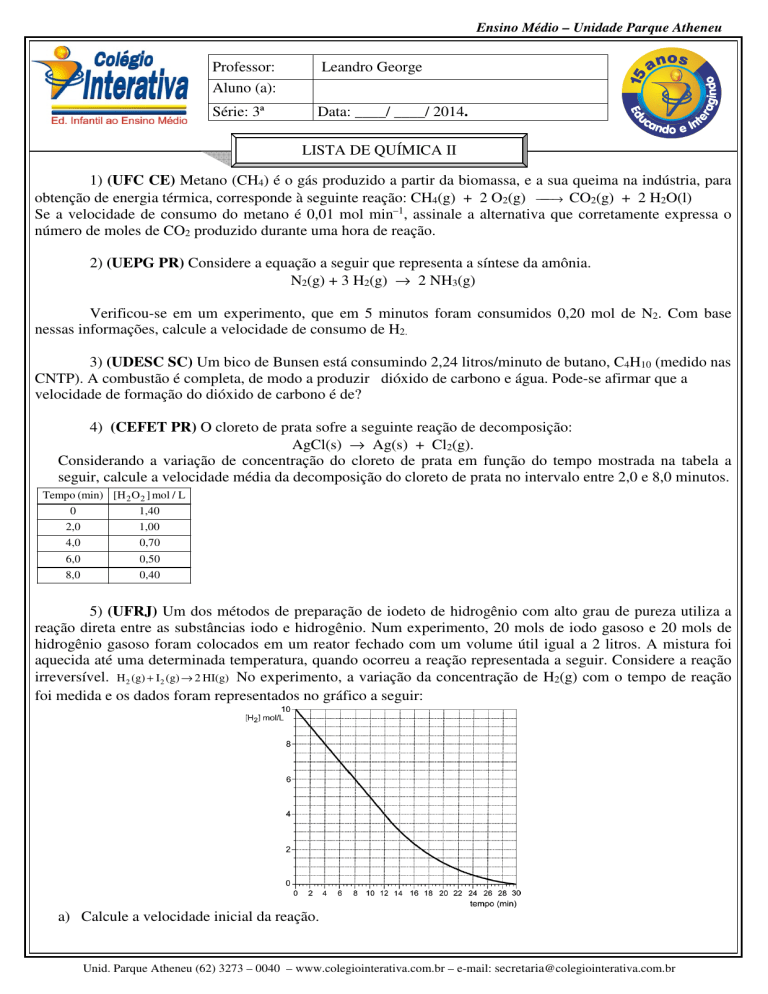
5) (UFRJ) Um dos métodos de preparação de iodeto de hidrogênio com alto grau de pureza utiliza a
reação direta entre as substâncias iodo e hidrogênio. Num experimento, 20 mols de iodo gasoso e 20 mols de
hidrogênio gasoso foram colocados em um reator fechado com um volume útil igual a 2 litros. A mistura foi
aquecida até uma determinada temperatura, quando ocorreu a reação representada a seguir. Considere a reação
irreversível. H 2 (g) + I 2 (g) → 2 HI(g) No experimento, a variação da concentração de H2(g) com o tempo de reação
foi medida e os dados foram representados no gráfico a seguir:
a) Calcule a velocidade inicial da reação.
Unid. Parque Atheneu (62) 3273 – 0040 – www.colegiointerativa.com.br – e-mail: [email protected]
b) Calcule a concentração de iodeto de hidrogênio após 10 minutos de reação.
6) (Unimontes MG) A combustão do gás butano é representada pela seguinte equação não balanceada:
C 4 H10 + O 2 → CO 2 + H 2 O
Considerando-se que foram consumidos 4 mols de butano a cada 20 minutos de reação, o número de
mols de gás carbônico produzido em uma hora de queima é?
7) (UFMS) A reação de combustão do gás butano (C4H10) é dada pela equação:
C 4 H10 + (13/2)O2 → 4CO 2 + 5H 2 O + Energia
Se, a cada intervalo de tempo de 30 segundos, são consumidos
velocidade de formação do dióxido de carbono, em g/min?
(Massa molar, em g/mol: C = 12; O = 16; H = 1)
5 × 10 −1
mols de butano, qual será a
8) (MACK SP) C 2 H 6 O + 3 O 2 → 2 CO 2 + 2 H 2 O A equação acima representa a combustão do etanol.
Se após 2 horas de reação forem produzidos 48 mol de CO2, a quantidade em mol de etanol consumido
em 1 minuto é de?
9) (FURG RS) Abaixo é mostrada a equação de decomposição da água oxigenada:
H 2 O 2( l) → H 2 O (l) + 1 / 2 O 2 (g )
A decomposição foi realizada em determinadas condições e mediu-se a massa de H2O2 remanescente a
intervalos de tempos regulares.
Com os dados obtidos, montou-se a tabela abaixo:
Tempo(min) 0
3
6
9 12
M H 2 O 2 (g) 300 204 136 85 39
A velocidade média de decomposição do H2O2 em mol/s, no intervalo de tempo entre 0 e 3 minutos, é
de, aproximadamente?
10) (UFPE) A reação de decomposição da amônia gasosa foi realizada em um recipiente fechado:
2NH3 → N2 + 3H2
A tabela abaixo indica a variação na concentração de reagente em função do tempo.
Qual é a velocidade média de consumo do reagente nas duas primeiras horas de reação?
Bom Final de semana!!!
Fiquem atentos ao prazo de devolução das listas!!!
Unid. Parque Atheneu (62) 3273 – 0040 – www.colegiointerativa.com.br – e-mail: [email protected]