Ciências da natureza, matemática e suas tecnologias
UTILIZE AS INFORMAÇÕES A SEGUIR PARA RESPONDER ÀS QUESTÕES de númeroS 22 a 25.
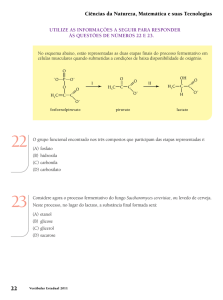
Algumas doenças infecciosas, como a dengue, são causadas por um arbovírus da família Flaviridae.
São conhecidos quatro tipos de vírus da dengue, denominados DEN 1, DEN 2, DEN 3 e DEN 4; os três primeiros
já produziram epidemias no Brasil.
A doença, transmitida ao homem pela picada da fêmea infectada do mosquito Aedes aegypti, não tem tratamento
específico, mas os medicamentos freqüentemente usados contra febre e dor devem ser prescritos com cautela. Na
tabela abaixo são apresentadas informações sobre dois medicamentos:
22
Questão
Na estrutura do paracetamol está presente a seguinte função da química orgânica:
(A) éter
(B) amida
(C) cetona
(D) aldeído
23
Questão
O número de átomos existente em uma amostra de 1g de ácido acetilsalicílico é igual a:
(A) 3,3 × 10 21
(B) 7,0 × 10 22
(C) 6,0 × 10 23
(D) 1,3 × 10 25 18
Ciências da natureza, matemática e suas tecnologias
24
Questão
Outra doença encontrada no Brasil causada por um arbovírus da mesma família do vírus da dengue, e
que também pode ter como vetor o Aedes aegypti, é a febre denominada:
(A) terçã
(B) palustre
(C) amarela
(D) maculosa
Questão
25
Um pesquisador possui em seu laboratório um recipiente contendo 100 exemplares de Aedes aegypti, cada
um deles contaminado com apenas um dos tipos de vírus, de acordo com a seguinte tabela:
tipo
quantidade de
mosquitos
DEN 1
30
DEN 2
60
DEN 3
10
Retirando-se simultaneamente e ao acaso dois mosquitos desse recipiente, a probabilidade de que pelo
menos um esteja contaminado com o tipo DEN 3 equivale a:
(A)
(B)
(C)
8
81
10
99
11
100
(D) 21
110
26
Questão
Um adulto, ao respirar durante um minuto, inspira, em média, 8,0 litros de ar a 20 ºC, expelindo-os a 37 ºC.
Admita que o calor específico e a densidade do ar sejam, respectivamente, iguais a 0,24 cal . g -1. ºC-1 e 1,2 g . L-1.
Nessas condições, a energia mínima, em quilocalorias, gasta pelo organismo apenas no aquecimento
do ar, durante 24 horas, é aproximadamente igual a:
(A) 15,4
(B) 35,6
(C) 56,4
(D) 75,5
Vestibular Estadual 2009
1ª Fase: Exame de Qualificação
19
Ciências da natureza, matemática e suas tecnologias
27
Questão
Um piso plano é revestido de hexágonos regulares congruentes cujo lado mede 10 cm.
Na ilustração de parte desse piso, T, M e F são vértices comuns a três hexágonos e representam os
pontos nos quais se encontram, respectivamente, um torrão de açúcar, uma mosca e uma formiga.
Ao perceber o açúcar, os dois insetos partem no mesmo instante, com velocidades constantes, para
alcançá-lo. Admita que a mosca leve 10 segundos para atingir o ponto T. Despreze o espaçamento entre
os hexágonos e as dimensões dos animais.
A menor velocidade, em centímetros por segundo, necessária para que a formiga chegue ao ponto T no
mesmo instante em que a mosca, é igual a:
(A) 3,5
(B) 5,0
(C) 5,5
(D) 7,0
28
Questão
A água sanitária é um agente desinfetante que contém a substância hipoclorito de sódio. A equação química
a seguir representa o equilíbrio do íon hipoclorito com o ácido hipocloroso, um agente desinfetante ainda
mais eficiente.
_
ClO (aq) + H2O(l)
_
HClO(aq) + OH
(aq)
Em um processo de limpeza, quantidades iguais de água sanitária foram adicionadas a volumes iguais
de líquidos com diferentes valores de pH a 25 ºC, de acordo com a tabela.
líquido
pH
1
5
2
7
3
9
4
11
O líquido no qual a água sanitária apresenta maior ação desinfetante é o de número:
(A) 1
(B) 2
(C) 3
(D) 4
20
Ciências da natureza, matemática e suas tecnologias
UTILIZE AS INFORMAÇÕES A SEGUIR PARA RESPONDER ÀS QUESTÕES de númeroS 29 E 30.
Vários grupos de pesquisadores vêm desenvolvendo técnicas de manipulação que retirem do vírus apenas a
parte de seu material genético associado à patogenicidade, e insiram o material correspondente ao de genes
humanos normais.
No tratamento de algumas doenças genéticas, esse vírus modificado, ao ser introduzido no organismo, poderá
transferir a informação nele adicionada para o DNA das células do paciente, substituindo o gene lesado.
29
Questão
O vírus usado nas pesquisas citadas no texto é do tipo:
(A) rotavírus
(B) retrovírus
(C) arbovírus
(D) coronavírus
30
Questão
Um vírus, formado por uma hélice simples de RNA contendo 51×103 bases nitrogenadas, sofreu o
seguinte processo de manipulação em um experimento:
–dois fragmentos de RNA, identificados como X e Y, contendo cada um 103 e 104 bases,
respectivamente, foram retirados de seu genoma;
–apenas um fragmento de RNA, contendo n bases, foi introduzido nele.
Admita que o número total de bases, após a modificação, equivalia ao quinto termo de uma progressão
geométrica, na qual o número de bases dos fragmentos X e Y correspondia, respectivamente, ao primeiro
e ao terceiro termos dessa progressão.
No experimento, a quantidade n de bases nitrogenadas contidas no fragmento introduzido no vírus
foi igual a:
(A) 3 × 10 2
(B) 5 × 10 3
(C) 6 × 10 4
(D) 4 × 10 5
31
Questão
Segundo o modelo simplificado de Bohr, o elétron do átomo de hidrogênio executa um movimento
circular uniforme, de raio igual a 5,0 × 10-11 m, em torno do próton, com período igual a 2 × 10-15 s.
Com o mesmo valor da velocidade orbital no átomo, a distância, em quilômetros, que esse elétron
percorreria no espaço livre, em linha reta, durante 10 minutos, seria da ordem de:
(A) 102
(B) 103
(C) 104
(D) 105
Vestibular Estadual 2009
1ª Fase: Exame de Qualificação
21
Ciências da natureza, matemática e suas tecnologias
32
Questão
A maioria dos seres autotróficos capta a energia da radiação luminosa que recebem. No entanto,
seus pigmentos fotossintetizantes são capazes de absorver essa radiação, com eficiência, apenas para
determinadas freqüências.
O gráfico abaixo mostra o espectro de absorção de luz desses pigmentos, encontrados em um
determinado fitoplâncton:
Uma mesma quantidade desse fitoplâncton foi adicionada a cada um de quatro recipientes, contendo
meio de crescimento adequado.
Durante determinado tempo, os recipientes foram mantidos sob temperatura constante e iluminados
com a mesma quantidade de energia. Foram usados, porém, comprimentos de onda diferentes, como
mostra a tabela:
Ao final do experimento, o número de células em cada um foi contado.
A maior e a menor quantidade de células foram encontradas, respectivamente, nos recipientes de
números:
(A) 1 e 4
(B) 2 e 3
(C) 2 e 4
(D) 3 e 1
22
Ciências da natureza, matemática e suas tecnologias
33
Questão
Observe o dado ilustrado abaixo, formado a partir de um cubo, e com suas seis faces numeradas de 1 a 6.
Esses números são representados por buracos deixados por semi-esferas idênticas retiradas de cada
uma das faces. Todo o material retirado equivale a 4,2% do volume total do cubo.
Considerando p = 3, a razão entre a medida da aresta do cubo e a do raio de uma das semi-esferas,
expressas na mesma unidade, é igual a:
(A) 6
(B) 8
(C) 9
(D) 10
UTILIZE AS INFORMAÇÕES A SEGUIR PARA RESPONDER ÀS QUESTÕES de númeroS 34 E 35.
Para estudar o metabolismo de organismos vivos, isótopos radioativos de alguns elementos, como o 14C, foram
utilizados como marcadores de moléculas orgânicas.
34
Questão
Podemos demonstrar, experimentalmente, utilizando a glicose marcada com 14C, o acúmulo de
produtos diferentes da glicólise na célula muscular, na presença ou na ausência de um inibidor da
cadeia respiratória mitocondrial.
Em presença desse inibidor, o metabólito radioativo que deve acumular-se no músculo é o ácido
denominado:
(A) lático
(B) cítrico
(C) pirúvico
(D) glicérico
35
Questão
O cátion que apresenta o mesmo número de elétrons do 14C é:
(A) N+
(B) C++
(C) P+++
(D) Si++++
Vestibular Estadual 2009
1ª Fase: Exame de Qualificação
23
Ciências da natureza, matemática e suas tecnologias
UTILIZE AS INFORMAÇÕES A SEGUIR PARA RESPONDER ÀS QUESTÕES de númeroS 36 E 37.
Uma pessoa de massa igual a 80 kg encontra-se em repouso, em pé sobre o solo, pressionando perpendicularmente
uma parede com uma força de magnitude igual a 120 N, como mostra a ilustração a seguir.
36
Questão
A melhor representação gráfica para as distintas forças externas que atuam sobre a pessoa está indicada em:
(A)
(B)
(C)
(D)
37
Questão
Considerando a aceleração da gravidade igual a 10 m . s -2, o coeficiente de atrito entre a superfície do
solo e a sola do calçado da pessoa é da ordem de:
(A) 0,15
(B) 0,36
(C) 0,67
(D) 1,28
24
Ciências da natureza, matemática e suas tecnologias
Utilize as informações a seguir para RESPONDER Às questões DE NÚMEROS 38 E 39.
Alguns animais, como o peixe elétrico, conseguem gerar corrente elétrica pela simples migração de íons de
metais alcalinos através de uma membrana. O órgão elétrico desse peixe é formado por células chamadas de
eletroplacas, que são similares às musculares, mas não se contraem. Essas células são discos achatados, nos quais
uma das superfícies é inervada por terminações nervosas colinérgicas. Quando estimuladas, apenas a superfície
inervada é despolarizada. Milhares de eletroplacas empilham-se em série formando conjuntos que, por sua vez,
se dispõem em paralelo.
O esquema abaixo, representando esses conjuntos, detalha também a estrutura básica da eletroplaca e mostra os
potenciais de repouso da membrana e a sua inversão na face inervada, quando o nervo é estimulado.
38
Questão
Admita as seguintes condições:
– cada conjunto de eletroplacas em série é formado por 5000 células e existem 5 desses conjuntos
em paralelo;
– esses 5 conjuntos em paralelo podem gerar uma intensidade total de corrente elétrica igual a 0,5 A.
Nesse caso, a potência máxima, em watts, que cada conjunto pode fornecer é igual a:
(A) 50
(B) 75
(C) 150
(D) 750
39
Questão
Como também ocorre na célula muscular, a inversão do potencial da superfície inervada da eletroplaca
é conseqüência da rápida difusão para o interior dessa célula do seguinte íon:
(A) K+
(B) Na+
(C) Ca++
(D) Mg++
Vestibular Estadual 2009
1ª Fase: Exame de Qualificação
25
Ciências da natureza, matemática e suas tecnologias
40
Questão
Os répteis se adaptam com facilidade à vida em regiões desérticas. Por excretarem o nitrogênio pela
urina incorporado em uma substância pouco solúvel em água, seu volume de urina diário é pequeno
e, conseqüentemente, sua ingestão de água é menor. Esse não é o caso do homem, que excreta o
nitrogênio através de um produto muito solúvel em água.
Os gráficos abaixo representam a excreção urinária de produtos nitrogenados. Em cada um deles,
no eixo da abscissa, estão indicados os produtos eliminados e, no eixo da ordenada, as respectivas
quantidades excretadas em 24 horas.
alantoína
amônia
uréia
0
ácido úrico
alantoína
4
amônia
uréia
0
ácido úrico
alantoína
3
amônia
uréia
0
ácido úrico
alantoína
2
amônia
uréia
0
ácido úrico
1
Os gráficos que correspondem, respectivamente, aos seres humanos e aos répteis são os de números:
(A) 1 e 3
(B) 1 e 4
(C) 3 e 2
(D) 4 e 2
41
Questão
26
Uma fração do volume emerso de um iceberg é subitamente removida.
Após um novo estado de equilíbrio, os valores finais da densidade e do volume submerso do iceberg,
d2 e V2 , apresentam, respectivamente, as seguintes relações com os valores iniciais d1 e V1 :
(A) d2 > d1
e
V2 < V1
(B) d2 = d1
e
V2 = V1
(C) d2 = d1
e
V2 < V1
(D) d2 < d1
e
V2 > V1
Ciências da natureza, matemática e suas tecnologias
42
Questão
Os gráficos 1 e 2 representam a posição S de dois corpos em função do tempo t.
gráfico 2
gráfico 1
No gráfico 1, a função horária é definida pela equação S = 2 + 1 t .
2
Assim, a equação que define o movimento representado pelo gráfico 2 corresponde a:
(A) S = 2 + t
(B)
S=2+2t
(C) S = 2 +
4
t
3
(D) S = 2 + 6 t
5
43
Questão
Alguns compostos químicos são empregados como coagulantes na remoção de impurezas em processos
de tratamento de água.
Um sal inorgânico, largamente utilizado em tais processos, pode ser obtido por meio da neutralização
total entre as seguintes substâncias:
– hidróxido do metal de maior eletronegatividade do terceiro período da tabela periódica;
– oxiácido contendo o elemento enxofre em seu estado de oxidação mais alto.
A fórmula desse sal está indicada em:
(A) Al2(SO4)3
(B) Al2(SO3)3
(C) Ga2(SO4)3
(D) Ga2(SO3)3
Vestibular Estadual 2009
1ª Fase: Exame de Qualificação
27
Ciências da natureza, matemática e suas tecnologias
22
Questão
Um circuito empregado em laboratórios para estudar a condutividade elétrica de soluções aquosas é
representado por este esquema:
Ao se acrescentar um determinado soluto ao líquido contido no copo, a lâmpada acende, consumindo a
potência elétrica de 60 W.
Nessas circunstâncias, a resistência da solução, em ohms, corresponde a cerca de:
(A) 14
(B) 28
(C) 42
(D) 56
23
Questão
Um estudante possui dez figurinhas, cada uma com o escudo de um único time de futebol, distribuídas de
acordo com a tabela:
Para presentear um colega, o estudante deseja formar um conjunto com cinco dessas figurinhas, atendendo,
simultaneamente, aos seguintes critérios:
– duas figurinhas deverão ter o mesmo escudo;
– três figurinhas deverão ter escudos diferentes entre si e também das outras duas.
De acordo com esses critérios, o número máximo de conjuntos distintos entre si que podem ser formados
é igual a:
(A) 32
(B) 40
(C) 56
(D) 72
18
Ciências da natureza, matemática e suas tecnologias
24
Questão
A água oxigenada consiste em uma solução aquosa de peróxido de hidrogênio, que se decompõe, sob a
ação da luz e do calor, segundo a equação química:
2 H2O2 (aq)
2 H2O(l) + O2 (g)
Em um experimento, foi monitorada a quantidade de peróxido de hidrogênio em três frascos idênticos
– A, B e C – de 1 L de água oxigenada, mantidos em diferentes condições de luminosidade e temperatura.
Observe os resultados no gráfico:
Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade
média de formação de O2 , em mol.ano-1, foi igual a:
(A) 1
(B) 2
(C) 6
(D) 12
25
Questão
Na natureza, são freqüentes os exemplos de relações benéficas entre indivíduos, mesmo de espécies
diferentes, como é o caso do caranguejo paguro e da anêmona.
O caranguejo aumenta sua proteção vivendo em conchas abandonadas e permitindo que anêmonas –
produtoras de substância urticante contra predadores – se depositem nelas. As anêmonas, por sua vez,
ganhando mobilidade, capturam melhor os alimentos.
O tipo de interação descrita é denominada:
(A) colônia
(B) sociedade
(C) amensalismo
(D) protocooperação
Vestibular Estadual 2009
2º Exame de Qualificação
19
Ciências da natureza, matemática e suas tecnologias
26
Questão
O metabolismo energético do organismo varia em função dos níveis de hormônios na circulação sangüínea.
Por sua vez, a produção hormonal está relacionada com fatores como existência de doenças, escolhas
alimentares e estado de atividade ou de inatividade física.
O esquema abaixo mostra transformações metabólicas predominantes em determinada condição do
organismo, envolvendo algumas substâncias em diferentes tecidos.
A condição representada pelo esquema é:
(A) repouso
(B) diabetes melito
(C) hiperinsulinismo
(D) dieta hiperglicídica
27
Questão
Duas bóias de isopor, B1 e B2 , esféricas e homogêneas, flutuam em uma piscina. Seus volumes submersos
correspondem, respectivamente, a V1 e V2 , e seus raios obedecem à relação R1 = 2R2 .
A razão V1 entre os volumes submersos é dada por:
V2
(A) 2
(B) 3
(C) 4
(D) 8
20
Ciências da natureza, matemática e suas tecnologias
28
Questão
Um atleta faz seu treinamento de corrida em uma pista circular que tem 400 metros de diâmetro. Nessa
pista, há seis cones de marcação indicados pelas letras A, B, C, D, E e F, que dividem a circunferência em
seis arcos, cada um medindo 60 graus.
Observe o esquema:
O atleta partiu do ponto correspondente ao cone A em direção a cada um dos outros cones, sempre
correndo em linha reta e retornando ao cone A. Assim, seu percurso correspondeu a ABACADAEAFA.
Considerando
3 = 1,7 , o total de metros percorridos pelo atleta nesse treino foi igual a:
(A) 1480
(B) 2960
(C) 3080
(D) 3120
29
Questão
Explosivos, em geral, são formados por substâncias que, ao reagirem, liberam grande quantidade de
energia. O nitrato de amônio, um explosivo muito empregado em atividades de mineração, se decompõe
segundo a equação química:
2 NH4NO3 (s)
2 N2 (g) + O2 (g) + 4 H2O(g)
Em um teste, essa decomposição liberou 592,5 kJ de energia e produziu uma mistura de nitrogênio e
oxigênio com volume de 168 L, medido nas CNTP.
Nas mesmas condições, o teste com 1 mol de nitrato de amônio libera, em quilojoules, a seguinte quantidade
de energia:
(A) 39,5
(B) 59,3
(C) 118,5
(D) 158,0
Vestibular Estadual 2009
2º Exame de Qualificação
21
Ciências da natureza, matemática e suas tecnologias
30
Questão
O aldicarb, conhecido popularmente como chumbinho, é uma substância de alta toxicidade, derivada do
ácido carbâmico. Ele age inibindo a acetilcolinesterase, enzima que, hidrolisando o mediador químico
acetilcolina, desempenha um papel importante no processo de transmissão do impulso nervoso em sinapses
como as encontradas nas junções neuromusculares.
Observe a concentração de Ca++ medida em dois compartimentos de células musculares, em repouso, na
ausência de aldicarb:
Nos gráficos a seguir, representados na mesma escala do anterior, observe algumas alterações na concentração
de Ca++ nesses compartimentos:
O gráfico que mostra a ação do aldicarb, logo após sua penetração na junção neuromuscular, é o de número:
(A) I
(B) II
(C) III
(D) IV
31
Questão
22
Ao se deslocar do Rio de Janeiro a Porto Alegre, um avião percorre essa distância com velocidade média v
1
no primeiro
do trajeto e 2v no trecho restante.
9
A velocidade média do avião no percurso total foi igual a:
(A)
9 v
5
(B)
8 v
5
(C)
5 v
3
(D)
5 v
4
Ciências da natureza, matemática e suas tecnologias
32
Questão
Os gráficos I e II representam as posições S de dois corpos em função do tempo t.
No gráfico I, a função horária é definida pela equação S = a1t2 + b1t e, no gráfico II, por S = a2t2 + b2t.
Admita que V1 e V2 são, respectivamente, os vértices das curvas traçadas nos gráficos I e II.
a
Assim, a razão 1 é igual a:
a2
(A) 1
(B) 2
(C) 4
(D) 8
33
Questão
A composição do leite colocado à venda para consumo humano pode ser, eventualmente, adulterada. Um
dos processos de adulteração consiste na adição de hidróxido de sódio para reduzir a acidez causada pelo
ácido láctico formado pela ação de microrganismos.
A equação química abaixo representa o processo de neutralização desse ácido pelo hidróxido de sódio.
Considere uma concentração de 1,8 g.L-1 de ácido láctico em um lote de 500 L de leite.
Para neutralizar completamente todo o ácido contido nesse lote, utiliza-se um volume, em litros, de solução
aquosa de hidróxido de sódio de concentração 0,5 mol.L-1, correspondente a:
(A) 20
(B) 40
(C) 60
(D) 80
Vestibular Estadual 2009
2º Exame de Qualificação
23
Ciências da natureza, matemática e suas tecnologias
34
Questão
Os metais formam um grupo de elementos químicos que apresentam algumas propriedades diferentes,
dentre elas o raio atômico. Essa diferença está associada à configuração eletrônica de cada um.
A ordenação crescente dos metais pertencentes ao terceiro período da tabela periódica, em relação a seus
respectivos raios atômicos, está apontada em:
(A) alumínio, magnésio e sódio
(B) sódio, magnésio e alumínio
(C) magnésio, sódio e alumínio
(D) alumínio, sódio e magnésio
35
Questão
Uma pequena caixa é lançada sobre um plano inclinado e, depois de um intervalo de tempo, desliza com
velocidade constante.
Observe a figura, na qual o segmento orientado indica a direção e o sentido do movimento da caixa.
Entre as representações abaixo, a que melhor indica as forças que atuam sobre a caixa é:
(A)
(B)
(C)
(D)
36
Questão
O petróleo de base parafínica é uma mistura cujos principais componentes são os alcanos.
A ordenação crescente da massa molar dos alcanos de cadeia normal gera uma progressão aritmética de
razão igual a:
(A) 10
(B) 12
(C) 14
(D) 16
24
Ciências da natureza, matemática e suas tecnologias
37
Questão
Um avião sobrevoa, com velocidade constante, uma área devastada, no sentido sul-norte, em relação a um
determinado observador.
A figura a seguir ilustra como esse observador, em repouso, no solo, vê o avião.
Quatro pequenas caixas idênticas de remédios são largadas de um compartimento da base do avião, uma a
uma, a pequenos intervalos regulares. Nessas circunstâncias, os efeitos do ar praticamente não interferem
no movimento das caixas.
O observador tira uma fotografia, logo após o início da queda da quarta caixa e antes de a primeira atingir
o solo.
A ilustração mais adequada dessa fotografia é apresentada em:
(A)
(B)
(C)
(D) Vestibular Estadual 2009
2º Exame de Qualificação
25
Ciências da natureza, matemática e suas tecnologias
LEIA O TEXTO A SEGUIR PARA RESPONDER ÀS QUESTÕES de númeroS 38 E 39.
Isótopos radioativos de diversos elementos têm grande importância na medicina, já que podem ser usados no
diagnóstico ou no tratamento de algumas doenças.
38
Questão
O uso do radioisótopo 131I é adequado para o diagnóstico de tumores no seguinte tecido:
(A) hepático
(B) ovariano
(C) tireoidiano
(D) pancreático
39
Questão
O composto de iodo utilizado em tratamentos radioterápicos é o iodeto de potássio. Em presença de cloro,
essa substância reage segundo a equação química:
2 KI(aq) + Cl2 (g)
2 KCl(aq) + I2 (s)
O fenômeno químico de conversão do iodeto em iodo, nessa reação, é classificado como:
(A) redução
(B) oxidação
(C) neutralização
(D) saponificação
40
Questão
Em um supermercado, um cliente empurra seu carrinho de compras passando pelos setores 1, 2 e 3, com
uma força de módulo constante de 4 newtons, na mesma direção e mesmo sentido dos deslocamentos.
Na matriz A abaixo, cada elemento aij indica, em joules, o trabalho da força que o cliente faz para deslocar
o carrinho do setor i para o setor j, sendo i e j elementos do conjunto {1, 2, 3}.
Ao se deslocar do setor 1 ao 2, do setor 2 ao 3 e, por fim, retornar ao setor 1, a trajetória do cliente
descreve o perímetro de um triângulo.
Nessas condições, o cliente percorreu, em metros, a distância de:
(A) 35
(B) 40
(C) 45
(D) 50
26
Ciências da natureza, matemática e suas tecnologias
41
Questão
Nas ilustrações abaixo, estão representados três sólidos de bases circulares, todos com raios iguais e mesma
altura. Considere as medidas dos raios iguais às medidas das alturas, em centímetros.
As massas específicas de quatro substâncias, três das quais foram empregadas na construção desses sólidos,
estão indicadas na tabela:
substâncias
massa específica (g.cm-3)
w
2
x
3
y
4
z
6
Admita que os sólidos tenham a mesma massa e que cada um tenha sido construído com apenas uma
dessas substâncias.
De acordo com esses dados, o cone circular reto foi construído com a seguinte substância:
(A) w
(B) x
(C) y
(D) z
42
Questão
Muitas jóias são constituídas por ligas feitas de uma mistura de ouro puro com outros metais.
Uma jóia é considerada de ouro n quilates se n de sua massa for de ouro, sendo n um número inteiro,
24
maior ou igual a 1 e menor ou igual a 24.
Uma aliança de ouro 15 quilates tem massa igual a 4 g.
Para transformar essa aliança em outra, de ouro 18 quilates, mantendo a quantidade dos outros metais, é
necessário acrescentar, em sua liga, uma quantidade de gramas de ouro puro equivalente a:
(A) 1,0
(B) 1,5
(C) 2,0
(D) 3,0
Vestibular Estadual 2009
2º Exame de Qualificação
27
Ciências da natureza, matemática e suas tecnologias
43
Questão
Uma pequena planta é colocada no centro P de um círculo, em um ambiente cuja única iluminação é feita
por uma lâmpada L. A lâmpada é mantida sempre acesa e percorre o perímetro desse círculo, no sentido
horário, em velocidade constante, retornando a um mesmo ponto a cada período de 12 horas.
Observe o esquema:
No interior desse círculo, em um ponto O, há um obstáculo que projeta sua sombra sobre a planta nos
momentos em que P, O e L estão alinhados, e o ponto O está entre P e L.
Nessas condições, mediu-se, continuamente, o quociente entre as taxas de emissão de O2 e de CO2 da
planta. Os resultados do experimento estão mostrados no gráfico, no qual a hora zero corresponde ao
momento em que a lâmpada passa por um ponto A.
As medidas, em graus, dos ângulos formados entre as retas AP e PO são aproximadamente iguais a:
(A) 20 e 160
(B) 30 e 150
(C) 60 e 120
(D) 90 e 90
28
1º EXAME DE QUALIFICAÇÃO - VESTIBULAR 2009
GABARITO OFICIAL
01
02
03
04
16 - C
17 - B
18 - A
22
23
24
25
05 - A
06 - D
19 - B
20 - D
26 - C
27 - D
48 - B
49 - C
07 - B
08 - C
21 - C
28 - A
29 - B
50 - B
51 - B
30
31
32
33
34
35
-C
-D
-C
-D
-A
-A
52
53
54
55
56
57
36
37
38
39
40
41
-D
-A
-B
-B
-A
-C
58 - C
59 - B
60 - A
09
10
11
12
13
14
-A
-C
-A
-D
-D
-D
-B
-D
-C
-A
15 - A
ESPANHOL
FRANCÊS
16
17
18
19
20
-D
-C
-B
-B
-A
21 - C
INGLÊS
16 - D
17 - A
18 - C
19 - B
20 - A
21 - C
-B
-B
-C
-D
42 - C
43 - A
44
45
46
47
-A
-D
-B
-A
-B
-A
-A
-D
-D
-D
Universidade do Estado do Rio de Janeiro
Sub-reitoria de Graduação - SR-1
Departamento de Seleção Acadêmica - DSEA
Coordenação Acadêmica
GABARITO . 2º exame de qualificação . 14/09/2008
01 – B
02 – A
03 – B
04 – A
05 – D
06 – D
07 – C
08 – B
09 – B
10 – A
11 – A
12 – D
13 – D
14 – D
15 – C
Espanhol
16 – D
17 – B
18 – C
19 – A
20 – B
21 – A
Francês
16 – B
17 – D
18 – A
19 – C
20 – D
21 – A
Inglês
16 – D
17 – D
18 – C
19 – A
20 – B
21 – C
22 – A
23 – B
24 – A
25 – D
26 – B
27 – D
28 – B
29 – C
30 – B
31 – A
32 – C
33 – A
34 – A
35 – D
36 – C
37 – A
38 – C
39 – B
40 – C
41 – D
42 – C
43 – C
44 – D
45 – C
46 – B
47 – D
48 – C
49 – B
50 – C
51 – C
52 – B
53 – A
54 – B
55 – B
56 – C
57 – A
58 – C
59 – A
60 – B