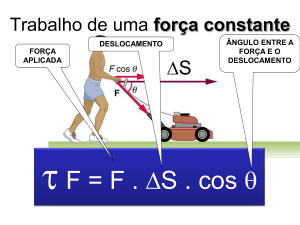
CINÉTICA QUÍMICA
Profa. Loraine Jacobs
DAQBI
[email protected]
http://paginapessoal.utfpr.edu.br/lorainejacobs
Cinética Química
Estudo da velocidade das reações
químicas.
REAGENTES
PRODUTOS
Termodinâmica Estado de Equilíbrio
Cinética Tempo necessário para a
transformação
Termodinâmica vs Cinética
Transformação do Diamante em Grafite
Termodinâmica Reação Espontânea, ou
seja, G0
Cinética Tempo necessário para a
transformação muito elevado.
Cinética Química
Velocidade Média
◦ Calculada através da variação de distância
percorrida e o tempo necessário para o
percurso.
v = ∆d distância
∆t tempo
Cinética Química
Velocidade Média
◦ Em reações químicas a “distância percorrida” é
a variação da concentração de reagentes ou
produtos Representada por ∆[ ]
◦ Sempre definidas para serem valores positivos
v = ∆[Produtos]
∆t
v =- ∆[Reagentes]
∆t
Atenção!!! Quando uma reação ocorre a
[R]f será sempre menor que a [R]i.
Cinética Química
◦ Velocidade Média
Ex: Decomposição da água oxigenada
H2O2 (aq)
2 H2O(g) + O2 (g)
Cinética Química
Velocidade Média e Estequiometria
◦ Na reação: 2O3 3O2
Para que as velocidades tenham parâmetros
iguais, devemos levar em consideração o
coeficiente estequiométrico.
◦ Assim podemos dizer que:
∆[Produtos] =- ∆[Reagentes]
p ∆t
r ∆t
= coeficiente estequiométrico
Cinética Química
Velocidade Média e Estequiometria
◦ Na reação: 2O3 3O2
Para o exemplo citado, teremos que:
∆[O2] =- ∆[O3]
3∆t
2∆t
Desta forma, podemos obter velocidade de
produção do composto ou a velocidade de consumo
dos reagentes.
Cinética Química
Exercício 01:
◦ A reação: 2O3 3O2 foi estudada em um
experimento e, a velocidade de consumo do
ozônio foi de 2,5.10-5mol.L-1.s-1.
Qual a velocidade de produção de O2 neste
experimento?
∆[Produtos] =- ∆[Reagentes]
p ∆t
r ∆t
Cinética Química
Velocidade Instantânea
◦ Limite da velocidade média para um intervalo
de tempo tendendo a zero.
r = [R]/dt = limt0 [R]/t
Velocidade Instantânea
Velocidade Instantânea
Velocidade Instantânea
Cálculo Gráfico
Velocidade Instantânea
Cálculo Gráfico
◦ Assinalar o ponto P, que corresponde ao instante de
tempo t1 considerado.
◦ Traçar um segmento de reta tangente ao gráfico
passando pelo ponto P.
◦ Construir um triângulo retângulo, como o triângulo
ABC, tendo esse segmento de reta tangente como
hipotenusa. Os catetos são tomados paralelamente aos
eixos.
◦ Estabelecer o valor de ∆x, segmento BC, e o valor de
∆t, segmento AC.
◦ Calcular o cociente de ∆x por ∆t e o resultado é v(t1),
o módulo da velocidade instantânea no instante de
tempo considerado.
Cinética Química
Leis de Velocidade
◦ Equações
matemáticas
que
resumem
comportamento de uma reação química.
o
◦ Divididas em:
Lei de Velocidade Diferencial
Lei de Velocidade Integrada
Estes métodos permitem a obtenção da ordem de
reação e da constante de velocidade (k)
Cinética Química
Lei de Velocidade Diferencial
◦ Dada a reação: X + Y Z
A velocidade será representada por
v = k[X]m[Y]n
◦ Onde:
k = constante de velocidade
m e n = ordem de reação
[X] e [Y] = concentração dos reagentes X e Y
Cinética Química
Lei de Velocidade Diferencial
◦ Quando a lei de velocidade depende de mais de
um reagente, teremos a ordem de reação total
e a ordem em relação a cada reagente.
◦ Utilizando o exemplo anterior
v = k[X]2[Y]1
◦ Neste caso, dizemos que a reação tem ordem
3, sendo de 2ª ordem para o reagente X e de
1ª ordem para o reagente Y
Cinética Química
Lei de Velocidade Diferencial
◦ Quando a lei de velocidade depender também do
produto, temos de incluí-lo na equação de
velocidade e também determinar a ordem de reação
em relação a ele.
Utilizando a reação X + Y Z, teríamos que:
v = k[X]2[Y]1 neste caso escrevemos:
[Z]1
v = k[X]2[Y]1[Z]-1
A reação tem ordem 2 sendo de 2ª ordem
para o reagente X, de 1ª ordem para o
reagente Y e de 1ª ordem para o produto
Cinética Química
Exercício 02:
◦ Lei de Velocidade Diferencial
◦ Determine as ordens em relação a cada
reagente e a ordem total da reação cuja lei de
velocidade é representada por:
v = k[A][B]½
Cinética Química
Exercício 03:
◦ Lei de Velocidade Diferencial
◦ Determine as ordens em relação a cada
reagente e a ordem total da reação cuja lei de
velocidade é representada por:
v = k[A]2[B]½
[C]2
Cinética Química
A constante de velocidade k
◦ Indica o desenvolvimento da reação (lenta ou
rápida).
◦ Não se altera para uma mesma reação exceto
se houver alteração de T
◦ Unidades de k
Para reações de 1ª ordem: s-1
Para reações de 2ª ordem: L.mol-1.s-1
Quanto maior o valor da constante de
velocidade (k), mais rapidamente se
processa a reação.
Cinética Química
Determinando k e a Lei de Velocidade
◦ Dada a seguinte equação de velocidade
v = k.[A]n
◦ Observamos que quando n for igual a:
◦ 0 – ao dobrarmos a [A] não teremos alteração
de v.
◦ 1 – ao dobrarmos a [A] a velocidade de reação
duplicará.
◦2
–
ao
dobrarmos
[A]
a
velocidade
quadruplicará.
Cinética Química
Determinando k e a Lei de Velocidade
◦ Considere a reação abaixo e observe a tabela:
2N2O5(g) 4NO2(g)+ O2(g)
Experimento
[N2O5] inicial
(mol.L-1)
Vinicial
(mol.L-1.s-1)
1
3.10-3
9.10-7
2
9.10-3
2,7.10-6
◦ Qual a ordem da reação e o valor da constante
de velocidade (k)?
Cinética Química
Determinando k e a Lei de Velocidade
◦ Para 2 reagentes o procedimento é similar
NO2 + O3 NO3+ O2
Experimento
[NO2] inicial
(mol.L-1)
[O3] inicial
(mol.L-1)
Vinicial
(mol.L-1.s-1)
1
2,3.10-5
3.10-5
1.10-5
2
4,6.10-5
3.10-5
2,1.10-5
3
4,6.10-5
6.10-5
4,2.10-5
◦ Qual a ordem da reação e o valor da constante
de velocidade (k)?
Cinética Química
Lei de Velocidade Integrada
◦ Mostra a variação das concentrações com o
tempo.
◦ Deduzida através
velocidade.
da integração da lei de
◦ Lembrando que v = ∆ [ ]
∆t
Cinética Química
Lei de Velocidade Integrada
◦ Para reação de ordem zero: v = k.[A]0
◦ Portanto v = k (Velocidade independe da[ ])
◦ - ∆ [R] = k ... Convertendo infinitesimalmente
∆t
◦ -d [R] = k ou d [R]= -k. dt
dt
Cinética Química
Lei de Velocidade Integrada
◦ Integrando no intervalo entre 0 e t, teremos:
[A]t - [A]0 = -k.t
◦ Para compararmos à uma equação de reta,
rearranjamos os termos:
[A]t = [A]0 -k.t
y = a – b.x
Reações de Ordem Zero
Com esta informação é possível expressar o
comportamento da velocidade graficamente e se
obter o valor de (k)
Coeficiente Angular será o valor de k.
Cinética Química
Lei de Velocidade Integrada
◦ Para reação de primeira ordem: v = k.[A]1
◦ Portanto v = k[A]
◦ - ∆ [R] = k.[A]
∆t
Convertendo infinitesimalmente
◦ -d [R] = k [A] ou d [R]= -k. [A] dt
dt
Cinética Química
Lei de Velocidade Integrada
◦ Integrando no intervalo entre 0 e t, teremos:
ln[A]t = -k.t ou [A]t = [A]0.e-k.t
[A]0
◦ Comparando à uma equação de reta para
observar o comportamento da velocidade,
temos:
[A]t = [A]0.e-k.t
y = b.x
Reações de Primeira Ordem
Representação Gráfica
◦ Comportamento exponencial - [A]t = [A]0.e-k.t
Não fornece o valor de k
Reações de Primeira Ordem
Representação Gráfica
◦ Para se obter o valor de k usa-se ln[A]t = -k.t
[A]0
Coeficiente Angular será o valor de k.
ln[A]t
[A]0
Reações de Primeira Ordem
Exercício 04:
◦ A fotodissociação do O3 pela luz UV é uma
reação de primeira ordem com k = 1.10-5s-1.
Considere um experimento onde a [O3] =
5mol.L-1. Qual será a concentração de O3 após
1 dia? Dado: ln[A]t = -k.t ou [A]t = [A]0.e-k.t
[A]0
Cinética Química
Lei de Velocidade Integrada
◦ Para reação de segunda ordem: v = k.[A]2
◦ Portanto v = k[A]2
◦ - ∆ [R] = k.[A]2
∆t
Convertendo infinitesimalmente
◦ -d [R] = k [A]2 ou d [R]= -k. [A]2 dt
dt
Cinética Química
Lei de Velocidade Integrada
◦ Integrando no intervalo entre 0 e t, teremos:
1 - 1 = k.t ou 1 = 1 +k.t
[A]t [A]0
[A]t
[A]0
◦ Comparando à uma equação de reta para
observar o comportamento da velocidade,
temos:
1 = 1 +k.t
[A]t
[A]0
y = b.x
Reações de Segunda Ordem
Representação Gráfica
◦ Coeficiente Angular será o valor de k.
1 = 1 + k.t
[A]t
[A]0
Reações de Segunda Ordem
Exercício 05:
◦ Entre os possíveis destinos do NO2 na química
atmosférica, está a decomposição para formar NO e
O2. Essa reação foi estudada a 370ºC e os
resultados obtidos foram os seguintes:
Tempo
(s)
[NO2]
(mol.L-1)
0
0,300
5
0,0197
10
0,0100
15
0,007
20
0,0052
25
0,0041
30
0,0035
◦ Com base nesses
dados, determine a
constante de
velocidade (k)