Caro Professor,
O principal objetivo do projeto RIVED é oferecer aos professores do Ensino Médio novos
recursos didáticos, em forma de módulos, para a melhoria da aprendizagem dos alunos em
sala de aula.
O módulo de aprendizagem é um conjunto de atividades de computador que exploram uma
determinada unidade curricular. Porém, as atividades digitais nem sempre são adequadas
para mediar todos os conteúdos de uma unidade. Por isso, atividades complementares são
sugeridas no guia do professor.
Cada atividade dos módulos RIVED vem acompanhada de um guia do professor para
ajudar a informar sobre as decisões relacionadas à escolha e execução da atividade. Os
guias, além de fornecerem dicas de como usar as atividades do módulo, também são criados
como uma fonte de enriquecimento do professor.
Considere as informações dos guias como sugestões. Você não precisará segui-las
exatamente como são descritas. Você poderá utilizar os guias como referência e adequá-los
a seus alunos e ao seu planejamento pedagógico.
Guia do professor
Módulo – Estrutura Atômica
Atividade 3 - Um olhar dentro do átomo
Introdução
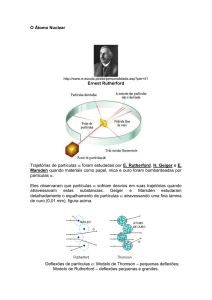
Esta atividade consiste em uma simulação do experimento de choque de partículas
alfa em folha de ouro, realizado por Rutherford e colaboradores, e que foi fundamental à
proposta do modelo planetário para o átomo. Além disso, ajudará em uma discussão
importante e necessária para o desenvolvimento do espírito científico no estudante: como, a
partir de resultados obtidos na experimentação e do tratamento desses dados, os cientistas
podem propor modelos e teorias para explicar os fenômenos estudados?
Objetivos
1. Identificar o contexto histórico-científico em que nasceu o modelo atômico proposto
por Rutherford;
2. Reconhecer os principais fatos científicos que influenciaram na formulação do
Modelo de Rutherford;
3. Reconhecer que a Ciência é dinâmica. Novos fatos, novos experimentos e novas
tecnologias permitem, a cada dia, confirmar ou contestar leis/teorias;
4. Reconhecer a interdisciplinaridade dos conhecimentos exigidos para interpretar e
compreender os fenômenos;
5. Reconhecer o importante papel da tecnologia para a realização de experimentos;
6. Compreender como os dados experimentais são obtidos e analisados, permitindo
fazer inferência sobre o assunto estudado.
Pré-requisitos de conhecimento
1. Ter conhecimentos sobre as características básicas das cargas elétricas;
2. Reconhecer que existe uma energia associada ao movimento dos corpos;
3. Conhecer os modelos atômicos propostos por Dalton e J. J. Thomson.
Tempo previsto para a atividade
Três aulas de 50 minutos.
atividade.
O tempo será especificado dentro de cada etapa da
Na sala de aula
Neste primeiro momento, é desejável que os alunos percebam como os trabalhos na
área de radioatividade contribuíram para a descoberta do núcleo no átomo. Sugerimos que
este tema seja desenvolvido por meio de uma aula expositiva do professor ou dos
estudantes.
O professor poderá dividir a turma em grupos de até 6 alunos (ou de acordo com a
realidade da sala de aula do professor) e pedir que cada grupo faça um trabalho de pesquisa,
em casa, sobre um tema relacionado ao assunto desta atividade.
Obs.: A organização e distribuição das atividades por grupo deverão ser feitas, no mínimo,
com uma semana de antecedência.
Temas para as atividades em grupos
- A descoberta dos raios X;
- Os tubos de raios catódicos;
- As lâmpadas fluorescentes;
- Os trabalhos de Becquerel;
- Os trabalhos de Marie e Pierre Curie;
- A vida de Marie e Pierre Curie;
- Os trabalhos de Rutherford;
- A história de Rutherford como estudante e pesquisador.
A partir desse trabalho, os estudantes apresentarão o resultado de suas pesquisas em
aulas expositivas.
Tempo previsto para a atividade
Duas aulas de 50 minutos. Em cada aula, 35 minutos serão destinados às aulas
expositivas apresentadas pelos grupos (3 grupos em cada aula) e 10 minutos à discussão.
Na sala de computadores
A atividade no computador é uma simulação que poderá ajudar o estudante a
compreender como, a partir de resultados obtidos na experimentação e de conhecimentos
anteriores, esses dados são tratados, permitindo aos cientistas propor modelos e teorias para
explicar os fenômenos estudados.
Preparação
Se possível, sugerimos que organize a sala com grupos de 2 alunos para cada
computador. Esta organização facilitará a troca de idéias e discussão entre os estudantes.
Requerimentos técnicos
1. Versão mínima de navegador (Browser):
-Internet Explorer versão 5
-Netscape versão 7
2. PLUG-INS
-Plug-in do Flash MX
-Plug-in Java(TM) Plug-in Version 1.4.1
-Acrobat Reader
Durante a atividade
1. Sugira a cada grupo que inicie a simulação, observando o que acontece e
procure responder às perguntas que são propostas;
2. Dê, aproximadamente, 10 minutos para que as duplas possam responder às
perguntas e anotar em seu diário ou caderno;
3. Em seguida, peça aos estudantes que desliguem o monitor e virem suas cadeiras
formando, se possível, um círculo. Um grupo deverá apresentar à classe as
respostas para as primeiras perguntas. Em seguida, o professor irá promover
uma discussão baseada nessas questões;
1. Como é o movimento das partículas neste experimento?
2. Por que, ao se chocar com a folha fina de ouro, a grande maioria das
partículas não sofre desvios?
3. Por que tão poucas partículas são desviadas, e um menor número ainda
deflete com ângulos tão grandes?
4. O professor deve se certificar de que os estudantes compreenderam e
responderam satisfatoriamente às perguntas antes de passar para as próximas
questões;
5. O professor poderá pedir para outro grupo que apresente as respostas para o
segundo conjunto de questões. Em seguida à apresentação do grupo, o professor
irá promover uma discussão baseada nessas questões.
Fazendo referência ao modelo "pudim de passas" proposto por Thomson e às suas
reflexões sobre o experimento de Rutherford, discuta as questões a seguir,
registrando suas idéias no seu diário.
1. Dê sua opinião sobre a frase: "Os átomos são compactos e a forma como eles se
organizam para formar a matéria é responsável pelos 'espaços vazios' evidenciados
pelo experimento de Rutherford".
2. O modelo de Thomson é adequado para representar a estrutura dos átomos? Se
você acha que não, proponha um modelo para o átomo.
6. Seria interessante que cada grupo apresentasse o seu modelo proposto. Discuta
de acordo com cada modelo, se julgar necessário.
Importante:
Para finalizar, com base na ilustração, obtida quando passa o mouse sobre a
placa amarela, o professor poderá mostrar, com desenhos no quadro da sala, que
utilizando o modelo atômico proposto por Thomson, o espaço vazio entre os
átomos seria muito pequeno e assim, a maioria das partículas deveriam ser
defletidas e poucas atravessariam a placa.
Depois da atividade
Após a atividade no computador, seguida das discussões, tem-se um excelente
momento para apresentar, formalmente, o modelo atômico proposto por Rutherford e suas
conclusões sobre o experimento por ele realizado.
Comentário:
Praticamente todas as partículas atravessam a folha em linha reta. Isso significa
que há espaços vazios por onde essas partículas possam passar. E, as partículas
que foram defletidas encontram um ‘obstáculo’. Como poucas partículas
defletem, significa que o espaço vazio é muito maior do que o espaço ocupado
por esse ‘obstáculo’. Assim, com o conhecimento das propriedades das
partículas alfa e o tratamento matemático dos dados obtidos nesse experimento,
Rutherford sugeriu que os átomos eram constituídos de um núcleo, muito
pequeno, pesado e positivo, e que os elétrons estariam distribuídos em volta
desse núcleo em um espaço muito maior e vazio.
Importante: Não cabe, aqui, entrar em detalhes sobre os cálculos matemáticos
utilizados por Rutherford e colaboradores.
Questões para discussão
Nesta discussão, é importante abordar as deficiências do modelo atômico proposto
por Rutherford, quando esse foi analisado segundo as leis da eletricidade e do magnetismo.
De acordo com essas leis, os elétrons (de carga negativa) circulando ao redor do núcleo
seriam inevitavelmente atraídos pelo núcleo (de carga positiva), causando o seu colapso. A
teoria da luz, desenvolvida por Maxwell em meados do século XIX, também levantou as
contradições desse modelo. De acordo com essa teoria, partículas eletrizadas deveriam
emitir ondas eletromagnéticas. Esta emissão implica a perda de energia e, assim, ao invés
dos elétrons ficarem em órbitas estáveis, eles se aproximariam do núcleo em movimento
espiral e precipitariam sobre ele. Então, segundo o modelo proposto por Rutherford, a
matéria seria altamente instável e em constante colapso.
Dica
Novamente, surge a oportunidade de discutir como as teorias e modelos propostos
devem sustentar os fenômenos observados. O modelo proposto apresenta falhas, isto
significa que mais estudos são necessários para responder as questões que são
pertinentes e fundamentais.
Avaliação
Além da avaliação que poderá ser feita ao longo da atividade, seja através das
observações ou respostas dos estudantes, o diário continua sendo um excelente meio para
avaliação.
Referências bibliográficas
1. REIS, Martha, Completamente Química, Editora FTD, 2001.
2. MAHAN, Química – Um curso universitário, Editora Edgard Blücher LTDA.
3. CARUSO, Francisco e OGURI, Vitor, A eterna busca do indivisível: Do átomo filosófico
aos Quarks e Léptons, Química nova, vol. 20, número 3, 1997.
4. SEGRÈ Emílio, Dos raios-x aos quarks, Brasília: Editora da UnB, 1987.